人源化抗体转基因动物的研究进展与趋势
2016-12-09葛良鹏邹贤刚刘作华
葛良鹏邹贤刚刘作华
(1 重庆市畜牧科学院,重庆 402460;2 农业部养猪科学重点实验室,重庆 402460;3 养猪科学重庆市市级重点实验室,重庆 402460)
人源化抗体转基因动物的研究进展与趋势
葛良鹏1邹贤刚2刘作华3
(1 重庆市畜牧科学院,重庆 402460;2 农业部养猪科学重点实验室,重庆 402460;3 养猪科学重庆市市级重点实验室,重庆 402460)

葛良鹏,博士,研究员,主要从事动物资源的创新开发研究。
E-mail:geliangpeng1982@163.com
刘作华,博士,研究员,主要从事动物资源保护与开发利用工作。
E-mail:liuzuohua66@163.com
人源化抗体转基因动物是人源化抗体药物开发的战略核心资源,能为抗体序列发现提供源头创新保障,并为突发性生物安全事件提供应急预案。文章对人源化抗体转基因动物的发展历程进行综述回顾,重点介绍目前世界上常用的人源化抗体转基因动物品系,并对其应用情况和发展趋势进行分析展望。
BRÜGGEMANN M, CASKEY H M, TEALE C, et al. A repertoire of monoclonal antibodies with human heavy chains from transgenic mice. Proc Natl Acad Sci U S A, 1989, 86(17):6709-6713.
LONBERG N, TAYLOR L D, HARDING F A, et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature, 1994, 368(6474):856-859.
GREEN L L, HARDY M C, MAYNARDCURRIE C E, et al. Antigen-specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nat Genet, 1994, 7(1):13-21.
人源化抗体转基因动物是指利用基因工程技术,将动物体内的免疫球蛋白基因用人类的免疫球蛋白基因替换,从而使转基因动物体内的人免疫球蛋白基因发生重排和突变,直接表达产生人类的抗体蛋白,利用转基因动物重排后的人抗体基因序列或抗体蛋白,通过细胞工程和蛋白质工程技术手段,制备出临床使用的人源化抗体,用于重大疾病(如肿瘤)的治疗或突发性生物安全事件(如SARS、EBOLA等)的防控。截至2015年底,60余个来源于转基因动物的人源化抗体进入临床试验阶段,其中8个获得FDA批准进入市场应用。人源化抗体转基因动物已成为抗体开发的核心工具动物,对改善人民群众的健康水平和保障公共卫生安全方面具有重要的作用和意义。
1 人源化抗体转基因动物的发展历程
人源化抗体转基因动物的培育大致可分为三个不同的发展阶段:第一代人源化抗体转基因动物主要以能在动物体内产生人类的抗体蛋白为标志;第二代人源化抗体转基因动物增加了转入的人免疫球蛋白基因片段,使人类抗体在动物体内重排多样性得到进一步增加;第三代人源化抗体转基因动物重点解决了转入的人免疫球蛋白基因片段与动物B细胞发育的匹配性问题,使得抗体的产量和质量进一步提升。
1.1 第一代人源化抗体转基因动物
Brüggemann博士于1989年最早报道人类免疫球蛋白基因能在动物体内进行重排和表达,在技术上验证了培育转基因动物生产人类抗体的可行性 。随后,1Lonberg小组和Green小组在1994年分别成功培育出了人源化抗体转基因小鼠,使培育人源化抗体转基因动物生产人类抗体蛋白成为现实23。
早期的人源化抗体转基因动物直接将人的免疫球蛋白基因转入动物体内,使其重排产生人类抗体蛋白。但由于动物会优先使用自身的免疫球蛋白基因,因此转入的人免疫球蛋白基因的重排和表达受内源性免疫球蛋白基因影响较大,为克服这一问题,培育的第一代人源化抗体转基因动物是在转入人免疫球蛋白基因的同时,对动物内源性免疫球蛋白基因(重链、к轻链和λ轻链)进行失活4。
1.2 第二代人源化抗体转基因动物
人免疫球蛋白重链(hIgH)基因约有1250kb,人免疫球蛋白к轻链(hIgκ)基因约1820kb,人免疫球蛋白λ轻链(hIgλ)基因约900kb。要在体外获得如此长的基因片段并将其完整导入到动物体内、实现稳定遗传具有较高的技术难度。500kb的基因片段是体外基因操作的极限5,因此,第一代人源化抗体转基因动物中的人免疫球蛋白基因已进行了改造,一般转入500kb以下的免疫球蛋白基因片段,尽管能够获得人类抗体蛋白,但受转入基因片段调控区的限制,其重排多样性受到制约。
第二代人源化抗体转基因动物是在第一代基础上,重点解决免疫球蛋白超大基因的稳定转基因、增加人类抗体重排多样性的问题。第二代人源化抗体转基因动物利用胚胎干细胞和基因同源重组技术,采用多次介导小片段基因转入和体内同源重组技术实现了完整的人免疫球蛋白基因稳定转入,使抗体重排多样性得到保障。但这一技术目前已有专利保护,进行商业化开发需要获得专利许可。
1.3 第三代人源化抗体转基因动物
免疫球蛋白除了能够重排表达形成抗体外,在B细胞的发育过程中也扮演重要的角色。B细胞发育早期阶段所需的B细胞受体(B cell receptor,BCR)由免疫球蛋白重链与信号蛋白Igα和Igβ分子组成。在人源化抗体转基因动物中,BCR中人的免疫球蛋白重链与动物自身信号蛋白的Igα和Igβ的相互匹配性并不是最优的,因此对B细胞的早期发育、B细胞分化抗体类型转换、亲和力成熟都具有重要的影响6。
LONBERG N. Human antibodies from transgenic animals. Nat Biotechnol, 2005, 23(9):1117-1125.
LI L, BLANKENSTEIN T. Generation of transgenic mice with megabase-sized human yeast artificial chromosomes by yeast spheroplast–embryonic stem cell fusion. Nature Protocols, 2013, 8(8):1567-1582.
LEE E C, LIANG Q, ALI H, et al. Complete humanization of the mouse immunoglobulin loci enables efficient therapeutic antibody discovery. Nature Biotechnology, 2014, 32(4):356-363.
MURPHY A J, MACDONALD L E, STEVENS S, et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proc Natl Acad Sci U S A, 2014, 111(14):5153-5158.
ZHU L, LAVOIR M, ALBANESE J, et al. Production of human monoclonal antibody in eggs of chimeric chickens. Nat Biotechnol, 2005, 23(9):1159-1169.
MENDICINO M, RAMSOONDAR J, PHELPS C, et al. Generation of antibody- and B cell-deficient pigs by targeted disruption of the J-region gene segment of the heavy chain locus. Transgenic Res, 2011, 20(3):625-641.
10 参考文献
GREEN L L. Antibody engineering via genetic engineering of the mouse: XenoMouse strains are a vehicle for the facile generayion of therapeutic human monoclonal antibodies. Journal of Immunological Methods, 1999, 231(1-2):11-23.
11 参考文献
Amgen 22亿美元收购Abgenix公司. (2016-02-01)[2016-10-30]. http://www.bioon.com/ industry/mdnews/171139.shtml.
为解决以上问题,VelocImmune和Kymab人源化抗体转基因小鼠仅将小鼠免疫球蛋白的V区、D区和J区全部替换为人免疫球蛋白V区、D区和J区,解决早期B细胞发育的问题,抗体的表达量和亲和力得到进一步的改进,但其产生抗体为人鼠嵌合抗体,需要二次改造才能形成全人源化抗体 。2016年,重庆市畜牧科学院成功培育出中国的人源化抗体转基因小鼠(CAMouse),其采用时空特异性表达技术,在B细胞发育的早期阶段,免疫球蛋白重排形成鼠源BCR,解决B细67胞发育的匹配性问题,而在B细胞发育到浆细胞阶段,免疫球蛋白重排直接表达形成人类抗体蛋白,这样转基因小鼠B细胞的早期发育、B细胞分化抗体类型转换、亲和力正常。
12 参考文献
庄洲娟. 百时美施贵宝公司以24亿美元收购Medarex. (2009-07-23)[2016-10-30]. http://finance. sina.com.cn/stock/t/20090723/10232966783.shtml.
13 参考文献
http://harbourantibodies.com/sciencetechnology/hcab/#.V67v_mV_H-Y.
14 参考文献
http://www.omniab.com/technology.
15 参考文献
药明康德与美国OMT公司扩大人类抗体研发及商用机会为亚洲及全球制药公司服务. (2013-03-05)[2016-10-30]. http://www.wuxiapptec. com.cn/press/detail/176/18.html
16 参考文献
英国生物制药公司Kymab与上海岸迈生物科技有限公司EpimAb Biotherapeutics宣布一项技术互相授权及合作协议. (2016-10-12)[2016-10-30]. http://www.xinjr.com/caijing/ redian/2016-10-12/371234.html.
17 参考文献
NELSON A L, DHIMOLEA E, REICHERT J M. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov, 2010, 9(10):767-774.
18 参考文献
葛良鹏, 丁宁, 兰国成, 等. 治疗性抗体的研究现状与未来. 中国生物工程杂志, 2013, 33(9):85-93.
19 参考文献
K U R O I WA Y, K A S I N AT H A N P, SATHIYASEELAN T, et al. Antigen-specific human polyclonal antibodies from hyperimmunized cattle. Nat Biotechnol, 2009, 27(2):173-181.
2 主要人源化抗体转基因动物品系
由于人源化抗体转基因动物培育难度较大,截至2015年底,全球仅有少数几家单位成功培育出能生产全人源化抗体的转基因动物,其他抗体研发公司基本上都是与以上单位进行合作利用转基因动物研制人源化抗体。此外,Therapeutic Human Polyclonals Inc(THP)、Ablynx、Origen Therapeutics、Revivicor等公司目前也在利用兔、骆驼、鸡和猪开展人源化抗体转基因动物的研究,但尚在进行之中,因此本小节仅介绍已培育成功的世界主流人源化抗体转基因动物89。
2.1 XenoMouse小鼠
XenoMouse小鼠是由Cell Genesys公司的Green博士领衔培育出的第一代人源化抗体转基因小鼠。早期的XenoMouse转入的人免疫球蛋白基因片段仅含有5个重链V区和2个к轻链V区,后经优化升级,目前XenoMouse携带有人IgH和Igк的主要基因序列,其中人IgH约1.0Mb(含有34个V区,23个D区,6个J区,以及Cμ、Cδ),人Igк约0.8Mb(包括32个V区,完整的J区,C区,KDE,Igк intronic和3’增强子),而小鼠自身的IgH和Igк已被失活。该品系小鼠可以识别人类的蛋白作为抗原,产生体液免疫反应。利用XenoMouse小鼠,从体内免疫到利用杂交瘤技术筛选出人源化抗体,只需3个月的时间,筛选出的抗体亲和力可达pM10。1996年,Cell Genesys公司将XenoMouse小鼠业务分拆出来成立Abgenix公司,2005年,Amgen公司花费22亿美元,收购Abgenix公司11。
2.2 UltiMab 小鼠
UltiMab小鼠与XenoMouse小鼠同步出现,由美国Medarex公司Lonberg博士领衔培育而成。UltiMab小鼠与XenoMouse小鼠性质类似,转入了人IgH和Igк的主要基因,同时使小鼠自身的IgH和Igк失活,差异在于UltiMAb小鼠采用原核注射的方式培养,而XenoMouse采用酵母原生质融合的方式培育而成2。Ulti-MAb小鼠经过几代的发展,已由最初的3个重链V区、4个к轻链V区发展成能产生所有抗体亚型的人源化抗体转基因小鼠,并开发了30余个抗体药物进入临床4。2009年,百时美施贵宝支付24亿美元收购Medarex公司试验12。
2.3 Harbour 小鼠
Harbour公司目前拥有H2L2和HCAB两个品系的小鼠。H2L2小鼠内源性的抗体表达被失活,同时转入了嵌合的人/大鼠/小鼠的免疫球蛋白基因。其转入的免疫球蛋白重链基因包括18个人的V区,19个人的D区,6个人的J区,大鼠的C区及小鼠的LCR区,转入的免疫球蛋白к轻链包括11个人的V区,5个人的J区,1个大鼠的C区,同时在大鼠C区的两侧各有1个小鼠的增强子。其产生的抗体亲和力可达(p~n)Molar。HCAB品系为单链特异性抗体转基因小鼠,小鼠自身的重链C区和к轻链被敲除,转入的人免疫球蛋白重链基因部分包括8个人V3区,1个人V6区,人AIID区和6个人的J区,同时还带有小鼠Cγ和小鼠LCR区。该品系小鼠可用于双功能抗体和四价抗体的开发13。
2.4 OmniAb
OmniAb目前拥有3个不同品系的人源化抗体转基因动物,即Omni-Rat、OmniMouse以及OmniFlic,由英国Marianne Brüggemann博士主导培育而成。OmniRat携带有嵌合的人/大鼠免疫球蛋白重链基因(包括22个人V区,所有的人D区和J区,以及大鼠的C区)和人的免疫球蛋白轻链(12个人к轻链V区和Jk-Ck,16个人λ轻链V区和Jλ-Cλ),同时利用锌指核酸酶对大鼠内源性免疫球蛋白基因进行灭活。OmniRat具有正常大鼠相近的免疫功能,免疫1只OmniRat,通过杂交瘤技术可获得约1600个克隆,其中阳性克隆为148个(正常SD大鼠约可获得3520个克隆)。 OmniMouse小鼠培养方式与OmniRat类似,但其携带的人免疫球蛋白V区要多于OmniRat。OmniFlic是用于单链抗体开发的人源化抗体转基因大鼠,与OmniRat相比,仅在人免疫球蛋白轻链方面存在差异,OmniFlic仅携带有重排后的单个Vk-Jk-Ck,其可避开杂交瘤技术获得抗体基因的相关信息14。2013年,药明康德宣布引入OmniRat开展人源化抗体合作研究15。
2.5 VelocImmune小鼠
VelocImmune小鼠是美国Regeneron公司培育的人源化抗体转基因小鼠,其将小鼠IgH和Igк的V区精确地替换为对应的人IgH和Igк的V区,保留了小鼠自身的所有C区及其他基因表达调控元件。通过连续三次同源重组,VelocImmune小鼠最终携带了人IgH的80个V区和Igк的40个V区。该小鼠具有正常小鼠类似的免疫反应特性和抗体产量,已开发了10余种抗体进入临床试验阶段,但该小鼠存在的问题是产生的抗体是人鼠嵌合抗体,需要进行二次改造才能实现全人源化7。
2.6 Kymab小鼠
Kymab小鼠由英国Kymab公司和Sanger研究所共同培育而成,其构建策略与VelocImmune小鼠类似,也是将小鼠IgH和Igк的V区精确地替换为对应的人IgH和Igк的V区,保留了小鼠自身的所有C区及其他基因表达调控元件6。细微的差别是VelocImmune小鼠采用的经典的同源重组策略实现完整的V区替换,而Kymab是采用的Cre介导的同源重组技术实现完整的V区替换,双方的专利冲突较大,2016年10月,英国Kymab公司宣布与中国岸迈生物科技有限公司进行技术互相授权及合作16。
2.7 CAMAB小鼠
CAMAB小鼠由中国重庆市畜牧科学院培育而成,包括两类抗体小鼠:CAMouseHG生产全人源抗体,CAMouseH生产全人源单域抗体(全人源纳米抗体)。CAMouse小鼠携带有经改造的人免疫球蛋白重链、人免疫球蛋白к轻链和λ轻链基因,同时对小鼠内源性免疫球蛋白基因进行了灭活。CAMouseHG和CAMouseH的最大特点是具有人/小鼠免疫球蛋白时空转换表达特性,在B细胞发育的早期阶段,形成鼠源BCR结构,确保小鼠B细胞的正常发育,在B细胞发育至浆细胞阶段,则又利用人源的Gamma区进行重排和表达,生产人源IgG。CAMouse小鼠的B细胞发育正常,抗体表达量高,重排多样性丰富,根据目标抗体的需要,可以选择使用抗体小鼠。
3 人源化抗体转基因动物的应用
2006年,利用XenoMouse开发的panitumumab获得美国FDA批准进入临床使用,这是第一个获批的来源于转基因动物的人源化抗体,截至2015年底,共有8个来源于转基因动物的人源化抗体获得FDA批准(表1),适应证主要以肿瘤和自身免疫疾病治疗为主,包括明星抗体P D-1与CTLA-4抗体,均由转基因动物开发而来,目前来源于转基因动物的抗体全球年销售额已超过30亿美元。自1996年以来,共有130余个人源化抗体进入临床试验,其中利用人源化抗体转基因动物共开发了60余种治疗性抗体,约占全部人源化抗体的一半,已有21个完成临床试验,22个在进行临床试验(7个Ⅰ期,14个Ⅱ期,1个Ⅲ期)。根据统计,来源于转基因动物的全人源化抗体从Ⅱ期到Ⅲ期以及从Ⅲ期到获得FDA许可的比例要高于其他方法制备的人源化抗体17。
4 人源化抗体转基因动物未来发展展望
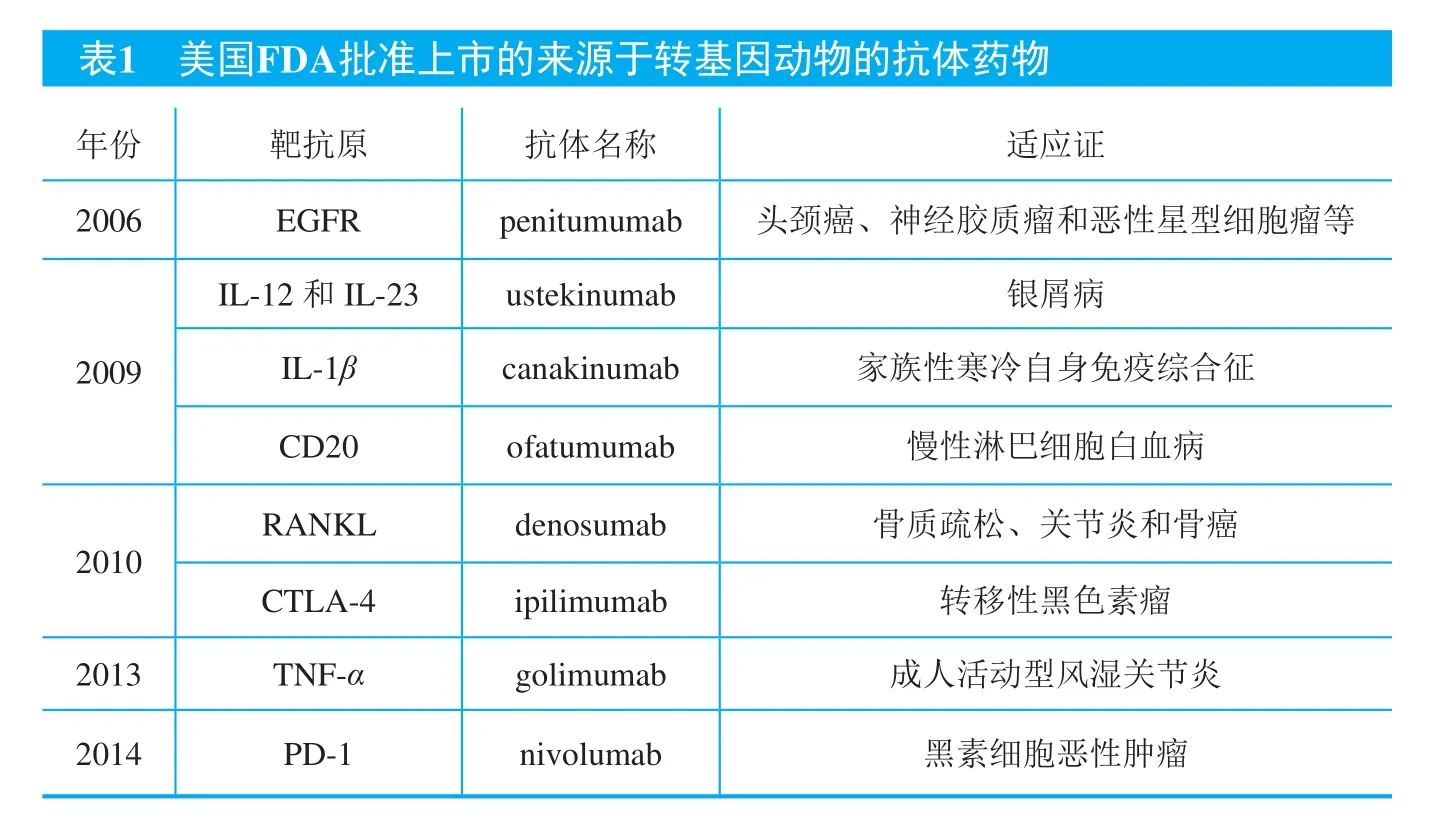
表1 美国FDA批准上市的来源于转基因动物的抗体药物年份 靶抗原 抗体名称 适应证2006 EGFR penitumumab 头颈癌、神经胶质瘤和恶性星型细胞瘤等IL-12和IL-23 ustekinumab 银屑病IL-1β canakinumab 家族性寒冷自身免疫综合征CD20 ofatumumab 慢性淋巴细胞白血病2009 2010 RANKL denosumab 骨质疏松、关节炎和骨癌CTLA-4 ipilimumab 转移性黑色素瘤2013 TNF-α golimumab 成人活动型风湿关节炎2014 PD-1 nivolumab 黑素细胞恶性肿瘤
随着基因编辑技术的快速发展,未来将会在越来越多的物种上培育出人源化抗体转基因动物,其功能特性也将日趋完善,但相关专利保护则是在培育人源化抗体转基因动物初期就需要优先考虑的问题。在相当长的一段时间内,人源化抗体转基因动物仍将是人源化抗体开发的一项核心技术,而人源化抗体转基因大动物和单链抗体转基因动物将是对现有人源化抗体转基因动物的重要补充18。
人源化抗体转基因大动物在短期内可以大量产生特异性抗体,在公共安全事件防控方面具有重要的作用。尽管日本Kyowa Hakko Kirin公司已培育出全人源化转基因牛,但由于其采用的技术存在一定的缺陷,难以稳定遗传,目前尚无法正常使用,需要进一步完善19。在培育大型转基因动物时,除了通用技术外,还需要考虑其繁殖性能、生物净化难易程度等特性。综合考虑,利用猪和兔等大型或高繁殖性能的动物将是未来的重要补充。
来源于驼科的单链抗体转基因动物由于分子量小,穿透力强,能够通过常规抗体无法到达的部位,具有重要的医药价值,已受到广泛的关注。目前,已有多家单位开展单链抗体转基因动物的培养,相信这一领域近期内会取得越来越多的进展。
[本研究项目获国家国际科技合作专项(2013DFA31820)、“863”项目(2014AA021602)、重庆市基础与前沿研究(CSTC2013jcyjC80001)、重庆市国际合作项目(CSTC2013gjhz80002)、重庆市农发资金(12402)资助。]
10.3969/j.issn.1674-0319.2016.06.005
简介
