标本保存方法和时间对促肾上腺皮质激素检测的影响研究
2016-12-09林江
林 江
(江苏省江阴市人民医院检验科 214400)
·临床研究·
标本保存方法和时间对促肾上腺皮质激素检测的影响研究
林 江
(江苏省江阴市人民医院检验科 214400)
目的 探讨标本的不同保存方法和时间对促肾上腺素皮质激素(ACTH)检测结果的影响。方法 试验分3组。1组采集自愿者的乙二胺四乙酸(EDTA)抗凝血标本2例,将离心血浆分别放置4 ℃冰箱及室温(20±5)℃保存,在不同的时间点取出标本进行检测;1组采集自愿者的EDTA抗凝血标本21例,每7例标本分别在冰浴、4 ℃冰箱及室温条件下保存,在不同的时间点进行离心,检测血浆ACTH;1组采集自愿者的EDTA抗凝血标本2例,将标本离心后,放4 ℃冰箱及室温条件下保存,在不同时间点取出一定量上层血浆进行ACTH检测。结果 血浆标本、不同时间点离心的标本、离心后在不同时间点检测的标本,在不同时间点及不同保存方法组间检测结果在24 h内变化差异无统计学意义(P>0.05)。结论 EDTA抗凝标本检测ACTH时,标本室温或4 ℃冰箱放置时,在24 h内检测结果变化相对稳定。
促肾上腺皮质激素; 标本保存; 温度; 时间
血标本的运送与保存是医学检验分析前质量控制的一部分,特别是对某些激素类检测项目,此类检测项目半衰期短,降解快,对标本采集、运送、检测时间等都有特别要求。促肾上腺皮质激素(ACTH)是由腺垂体分泌、维持肾上腺正常形态和功能的重要激素。按照国际临床实验室标准化组织要求,采集ACTH标本应采用冰冻乙二胺四乙酸(EDTA)管,采集后冰浴送检,低温离心机分离血浆和血细胞,然后立即用塑料或硅化玻璃分装冷冻保存或冰冻长期保存[1]。临床检测ACTH多采用节律试验[2],按8、16、24 h的时间点采样,因此,临床标本运送很难按照要求送检,标本到达检验科后也未能立即检验。标本运送保存条件、放置时间及检测的及时性等因素可能对检测结果造成的影响,一直困扰着临床和检验,而对其检测结果的影响研究鲜见报道。本研究将对相关影响因素进行分析,现报道如下。
1 资料与方法
1.1 一般资料 选取门诊自愿者6例,其ACTH值在正常参考范围内;住院患者6例,其中3例患者ACTH值为高值,3例患者ACTH值为低值;本科室自愿者3例,其中ACTH值为正常参考范围。男8例,女7例,中位年龄32岁。
1.2 仪器与试剂 采用西门子IMMULITE 1000 化学发光检测仪及仪器配套的ACTH检测试剂盒。仪器操作严格按照仪器操作规程进行。
1.3 方法 (1)取本院门诊自愿者3例、高值ACTH住院患者1例、低值ACTH住院患者1例,每人晨采集前臂静脉血2例各4 mL于EDTA抗凝管中,混匀后即刻低温离心处理(3 500 r/min,5 min),取血浆于编号的EP管中,置4 ℃及室温(20±5)℃环境下存放,分别于0、2、4、8、12、24 h取150 μL血浆按常规方法分别进行ACTH检测,记录4 ℃及室温环境条件下存放不同时间点血浆标本ACTH的检测结果。(2)准备冰浴,并准备冰浴的EDTA抗凝管,取本科室自愿者3例、高值ACTH住院患者1例、低值ACTH住院患者1例,每人晨采集前臂静脉血3组7例各2 mL于EDTA抗凝管中,混匀后置冰浴、4℃及室温(20±5)℃环境下存放,分别于0、2、4、8、12、24 h各取1例血标本低温离心处理,按常规方法进行ACTH检测,记录冰浴、4 ℃及室温环境条件下不同时间点分离血浆标本ACTH的检测结果。(3)取本院门诊自愿者3例、高值ACTH住院患者1例、低值ACTH住院患者1例,每人晨采集前臂静脉血2例各4 mL于EDTA抗凝管中,混匀后即刻离心,分别置4 ℃及室温(20±5)℃环境下存放,分别于0、2、4、8 、12、24 h取出150 L血浆进行ACTH检测,记录4 ℃及室温环境条件下不同时间点血浆标本ACTH的检测结果。

2 结 果
2.1 不同保存方法血浆标本放置时间对ACTH结果的影响 EDTA抗凝标本检测ACTH,分离后得到的血浆标本在室温(20±5)℃及4 ℃放置到24 h时,各组间检测结果比较差异无统计学意义(F=0.135,P=0.729)。室温组与4 ℃组间检测结果比较差异无统计学意义(F=1.689,P=0.290)。见表1。
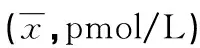
表1 不同保存方法血浆标本放置时间对ACTH结果的影响
2.2 不同保存方法在放置时间点分离血浆对ACTH检测结果的影响 EDTA抗凝标本检测ACTH,冰浴放置、4 ℃放置、室温放置的标本到24 h在不同时间点分离血浆,各组间检测的结果比较差异无统计学意义(F=2.750,P=0.110)。4 ℃放置、室温放置与冰浴放置检测结果间比较差异无统计学意义(F=6.503,P=0.061)。见表2。
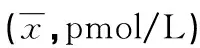
表2 不同保存方法在放置时间点分离血浆检测对ACTH结果的影响
2.3 不同保存方法离心后不同时间点检测对ACTH结果的影响 EDTA抗凝标本检测ACTH项目时,标本离心分离后,分别在室温(20±5)℃及4 ℃放置到24 h时,不同时间点检测,各组间检测的结果变化差异无统计学意义(F=6.063,P=0.057)。室温放置的标本呈下降的趋势,4 ℃组的结果无趋势性变化,但是各组间检测结果比较差异无统计学意义(F=1.381,P=0.428)。见表3。
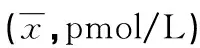
表3 不同保存方法下离心后不同时间点检测对ACTH结果的影响
3 讨 论
ACTH是脊椎动物脑垂体分泌的一种多肽类激素,含39个氨基酸,相对分子质量为4 500×103。其增高可见于原发性肾上腺皮质功能减退症、异位ACTH综合征、库欣症、Nelson综合征、先天性肾上腺皮质增生症等[3]。ACTH降低可见于垂体前叶功能减退症、肾上腺皮质腺瘤或癌、单纯性ACTH缺乏综合征、医源性ACTH减少等[4]。ACTH的临床意义越来越引起临床重视,开展此项目的医院也越来越多,而多数实验室人员专注于分析阶段的质量保证,而分析前阶段的质量环节还存在许多问题值得探讨[5]。
分析前检验标本质量是目前影响检验结果的最大不确定因素[6]。采用放免竞争法检测ACTH的结果不稳定,体现了ACTH免疫原性低、储存稳定性较差、半衰期短及不同抗原决定族的位阻竞争等特性,通常要求标本立即分离、收集血浆,并储存在-20 ℃条件下。多数医院已淘汰放免方法检测ACTH,多采用双抗体夹心化学发光法检测。采用新的检测技术及标记方法,大大提高了检测敏感性和特异性,对标本的要求不再过分苛刻。有研究证明,ACTH在血浆中可稳定较长时间。本研究通过研究标本不同贮存条件及处理时间,分析其对ACTH检测结果的影响,并期在保证分析前质量控制时,找到适合ACTH测定标本的试验前预处理便利方法。有关标本运送及保存对ACTH的影响报道不多。Evans等[7]在研究抗凝血浆于不同保存温度下检测激素类项目标本的稳定性时指出,采用放射免疫法检测ACTH,采用EDTA抗凝管,标本在4 ℃保存时在18 h内的检测结果稳定,在30 ℃保存时结果可稳定8 h。
本研究在考虑标本受储存方式及时间影响的同时,也考虑到标本检测结果可能会受到血细胞影响。研究中,首先立即离心分离采集的EDTA血标本,将分离出的血浆分别放置于4 ℃冰箱及室温(20±5)℃保存,在不同的时间点取出进行检测,并与初次检测结果比较,发现检测结果差异无统计学意义。其次,观察EDTA抗凝标本在冰浴、4 ℃冰箱及室温保存条件下,于不同时间点进行离心检测血浆ACTH,并将检测结果与初次检测结果比较,发现不同组间、不同时间点间的结果差异无统计学意义。最后,观察EDTA抗凝标本离心后,于不同时间点取出一定量血浆进行ACTH检测,结果显示不同时间比较差异无统计学意义。
质量的管控贯穿于患者采样前准备、标本采集、保存、运送等多个过程[8]。影响ACTH检验的可能因素较多,本试验重点研究了标本采用不同处置方式时标本放置时间对检测结果的影响,发现EDTA抗凝血浆的标本检测ACTH时,标本室温或4 ℃冰箱放置在24 h内检测结果相对稳定。笔者认为,目前采用西门子IMMULITE 1000 化学发光检测仪及配套试剂检测ACTH时,标本已不需要冰浴保存送检,在24h内检测可室温送检。但需注意,离心后室温放置的标本,在24 h内的变化差异无统计学意义,但血浆检测结果呈下降趋势,放置时间越长,下降幅度越大。
[1]National Committee for Clinical Laboratory Standards.Procedures for the collection of diagnostic blood specimens by venipuncture[M].4th ed.Wayne,PA,USA:NCCLS,1998.
[2]Richards JB,Sayers G.Fate and excretion of adrenocorticotrophic hormone[J].Proc Soc Exp Biol Med,1951,77(77):87-93.
[3]Yalow RS,Glick SM,Roth J,et al.RADIOIMMUNOASSAY OF HUMAN PLASMA ACTH[J].J Clin Endocrinol Metab,1964,24(11):1219-1225.
[4]巴德年.当代免疫学技术与应用[M].北京:北京医科大学中国协和医科大学联合出版社,1998.
[5]童清,周睿.监测和改善分析阶段外的质量是检验医学面临的挑战[J].中华检验医学杂志,2015,38(11):786-788.
[6]路爱丽,张敏,齐振普.分析前检验标本质量的缺陷及对策[J].国际检验医学杂志,2012,33(21):2668-2669.
[7]Evans MJ,Livesey JH,Ellis MJ,et al.Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones[J].Clin Biochem,2001,34(2):107-112.
[8]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:39-47.
10.3969/j.issn.1673-4130.2016.22.047
A
1673-4130(2016)22-3205-03
2016-04-07
2016-06-13)
