慢性髓性白血病患者骨髓中Notch信号通路的表达*
2016-12-09田登梅刘丽辉张永清
冯 超,田登梅,刘丽辉,施 兵,张永清#
1)河北北方学院 张家口 075000 2)解放军第309医院移植血液科 北京 100091
慢性髓性白血病患者骨髓中Notch信号通路的表达*
冯 超1),田登梅2),刘丽辉2),施 兵2),张永清2)#
1)河北北方学院 张家口 075000 2)解放军第309医院移植血液科 北京 100091
#通信作者,男,1965年7月生,博士,副教授,研究方向:造血干细胞移植,E-mail:zhangyongqing0725@163.com
Notch信号通路;慢性髓性白血病;BCR-ABL 融合基因
目的:探讨慢性髓性白血病(CML)患者骨髓中Notch信号通路的表达水平及临床意义。方法:采用实时荧光定量PCR检测24例CML患者(慢性期12例、急变期12例)和9例正常对照骨髓中Notch1、Notch2、 Delta-like1、Jagged1及Hes1 mRNA的表达。结果:急变期CML患者骨髓中Notch1和Notch2 mRNA表达水平高于正常对照组及慢性期患者(P<0.05),Delta-like1 mRNA表达水平低于正常对照组及慢性期患者(P<0.05)。慢性期及急变期患者骨髓中Jagged1、Hes1 mRNA表达水平高于正常对照组(P<0.05)。Notch1、Notch2、Jagged1、Hes1 mRNA表达水平与CML患者临床特征无关(P>0.05),仅染色体异常的CML患者Delta-like1 mRNA表达水平较染色体正常者升高(P<0.05)。结论:Notch信号通路可能参与了CML的发病和急性变。
慢性髓性白血病(chronic myeliod leukaemia,CML)是造血干细胞恶性克隆性疾病,95%以上患者的骨髓中可以找到特征性的Ph染色体和(或)BCR-ABL 融合基因[1]。CML患者的中位生存期为3~5 a,自然病程可分为慢性期、加速期/急变期,慢性期病情较为隐匿,而进入加速期/急变期,患者往往对治疗反应差,病情进展迅速。有研究[2-8]证实:血液系统肿瘤中存在Notch信号通路的异常活化,其可能与血液肿瘤的发生发展有关;Notch信号通路在血细胞发育过程中调控干细胞的增殖、分化,可以促进脐血造血干细胞的植入。目前在CML中也发现了Notch信号的激活,但关于Notch信号通路在CML中的研究主要集中在细胞系及小鼠模型上。研究[9-11]证实,K562细胞系存在Notch1~4和Jagged2的表达,Notch受体及配体基因转染可抑制K562细胞的生长,诱导凋亡。Notch1活化和 BCR-ABL融合基因的表达缩短了转基因CML小鼠的急淋变周期[12]。在小鼠的骨髓移植模型中,Hes1与BCR-ABL融合基因促进了CML的转变[13]。该研究着重对CML患者Notch信号通路相关基因mRNA的表达水平及临床意义进行了研究。
1 对象与方法
1.1 研究对象 选取2014年4月至2015 年8月解放军第309医院血液科收治的CML患者,慢性期12例,男8例,女4例,中位年龄34岁;急变期12例,男10例,女2例,中位年龄45岁。诊断标准参照《慢性髓性白血病治疗专家共识(2010版)》[12]。以9例血常规1系或多系异常、骨髓穿刺报告为正常者作为正常对照,男3例,女6 例,中位年龄44岁。
1.2 主要试剂和仪器 红细胞裂解液购自碧云天生物技术有限公司,Trizol试剂购自美国Invitrogen 公司,PrimeScriptTMRT Master Mix试剂盒、SYRB Premix Ex TaqTMⅡ试剂盒购自大连宝生物有限公司,Prism Real Time 7500 PCR 扩增仪为美国ABI公司产品。
1.3 染色体核型分析 收集患者骨髓细胞,培养24 h后常规制片,R显带,每份标本至少分析20 个分裂相,根据《细胞遗传学国际命名体制( ISCN1995)》判定核型。
1.4 脊髓中Notch1、Notch2、 Delta-like1、Jagged1及Hes1 mRNA检测
1.4.1 RNA提取及cDNA合成 无菌条件下采集骨髓标本3~4 mL,EDTA 抗凝,加入红细胞裂解液,离心去上清后,提取单个核细胞。以Trizol提取细胞总RNA,紫外分光光度法检测RNA浓度及纯度。逆转录体系包括: 5×PrimeScriptTMRT Master Mix 2 μL,RNA浓度最大为500 mg/L,双蒸水补至10 μL。反应条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ ∞。合成的cDNA 置于-20 ℃保存备用。
1.4.2 引物设计与合成 引物均由上海生工生物工程技术有限公司合成,序列见表1。

表1 引物序列
1.4.3 实时荧光定量PCR 采用SYBR Green Ⅰ荧光染料法检测。反应体系包括2×SYRB Premix Ex TaqTMⅡ 10 μL,Rox Reference DyeⅡ 0.4 μL,上、下游引物(10 μmol/L)各1 μL,cDNA 2 μL,加无RNase水至20 μL。反应参数:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,42个循环。以GAPDH作为内参照。每份标本均设3个复孔,每次扩增均设立内参照和无模板阴性对照。结果采用2-ΔΔCt法表示,ΔΔCt =(目的基因Ct-内参基因Ct)实验组-(目的基因Ct-内参基因Ct)对照组。
1.5 统计学处理 采用SPSS 16.0进行统计分析。正常对照,CML慢性期、急变期患者间各mRNA表达水平的比较采用单因素方差分析,两两比较采用LSD-t检验;不同临床特征CML患者各mRNA表达水平的比较采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 CML慢性期、急变期患者及正常对照骨髓中Notch1、Notch2、Jagged1、Delta-like1、Hes1 mRNA表达水平的比较 见表2。与正常对照比较,慢性期CML患者骨髓中Jagged1、Hes1 mRNA表达水平升高(P<0.05);急变期CML患者骨髓中Notch1、Notch2、Jagged1、Hes1 mRNA表达水平升高, Delta-like1 mRNA表达水平降低(P<0.05)。与慢性期组比较,急变期CML患者骨髓中Notch1、Notch2表达水平升高, Delta-like1 mRNA表达水平降低(P<0.05)。
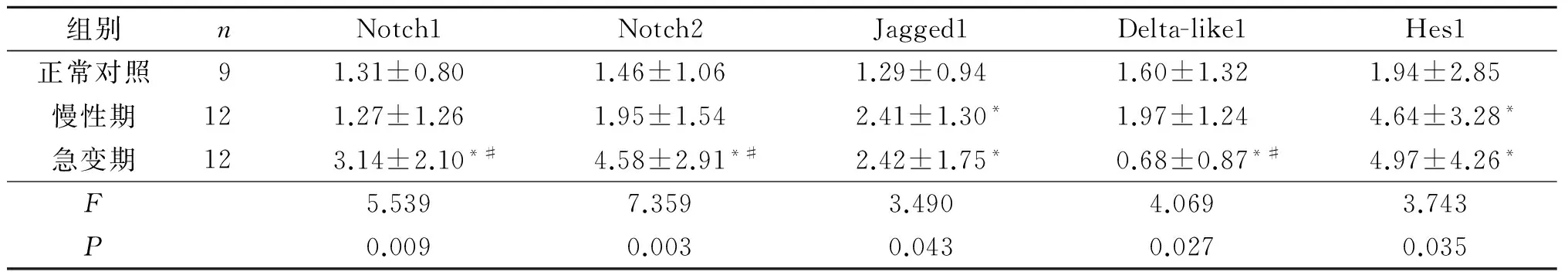
表2 CML慢性期、急变期患者及正常对照骨髓中Notch1、Notch2、Jagged1、Delta-like1、Hes1 mRNA表达水平的比较
*:与正常对照比较,P<0.05;#:与慢性期比较,P<0.05。
2.2 不同临床特征CML患者Notch1、Notch2、Jagged1、Delta-like1、Hes1 mRNA表达水平的比较
见表3。Notch相关基因mRNA的表达与CML患者性别、白细胞计数、BCR-ABL1/ABL1阳性与否无关(P>0.05),仅Delta-like1在染色体异常患者中表达升高(P<0.05)。
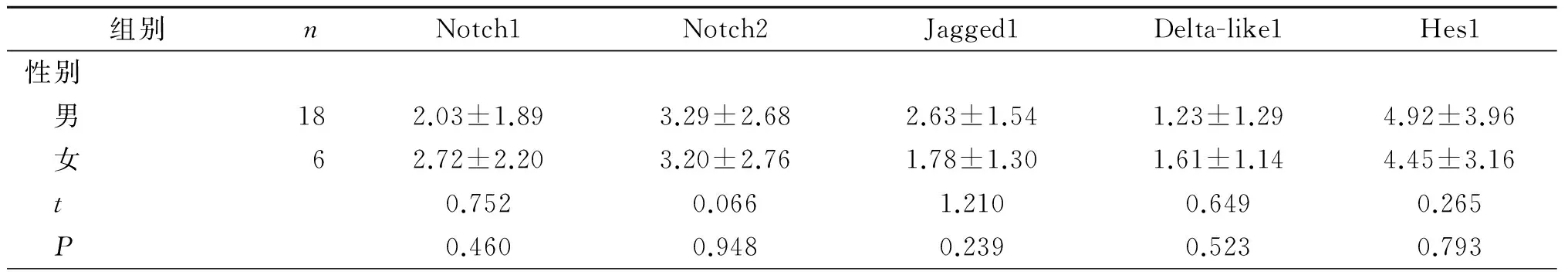
表3 不同临床特征CML患者Notch1、Notch2、Jagged1、Delta-like1、Hes1 mRNA表达水平的比较
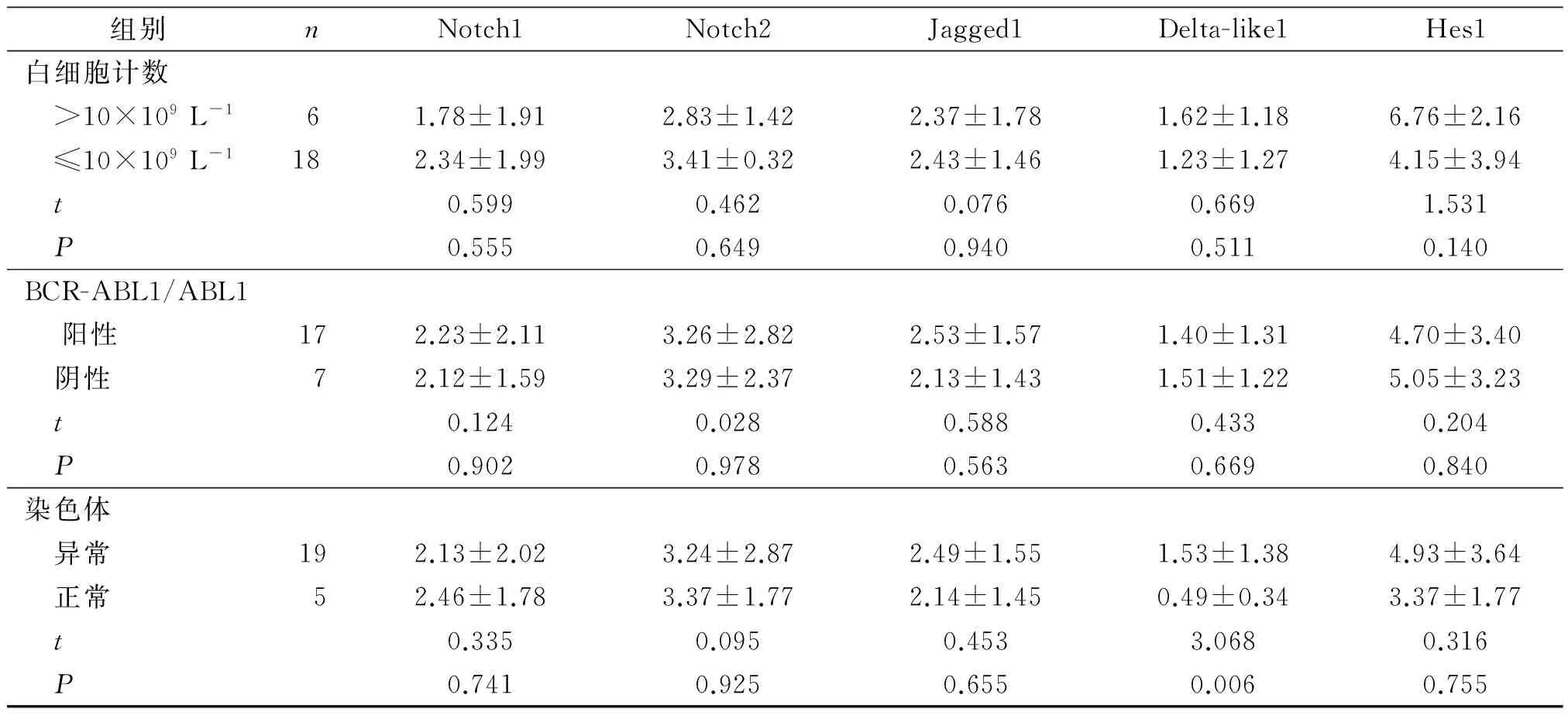
续表3
3 讨论
Notch信号通路广泛存在于动物体内并高度保守,在细胞增殖、分化和凋亡中发挥重要作用。Notch信号通路是由受体、配体、细胞内效应分子CSL蛋白(CBF-1,suppressor of hairless,Lag1,3者的合称)以及多种下游靶基因组成。在哺乳动物中存在4个Notch受体(Notch1~4)和5个配体(Jagged1、2及Delta-like1、3、4)。Notch受体主要表达于造血干/祖细胞,其配体主要表达于基质细胞,二者结合后释放Notch受体胞内段(intracellular domain of Notch,ICN),ICN 与CSL DNA 结合蛋白相互作用,形成活化因子,进而调节下游靶基因的表达,从而调控机体的正常造血功能,当其异常活化时则可导致恶性血液增殖性疾病。目前研究发现,越来越多的恶性血液系统肿瘤与Notch 信号通路的活化关系密切[14]。急性T淋巴细胞白血病患者几乎全部高表达Notch受体,约50%的患者存在Notch1基因突变[3-4]。慢性B淋巴细胞白血病患者存在Notch1、Notch2及Jagged1、Jagged2的活化,而正常B细胞中未见该现象,表明Notch信号参与慢性B淋巴细胞白血病细胞的存活及抗凋亡作用[5-6]。在经典的霍奇金淋巴瘤中,Notch1及Jagged1高表达,Notch信号通路参与了体外霍奇金淋巴瘤细胞的增殖及存活[7]。
CML是起源于造血干细胞的克隆增殖性疾病,其疾病的进展被认为是多步骤、时间依赖性的,并需要基因的突变或失调参与[15]。在CML中发现也存在Notch信号通路的激活[9-13,16]。该研究对CML患者体内Notch信号通路的表达进行了分析。结果显示,慢性期患者骨髓中Jagged1和Hes1 mRNA的表达高于正常对照,与急变期患者比较差异无统计学意义;与正常对照、慢性期患者相比,CML急变期患者骨髓中Notch1、Notch2 mRNA的表达显著增高,Delta-like1 mRNA的表达降低;CML患者Notch基因的表达水平与患者性别、白细胞计数、BCR-ABL1/ABL1阳性与否无关,仅染色体异常患者骨髓中Delta-like1 mRNA表达水平升高。研究结果提示,Notch信号通路的配体Jagged1和下游靶基因Hes1可能参与了慢性期CML的发生和发展,但没有参与慢性期向急变期的转变;而Notch1、Notch2、Delta-like1可能参与了CML的进展。
Aljedai等[17]对4例慢性期CML患者和3例正常对照的骨髓进行了测定,但结果显示,CD34+Thy+细胞中Notch1 mRNA表达上调,CD34+Thy+、CD34+Thy-细胞中Notch2 mRNA表达上调。Aljedai等的研究结果与此次结果不同,原因可能有:①所采用的骨髓标本不一致,骨髓的单个核细胞是混合细胞,既包括CML细胞,也包括正常的造血干细胞。②标本取自原代细胞,而患者之间存在着明显的个体差异。③病例数较少。
Nakahara等[18]对20例急变期CML患者的样本(11例外周血,1例脑脊液,8例骨髓)进行分析,发现Hes1 mRNA表达水平明显高于正常,而19例慢性期CML患者的骨髓样本中Hes1 mRNA表达水平则低于正常。但是,Aljedai等[17]研究发现在慢性期CD34+CML患者的骨髓样本中,Hes1的表达水平增加。Sengupta等[19]发现在急变期CD34+CML患者体内Hes1表达水平显著降低,下调的Hes1促进了CML的急变。造成上述研究结果差异较大的原因可能为:①标本不一致,外周血、脑脊液、骨髓均有。②研究的分子水平不一致,既在单个核细胞水平上,又在CD34水平上。③多种信号通路(如Sonic Hedgehog通路)调控或参与Hes1的表达,其他信号通路的激活或失活也可影响Hes1的表达。
综上所述,CML慢性期、急变期存在Notch信号通路的异常表达,其可能参与了CML的发病及急性变转化,但Notch信号通路异常表达的原因及其在CML发病及进展中的具体作用机制尚不是很清晰,需要进一步研究。
[1]慢性髓性白血病治疗专家共识(2010版)[J] .中华血液学杂志,2010,31(3):214
[2]田登梅,梁英民,韩骅,等.内皮细胞靶向的可溶性Notch配体hD1R蛋白对脐血造血干/祖细胞增殖及植入的影响[J].中华血液学杂志,2014,35(10):885
[3]WENG AP,FERRANDO AA,LEE W,et al.Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia[J].Science,2004,306(5694):269
[4]BREIT S,STANULLA M,FLOHR T,et al.Activating NOTCH1 mutations predict favorable early treatment response and long-term outcome in childhood precursor T-cell lymphoblastic leukemia[J].Blood,2006,108(4):1151
[5]FABBRI G,RASI S,ROSSI D,et al.Analysis of the chronic lymphocytic leukemia coding genome: role of NOTCH1 mutational activation[J].J Exp Med,2011,208(7):1389
[6]ROSATI E,SABATINI R,RAMPINO G,et al.Constitutively activated Notch signaling is involved in survival and apoptosis resistance of B-CLL cells[J].Blood,2009,113(4):856
[7]JUNDT F,SCHWARZER R,DÖRKEN B.Notch signaling in leukemias and lymphomas[J].Curr Mol Med,2008,8(1):51
[8]岳宗进,刘汝银,于露,等.miR146通过靶向Notch1促进骨髓间充质干细胞向髓核样细胞分化[J].西安交通大学学报(医学版),2016,37(5):663
[9]YIN DD,FAN FY,HU XB,et al.Notch signaling inhibits the growth of the human chronic myeloid leukemia cell line K562[J].Leuk Res,2009,33(1):109
[10]LIAO WR,HSIEH RH,HSU KW,et al.The CBF1-independent Notch1 signal pathway activates human c-myc expression partially via transcription factor YY1[J].Carcinogenesis,2007,28(9):1867
[11]YANG Z,YANG C,ZHANG S,et al.Notch2 inhibits proliferation of chronic myeloid leukemia cells[J].Oncol Lett,2013,5(4):1390
[12]MIZUNO T,YAMASAKI N,MIYAZAKI K,et al.Overexpression/enhanced kinase activity of BCR/ABL and altered expression of Notch1 induced acute leukemia in p210BCR/ABL transgenic mice[J].Oncogene,2008,27(24):3465
[13]NAKAHARA F,KITAURA J,UCHIDA T,et al.Hes1 promotes blast crisis in chronic myelogenous leukemia through MMP-9 upregulation in leukemic cells[J].Blood,2014,123(25):3932
[14]胡彦伟,张明智,曹玲,等.Notch信号分子在人NK细胞淋巴瘤细胞中的表达及其意义[J].吉林大学学报(医学版),2013,39(4):657
[15]ALBAJAR M,GMEZ-CASARES MT,LLORCA J,et al.MYC in chronic myeloid leukemia: induction of aberrant DNA synthesis and association with poor response to imatinib[J].Mol Cancer Res,2011,9(5):564
[16]芮红兵,张汉花,石丽芳,等.DLL4/Notch1配体过表达抑制K562细胞生长机制研究[J].中国实验血液学杂志,2014,22(5):1256
[17]ALJEDAI A,BUCKLE AM,HIWARKAR P,et al.Potential role of Notch signalling in CD34+chronic myeloid leukaemia cells:cross-talk between Notch and BCR-ABL[J].PLoS One,2015,10(4):e0123016
[18]NAKAHARA F,SAKATA-YANAGIMOTO M,KOMENO Y,et al.Hes1 immortalizes committed progenitors and plays a role in blast crisis transition in chronic myelogenous leukemia[J].Blood,2010,115(14):2872
[19]SENGUPTA A,BANERJEE D,CHANDRA S,et al.Deregulation and cross talk among Sonic hedgehog, Wnt, Hox and Notch signaling in chronic myeloid leukemia progression[J].Leukemia,2007,21(5):949
(2016-01-13收稿 责任编辑王 曼)
Expression of Notch signal pathway in bone marrow from patients with chronic myeliod leukaemia
FENGChao1),TIANDengmei2),LIULihui2),SHIBing2),ZHANGYongqing2)
1)HebeiNorthUniversity,Zhangjiakou075000 2)DepartmentofHematology,the309thHospitalofPLA,Beijing100091
Notch signal pathway;chronic myeliod leukaemia;BCR-ABL fusion gene
Aim: To explore the expression of Notch signal pathway in bone marrow from patients with chronic myeliod leukaemia(CML).Methods: Bone marrow from 24 cases of CML(including 12 cases of chronic phase,12 cases of blast crisis) and 9 subjects as control were collected to detect mRNA expression of Notch1,Notch2,Delta-like1,Jagged1,and Hes1 using RT-qPCR.Results: The expression levels of Notch1 and Notch2 mRNA in blast crisis patients were both significantly higher than those in chronic phase patients and the control group(P<0.05),while the expression level of Delta-like1 mRNA was lower(P<0.05).The expression level of Jagged1 and Hes1 mRNA in chronic phase and blast crisis patients were significantly higher than those in the control group(P<0.05).The expression levels of Notch1,Notch2,Jagged1,and Hes1 mRNA in CML patients did not related to clinical parameters(P>0.05),but Delta-like1 mRNA expressed highly in patients with abnormal karyotype(P<0.05).Conclusion: Notch signal pathway may play roles in the pathogenesis and blast crisis of CML.
10.13705/j.issn.1671-6825.2016.06.012
*国家自然科学基金项目 81400075;解放军第309医院重点课题 2014ZD-002
R733.72