棘托竹荪抑菌物质的乙醇提取工艺优化与抑菌作用
2016-12-09张璞瑜蒋达青张立钦林海萍
张 爽,张璞瑜, 蒋达青, 张 媚,张立钦, 林海萍
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;2.浙江农林大学 生物农药高效制备技术国家地方联合工程实验室,浙江 临安311300)
棘托竹荪抑菌物质的乙醇提取工艺优化与抑菌作用
张 爽1,2,张璞瑜1,2, 蒋达青1,2, 张 媚1,2,张立钦1,2, 林海萍1,2
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;2.浙江农林大学 生物农药高效制备技术国家地方联合工程实验室,浙江 临安311300)
为研究棘托竹荪Dictyophora echinovolvata乙醇提取物对食品腐败菌和植物病原菌的抑菌作用,以不同体积分数乙醇溶液为提取剂,对棘托竹荪子实体进行浸提,通过单因素和正交试验测定了乙醇体积分数、料液比、浸提时间和浸提温度等4个因素对棘托竹荪提取物抑菌效果的影响,获得的最佳提取工艺为乙醇体积分数90%,料液比50.0 g·L-1,浸提时间2.0 h,浸提温度75℃。用牛津杯法和菌丝生长速率法分别测定了棘托竹荪乙醇提取液对食品腐败菌与植物病原菌的抑菌作用。结果表明:棘托竹荪乙醇提取液对食品腐败细菌和植物病原真菌均具有抑制作用,但对啤酒酵母不表现抑制作用。在供试的4种食品腐败细菌中,抑菌效果从高到低依次是金黄色葡萄球菌Staphylococcus aureus,枯草芽孢杆菌Bacillus subtilis,蜡状芽孢杆菌Bacillus cereus,大肠埃希菌Escherichia coli,抑菌圈直径分别为24.08,23.12,23.02和22.16 mm,可见棘托竹荪乙醇提取液对革兰氏阳性细菌的抑菌效果显著大于革兰氏阴性细菌。在供试的5种植物病原真菌中,抑菌效果从高到低依次为玉米大斑病菌Exserohilum turcicum,油菜菌核病菌Sclerotinia sclerotiorum,番茄灰霉病菌Botrytis cinerea,小麦赤霉病菌Fusarium graminearum,苹果腐烂病菌Valsa mali,抑菌率分别为75.01%,57.67%,49.65%,21.34%和9.26%,且五者间均存在显著性差异(P<0.05),可见棘托竹荪乙醇提取液对真菌的抑菌作用因菌种而异。图4表4参16
微生物学;棘托竹荪;乙醇提取;工艺优化;抑菌作用;食品腐败菌;植物病原菌
棘托竹荪Dictyophora echinovolvata属担子菌门Basidiomycotina腹菌纲Gasteromycetes鬼笔科Phallaceae竹荪属Dictyophora真菌,是中国科学工作者发现并于1988年定名的新种[1]。棘托竹荪是一种名贵的食用菌,香气浓郁,脆嫩爽口,并具有降低血液中脂肪、胆固醇和延缓食品腐败的功能[2]。卢惠妮等[3]研究发现棘托竹荪提取物对5种常见的食源性致病菌均具有明显抑制作用,抑菌率从大到小依次为副溶血弧菌Vibrio parahaemolyticus,单增李斯特菌Listeria monocytogenes,大肠埃希菌Escherichia coli O157:H7,肠炎沙门氏菌Salmonella enteritidis,金黄色葡萄球菌Staphylococcus aureus。棘托竹荪提取物同时具有较高的热稳定性和广泛的pH值稳定性;刘文波等[4]利用超声波辅助破碎竹荪干粉,制取水、乙醇和石油醚为提取介质的浸提物以及竹荪挥发油,利用液体培养基连续稀释法对5种供试菌:大肠埃希菌、肠炎沙门菌、副溶血性弧菌、金黄色葡萄球菌和单增李斯特菌等进行抑菌实验,结果所有提取物对供试菌都具有抑菌活性;梁鸣等[5]报道棘托竹荪醇提取物抑菌效果优于水提取物。尽管目前国内外对棘托竹荪的研究已比较广泛,但对乙醇提取工艺的优化研究还比较少,且目前对于竹荪抑菌作用的研究绝大多数还集中在对食品腐败菌的研究,对植物病原菌的抑菌研究尚未见报道。本研究对棘托竹荪抑菌活性物质的乙醇提取工艺进行优化,测定了提取液对常见食品腐败菌与部分植物病原真菌的抑制效果,以期为利用竹荪开发成天然的食品防腐剂和生物农药奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试材料 棘托竹荪子实体干品购于浙江菇尔康食用菌有限公司,鼓风干燥箱60℃烘干至恒量,粉碎物过80目筛,密封避光保存。
1.1.2 供试菌 选用常见食品腐败菌:大肠埃希菌,金黄色葡萄球菌,枯草芽孢杆菌Bacillus subtilis,蜡状芽孢杆菌Bacillus cereus和啤酒酵母Saccharomyces cerevisiae;部分植物病原真菌:玉米大斑病菌Exserohilum turcicum,油菜菌核病菌Sclerotinia sclerotiorum,番茄灰霉病菌Botrytis cinerea,苹果腐烂病菌Valsa mali和小麦赤霉病菌Fusarium graminearum为供试菌。菌种由生物农药高效制备技术国家地方联合工程实验室与浙江农林大学林业与生物技术学院微生物学实验室提供。
1.1.3 培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200.00 g,葡萄糖20.00 g,琼脂20.00 g。马铃薯去皮切成块煮30 min,用纱布过滤取汁,加葡萄糖和琼脂溶化,补水至1 000 mL,pH值自然。Luria-Bertani(LB)培养基:胰化蛋白胨10.00 g,酵母提取物5.00 g,氯化钠10.00 g,补水至1 000 mL,pH值自然。培养基121℃蒸汽灭菌20 min备用。
1.2 方法
1.2.1 提取方法 取棘托竹荪粉末10.00 g,分别按照33.3,40.0,50.0,66.7,100.0 g·L-1的料液比加入60.0,70.0,80.0,90.0,1 000.0 g·kg-1的乙醇水溶液,混匀后置于60,65,70,75,80℃水浴锅中处理1.5,2.0,2.5,3.0,3.5 h,过滤,所得滤渣再按原条件进行抽提,过滤,弃滤渣,合并2次滤液,
过滤除菌浓缩到10.0 mL,置于4℃下保存备用。
1.2.2 抑菌试验 ①供试菌株的准备。在无菌室中将供试菌株接入相应斜面培养基上,细菌37℃恒温培养18~24 h,植物病原真菌、酵母菌在30℃恒温培养44~48 h后备用。②供试菌悬液制备。用接种环挑取少许菌体于装有9.0 mL无菌水的试管内,制成菌悬液。细菌用麦氏比浊法计数,酵母菌用血球计数板计数,调整菌悬液比例为含细胞(或孢子)量109~1010个·L-1。③对食品腐败菌抑菌作用测定。吸取0.2 mL供试细菌悬液涂布于LB平板上,37℃培养18~24 h,0.2 mL啤酒酵母涂布于PDA平板上,30℃培养48 h,采用祖若夫等[6]的牛津杯法测定抑菌圈,重复3次。④对植物病原真菌的抑制率测定。吸取0.2 mL质量浓度为100.0 g·L-1棘托竹荪提取液涂布于PDA平板上制成含药培养基平板,在对照上则涂布相同体积的溶剂;用打孔器取直径为8 mm的供试菌菌饼,移至含药培养基平板中央,使菌饼培养基面向上;置于26℃培养44~48 h,采用欧阳桐娇等[7]的菌丝生长速率法测定菌落直径,重复3次,用公式(1)计算抑菌率。

1.2.3 提取工艺优化试验 ①乙醇体积分数对提取物抑菌能力的影响。准确称取10.00 g竹荪粉末,以50.0 g·L-1的料液比分别加入到体积分数为60%,70%,80%,90%和100%的乙醇水溶液中,于80℃水浴2 h后过滤,收集滤渣,用滤渣代替竹荪粉末,用相同的方法再处理1次,合并2次的滤液,过滤并浓缩至10.0 mL。按照方法1.2.2节中③以金黄色葡萄球菌作为指示菌种测定提取液的抑菌圈直径。②料液比对提取物抑菌能力的影响。准确称取10.00 g竹荪粉末,分别以33.3,40.0,50.0,66.7,100.0 g·L-1的料液比加入到体积分数90%乙醇水溶液中,于80℃水浴2.0 h后过滤,之后操作同①。③浸提时间对提取物抑菌能力的影响。准确称取10.00 g竹荪粉末,以50.0 g·L-1的料液比加入到体积分数为90%乙醇水溶液中,于80℃分别水浴1.5,2.0,2.5,3.0,3.5 h后过滤,之后操作同①。④浸提温度对提取物抑菌能力的影响。准确称取10.00 g竹荪粉末,以50.0 g·L-1的料液比加入到体积分数90%乙醇水溶液中,分别于60,65,70,75和80℃水浴2.5 h后过滤,之后操作同①。⑤多因素正交试验。选择乙醇体积分数(A),浸提温度(B),料液比(C),浸提时间(D)4个因素进行4因素3水平正交设计,采用L9(34)正交表进行正交试验以确定最佳工艺参数(表1)。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
2 结果与分析
2.1 单提取工艺因素试验结果
2.1.1 乙醇体积分数对提取物抑菌能力的影响 乙醇提取液对金黄色葡萄球菌的抑菌结果见图1。从图1可见:随着乙醇体积分数的加大,抑菌效果不断增强,乙醇体积分数从60%~90%时,抑菌圈直径显著增加(P<0.05),而乙醇体积分数为90%~100%时,抑菌圈直径增加不显著,综合考虑工艺成本,确定90%乙醇水溶液为竹荪提取溶剂。乙醇体积分数的差异造成抑菌圈直径的显著差异,可能是因为不同体积分数乙醇提取液的抑菌成分存在差异,乙醇体积分数高更有利于抑菌物质的浸出。
2.1.2 料液比对提取物抑菌能力的影响 从图2可以看出:随着料液比的增加,提取液的抑菌效果不断下降,料液比从33.3 g·L-1到40.0 g·L-1和50.0 g·L-1,从66.7 g·L-1到100.0 g·L-1,抑菌圈直径降低均不显著,而料液比从50.0 g·L-1到66.7 g·L-1,抑菌圈直径显著降低(P<0.05),因此确定在料液比为50.0 g·L-1时进行抑菌物质的提取。固液提取中,料液比的大小在较大程度上影响着传质的效率和速度,浓度差是提取过程的一个推动力,保持良好的浓度差可得到较好的提取效果[8]。
2.1.3 浸提时间对提取物抑菌能力的影响 分别浸提1.5,2.0,2.5,3.0与3.5 h后,乙醇提取液对金黄色葡萄球菌的抑菌结果见图3。由图3可得:随着浸提时间的增加,提取液的抑菌效果不断上升,提取时间从1.5 h增加到2.0 h,从2.5 h增加到3.0 h和3.5 h,抑菌圈直径增加均不显著,而提取时间从2.0 h增加到2.5 h,抑菌圈直径显著增加(P<0.05)。综合考虑时间成本,确定提取时间为2.5 h。

图1 不同体积分数乙醇提取液对金黄色葡萄球菌的抑菌圈直径的影响Figure 1 Effect of ethanol concentration on the inhibitory zone diameter of Staphylococcus aureus
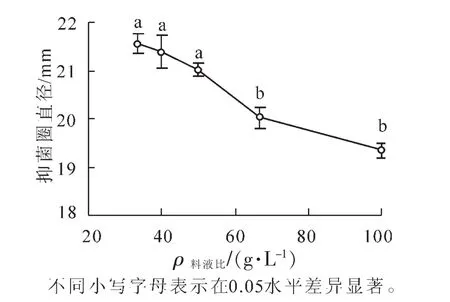
图2 不同料液比提取液对金黄色葡萄球菌的抑菌圈直径的影响Figure 2 Effect of material and resolvent ration on the inhibitory zone diameter of S.aureus
2.1.4 浸提温度对提取物抑菌能力影响 从图4可见:随着浸提温度的升高,提取液的抑菌效果不断上升,提取温度从60℃增加到65℃和70℃,抑菌圈直径显著增加(P<0.05),而提取温度从70℃增加到75℃和80℃,抑菌圈直径增加均不显著,综合考虑能源成本,确定提取温度为70℃。提取温度是影响浸出效果的重要因素,温度高有利于有效成分的溶解和渗透扩散,促进其浸出[9]。

图3 不同浸提时间提取液对金黄色葡萄球菌的抑菌圈直径的影响Figure 3 Effect of ethanol water bath time on the inhibitory zone diameter of S.aureus
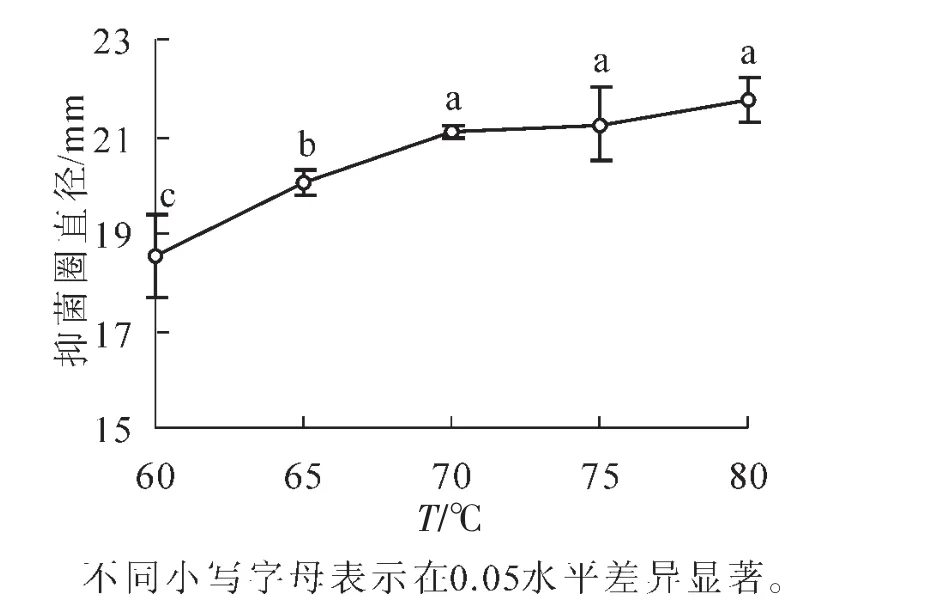
图4 不同浸提温度提取液对金黄色葡萄球菌的抑菌圈直径的影响Figure 4 Effect of ethanol water bathtemperature on the inhibitory zone diameter of S.aureus
2.2 多提取因素正交试验结果
以金黄色葡萄球菌为测试菌株,对棘托竹荪子实体的提取工艺进行乙醇体积分数、料液比、浸提时间、浸提温度等4个因素的3个水平进行正交实验测试,结果见表2。从表2极差分析结果可知:影响竹荪有效成分提取率的主次因素顺序为A(乙醇体积分数)>D(浸提温度)>B(料液比)>C(浸提时间),A2B3C1D3为提取参数因子的最佳组合,即乙醇体积分数为90%,料液比为40.0 g·L-1,浸提时间为2.0 h,浸提温度75℃。
对4个因素进行方差分析,结果见表3。从表3可见:A和D因子对提取液抑菌效果有显著性影响(P<0.05),B和C因子对提取液抑菌没有显著性影响。说明乙醇体积分数、浸提温度对竹荪中抑菌物质的提取效果起主要作用。
2.3 抑菌效果
按照正交实验优化的提取工艺对棘托竹荪的抑菌物质进行提取,测得的它对食品腐败菌和植物病原真菌的抑菌结果分别见表4~5。由表4可见:棘托竹荪乙醇提取液对食品腐败细菌均具有抑制作用,但对啤酒酵母不表现抑制作用。在供试的4种食品腐败细菌中,抑菌效果从高到低依次是金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌和大肠埃希菌。其中提取物对金黄色葡萄球菌的抑菌圈直径显著大于
枯草芽孢杆菌与蜡状芽孢杆菌(P<0.05),同时提取物对这3种革兰氏阳性菌(G+)的抑菌圈直径亦显著大于革兰氏阴性菌(G-)大肠埃希菌(P<0.05),可见在当前优化工艺下,棘托竹荪乙醇提取液对革兰氏阳性菌的抑制效果显著大于对革兰氏阴性菌的抑制效果。

表2 正交试验结果Table 2 Design and results of orthogonal experiment
从表5可知:棘托竹荪乙醇提取液对供试5种植物病原真菌菌丝生长的抑制效果从高到低依次为玉米大斑病菌、油菜菌核病菌、番茄灰霉病菌、小麦赤霉病菌和苹果腐烂病菌,且五者间的差异均为显著(P<0.05),可见棘托竹荪乙醇提取液对真菌菌丝生长具有广谱的抑制作用,但抑制作用强弱因真菌种类而异。
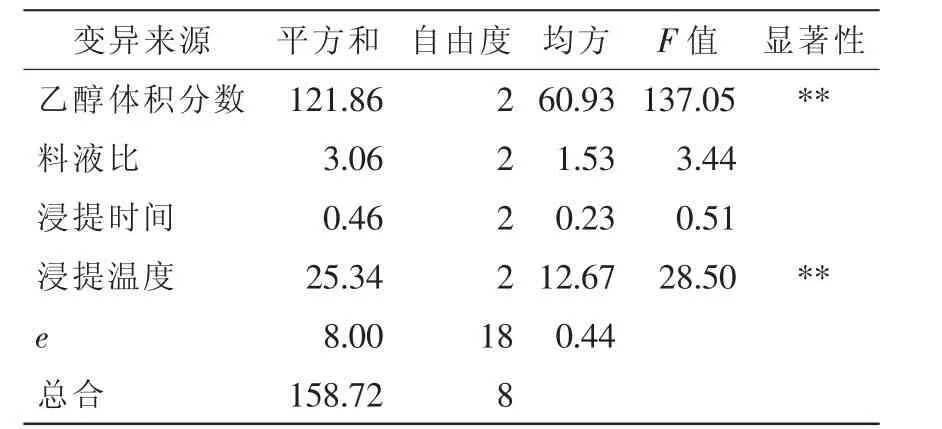
表3 正交实验方差分析表Table 3 VARA analyze of orthogonal experiment
3 结论与讨论
获得棘托竹荪子实体抑菌物质提取优化工艺为:乙醇体积分数90%,料液比40.0 g·L-1,浸提时间2.0 h,浸提温度75℃。极差分析确定影响竹荪有效成分提取率效率的主次因素顺序为A(乙醇体积分数)>D(浸提温度)>B(料液比)>C(浸提时间),A2B3C1D3为提取参数因子的最佳组合,即乙醇体积分数为90%,料液比为40.0 g·L-1,浸提时间为2.0 h,浸提温度75℃。方差分析发现乙醇体积分数和浸提温度对竹荪抑菌有效成分提取起关键作用。
本研究结果表明:棘托竹荪乙醇浸提液对食品腐败细菌有明显抑菌效果,但对啤酒酵母不表现抑制作用,该结果与郝景雯等[10-11]和宋飞飞等[12]的研究结论一致。棘托竹荪乙醇浸提液对4种供试细菌的抑菌效果从强到弱依次是金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌和大肠埃希菌,与林陈强[13]报道的结果一致。可见,革兰氏阳性菌相对革兰氏阴性菌对棘托竹荪乙醇提取物质更敏感。革兰氏阳性菌和
革兰氏阴性菌细菌对棘托竹荪乙醇提取物的敏感性差异可能与革兰氏阳性菌和革兰氏阴性菌的细胞壁结构与组成的差异有关。棘托竹荪乙醇提取物对革兰氏阳性菌的抑制机理值得进一步探明。
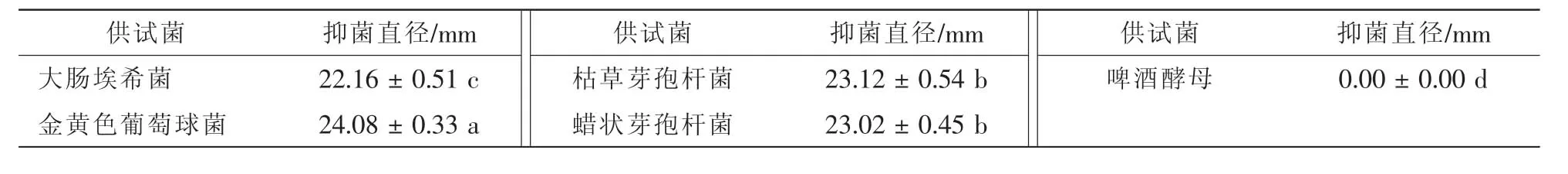
表4 棘托竹荪醇提物对供试细菌、酵母菌的抑菌圈直径Table 4 Antimicrobial activity of the ethanol extract on tested bacteria and Saccharomyces cerevisiae

表5 棘托竹荪醇提物对供试植物病原真菌的抑菌率Table 5 Antimicrobial activity of the ethanol extract on phytopathogenic fungi
本研究发现:竹荪醇提物对5种植物病原真菌均具有一定抑制作用,其中对植物生产危害性大的玉米大斑病菌、油菜菌核病菌、番茄灰霉病菌等3种植物病原菌抑制效果较好,因此,竹荪具有开发成生物农药的较大潜力。
梁鸣等[5]研究认为:棘托竹荪丙酮提取物的化学成分主要成分为酮、有机酸、倍半萜、酯等,其中酮类物质占主导地位,其对细菌抑菌作用明显,而对霉菌和酵母菌抑菌作用不明显。罗盛莲等[14]研究表明:棘托竹荪乙酸乙酯浸膏水溶液的主要成分是脂肪酸及其酯类、烯烃、邻苯二甲酸酯类、酚类和酮类,其中有机酸和芳香酯类含量较多,对供试的细菌、霉菌和酵母菌均有明显抑菌作用。迄今为止,棘托竹荪乙醇提取物中抑菌活性物质的化学成分尚未明确,值得进一步探讨。
由于竹荪本身是一种名贵食用菌,具有较大的食用与保健功能,其可食部分价格较高,为竹荪开发利用带来了一定的阻力,但是竹荪采收加工时,菌盖和菌托均被弃而不用,而这2部分占总生物量的60%以上[15]。檀东飞等[16]用水蒸汽蒸馏法提取棘托竹荪菌托干品挥发油,表明其挥发油对受试的霉菌、酵母菌、细菌都有强的抑菌作用,若棘托竹荪的菌盖和菌托可提取抑菌活性物质而加以利用,可变废为宝。这些都值得进一步深入研究。
[1] 上海农业科学院食用菌研究所.中国食用菌志[M].北京:中国林业出版社,1991:271.
[2] 暴增海,周超,夏振强,等.棘托竹荪发酵液的抑菌作用研究[J].北方园艺,2010(3):171-173.
BAO Zenghai,ZHOU Chao,XIA Zhenqiang,et al.Study on bacteriostatic action of Dictyophora echinovolvata fermentation broth[J].Northern Hortic,2010(3):171-173.
[3] 卢惠妮,潘迎捷,孙晓红,等.棘托竹荪子实体抑菌活性的研究[J].食品科学,2009,30(15):120-123.
LU Huini,PAN Yingjie,SUN Xiaohong,et al.Antibacterial activity of water extract of Dictyophora echinovolvata fruitbody[J].Food Sci,2009,30(15):120-123.
[4] 刘文波,赵勇,孙晓红,等.竹荪提取物对食源性细菌的抑菌特性研究[J].微生物学杂志,2013,33(4):50-54.
LIU Wenbo,ZHAO Yong,SUN Xiaohong,et al.Inhibition effects of zhusun (Dictyophora spp.)extract on foodborne pathogens[J].J Microbiol,2013,33(4):50-54.
[5] 梁鸣,檀东飞,李惠珍,等.棘托竹荪丙酮提取物的化学成分及丙酮、乙醇、水提取物的抑茵活性研究[C]//中国菌物学会.首届海峡两岸食(药)用菌学术研讨会论文集.北京:[s.l.],2005:197-201.
[6] 祖若夫,胡宝龙,周德庆.微生物学实验教程[M].上海:复旦大学出版杜,1993:199-203.
[7] 欧阳桐娇,林勇,张迪,等.长裙竹荪发酵液抗菌活性初步研究[J].江西农业学报,2012,24(6):76-79.
OUYANG Tongjiao,LIN Yong,ZHANG Di,et al.Preliminary study on antimicrobial activity of fermentation liquor of Dictyophora indusial[J].Acta Agric Jiangxi,2012,24(6):76-79.
[8] 吕峰.我国薏苡仁资源主要品质及薏苡仁活性多糖的研究[D].福州:福建农林大学,2008.
L譈Feng.Studies on Main Qualities of Coix Lachryma-jobi Kernel Resources of China and Activative Coixan[D]. Fuzhou:Fujian Agriculture and Forestry University,2008.
[9] 王宏雨.食用菌抗氧化活性研究及竹荪抗氧化物质提取工艺优化[D].福州:福建农林大学,2010.
WANG Hongyu.Study on Antionxidant Activities of Mushrooms and Extraction Process Optimization for Dictyophora indusiata[D].Fuzhou:Fujian Agriculture and Forestry University,2010.
[10] 郝景雯,张刚,韩慧,等.长裙竹荪乙醇提取工艺及抑菌作用研究[J].食品工业科技,2008,29(10):123-127.
HAO Jingwen,ZHANG Gang,HAN Hui,et al.Study on the extracted method of Dictyophora indusia fisscher and its antimicrobial action[J].Sci Technol Food Ind,2008,29(10):123-127.
[11] 郝景雯,贾士儒,张刚.长裙竹荪乙醇提取物与水提取物抑菌作用研究[J].食品研究与开发,2010,31(10):8-10.
HAO Jingwen,JIA Shiru,ZHANG Gang.Comparison on the antimicrobial activity of ethanol and water extracts of Dictyophora indusia fisscher[J].Food Res Dev,2010,31(10):8-10.
[12] 宋飞飞,尤洁,王倩雯,等.不同溶剂提取菌草竹荪抑菌活性物质的初步研究[J].中国农学通报,2015,31(4):
95-98.
SONG Feifei,YOU Jie,WANG Qianwen,et al.Preliminary study on antimicrobial activity of the extracts from Dictyophora indusial by different solvents[J].Chin Agric Sci Bull,2015,31(4):95-98.
[13] 林陈强.棘托竹荪菌托抑菌物质及多糖研究[D].福州:福建农林大学,2011.
LIN Chenqiang.The Study of the Antimicrobial Activity Components and the Polysaccharides of Dictyophora echinovolvata volva[D].Fuzhou:Fujian Agriculture and Forestry University,2011.
[14] 罗盛莲,游霞,丁聪聪,等.长裙竹荪和棘托竹荪的抑菌作用及其化学成分研究[J].食品工业科技,2012,21(33):70-73.
LUO Shenglian,YOU Xia,DING Congcong,et al.Antimicrobial activities and chemical compositions of Dictyophora indusia fisscher and Dictyophora echinovolvata[J].Sci Technol Food Ind,2012,21(33):70-73.
[15] 林陈强,陈济琛,林戎斌,等.竹荪资源综合利用研究进展[J].中国食用菌,2011,30(2):8-11.
LIN Chenqiang,CHEN Jichen,LIN Rongbin,et al.Study on the development of the comprehensive utilization about the Dictyophora resource[J].Edible Fungi China,2011,30(2):8-11.
[16] 檀东飞,吴若菁,梁鸣,等.棘托竹荪挥发油化学成分及抑菌作用的研究[J].菌物系统,2002,21(2):228-233.
TAN Dongfei,WU Ruojing,LIANG Ming,et al.Studies on chemical compositions and antimicrobial activity of volatile oil of Dictyophora echinovolvata[J].Mycosystema,2002,21(2):228-233.
Antibiotic activity of Dictyophora echinovolvata and optimization of the ethanol extracted antibiotic substance
ZHANG Shuang1,2,ZHANG Puyu1,2,JIANG Daqing1,2,ZHANG Mei1,2,ZHANG Liqin1,2,LIN Haiping1,2
(1.The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.Local and National Joint Engineering Laboratory of Biopesticide High-Efficient Preparation,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
To study the antibiotic activity of Dictyophora echinovolvata on food spoilage microorganisms and phytopathogenic fungi and to provide a theoretical basis for developing D.echinovolvata into a natural food preservative and a green biological pesticide,an antibiotic extraction of the D.echinovolvata fruiting body was prepared by boiling an ethanol extract.Single factor and orthogonal experiments were used to determine the optimal extraction parameters.Four factors was optimized included ethanol concentration,ratio of material to solvent,extraction time and extraction temperature.Antibiotic activity was determined by the Oxford cup method and mycelium growth rate method.The size of the inhibitory zone diameter was to evaluate antibacterial ability of food spoilage microorganisms,and the inhibitory rate was used for phytopathogenic fungi,with three replications.Results showed that the optimal extraction parameters were ethanol concentration-90%,ratio of material to solvent-50.0 g·L-1,extraction time-2.0 h,and extraction temperature-75℃.Extract from
microbiology;Dictyophora echinovolvata;ethanol extraction;optimizing process;antimicrobial activity;food spoilage microorganisms;phytopathogenic fungi
S646
A
2095-0756(2016)06-1045-07
2015-11-17;
2015-12-15
浙江省科技厅公益技术研究农业项目(2015C32078)
张爽,从事食药用菌开发研究。E-mail:1148971445@qq.com。通信作者:林海萍,教授,博士,从事食用菌研究。E-mail:zjlxylhp@163.com
10.11833/j.issn.2095-0756.2016.06.017
D.echinovolvata exhibited a strong antibiotic effect on food spoilage bacteria and phytopathogenic fungi,but no inhibitory effect on Saccharomyces cerevisiae.For four selected species of bacteria causing food decay,the successive order for the bacteriostatic effect with inhibitory zone diameter(in mm)was Staphylococcus aureus(24.08),Bacillus subtilis(23.12),Bacillus cereus(23.02),and Escherichia coli(22.16).The antibiotic effect of gram positive bacteria was significantly greater(P<0.05)than the antibiotic effect of gram-negative bacteria.Five selected phytopathogenic fungi were significantly different(P<0.05)for bacteriostatic effect and inhibitory rate (%)with the successive order being Exserohilum turcicum (75.0%),Sclerotinia sclerotiorum(57.7%),Botrytis cinerea(49.7%),Fusarium graminearum(21.3%),and Valsa mali(9.3%).Obviously,there is a great potential for developing D.echinovolvata into natural food preservatives and green biological pesticide.[Ch,4 fig.4 tab.16 ref.]
