铝胁迫下不同耐铝型桉树无性系根和叶抗氧化特征的差异
2016-12-09徐圆圆陆明英蒋维昕
徐圆圆,陆明英, 蒋维昕,程 飞,谭 玲,杨 梅
(1.广西大学 林学院,广西 南宁 530004;2.广西大学 广西高校林业科学与工程重点实验室,广西 南宁530004)
铝胁迫下不同耐铝型桉树无性系根和叶抗氧化特征的差异
徐圆圆1,2,陆明英1, 蒋维昕1,2,程 飞1,2,谭 玲1,2,杨 梅1,2
(1.广西大学 林学院,广西 南宁 530004;2.广西大学 广西高校林业科学与工程重点实验室,广西 南宁530004)
为了阐明不同桉树无性系对铝的抗逆性生理响应机制,采用室内水培法,以广西区2个桉树无性系耐铝型巨尾桉9号Eucalyptus grandis×E.urophylla No.9(记为G9)和铝敏感型尾叶桉4号E.urophylla No.4(记为G4)为研究对象,在4.4 mmol·L-1铝离子浓度下处理24 h(以pH 4.0,0.5 mmol·L-1氯化钙为对照),从根系及叶片内细胞膜透性(CMP),丙二醛(MDA)质量摩尔浓度及过氧化氢酶(CAT),多酚氧化酶(PPO),超氧化物歧化酶(SOD),抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等抗氧化酶活性方面探讨了铝胁迫下供试苗木的耐铝机制。采用SPSS 21.0软件分别对根和叶中G9和G4的各测定指标进行单因素方差分析和Duncan多重比较。根细胞膜透性、丙二醛质量摩尔浓度均显著(P<0.05)高于叶,铝对2个桉树无性系苗木的毒害主要表现在根部。在4.4 mmol·L-1铝离子处理下,G4根相对电导率与丙二醛质量摩尔浓度最高,分别为48.8%,11.5 μmol·g-1,而G9根内过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶活性极显著(P<0.01)大于G4,且G9根过氧化氢酶活性比相应对照增加145.0%,G4根过氧化氢酶活性比相应对照仅增加43.0%,过氧化氢酶在G9根中对铝毒害的缓解起到了更为重要的作用。G9清除活性氧能力较G4强,表明耐铝型桉树对铝毒害具有较好的适应能力。图7参28
林木育种学;铝胁迫;桉树;抗氧化酶;细胞膜透性;丙二醛
铝是地壳中含量最高的金属元素,约占土壤矿物质总量的7%,仅次于氧元素和硅元素,通常以难溶性的硅酸盐和氧化物的形式存在于长石、云母、高岭石等矿石中,对植物和环境没有毒害作用[1]。酸性条件下(pH<5.5),难溶性的铝会逐渐解离转变为有毒的离子态铝离子(Al3+),Al(OH)2+和Al(OH)2+,酸雨的沉降加上长期施用生理酸性化肥可进一步增进土壤的酸化过程,土壤中活性铝的增加会对植物生长造成极为不利的影响。目前,已经对玉米Zea mays,小麦Triticum aestivum,高粱Sorghum bicolor,马尾松Pinus massoniana,杉木Cunninghamia lanceolata,桉树Eucalyptus,柚木Tectona grandis等农林作物开展了有关铝毒害及耐铝毒机制的研究[2]。铝对植物的危害主要是通过抑制植物根系的生长,进而影响根系对水分和养分的吸收,最终影响植物的生长和发育[3]。不同植物或同种植物不同基因型对铝毒的耐性存在着一定的差异[4]。铝会对植物细胞产生氧化损伤,而这些损伤可以得到抗氧化酶的保护[5]。植物器官在铝胁迫下受到伤害时往往会发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化过程的最终分解产物,其含量可以反映植物遭受酸铝伤害的程度。植物体内的过氧化物酶(POD),过氧化氢酶(CAT),超氧化物歧化酶(SOD),多酚氧化酶(PPO),抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等是重要的抗氧化酶,在清除金属等诱发产生的氧自由基和过氧化物、抑制膜脂过氧化、保护细胞免遭伤害等方面起着重要作用。在许多作物抗性机制研究中,这类抗氧化酶活性的变化已广泛作为指示植物抵御逆境伤害的指标[6]。目前,关于铝处理下抗氧化系统的变化多集中在农作物及经济作物方面,而有关林木方面的研究相对较少。桉树具有丰产、优质、适应性强、用途广泛等特点。目前,中国桉树人工林面积已达300万hm2,广西是其主要栽培区之一[7]。桉树人工林生产力的维持与养分供应有很大关系,持续施肥可加剧土壤酸化,使土壤活性铝不断增多[8]。西班牙桉树林土壤中铝含量及桉树根系中铝的积累受土壤酸度影响,且存在潜在的铝毒危险性,赤桉E.camaldulensis,蓝桉E.globulus,巨桉E.grandis,邓恩桉E.dunnii等实生苗在铝胁迫下分泌苹果酸、柠檬酸和草酸[9],低浓度铝离子甚至会促进桉树生长[10]。笔者曾对4个速生桉优良无性系(巨尾桉9号E.grandis×E.urophylla No.9,巨尾桉12号E.grandis×E. urophylla,尾叶桉4号E.urophylla,韦赤桉3号E.wetarensis×E.Camaldulensis No.3等的耐铝性进行了研究,结果为巨尾桉9号具有较强的耐铝性,而尾叶桉4号的耐铝性较差,且耐铝桉树无性系根部铝的积累量较低[11-12]。在此基础上,本研究进一步探讨了不同耐铝型桉树无性系在根、叶器官中对铝的抗性生理响应差异,为阐明桉树耐铝机制提供参考依据。
1 材料与方法
1.1 试验设计
以2月生速生桉无性系组培苗巨尾桉9号(G9)及尾叶桉4号(G4)为试验材料,修剪留根长4.0 cm,去根基向上1/3叶以便固定植株。试验苗浸入1.0‰多菌灵溶液消毒30 min后,用自来水冲洗净。移入盛有约2.5 L营养液的塑料桶中,用剪成圆形的珍珠棉泡沫板做固定材料,分4孔·板-1,5株·孔-1,此外板中央留1孔通气。使用Hoagland营养液(pH 5.5)[13]进行培养,3 d更换培养液1次,并用1.0‰多菌灵溶液消毒5 min,用2.0 mol·L-1盐酸及氢氧化钠将营养液的酸度从pH 5.5以0.1降幅逐级调至pH 4.0,持续7 d后转入pH 4.0,0.5 mmol·L-1氯化钙中清洗1 d。采用完全随机试验设计,取长势优良、大小一致的桉树苗进行铝处理。本课题组前期检测5年生桉树人工林林地土壤可溶性铝的平均浓度为4.4 mmol·L-1[12]。参照杨振德等[14]进行的铝对桉树幼苗生长影响的研究,当铝质量浓度为120.0 mg·L-1时,仅有1株桉树幼苗存活,被认为是耐铝性较强的单株。因此,铝离子浓度设为 4.4 mmol·L-1
(以AlCl3·6H2O形式加入),以pH 4.0,0.5 mmol·L-1氯化钙为对照(ck),处理24 h后测定相关指标。试验期间营养液容器密闭遮光处理,增氧电泵全天通气。
1.2 指标测定方法
取中间部位叶片、根尖3 cm以内根系0.2 g,叶片用蒸馏水冲洗3次,根系在0.5 mmol·L-1氯化钙溶液中清洗30 min,以洗脱样品表面的铝残留,再用去离子水冲洗3次以除去表面的电解质,吸干水分后剪碎,细胞膜透性(CMP)采用电导率仪测定[15],用相对电导率(%)表示。
参照陈建勋等[16]方法提取酶液。其中,丙二醛(MDA)提取方法为取桉树苗木中间部位叶片、根尖3.0 cm以内根系0.5 g,加体积分数为5%的三氯乙酸(TCA)2.0 mL,研磨至匀浆,再加8.0 mL三氯乙酸充分研磨,匀浆以4 000 r·min-1离心20 min,上清液即为样品提取液。抗氧化酶液提取方法为取桉树苗木中间部位叶片、根尖3.0 cm以内根系0.5 g于预冷的研钵中,加10.0 mL pH 7.0,0.05 mol·L-1磷酸缓冲液、0.1 g聚乙烯吡咯烷酮(PVP)及少许石英砂,在冰浴中研磨成匀浆,于4℃ ,5 000 g下离心20 min,上清液即为过氧化氢酶(CAT)提取液/抗坏血酸过氧化物酶(APX)提取液/超氧化物岐化酶(SOD)提取液/多酚氧化酶(PPO)提取液/谷胱甘肽还原酶(GR)提取液。
试验参照陈建勋等[16]测定丙二醛质量摩尔浓度及酶液活性。丙二醛质量摩尔浓度用硫代巴比妥酸(TBA)法测定,单位为 μmol·g-1。过氧化氢酶活性采用过氧化氢(H2O2)法测定,酶活力以1 min变化0.01个吸光度值D(240)所需酶量为1个活性单位,以U·min-1·g-1(1 U=16.67 nkat)表示;抗坏血酸过氧化物酶活性采用紫外吸收法测定,酶活力以1 min变化0.01个吸光度值D(290)所需酶量为1个活性单位,以U·min-1·g-1(1 U=16.67 nkat)表示;超氧化物歧化酶活性采用氮蓝四唑比色法测定酶活力以四唑氮蓝(NBT)被抑制50%为1个酶活性单位,以鲜质量酶单位每克表示(U·g-1,1 U=16.67 nkat);多酚氧化酶活性采用邻苯二酚法测定,酶活力以1 min变化0.01个吸光度值D(400)所需酶量为1个活性单位,以U·min-1·g-1(1 U=16.67 nkat)表示;谷胱甘肽还原酶采用紫外分光法测定,酶活力以1 min变化0.01个吸光度值D(340)所需酶量为1个活性单位,以U·min-1·g-1(1 U=16.67 nkat)表示。
1.3 数据分析
采用Microsoft Excel和SPSS 21.0等软件对数据进行单因素方差分析,并分别对根和叶中G9和G4的各测定指标进行Duncan多重比较分析。
2 结果与分析
2.1 铝处理对2个桉树无性系细胞膜透性的影响
图1显示:2个桉树无性系根相对电导率均比叶高;G4根电导率最大,4.4 mmol·L-1铝离子处理下为48.8%,细胞膜透性显著(P<0.05)增大,而G9变化不明显,但G9叶片的电导率则与对照有极显著(P<0.01)差异;G4和G9根电导率分别为相应对照的1.3倍和1.2倍,叶电导率分别为相应对照的1.2倍和1.5倍;可见2个无性系在铝处理下细胞受损情况不一样,同一个无性系根系和叶片表现不同。
2.2 铝处理对2个桉树无性系丙二醛质量摩尔浓度的影响
图2所示:G4根及叶内丙二醛质量摩尔浓度均较G9大,4.4 mmol·L-1铝离子处理下桉树根及叶内丙二醛质量摩尔浓度均有显著(P<0.05)增加;G4根丙二醛质量摩尔浓度最大,为11.5 μmol·g-1,且其变化幅度最大,比相应对照增加46.0%,G4叶、G9根及叶内丙二醛质量摩尔浓度变化相对较小,均小于20.0%。
2.3 铝处理对2个桉树无性系过氧化氢酶活性的影响
图3显示:4.4 mmol·L-1铝离子处理下G9根及叶内过氧化氢酶活性均显著(P<0.05)大于G4,G9根及叶过氧化氢酶活性变化幅度较大,分别比相应对照增加145.0%和43.0%,差异极显著(P<0.01);而G4根和叶的过氧化氢酶活性变化不明显,并在铝处理后其根过氧化氢酶活性受到抑制。
2.4 铝处理对2个桉树无性系抗坏血酸过氧化物酶活性的影响
图4所示:G9根内抗坏血酸过氧化物酶活性显著(P<0.05)大于G4,而叶内的抗坏血酸过氧化物酶活性则相反;在4.4 mmol·L-1铝离子处理下, G4根、叶内抗坏血酸过氧化物酶活性均有极显著(P<0.01)变化,分别增加92.9%和30.7%;而G9根抗坏血酸过氧化物酶活性变化不大,叶抗坏血酸过氧化
物酶活性则增加了35.4%,差异极显著。G4根抗坏血酸过氧化物酶活性增幅达到G9的5.6倍,表明其在G4根部清除活性氧的过程中起到重要作用。

图1 铝处理下不同桉树无性系根、叶细胞膜透性的变化Figure 1 Changes of CMP in 2 eucalyptus seedling roots and leaves under aluminum-induced

图2 铝处理下不同桉树无性系根、叶丙二醛质量摩尔浓度的变化Figure 2 Changes of MDA in 2 eucalyptus seedling roots and leaves under aluminum-induced
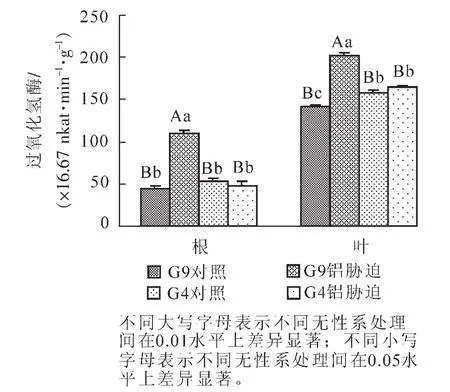
图3 铝处理下不同桉树无性系根、叶过氧化氢酶活性的变化Figure 3 Changes of CAT in 2 eucalyptus seedling roots and leaves under aluminum-induced

图4 铝处理下不同桉树无性系根、叶抗坏血酸过氧化物酶活性变化Figure 4 Changes of APX in 2 eucalyptus seedling roots and leaves under aluminum-induced
2.5 铝处理对2个桉树无性系超氧化物歧化酶活性的影响
图5所示:G4根及叶内超氧化物歧化酶活性均显著(P<0.05)大于G9,且其增幅均较G9大。4.4 mmol·L-1铝离子处理下,G4根及叶超氧化物歧化酶活性变化幅度较大,分别为相应对照的1.9倍和1.7倍,差异极显著(P<0.01);G9根超氧化物歧化酶活性显著(P<0.05)大于对照,而其叶中超氧化物歧化酶活性变化较小;2个桉树无性系均表现出根内超氧化物歧化酶活性较叶大。
2.6 铝处理对2个桉树无性系多酚氧化酶活性的影响
图6所示:G4根中多酚氧化酶活性显著(P<0.05)高于G9。在4.4 mmol·L-1铝离子处理下,G4和G9根的多酚氧化酶活性均与相应的对照有显著(P<0.05)差异,其中G4的多酚氧化酶活性最高,为488.9×16.67 nkat·min-1·g-1,增幅达49.5% ,且显著大于G9根多酚氧化酶活性。而2个无性系的叶多
酚氧化酶活性较稳定,均没有明显变化。

图5 铝处理下不同桉树无性系根、叶超氧化物歧化酶活性变化Figure 5 Changes of SOD in 2 eucalyptus seedling roots and leaves under aluminum-induced
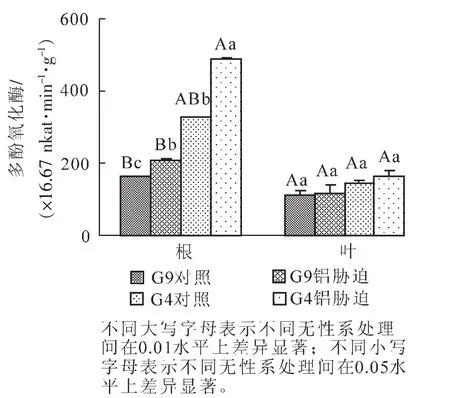
图6 铝处理下不同桉树无性系根、叶多酚氧化酶活性变化Figure 6 Changes of PPO in 2 eucalyptus seedling roots and leaves under aluminum-induced
2.7 铝处理对2个桉树无性系谷胱甘肽还原酶活性的影响
在4.4 mmol·L-1铝离子处理下,2个无性系根谷胱甘肽还原酶活性均被抑制,G4根谷胱甘肽还原酶活性降幅比G9大2.5倍。其中G4根谷胱甘肽还原酶活性最低(7.1× 16.67 nkat·min-1·g-1),明显受到抑制,而G9根谷胱甘肽还原酶活性下降幅度不显著。叶部谷胱甘肽还原酶活性较稳定,在铝处理下均没有显著的变化,但G4降低而G9有所增加(图7)。

图7 铝处理下不同桉树无性系根、叶谷胱甘肽还原酶活性变化Figure 7 Changes of GR in 2 eucalyptus seedling roots and leaves under aluminum-induced
3 讨论与结论
3.1 讨论
在逆境或胁迫条件下,植物对环境中铝离子的吸收及铝在植物不同器官中的分布因不同植物而异,一般植株吸收的铝大部分积累在根中,只有很少量部分转运到地上部分,胁迫下根系受铝毒害更严重[17-18]。铝离子进入桉树植株体内后,主要集中在桉树根部[19]。在4.4 mmol·L-1铝离子处理下,桉树根系反应敏感,其相对电导率、丙二醛质量摩尔浓度的变化程度比叶片的高。由于铝离子直接作用于根部,使根部细胞受到较重伤害,膜透性增强,电解质外渗多[20-21],巨尾桉9号的根部细胞透性变化较小,表现出其耐铝的特征。
根部细胞的抗氧化系统对铝胁迫起到重要的防御作用,能有效阻止活性氧在植物体内的积累,其活性的升降反映了植物在逆境因子作用下通过自身防御机制对环境胁迫做出保护性应激反应[22]。在耐铝的巨尾桉9号和铝敏感的尾叶桉4号中,根中抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶活性均有显著增加,且增幅较叶明显,而过氧化氢酶、谷胱甘肽还原酶则在叶中变化幅度较大。植株受害后其体内抗氧化酶系统做出反应,通过过氧化氢酶、抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶、谷胱甘肽还原酶等协同作用来减缓铝的毒害,超氧化物歧化酶将O2-歧化成过氧化氢和氧气,紧接着过氧化氢酶将过氧化氢转化为水和氧气,多酚氧化酶是清除多余的氧气,抗坏血酸过氧化物酶、谷胱甘肽还原酶能通过抗坏血酸(AsA)-谷胱甘肽-NADPH循环,催化AsA氧化,清除过氧化氢和氧离子(O2-)[23]。
在铝胁迫下,桉树植株体内的抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶起到重要的抗氧化作用。
铝胁迫下植物体内保护酶活性高低与植物铝毒耐性成正相关,且抗氧化酶在抗铝处理上具有一定的协同性[24-27]。耐铝基因型巨尾桉9号在铝诱导下抗氧化系统比较活跃,消除活氧能力较强,其根和叶过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶活性显著大于尾叶桉4号,超氧化物歧化酶、多酚氧化酶活性较尾叶桉4号小,这可能与不同耐铝性的无性系活性氧生成量有关。尾叶桉4号产生较多的活性氧,而激发了超氧化物歧化酶活性,而巨尾桉9号的活性氧少,而且在清除过氧化氢和氧离子后期时,过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶活性较大,对氧化损伤具有较高的保护作用。植物器官在逆境条件下,耐受型品种有较高的抗氧化酶活性[28]。巨尾桉9号细胞膜透性没有受到铝胁迫的显著影响,且其膜脂过氧化程度也较低,其自身细胞膜系统较稳定,对于缓解铝离子的毒害作用起到重要的防身作用,而且其抗氧化酶的协同作用能有效清除自由基,减轻了对膜的破坏,维持质膜的正常通透性。
今后可对不同浓度梯度及胁迫时间梯度的铝胁迫下不同耐铝型桉树无性系根系与叶片生理生化指标的变化过程进行进一步研究,并在多个桉树种植区域对桉树人工林地铝含量及形态进行测定,将室内试验结果与田间试验相结合,阐明桉树人工林铝胁迫情况,对桉树在中国南方酸性土壤的栽植、提高林地利用率及保证人工林的可持续发展提供理论依据。
3.2 结论
2个桉树无性系根、叶的相对电导率、丙二醛质量摩尔浓度及过氧化氢酶、抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶、谷胱甘肽还原酶等活性在不同部位对铝处理的响应程度不一致。铝对桉树苗木的毒害主要表现在根部,根中抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶活性变化幅度较大,而过氧化氢酶在根和叶中变化趋势相似,谷胱甘肽还原酶在根中受到抑制,所以抗坏血酸过氧化物酶、超氧化物歧化酶、多酚氧化酶主要在根中起作用,过氧化氢酶在根和叶中起同等重要的作用,谷胱甘肽还原酶则在叶中对活性氧的清除起有更为重要的作用。
4.4 mmol·L-1铝离子处理下,根和叶丙二醛质量摩尔浓度均显著高于对照;巨尾桉9号根和叶相对电导率、丙二醛质量摩尔浓度及其叶内变化幅度均低于尾叶桉4号,巨尾桉9号根和叶过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶活性显著大于尾叶桉4号,超氧化物歧化酶、多酚氧化酶活性较尾叶桉4号小;耐铝性较强的巨尾桉9号膜质过氧化程度较低,其根内过氧化氢酶及叶过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶活性显著增强,可更有效地消除膜脂过氧化产生的活性氧,同时其根和叶的超氧化物歧化酶、多酚氧化酶活性又低于敏感品种,说明巨尾桉9号产生的活性氧较少及褐化水平较低,且消除活氧能力较强,比尾叶桉4号具有更高的抗氧化水平。
[1] 王保义,李朝苏,刘鹏,等.荞麦叶内抗氧化系统对铝胁迫的响应[J].生态环境,2006,15(4):816-821.
WANG Baoyi,LI Chaosu,LIU Peng,et al.The antioxidant response to Al-stress in buckwheat[J].Ecol Environ, 2006,15(4):816-821.
[2] 肖祥希,刘星辉,杨宗武,等.植物铝毒害研究进展[J].福建林业科技,2004,31(4):94-99.
XIAO Xiangxi,LIU Xinghui,YANG Zongwu,et al.Advances in the plant aluminum poisoning research[J].J Fujian For Sci Technol,2004,31(4):94-99.
[3] 杨列耿,杨曙,张永先,等.铝离子胁迫下大豆根尖柠檬酸的分泌及SGA1基因的表达[J].作物学报,2015,41(4):666-670.
YANG Liegeng,YANG Shu,ZHANG Yongxian,et al.Secretion of citrate from root apices and expression of SGA1 in soybean under AlCl3stress[J].Acta Agronom Sin,2015,41(4):666-670.
[4] 林咸永,章永松,罗安程.不同小麦基因型耐Al性的差异及筛选方法的研究[J].植物营养与肥料学报,2001,7(1):64-70.
LI Xianyong,ZHANG Yongsong,LUO Ancheng.Differences of aluminum tolerance on wheat genotypes and its screening techniques[J].Plant Nutr Fertil Sci,2001,7(1):64-70.
[5] 于力,孙锦,郭世荣,等.铝胁迫对豇豆幼苗根尖抗氧化系统的影响[J].西北植物学报,2012,32(11):2299-2304.
YU Li,SUN Jin,GUO Shirong,et al.Antioxidant enzyme activities in root tips of Vigna unguiculata L.seedings under aluminum stress[J].Acta Bot Boreal-Occident Sin,2012,32(11):2299-2304.
[6] 曹莹,黄瑞冬,曹志强.铅胁迫对玉米生理生化特性的影响[J].玉米科学,2005,13(3):61-64.
CAO Ying,HUANG Ruidong,CAO Zhiqiang.Effects of stress on the physiological and biochemical traits of maize[J].J Maize Sci,2005,13(3):61-64.
[7] 林婷.桉树人工林的生态效应研究[J].林业勘察设计,2012(1):16-20.
LIN Ting.Study on ecological effect of Eucalyptus plantation[J].For Prospect Design,2012(1):16-20.
[8] RIFAI S W,MARKEWITZ D,BORDERS B.Twenty years of intensive fertilization and competing vegetation suppression in loblolly pine plantations:Impacts on soil C,N,and microbial biomass[J].Soil Biol Biochem,2010,42(5): 713-723.
[9] SILVA S,PINTO-CAIMIDE O,MARTINS-LOPES P,et al.Differential aluminum changes on nutrient accumulation and root differentiation in an Al sensitive vs.tolerant wheat[J].Environ Exp Bot,2010,68(1):91-98.
[10] CHEN Rongfu,SHEN Renfang,GU Pei,et al.Investigation of aluminum tolerant species in acid soils of South China[J].Commun Soil Sci Plant Anal,2008,39(9/10):1493-1506.
[11] 杨梅,黄晓露,谭玲,等.4个桉树优良无性系的耐铝性评价指标分析[J].中南林业科技大学学报,2011,31(9):28-32.
YANG Mei,HUANG Xiaolu,TAN Ling,et al.Evaluation on aluminum-tolerance of four Eucalyptus clones[J].J Cent South Univ For Technol,2011,31(9):28-32.
[12] YANG Mei,TAN Ling,XU Yuanyuan,et al.Effect of low pH and aluminum toxicity on the photosynthetic characteristics of different fast-growing Eucalyptus vegetatively propagated clones[J].PLoS One,2015,10(6):E0130963. doi:10.1371/journal.pone.0130963.
[13] 陈帅飞.桉树水培采穗圃营养液配比及营养不平衡对桉树苗生长影响研究[D].北京:中国林业科学研究院, 2007.
CHEN Shuaifei.Study on Nutrient Solution Formula for Eucalypt Hydroponics Cutting Orchard and Effects of Nutrition Imbalance on Growth of Eucalypt Seedling[D].Beijing:Chinese Academy of Forestry,2007.
[14] 杨振德,方小荣,牟继平.铝对桉树幼苗生长及某些生理特性的影响[J].广西科学,1996,3(4):30-33.
YANG Zhengde,FANG Xiaorong,MOU Jiping.Effect of aluminum on the growth and some physiological characters of Eucalyptus seedlings[J].Guangxi Sci,1996,3(4):30-33.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004:167-261.
[16] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006:28.
[17] 陈志刚,张红蕊,周晓红,等.铝胁迫对黑麦草根系抗氧化酶活性和丙二醛含量的诱导特征研究[J].土壤通报, 2012,43(2):391-395.
CHEN Zhigang,ZHANG Hongrui,ZHOU Xiaohong,et al.Study on characteristics of antioxidant enzymes activity and MDA contents in Lolium multiflorum roots induced by aluminum stress[J].Chin J Soil Sci,2012,43(2):391-395.
[18] 韦冬萍,刘鹏,徐根娣,等.油菜叶片保护酶活性、丙二醛及脯氨酸对铝胁迫的响应[J].中国粮油学报,2008, 23(5):107-111.
WEI Dongping,LIU Peng,XU Gendi,et al.Response of protectiase activity,MDA and proline contents to aluminum stress in leaves of rape seedlings[J].J Chin Cereals Oils Assoc,2008,23(5):107-111.
[19] 杨梅,曹雪宁,吴幼媚,等.酸铝处理对不同耐铝性桉树无性系吸收Al及N,P,K的影响[J].西南农业学报, 2012,25(3):1061-1064.
YANG Mei,CAO Xuening,WU Youmei,et al.Effect of acid aluminum on absorption of Al and N,P,K in Eucalyptus clones with different aluminum tolerance[J].Southwest China J Agric Sci,2015,25(3):1061-1064.
[20] 杨野,王伟,刘辉,等.铝胁迫对不同耐铝小麦品种根伸长生长影响的研究[J].植物营养与肥料学报,2010,16(3):584-590.
YANG Ye,WANG Wei,LIU Hui,et al.Effects of aluminum stress on root elongation of different aluminum tolerance
wheat cultivars[J].Plant Nutr Fertil Sci,2010,16(3):584-590.
[21] 宇克莉,邹婧,邹金华.镉胁迫对玉米幼苗抗氧化酶系统及矿质元素吸收的影响[J].农业环境科学学报,2010, 29(6):1050-1056.
YU Keli,ZOU Jing,ZOU Jinhua.Effects of cadmium stress on antioxidant enzyme system and absorption of mineral elements in maize seedlings[J].J Agro-Environ Sci,2010,29(6):1050-1056.
[22] 张清智,陈振德,王文娇,等.毒死蜱胁迫对小白菜抗氧化酶活性和相关生理指标的影响[J].生态学报,2008, 28(9):4524-4530.
ZHANG Qingzhi,CHEN Zhende,WANG Wenjiao,et al.Effects of chlorpyrifos stress on antioxidant enzyme activities and some related compound contents in pakchoi[J].Acta Ecol Sin,2008,28(9):4524-4530.
[23] 于娟,唐学玺,张培玉,等.CO2加富对2种海洋微绿藻的生长、光合作用和抗氧化酶活性的影响[J].生态学报,2005,25(2):197-202.
YU Juan,TANG Xuexi,ZHANG Peiyu,et al.Effects of CO2enrichment on growth,photosynthesis and activities of antioxidant enzymes of two marine micro-green-algae[J].Acta Ecol Sin,2005,25(2):197-202.
[24] 郑世英,张秀玲,王丽燕,等.Cd2+胁迫对蚕豆抗氧化酶活性及丙二醛含量的影响[J].河南农业科学,2007(2): 35-37.
ZHENG Shiying,ZHANG Xiuling,WANG Liyan,et al.Effects of Cd2+on antioxidant enzyme activityand MDA content of horsebean[J].J Henan Agric Sci,2007(2):35-37.
[25] DEMIRAL T,T譈RKAN I.Comparative lipid peroxidation,antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance[J].Environ Experim Bot,2005,53(3):247-257.
[26] 彭艳,李洋,杨广笑,等.铝胁迫对不同小麦SOD,CAT,POD活性和MDA含量的影响[J].生物技术,2006,16(3):38-42.
PENG Yan,LI Yang,YANG Guangxiao,et al.Effects of aluminum stress on the activities of SOD,POD,CAT and the contents of MDA in the seedlings of different wheat cultivars[J].Biotechnology,2006,16(3):38-42.
[27] HASHEMPOUR A,GHASEMNEZHAD M,GHAZVINI R F,et al.Effect of freezing stress on lipid peroxidation and antioxidant enzyme activities of olive cvs.‘Fishomi’and‘Roughani’[J].Agric Conspect Sci,2015,79(4):245-252.
[28] CHAKRABORTY K,SINGH A L,KALARIYA K A,et al.Physiological responses of peanut(Arachis hypogaea L.)cultivars to water deficit stress:status of oxidative stress and antioxidant enzyme activities[J].Acta Bot Croatica, 2015,74(1):123-142.
Al stress with lipid peroxidation and antioxidant enzyme activities in eucalyptus roots and leaves
XU Yuanyuan1,2,LU Mingying1,JIANG Weixin1,2,CHENG Fei1,2,TAN Ling1,2,YANG Mei1,2
(College of Forestry,Guangxi University,Nanning 530004,Guangxi,China;2.Key Laboratory of Forestry Science and Engineering of Guangxi,Guangxi University,Nanning 530004,Guangxi,China)
Eucaplytus is the main timber tree species in south China with enrichment of aluminum(Al)in soil, but the physiological mechanisms of Al tolerance in eucalyptus trees is not well understood.To clarify the physiological response mechanism of Al resistance of eucalyptus,seedlings of the two eucalyptus genotypes(Eucalyptus grandis×Eucalyptus urophylla No.9,Al-resistant type,designated G9;E.urophylla No.4,Al-sensitive type,designated G4)were grown for 24 hours in 0.5 mmol·L-1CaCl2solutions(pH 4.0)containing 0 and 4.4 mmol·L-1Al respectively.The indexes of plant stress resistance were measured by cell membrane permeability(CMP),malondialdehyde content(MDA),catalase activities(CAT),polyphenol oxidase(PPO),superoxide dismutase(SOD),ascorbate peroxidase(APX),and glutathione reductase(GR)in the roots and leaves. The significance of data was analyzed with one-way Anova and Duncan multiple comparison by SPSS 21.0 system.The contents of CMP and MDA in the roots were significant higher(P<0.05)than those in the leaves indicating that Al toxicity mainly happened in the roots of the two eucalyptus genotypes.With 4.4 mmol·L-1of Al stress in the roots of G4,the highest relative electrical conductivity was 48.8%and MDA content was 11.5
forest tree breeding;aluminum stress;eucalyptus;antioxidant enzymes;cell membrane permeability;malondialdehyde
S722.3
A
2095-0756(2016)06-1009-08
2015-11-05;
2015-11-28
国家自然科学基金资助项目(31070560);广西自然科学基金资助项目(2015GXNSFAA139081)
徐圆圆,从事森林培育研究。E-mail:xuyuan829475@163.com。通信作者:杨梅,教授,博士,从事森林培育研究。E-mail:fjyangmei@126.com
10.11833/j.issn.2095-0756.2016.06.012
μmol·g-1.CAT,APX,and GR activities in roots of G9 were extremely significant higher (P<0.01)than G4. CAT play an important role in the detoxification of reactive oxygen species in Al-tolerant eucalyptus clone,because it rose by 145%in the roots of G9 in response to Al treatment,only rose by 43%in G4.Conclusively, the Al-resistant eucalyptus genotype G9 was adapted to Al toxicity with active physiological characteristics to remove reactive oxygenresistant.[Ch,7 fig.28 ref.]
