玻璃体腔注射VAS2870对小鼠氧诱导视网膜病变的保护作用
2016-12-08郝艳芳朱巧平谢安明
郝艳芳,朱巧平,谢安明
·实验论著·
玻璃体腔注射VAS2870对小鼠氧诱导视网膜病变的保护作用
郝艳芳1,2,朱巧平1,2,谢安明1
1Department of Ophthalmology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, Shaanxi Province, China;2Department of Ophthalmology, the First Hospital of Yulin, Yulin 719000, Shaanxi Province, China
•METHODS: Neonatal C57BL/6J mice were divided randomly into three groups: normoxic control group, PBS injection of OIR group and VAS2870 injection of OIR group. The mice of the latter two groups were exposed to 75% oxygen from the postnatal 7d (P7) to the postnatal 12d (P12) to induced OIR. VAS2870 was administered by intravitreal injection (0.5μL) in a mice model of OIR in P12. Another set of mice model of OIR were received a similar treatment with PBS. All eyes were collected at P17. The right eyes were whole mounted and stained with Lectin to observe the growth of retinal vessels; The eyes were enucleated to assess the levels of reactive oxygen species ROS/RNS. The expression of vascular endothelial growth factor (VEGF) and Nox4 mRNA were detected by western blot and RT-PCR, respectively.
•RESULTS: In the retina of OIR, VAS2870 reduced the retinal avascular area and neovascularization, the hypoxia-induced increase in ROS levels, the protein expression of VEGF and gene expression of Nox4 mRNA.
•CONCLUSION: NOX4 enzyme inhibition with VAS2870 has potent anti-oxidative stress effects in the retina, indicating its potential as a treatment for retinopathy of prematurity.
目的:观察玻璃体腔注射VAS2870对C57小鼠氧诱导视网膜病变的影响。
方法:将新生C57BL/6J小鼠随机分为3组,分别为正常对照组、VAS2870注射OIR组和无菌PBS缓冲液注射OIR组。将后两组小鼠在出生后第7d(P7)至P12置于体积分数为75%±2%的恒定高氧氧箱中以构建OIR模型,在P12时给予幼鼠双眼玻璃体腔注射VAS2870(0.5μL),另一组幼鼠双眼注射同等剂量的无菌PBS缓冲液。三组小鼠均在P17时取右眼行视网膜铺片和Lectin染色,观察视网膜中央无血管区及病理性新生血管的情况;取右眼行视网膜组织定量检测ROS/RNS含量;取左眼应用RT-PCR检测Nox4 mRNA含量,并应用Western-blot测定视网膜组织中VEGF的表达。
结果:VAS2870注射OIR组小鼠视网膜中央无血管区面积较无菌PBS缓冲液注射OIR组明显减少(P<0.05),病理性新生血管数目明显减少(P<0.05);VAS2870注射OIR组小鼠视网膜组织Nox4 mRNA的表达量明显低于无菌PBS缓冲液注射组;VAS2870注射OIR组小鼠视网膜组织ROS含量较无菌PBS缓冲液注射组明显降低(P<0.05);VAS2870注射OIR组小鼠视网膜组织VEGF的表达明显低于无菌PBS缓冲液注射组(P<0.05)。
结论:在小鼠OIR模型中,VAS2870可抑制Nox4 mRNA的表达,减少ROS/RNS,下调VEGF的生成,在视网膜病变进程中具有保护作用。
VAS2870;氧诱导视网膜病变;氧自由基;血管内皮生长因子
引用:郝艳芳,朱巧平,谢安明.玻璃体腔注射VAS2870对小鼠氧诱导视网膜病变的保护作用.国际眼科杂志2016;16(12):2200-2203
0引言
早产儿视网膜病变(retinopathy of prematurity,ROP)是一种多发生于早产儿或低体重婴幼儿的视网膜增生性病变,与出生后暴露于波动氧诱导未发育成熟视网膜血管的收缩和闭塞形成无血管区并继发病理性新生血管大量生成有着密切关系,后期可引起视网膜脱离,严重危害患儿的视力[1]。虽然在防治方面取得一些进展,但该病变一旦发生,进展很快,可有效治疗的时间窗口很窄,仍无法有效地阻止病变的进展。目前针对视网膜病变进展的基本发病机制为靶点的治疗已成为新的战略[2]。在ROP的病理过程中,视网膜暴露于不断波动的氧分压中,引起视网膜缺血缺氧,产生过量的活性氧自由基(reactive oxygen species,ROS)/活性氮自由基(reactive nitrogen species,RNS),可直接对视网膜血管造成损伤。NADPH氧化酶是血管内皮细胞ROS/RNS的主要来源,在外来信号刺激下激活或失活,从而迅速升高或降低细胞内的ROS/RNS水平[3]。Nox4是NADPH氧化酶家族中的一员,在人视网膜血管内皮细胞、平滑肌细胞、成纤维细胞中高度表达[4]。Nox4是一种多效性信号肽,可通过多种信号通路发挥多样的功能,包括细胞生长和分化、血管壁重塑、血管发生和肿瘤生长[5]。然而,目前有关Nox4在氧诱导视网膜病变(oxygen-induced retinopathy,OIR)模型中的作用尚不完全清楚,本研究拟使用Nox4特异性抑制剂VAS2870,给予高氧波动中的C57BL/6J新生幼鼠双眼玻璃体腔注射,观察幼鼠视网膜病变的发生情况,为ROP的防治提供新的治疗方向。
1材料和方法
1.1材料 新生C57BL/6J小鼠(西安交通大学实验动物中心提供)共96只,按照随机原则选取64只为OIR组,另32只正常对照组。OIR组新生小鼠随机分为VAS2870注射OIR组和无菌PBS注射OIR组,每组各32只。每组新生幼鼠与母鼠同笼饲养直至造模完成,按照实验动物中心SPF级动物实验室饲养,昼夜比12h∶12h,温度控制(24±1)℃,湿度为50%~60%。
1.2方法
1.2.1小鼠OIR模型的建立 参照小鼠OIR模型建立方法[6],在出生后第7d(P7),将新生C57BL/6J小鼠与母鼠共同置于体积分数75%±2%的恒定高氧箱中饲养,常规食水供应,在P12返回正常空气中继续饲养。正常对照组小鼠则置于正常空气中饲养。
1.2.2小鼠玻璃体腔注射 在P12返回正常空气中取幼鼠称重后,4.3%水合氯醛(0.01mL/g,腹腔注射)麻醉后使用复方托吡卡胺散大两侧瞳孔,生理盐水湿润眼表,左氧氟沙星滴眼,使小鼠侧卧在手术台,在解剖显微镜下拨开眼睑,暴露角巩膜缘。使用10-0针在角巩膜缘后1mm做切口,33G注射器刺入玻璃体腔,注射0.5μL的VAS2870,对照组注射无菌PBS 0.5μL。术后红霉素眼膏涂眼预防感染。
1.2.3小鼠视网膜铺片Lectin染色及图像分析 造模结束后(P17),使用1%戊巴比妥钠(30mg/kg,腹腔注射)过量麻醉处死幼鼠,取右眼置于4%多聚甲醛4固定。在手术显微镜下用角膜剪沿眼球的角巩膜剪开,去除角膜、虹膜、晶状体及玻璃体,分离视网膜。分离的视网膜组织于4%多聚甲醛溶液固定3h,用PBS(0.01mol/L,pH:7.4)漂洗5min,用1%牛血清白蛋白+0.5% Triton+0.01mol/L PBS在室温中封闭2.5h,加入抗体Isolectin B4过夜,用PBS漂洗5min×3次后在手术显微镜下以视盘为中心,放射状切开视网膜,平铺于载玻片上,树脂胶封片。
1.2.4 RT-PCR测定各组小鼠视网膜组织Nox4 mRNA表达量 造模结束后(P17),以上述实验方法分离得到视网膜,按照Trizol试剂盒说明书提取视网膜总RNA,逆转录反应按照Promega公司试剂盒提供的实验程序完成。PCR引物序列:Nox4:正向序列:5’-CAG GAG GGC TGC TGA AGT ATC AA-3’和反向序列:5’-TGA CTG GCT TAT TGC TCC GGA TA-3’。GAPDH:正向序列:5’-TCT GGA AAG CTG TGG CGT G-3’和反向序列:5’-CCA GTG AGC TTC CCG TTC AG-3’。检测幼鼠视网膜组织中Nox4 mRNA的表达量。
1.2.5蛋白免疫印迹法(Western blot)测定各组小鼠视网膜组织VEGF表达量 造模结束后(P17),取眼球分离小鼠视网膜组织后置于细胞裂解液(1% Triton X-100,50mmol/L Tris,1mmol/L EDTA,0.1% SDS,1%脱氧胆酸钠)中匀浆。BCA法测定蛋白浓度,取等量蛋白样品,10% SDS-PAGE电泳、转膜。加入一抗,室温孵育12h,HRP标记的二抗室温孵育2h。ECL显影后,半定量分析视网膜组织中VEGF条带的光密度值。
1.2.6高质荧光测定各组小鼠视网膜组织氧化应激活性氧(ROS) 造模结束后(P17),取眼球分离视网膜后用预冷的GENMED清理液漂洗2~3次;视网膜组织加入100μL GENMED稀释液,漩涡混合器充分震荡充分混匀后移取50μL组织匀浆物或50μL GENMED稀释液(背景对照)到96孔平板上,加入950μL GENMED染色液和GENMED稀释液的染色工作液,充分混匀后放37℃恒温水孵育20min,避免光照。随后使用避荧光定量分光光度仪(M5)检测:激发波长490nm,散发波520nm。对比OIR模型组ROS荧光度/常氧对照组ROS荧光强度值。
1.2.7图像观察 荧光显微镜下拍摄视网膜血管染色图像,应用Adobe Photoshop CS6合成视网膜全图,参照Connor等[7]分析方法选取视网膜无血管区、病理性新生血管和视网膜总面积(以像素为单位),分别计算无血管区和病理性新生血管与视网膜总面积比值。
2结果
2.1三组小鼠视网膜血管化情况 三组小鼠视网膜血管染色铺片显示,在P17时,正常对照组小鼠视网膜血管化已经完成,血管走形规则,分支良好(图1A);两组小鼠OIR模型构建成功,VAS2870注射OIR组和无菌PBS注射组小鼠视网膜中央均出现程度不同的无血管化区域(绿色线标出区域,图1B~C)以及呈团簇状的新生血管(白色箭头所指,图1B~C)。统计分析显示:VAS2870注射OIR组小鼠视网膜中央无血管区面积显著减少(t=8.393,P<0.05),病理性新生血管数目减少,差异有统计学意义(t=3.014,P<0.05,表1)。
2.2三组小鼠视网膜组织Nox4 mRNA表达情况 RT-PCR结果显示,在P17时正常小鼠视网膜组织中有少量Nox4 mRNA表达;两组OIR模型组中小鼠视网膜组织Nox4 mRNA的表达量明显升高。统计分析显示,三组间小鼠视网膜Nox4 mRNA的表达量差异存在统计学意义(F=151.98,P<0.05),VAS2870注射OIR组和无菌PBS缓冲液注射组小鼠视网膜Nox4 mRNA的表达量均明显高于正常对照组(均P<0.05),而VAS2870注射OIR组小鼠视网膜Nox4 mRNA的表达量明显低于无菌PBS注射组,差异有统计学意义(P<0.05,表2)。
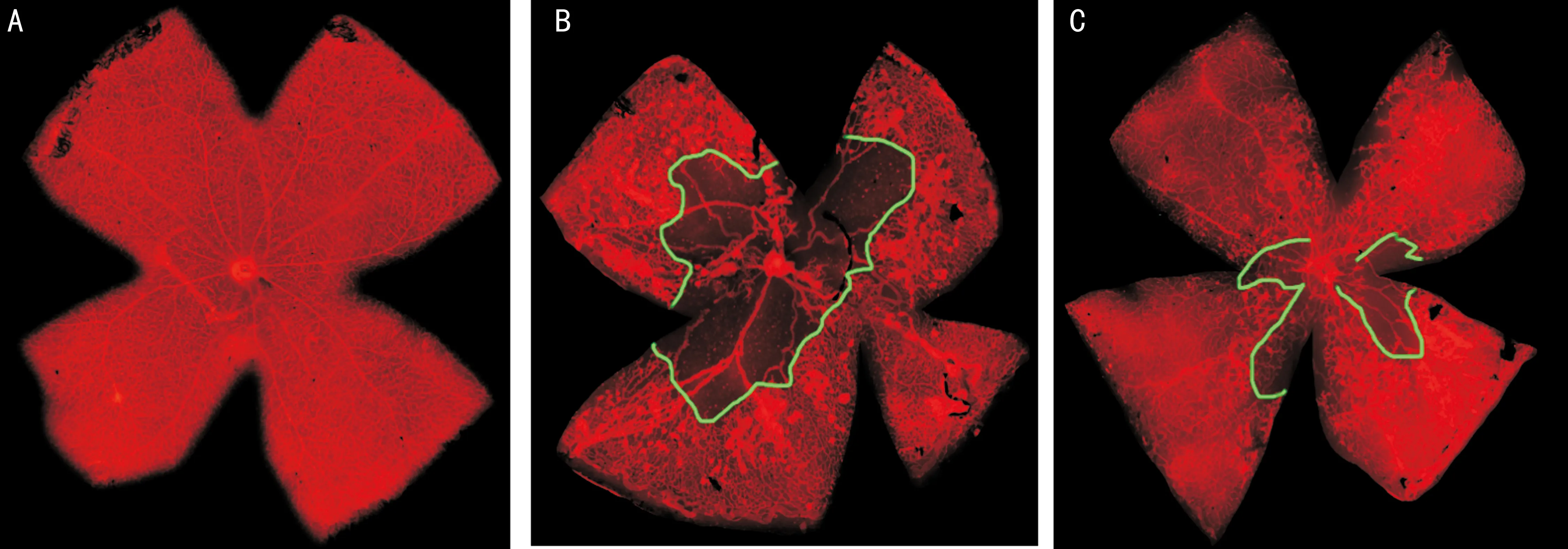
图1 三组小鼠视网膜血管染色铺片图(×400) A:常氧对照组;B:无菌PBS注射OIR模型组;C:VAS2870
注射OIR模型组。
表1 OIR模型小鼠视网膜无血管区以及病理性新生血管像素百分比
(±s,%)
注:aP<0.05vsPBS注射OIR组。
2.3三组小鼠视网膜组织VEGF表达情况 Western blot结果显示:两组OIR模型组中小鼠视网膜组织VEGF的表达量明显升高。统计分析显示,三组间小鼠视网膜VEGF表达量的差异存在统计学意义(F=102.703,P<0.05),VAS2870注射OIR组和无菌PBS缓冲液注射组小鼠视网膜VEGF表达量均明显高于正常对照组(均P<0.05),而VAS2870注射OIR组小鼠视网膜VEGF表达量明显低于无菌PBS注射组,差异有统计学意义(P<0.05,图2)。
2.4三组小鼠视网膜组织ROS生成情况 在P17时,正常小鼠视网膜组织中有少量的ROS生成;两组OIR模型组小鼠视网膜组织中ROS生成量均明显增加。统计分析显示,三组间小鼠视网膜ROS生成量差异存在统计学意义(F=86.856,P<0.05),VAS2870注射OIR组和无菌PBS缓冲液注射组小鼠视网膜ROS生成量均明显高于正常对照组(均P<0.05),而VAS2870注射OIR组小鼠视网膜ROS生成量明显低于无菌PBS注射组,差异有统计学意义(P<0.05,图3)。
3讨论
视网膜组织代谢活跃、氧含量及耗氧量高、不饱和脂肪酸含量高,且经常暴露于可见光下,对活性氧自由基(reactive oxygen species,ROS)/活性氮自由基(reactive nitrogen species,RNS)的损伤敏感[8]。研究显示,在出生后早产儿未发育成熟的视网膜暴露于外界不断波动的氧分压(高氧低氧相交替)中,导致视网膜局部缺血缺氧,引发过量的ROS/RNS生成,过量生成的自由基具有直接细胞毒性,损伤正常的血管内皮细胞,导致氧化应激损伤,使正常生长发育的视网膜血管停滞,并继发生成病理性新生血管,严重者可牵拉引起视网膜脱离。因此,氧化应激在ROP的病理进程中扮演着重要的作用[9]。
表2 三组小鼠视网膜Nox4 mRNA表达量
±s
注:aP<0.05vs正常对照组;cP<0.05vsPBS注射OIR组。
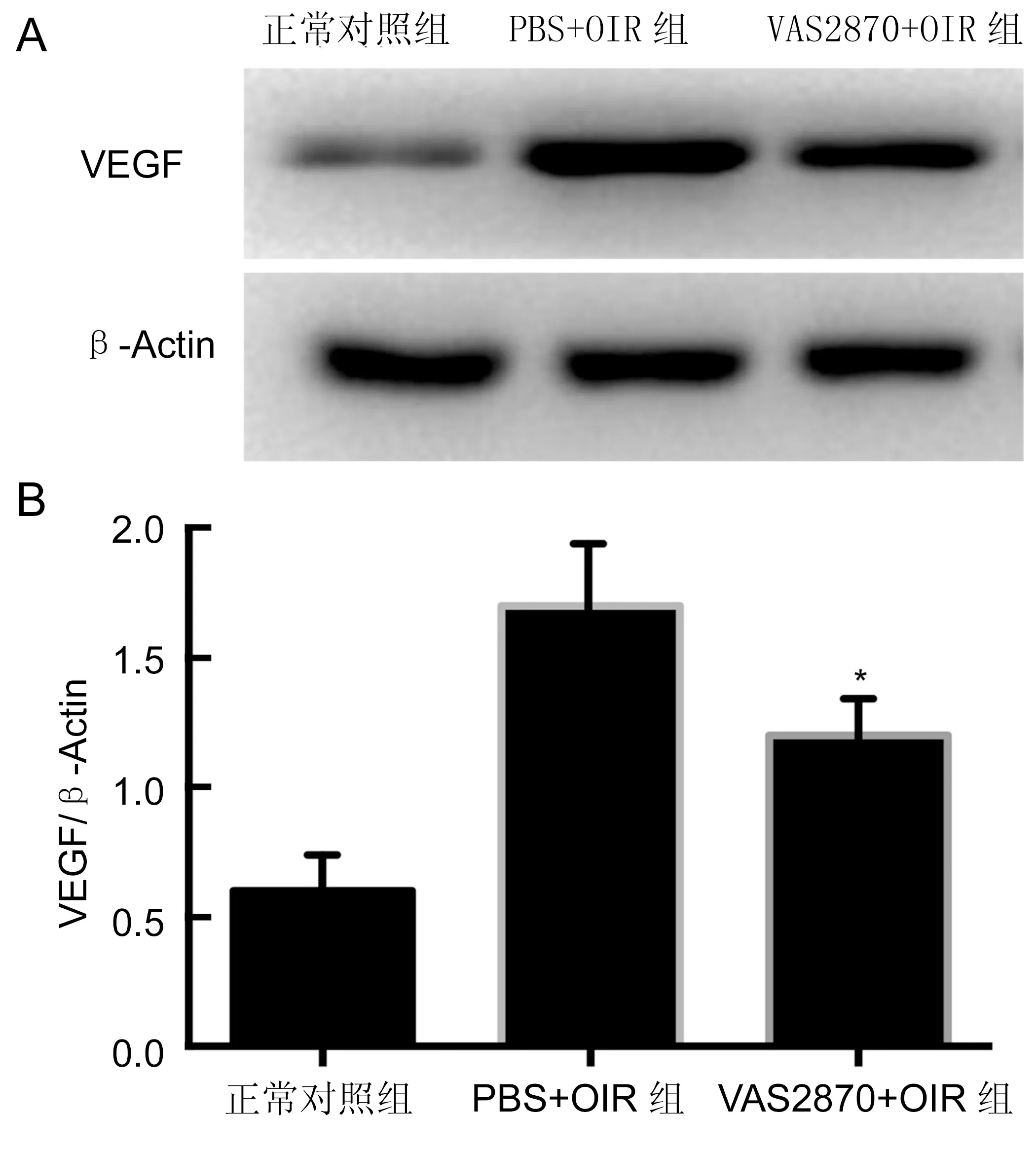
图2 三组小鼠视网膜组织VEGF蛋白表达水平的免疫印迹结果 A:蛋白印记条带;B:VEGF蛋白表达的条形图。
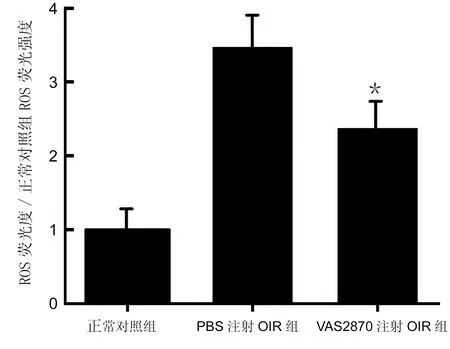
图3 三组小鼠视网膜组织ROS荧光强度相对值。
在OIR模型中的研究显示,视网膜局部缺血缺氧可活化NADPH氧化酶,引起局部ROS/RNS升高,从而上调VEGF表达、促进血管内皮细胞凋亡、促进视网膜无血管区和病理性新生血管的形成,而注射夹竹桃麻素抑制NADPH氧化酶的活性后可减少视网膜无血管区及病理性新生血管的形成[10-11]。进一步的研究显示,NADPH氧化酶家族的亚单位参与了内皮细胞的功能调节和血管发生的调控。Nox家族组包括7个成员,分别为Nox1,Nox2,Nox3,Nox4,Nox5,Duox1和Duox2。在血管系统,Nox1,Nox2,Nox4和Nox5均有表达,Nox4在人视网膜血管内皮细胞、平滑肌细胞、成纤维细胞中高度表达[12]。
在实验中我们发现,在两组幼鼠OIR造模成功后,视网膜中心均形成明显的无血管区,周边视网膜继发形成病理性新生血管,且在视网膜组织Nox4 mRNA的表达量、ROS/RNS生成量及VEGF的表达也较正常对照组明显增加。在P12使用VAS2870特异性抑制Nox4活性后,幼鼠视网膜中心的无血管区较PBS组明显减小,病理性新生血管的数量也减少,视网膜组织中Nox4 mRNA的表达量下降,ROS/RNS生成量及VEGF的表达量均明显下降,说明在小鼠OIR模型中,视网膜缺血缺氧可活化Nox4,促进视网膜无血管区以及病理性新生血管的形成,而抑制Nox4活性可减轻视网膜血管的病变。
前期研究显示在低氧培养的血管内皮细胞中可检测到Nox4 mRNA表达增加,且血管内皮细胞增生、移行形成管腔也明显增加,而在低氧培养的Nox4基因敲除小鼠内皮细胞中所形成的管腔明显减少,且用药物抑制Nox4活性后,可减少缺氧组织中新生血管的密度[13-14]。在其他缺血/缺氧诱导的新生血管模型中,在内皮细胞Nox4过量表达的转基因小鼠上臂缺血组织中主动脉毛细血管萌芽增加[15]。总之,这些研究都说明内皮细胞Nox4可促进缺血缺氧状态下的血管发生,抑制Nox4活性后可减少新生血管的形成[16]。
综上所述,本实验结果表明在小鼠氧诱导视网膜病变模型中VAS2870可抑制Nox4活性,减少ROS/RNS的生成,下调VEGF的表达从而发挥视网膜保护作用,可能成为治疗的潜在靶点。
1 Shah PK. Retinopathy of prematurity: Past, present and future.WorldJClinPediatr2016;5 (1):35
2 Klufas M,Chan R. Intravitreal anti-VEGF therapy as a treatment for retinopathy of prematurity: what we know after 7 years.JPediatrOphthalmolStrabismus2015;52 (2):77-84
3 Tawfik A, Sanders T, Kahook K,etal. Suppression of retinal peroxisome proliferator-activated receptor gamma in experimental diabetes and oxygen-induced retinopathy: role of NADPH oxidase.InvestOphthalmolVisSci2009;50 (2):878-884
4 Schröder K, Zhang M, Benkhoff S,etal. Nox4 Is a Protective Reactive Oxygen Species Generating Vascular NADPH Oxidase.CircRes2012;110(6):1217-1225
5 Meng D, Mei A, Liu J,etal. NADPH oxidase 4 mediates insulin-stimulated HIF-1a and VEGF expression, and angiogenesisinvitro.PLoSOne2012;10(2):1-9
6 Smith LE, Wesolowski E, McLellan A,etal. Oxygen-induced retinopathy in the mouse.InvestOphthalmolVisSci1994;35:101-111
7 Connor KM, Krah NM, Dennison RJ,etal. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis.NatProtoc2009;4:1565-1573
8 Sickel W. Electrical and metabolic manifestations of receptor and higher-order neuron activity in vertebrate retina.AdvExpMedBiol1972;24:101-118
9 Li SY, Fu ZJ, Lo AC. Hypoxia-Induced Oxidative Stress in Ischemic Retinopathy.OxidMedCellLongev2012;2012:426769-426778
10 Hartnett ME. The effects of oxygen stresses on the development of features of severe retinopathy of prematurity:knowledge from the 50/10 OIR model.DocumentaOphthalmologic2010;120(1):25-39
11 Saito Y, Uppal A, Byfield G,etal. Activated NAD(P)H oxidase from supplemental oxygen induces neovascularization independent of VEGF in retinopathy of prematurity model.InvestOphthalmolVisSci2008;(4):1591-1598
12 Chen F, Haigh S, Barman S,etal. From form to function: the role of Nox4 in thecardiovascular system.ActaPediatrSuppl2012;43:1311-1481
13 Schröder K, Zhang M, Benkhoff S,etal. Nox4 is a protective reactive oxygen species generating vascular NADPH oxidase.CircRes2012;110:1217-1225
14 Kuroda J, Ago T, Matsushima S,etal. NADPH oxidase 4 (Nox4) is a major source of oxidative stress in the failing heart.CircRes2013;198:1231-1339
15 Craige SM, Chen K, Pei Y,etal. NADPH oxidase 4 promotes endothelial angiogenesis through endothelial nitric oxide synthase activation.CircRes2011;121:1245-1356
16 Green DE, Murphy TC, Kang BY,etal. The Nox4 inhibitor GKT137831 attenuates hypoxia-induced pulmonary vascular cell proliferation.AmJRespirCellMolBiolVol2012;5:718-726
Protection of VAS2870 to oxygen-induced retinopathy in mice
Yan-Fang Hao1,2, Qiao-Ping Zhu1,2, An-Ming Xie1
An-Ming Xie.Department of Ophthalmology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, Shaanxi Province, China. Xie9102@163.com
•AIM: To investigate the protective effect of VAS2870 on mice oxygen-induced retinopathy (OIR) and the possible underlying mechanisms.
VAS2870; oxygen-induced retinopathy; reactive oxygen species; reactive nitrogen species; vascular endothelial growth factor
1(710061)中国陕西省西安市,西安交通大学第一附属医院眼科;2(719000)中国陕西省榆林市第一医院眼科
郝艳芳,在读硕士研究生,主治医师,研究方向:眼底病。
谢安明,主任医师,硕士研究生导师,研究方向:眼底病.Xie9102@163.com
2016-07-02
2016-11-03
:Hao YF, Zhu QP, Xie AM. Protection of VAS2870 to oxygen-induced retinopathy in mice.GuojiYankeZazhi(IntEyeSci) 2016;16(12):2200-2203
10.3980/j.issn.1672-5123.2016.12.07
Received:2016-07-02 Accepted:2016-11-03
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- Comparison of indocyanine green and brilliant blue G to assist internal limiting membrane peeling during macular hole surgery: a systematic review and meta-analysis
- 环境亮度及瞳孔直径对人眼神经对比敏感度的影响
- 三种方式测量中央角膜厚度的对比研究
- 玻璃体腔注射康柏西普治疗视网膜静脉阻塞并黄斑水肿
- The effect of intravitreal ranibizumab after pars plana vitrectomy in severe proliferative diabetic retinopathy
- 复发性泪腺区肿瘤25例临床病理分析
