非多重耐药及多重耐药鲍曼不动杆菌外排泵及其表达
2016-12-08刘泽世陈正立
刘泽世,呼 瑞,张 毅,陈正立,耿 燕,薛 丽
(1.西安交通大学第二附属医院检验科,陕西西安 710004;2. 西北妇女儿童医院
◇临床研究◇
非多重耐药及多重耐药鲍曼不动杆菌外排泵及其表达
刘泽世1,呼 瑞2,张 毅1,陈正立3,耿 燕1,薛 丽1
(1.西安交通大学第二附属医院检验科,陕西西安 710004;2. 西北妇女儿童医院
妇产科重症监护室,陕西西安 710061;3. 河北医科大学第一医院检验科,河北石家庄 050031)
目的 探讨多重耐药鲍曼不动杆菌(multidrug resistantAcinetobacterbaumannii, MDRAB)及非多重耐药鲍曼不动杆菌(non-multidrug resistantAcinetobacterbaumannii, N-MDRAB)的外排泵表型、基因型和外排泵基因表达情况。方法 应用K-B法将120株临床分离的鲍曼不动杆菌,分成MDRAB 96株和N-MDRAB 24株两组;参照Sylvia Valdezate方法检测鲍曼不动杆菌的外排泵表型,即采用微量肉汤稀释法,观察加入泵抑制剂羰基氰氯苯腙(CCCP)前后其MIC值的变化,筛选出加入泵抑制剂后MIC值比原值降低1/4倍或以上的菌株为AB外排泵表型阳性;PCR法扩增外排泵蛋白基因并测序进行序列分析。结果 96株MDRAB对β-内酰胺类、头孢菌素类、碳青霉烯类、氨基糖苷类、喹诺酮类、四环素类、磺胺类、多黏菌素类抗菌药物的耐药率分别为76.04%~92.71%、73.96%~97.92%、40.63%~42.71%、92.71%~98.96%、93.75%~98.96%、98.96%、79.17%、0。24株N-MDRAB对头孢菌素类、β-内酰胺类、碳青霉烯类、氨基糖苷类、喹诺酮类、四环素类、磺胺类、多黏菌素类抗菌药物的耐药率分别为16.52%~20.43%、11.22%~15.65%、0、17.83%~18.26%、20.43%~23.39%、14.78%、19.57%、0。外排泵抑制检测结果显示,96株MDRAB有34株外排泵阳性,外排泵基因检测有33株adeB、32株adeR、33株adeS、33株adeJ、0株adeE和33株abeM,检出阳性率分别为97.06%、94.12%、97.06%、97.06%、0、97.06%; 24株N-MDRAB未检测到外排泵阳性菌株,但外排泵基因检测有12株adeB、20株adeR、16株adeS、18株adeJ、0株adeE和16株abeM,检出阳性率分别为50%、83.33%、66.67%、75%、0、66.67%。对adeB、adeR、adeS、adeJ、abeM基因进行测序,经比对,所测序列与GenBank中序列同源性为100%。结论 外排泵基因广泛存在于MDRAB中,但在N-MDRAB中亦可以发现主动外排泵基因的存在。
鲍曼不动杆菌;多重耐药;外排泵;羰基氰氯苯腙;基因型;表型
鲍曼不动杆菌(Acinetobacterbaumannii, Ab)是一种临床常见的非发酵革兰阴性杆菌,其可以广泛分布于医院环境、医务人员和患者的皮肤表面,属于常见的院内感染条件致病菌[1]。近年来随着免疫抑制剂、广谱抗生素的广泛使用和侵入性的医疗操作的常规开展,使Ab的感染率呈逐年上升的趋势[2-3]。《中国鲍曼不动杆菌感染与防控专家共识》将多重耐药鲍曼不动杆菌(multidrug resistantAcinetobacterbaumannii, MDRAB)定义为对5类抗菌药物中至少3类抗菌药物耐药的菌株,其中包括: 含有β内酰胺酶抑制剂的复合制剂(包括哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、氨苄西林/舒巴坦) 、抗假单胞菌碳青霉烯类抗生素、抗假单胞菌头孢菌素、氨基糖苷类抗生素、氟喹诺酮类抗菌药物[4]。笔者以往研究表明,在体外实验中外排泵的存在使Ab对头孢菌素类、β-内酰胺类、碳青霉烯类、氨基糖苷类、喹诺酮类、四环素类、磺胺类、多黏菌素类等抗菌药物呈现不同程度的耐药;而在体外实验中加入泵抑制剂羰基氰氯苯腙(CCCP)后,泵抑制剂与外排泵相互作用,通过逆转质子的主动转运,提高药物对MDR-AB的抗菌活性[5]。MARCHAND[6]和CHAU[7]发现外排泵基因adeB、adeR、adeS、adeJ、adeE、abeM与Ab的耐药密切相关。但是,目前尚无明确研究表明非多重耐药鲍曼不动杆菌(non-multidrug resistantAcinetobacterbaumannii, N-MDRAB)是否存在有上述外排泵基因的表达。本研究通过对MDRAB及N-MDRAB表型和基因型检测,探讨外排泵对Ab耐药性的影响。
1 材料与方法
1.1 材料 药敏纸片:哌拉西林(PIP,100 μg/片)、亚胺培南(IPM,10 μg/片)、阿米卡星(AK,30 μg/片)、庆大霉素(GEN,10 μg/片)、氨苄西林/舒巴坦(SAM,10/10 μg/片)、环丙沙星(CIP,5 μg/片)、复方新诺明(SXT,23.75 μg/片)、头孢吡肟(CPR,30 μg/片)、头孢曲松(CRO,30 μg/片)、四环素(TC,30 μg/片)、多黏菌素B(PMB,300 IU/片)、头孢哌酮/舒巴坦(SCF,75/10 μg/片)、哌拉西林/他唑巴坦(TZP,100/10 μg/片)、美罗培南(MRP,10 μg/片)、左氧氟沙星(LEV,5 μg/片)、头孢噻肟(CTX,30 μg/片)。法国生物梅里埃公司产品阴性杆菌的GN鉴定卡。英国OXID公司的K-B法药敏纸片。大肠埃希菌ATCC25922及鲍曼不动杆菌ATCC19606为质控菌株。购自Promega公司Maxwell®16 Cell LEV DNA Purification Kit试剂盒提取DNA,购自美国Promega公司GoTaq®Green Master Mix、GoTaq®Colorless Master Mix试剂盒进行PCR扩增,购自北京赛百盛公司Goldview进行DNA染色剂,购自北京赛百盛公司的DNA Ladder Marker 100 bp,购自上海生工生物工程技术服务有限公司的琼脂糖X-gal。羰基氰氯苯腙(CCCP)和泵抑制剂溶解试剂二甲亚砜均购于河北博世林公司。
1.2 菌株来源与保存 2014年4月至2015年3月从河北医科大学第一医院和西安交通大学第二附属医院分离到的不重复菌株120株作为实验菌株。标本类型包括痰液、分泌物、尿液、血液、脓液、引流物(胸腹水)。使用MH培养基将收集的菌株进行纯培养,挑取单个菌落接种于营养肉汤中,待增菌后,将增菌液与50%甘油肉汤1∶1混匀,置于-70 ℃冰箱保存。
1.3 细菌鉴定 根据临床分离的120株不重复菌株的菌落形态和革兰染色结果,经法国梅里埃公司Vitek32全自动微生物检测仪鉴定为Ab。
1.4 药敏实验 按照2012年M02-A11临床实验室标准研究所(Clinical and Laboratory Standards Institute, CLSI)推荐的Kirby-Bauer法,进行哌拉西林、亚胺培南、阿米卡星、庆大霉素、氨苄西林/舒巴坦、环丙沙星、复方新诺明、头孢吡肟、头孢曲松、四环素、多黏菌素B、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、美罗培南、左氧氟沙星、头孢噻肟等17种抗菌药物药敏实验。对5类抗菌药物中至少3类抗菌药物耐药的菌株为MDRAB,<3类同时耐药的菌株为N-MDRAB。
1.5 Ab外排泵表型的检测 应用Sylvia Valdezate方法,比较加入CCCP泵抑制剂前后其MIC值的变化,筛选出加入泵抑制剂后MIC值比原值降低1/4倍或以上的Ab菌株。外排泵表型检测的抗菌药物选用四环素、庆大霉素、头孢噻肟、左氧氟沙星。具体步骤如下:用分析天平称取20.48 mg抗菌药物溶解于4 mL的无菌生理盐水,使其原液的质量浓度为5 120 μg/mL。取12只无菌试管,第1个无菌试管加入1.6 mL营养肉汤以及0.4 mL抗菌药物原液,其余无菌试管加入1 mL营养肉汤。将第1个无菌试管中液体混匀后吸取1 mL加入第2管,混匀再吸取1 mL加入第3管,依次倍比稀释至第11管,再吸取第11管中1 mL混合物弃去,第12管为阳性对照(不含抗菌药物)。这样第1管至第11管的药物质量浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25 μg/mL。从每个无菌管中取100 μL抗菌液加入至96孔微量肉汤药敏板中。用分析天平准确称取4 mg CCCP粉剂,完全溶解于2 mL 二甲亚砜。取11只无菌试管,每个管中加入2 mL 无菌生理盐水,再分别向每个无菌试管中加入0.55、0.5、0.45、0.4、0.35、0.3、0.25、0.2、0.15、0.1、0.05 mL CCCP溶液,此时质量浓度依次为550、500、450、400、350、300、250、200、150、100、50 μg/mL。分别取10 μL CCCP溶液至96孔微量肉汤药敏板,并同时每孔加入90 μL菌悬液,此时,第1孔至第11孔CCCP溶液质量浓度分别为55、50、40、35、30、25、20、15、10、5 μg/mL。第12孔作为仅加入菌悬液的阳性对照。最终确定CCCP溶液的工作浓度。采用微量肉汤稀释法测定加入泵抑制剂CCCP后,4种抗菌药物(四环素、庆大霉素、左氧氟沙星、头孢噻肟)对96株MDRAB和24株N-MDRAB的MIC值。同时使用加入泵抑制剂和空白孔作为生长对照。对照管中Ab生长良好,MIC值为抑制细菌生长的最低药物稀释浓度。参照CLSI 2013年标准进行结果判读(单位为μg/mL)。
1.6 目的基因的扩增
1.6.1 引物设计 参考文献[8]设计引物,包括adeB、adeR、adeS、adeJ、adeE、abeM和16S RNA,见表1。

表1 外排泵耐药基因引物Tab.1 The primers of efflux pump drug-resistant genes
1.6.2 DNA提取及扩增 使用Maxwell®16 Cell LEV DNA Purification Kit 试剂盒提取DNA,按说明书操作。PCR总反应体系为25 μL,其中2×GoTaq®Green Master Mix 12.5 μL,引物A 1.0 μL,引物B 1.0 μL,DNA模板4.0 μL,RNase-free水6.5 μL。反应条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃复性50 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸5 min。
1.6.3 琼脂糖凝胶电泳 将配制10×TBE的电泳液稀释成为0.5×TBE的缓冲液,分别加入8 μL的上样标本量和DNA分子量Maker(100 bp)在电压100 V作用下,电泳50 min。在紫外凝胶成像系统和全自动凝胶图像成像仪上观察电泳结果,阳性的判定标准为凝胶上出现与目的基因片段分子相当的条带。
1.6.4 产物核苷酸序列的测定 由上海生工生物工程技术服务有限公司进行PCR产物核苷酸序列测定,测得的核苷酸序列应用DNAStar软件中的Editseq和Megalign进行分析,参比序列选取正反向双向测序结果一致的序列,比对序列应用BLAST程序。
1.7 统计学处理 所得数据均采用细菌耐药性监测中心推行的WHONET统计软件和SPSS 13.0进行数据处理。MDRAB及N-MDRAB对17种抗菌药物的耐药率及外排泵基因型表达阳性率进行卡方检验(χ2)检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 96株MDRAB和24株N-MDRAB对17种抗菌药物的耐药情况 96株MDRAB对阿米卡星、庆大霉素、氨苄西林/舒巴坦、哌拉西林、环丙沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、诺氟沙星、左氧氟沙星、头孢噻肟、复方新诺明、头孢吡肟、头孢曲松、四环素等14种抗菌药物耐药率在65%以上,对亚胺培南、美罗培南抗菌药物耐药率分别为36.46%、35.42%,对多黏菌素B无耐药发生;24株N-MDRAB对阿米卡星、庆大霉素、氨苄西林/舒巴坦、哌拉西林、环丙沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、诺氟沙星、左氧氟沙星、头孢噻肟、复方新诺明、头孢吡肟、头孢曲松、四环素等14种抗菌药物耐药率在13%以下,对亚胺培南、美罗培南、多黏菌素B抗菌药物无耐药发生(表2)。
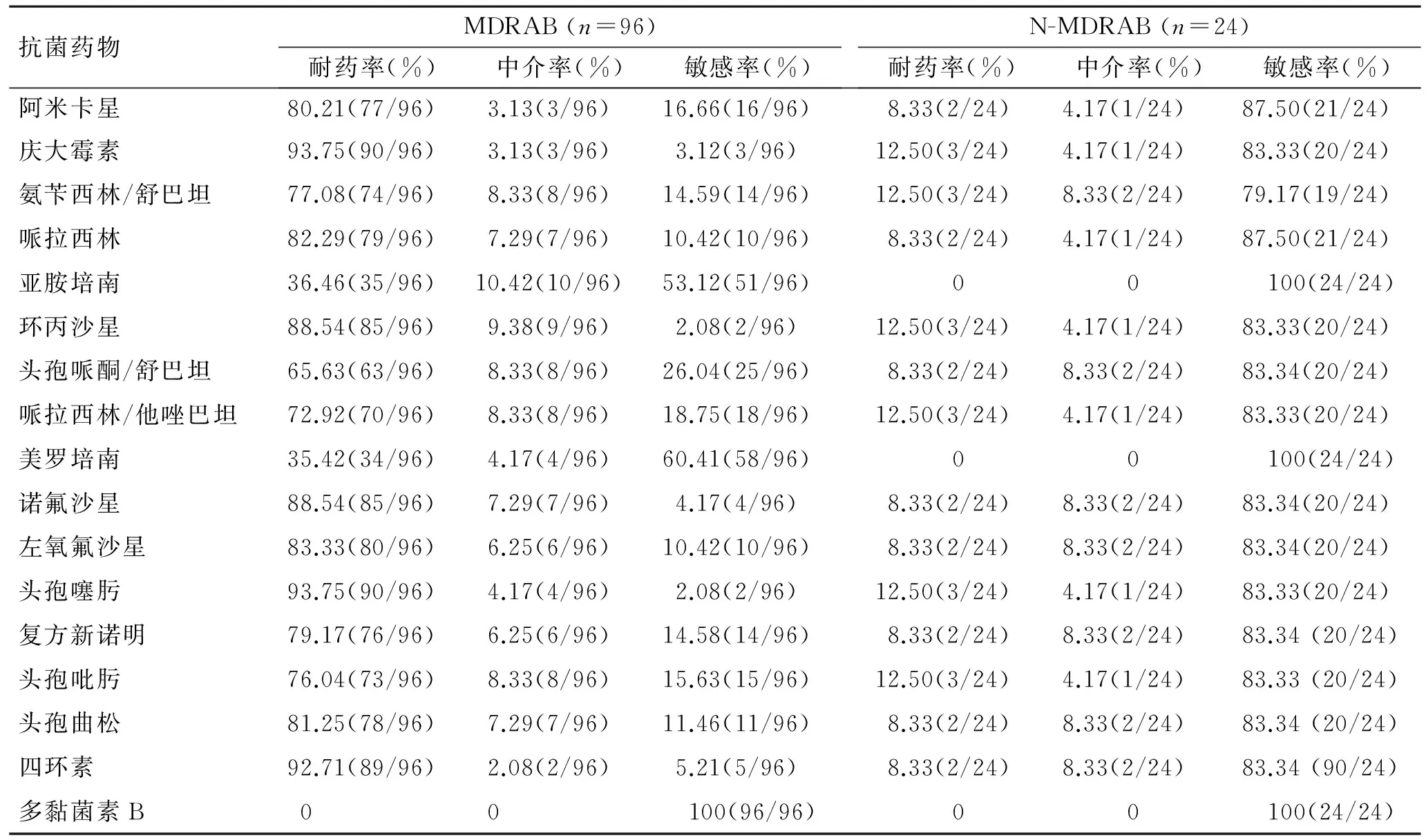
表2 96株MDRAB和24株N-MDRAB对17种抗菌药物的耐药情况Tab.2 Results of drug sensitivity test of 96 MDRAB and 24 N-MDRAB
2.2 抗菌药物加入外排泵抑制剂CCCP前后的药物敏感试验结果 96株MDRAB在4种抗菌药物加入CCCP后,四环素、左氧氟沙星、庆大霉素、头孢噻肟的MIC范围分别由32~128、64~128、16~128、64~128变为8~64、1~128、1~64、8~128(表3)。24株N-MDRAB在4种抗菌药物加入CCCP后,四环素、左氧氟沙星、庆大霉素、头孢噻肟的MIC范围未发生明显变化。
2.3 外排泵阳性菌株检出结果 96株MDRAB在加入泵抑制剂CCCP后,四环素的药敏结果中,MIC值降低4倍及以上共有37株,降低2倍的共有8株,没有变化的共有51株;左氧氟沙星的药敏结果中,MIC值降低4倍及以上共有41株,降低2倍的共有12株,没有变化的共有43株;庆大霉素的药敏结果中,MIC值降低4倍及以上共有53株,降低2倍的共有9株,没有变化的共有34株;头孢噻肟的药敏结果中,MIC值降低4倍及以上共有39株,降低2倍的共有6株,没有变化的共有51株。筛选出34株Ab在加入CCCP泵抑制剂后四种抗生素MIC值均降低4倍。24株N-MDRAB未检测到外排泵阳性菌株。
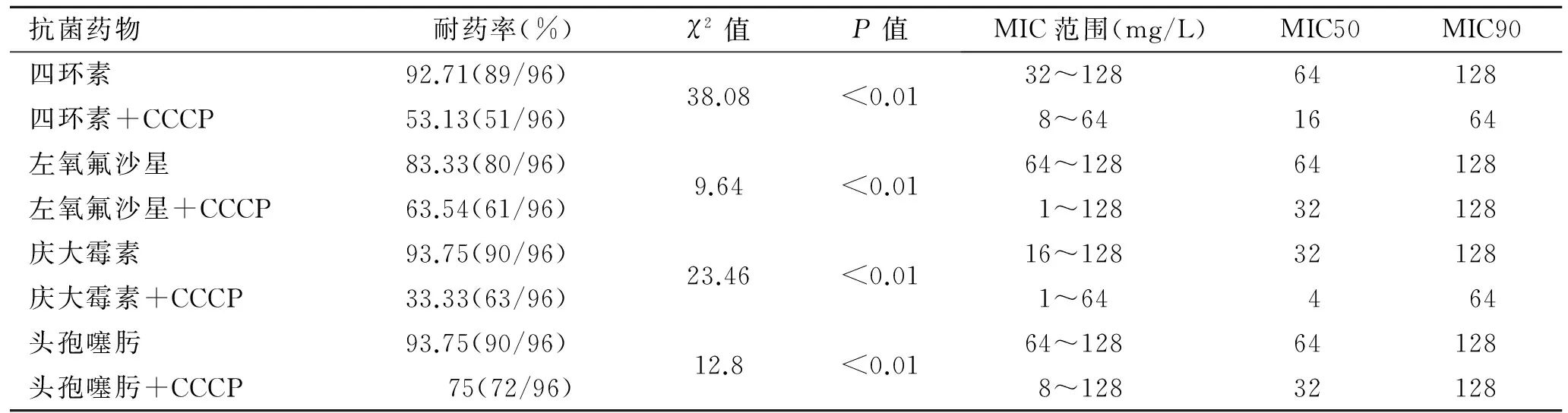
表3 加入外排泵抑制剂CCCP前后对96株MDRAB药物MIC的影响Tab.3 The effect of presence or absence of CCCP on drug sensitivity of 96 MDRAB strains
2.4 34株外排泵阳性MDRAB和24株N-MDRAB外排泵基因型的检测 34株外排泵MDRAB中外排泵基因检测有33株adeB、32株adeR、33株adeS、33株adeJ、0株adeE和33株abeM,检出阳性率分别为97.06%、94.12%、97.06%、97.06%、0、97.06%;24株N-MDRAB外排泵基因检测有12株adeB、20株adeR、16株adeS、18株adeJ、0株adeE和16株abeM,检出阳性率分别为50%、83.33%、66.67%、75%、0、66.67%。耐药基因adeB、adeR、adeS、adeJ、abeM序列与GenBank参考株序列核苷酸同源性均为100%,未发现基因变异现象(表4)。
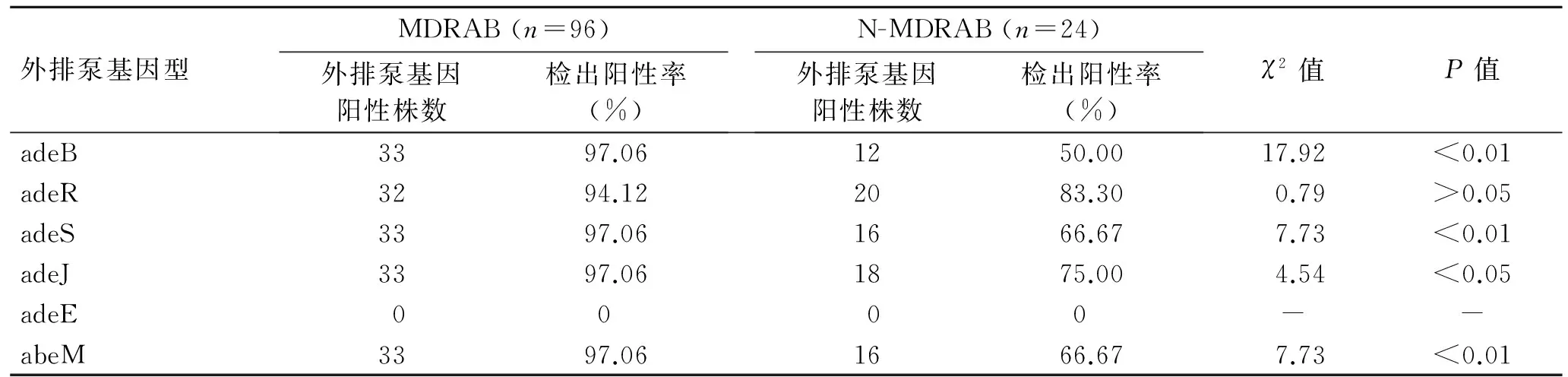
表4 34株外排泵阳性MDRAB和24株N-MDRAB外排泵基因型检测结果Tab.4 The result of efflux pump genotype of 34 MDRAB and 24 N-MDRAB
3 讨 论
近10年来,Ab已逐步成为引起院内感染最重要的机会致病菌。Ab在高水平基因组可塑性和内源性基因突变的影响下,菌体表面外排泵过度表达,排出诸如庆大霉素、氯霉素、喹诺酮类、红霉素、卡那霉素等药物。由于药物无法进入Ab的菌体,故Ab免于药物的杀灭,继而形成多重耐药株[9-11]。引起Ab多重耐药的主要外排泵包括AdeABC、AdeIJK、AdeDE、AbeM。因此,上述外排泵在N-MDRAB和MDRAB中的作用已逐渐成为Ab是否形成多重耐药株的关键。
本研究中96株MDRAB和24株N-MDRAB的药敏结果显示,MDRAB头孢吡肟、头孢噻肟、头孢曲松、头孢哌酮/舒巴坦的耐药率分别为76.04%、93.75%、81.25%、65.63%,对哌拉西林、氨苄西林/舒巴坦、哌拉西林/他唑巴坦的耐药率分别为82.29%、77.08%、72.92%,对亚胺培南、美罗培南的耐药率分别为36.46%、35.42%,对阿米卡星、庆大霉素的耐药率分别为80.21%、93.75%,对环丙沙星、诺氟沙星、左氧氟沙星的耐药率分别为88.54%、88.54%、83.33%,对四环素、复方新诺明、多黏菌素B的耐药率分别为92.71%、79.17%、0。N-MDRAB头孢吡肟、头孢噻肟、头孢曲松、头孢哌酮/舒巴坦的耐药率分别为12.50%、12.50%、81.25%、8.33%,对哌拉西林、氨苄西林/舒巴坦、哌拉西林/他唑巴坦的耐药率分别为8.33%、12.50%、12.50%,对亚胺培南、美罗培南的耐药率分别为0、0,对阿米卡星、庆大霉素的耐药率分别为8.33%、12.50%,对环丙沙星、诺氟沙星、左氧氟沙星的耐药率分别为12.50%、8.33%、8.33%,对四环素、复方新诺明、多黏菌素B的耐药率分别为8.33%、8.33%、0。与何振辉[12]等报告的药敏结果基本一致。
在分子解离状态下,CCCP是一种很强的解偶联剂,通过在膜磷脂两侧自由扩散而形成浓度差,这种浓度差可以减慢H+进入细胞膜时由跨膜电化学浓度梯度产生的ATP的过程,ATP的减少使得菌体外排蛋白能量供应缺失,外排泵无法将药物从菌体内泵出至菌体外[13]。本实验选取了Ab耐药率最高的4种抗菌药物:四环素、左氧氟沙星、庆大霉素、头孢噻肟作为外排底物,通过比较加入CCCP泵抑制剂前后,96株MDRAB及24株N-MDRAB对抗菌药物MIC的变化,实验结果表明,四环素MIC值降低4倍及以上共有37株;左氧氟沙星的药敏结果中,MIC值降低4倍及以上共有41株;庆大霉素,MIC值降低4倍及以上共有53株;头孢噻肟MIC值降低4倍及以上共有39株。最终筛选出34株Ab在加入CCCP泵抑制剂后4种抗生素MIC值均降低4倍。24株N-MDRAB未检测到外排泵阳性菌株。与徐轶等[14]报道的CCCP逆转泛耐药鲍曼不动杆菌耐药性的趋势较为一致。说明泵抑制剂CCCP可以体外抑制外排泵,提升药物对MDRAB的体外抗菌活性。
本研究对34株外排泵阳性株进行外排泵基因检测,得到33株adeB、32株adeR、33株adeS、33株adeJ、0株adeE和33株abeM,检出阳性率0~97.06%;本研究中,adeB的出现几乎伴随着adeR和adeS的出现,这与MARCHAND等[6]的adeR和adeS协同参与adeABC的过度表达,引起调控蛋白转录活性增强,增加耐药几率的研究结果一致。研究中adeJ的存在表明AdeIJK过度表达,其可以影响Ab对β-内酰胺类药物、氯霉素、四环素、林可霉素、喹诺酮类药物、新生霉素、利福平的敏感性。同时AdeIJK、AdeABC协同参与对替加环素的耐药[15]。研究中未检测到adeE的存在,与LIN等[16]发现当adeDE存在于Ab基因组3中时,adeABC无法与其共同存在与同一株Ab中的结论一致。研究中abeM的存在,表明abeM外排系统过度表达,其可以引起Ab对喹诺酮类、庆大霉素、卡那霉素、红霉素、氯霉素敏感性降低[17]。尽管在24株N-MDRAB未检测到外排泵阳性菌株的存在,但外排泵基因检测有12株adeB、20株adeR、16株adeS、18株adeJ、0株adeE和16株abeM,检出阳性率为0~83.33%。尽管统计学表明除adeR之外,其余阳性率有明显差异,但由于在N-MDRAB菌体表面检测到有外排泵基因的存在,可以证明虽然主动外排泵是Ab发生耐药的主要因素,但只单纯检测Ab是否存在主动外排泵基因并不能区分菌株是否多重耐药。因此,Ab发生多重耐药是否与外排泵基因的表达水平或与其他耐药机制相互作用有关仍需进一步证实。
[1] PARK S, LEE KM, YOO YS, et al. Alterations of gyrA, gyrB, and parC and activity of efflux Pump in fluoroquinolone-resistantAcinetobacterbaumannii[J]. Osong Public Health Res Perspect, 2011, 2(3):164-170.
[2] SOROUSH S, HAGHI-ASHIANI MT, TAHERI-KALANI M, et al. Antimicrobial resistance of nosocomial strain ofAcinetobacterbaumanniiin Children’s Medical Center of Tehran: A 6-year prospective study[J]. Acta Med Iran, 2010, 48(3):178-184.
[3] TAWNEY A, SEMPROCH L, LEPHART P, et al. Impact of contact isolation precautions on multi-drug resistantAcinetobacterbaumanniiin the pediatric intensive care unit[J]. Infect Cont Hosp Ep, 2015, 36(09):1108-1110.
[4] 陈佰义,何礼贤,胡必杰,等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志, 2012, 92(2):76-85.
[5] 刘泽世. 泛耐药鲍曼不动杆菌与其主动外排泵蛋白的相关性研究[D]. 河北医科大学,2014.
[6] MARCHAND I, DAMIER-PIOLLE L, COURVALIN P, LAMBERT T: Expression of the RND-type efflux pump AdeABC in Acinetobacter baumannii is regulated by the AdeRS two-component system[J]. Antimicrob Agents Chemother, 2004, 48(9):3298-3304.
[7] CHAU SL, CHU YW, HOUANG ETS. Novel resistance-nodulation-cell division efflux system AdeDE in Acinetobacter genomic DNA group 3[J]. Antimicrob Agents Chemother, 2004, 48(10):4054-4055.
[8] HOU PF, CHEN XY, YAN GF, et al. Study of the correlation of imipenem resistance with efflux pumps AdeABC, AdeIJK, AdeDE and AbeM in clinical isolates ofAcinetobacterbaumannii[J]. Chemother, 2012, 58(2):152-158.
[9] 宋彩虹,陆水英,张秀瑜,等. 鲍曼不动杆菌临床分离株的耐药性及同源性分析[J]. 中国微生态学杂志, 2013, 25(002):161-164.
[10] ABDALLAH M, OLAFISOYE O, CORTES C, et al. Activity of eravacycline against Enterobacteriaceae andAcinetobacterbaumannii, including multidrug-resistant isolates, from New York City[J]. Antimicrob Agents Chemother, 2015, 59(3):1802-1805.
[11] RAJAMOHAN G, SRINIVASAN VB, GEBREYES WA. Molecular and functional characterization of a novel efflux pump, AmvA, mediating antimicrobial and disinfectant resistance inAcinetobacterbaumannii[J]. J Antimicrob Chemother, 2010, 65(9):1919-1925.
[12] 何振辉,严俭敏,钟瑞雪,等. 鲍曼不动杆菌的临床分布、耐药表型分析及防治对策[J]. 中华疾病控制杂志, 2014, 18(7):674-678.
[13] 卢灵锋,李光荣,向成玉,等. 鲍曼不动杆菌adeB基因检测及外排泵抑制剂对其药物敏感性的影响[J]. 国际检验医学杂志, 2015, 36(11):1520-1522.
[14] 徐轶,章白苓,章洁苓,等. 泛耐药鲍曼不动杆菌主动外排泵adeB基因表达及耐药性研究[J]. 实验与检验医学, 2015, 33(3):261-263.
[15] COYNE S, COURVALIN P, PERICHON B. Efflux-mediated antibiotic resistance in Acinetobacter spp[J]. Antimicrob Agents Chemother, 2011, 55(3):947-953.
[16] LIN L, LING BD, LI XZ. Distribution of the multidrug efflux pump genes, adeABC, adeDE and adeIJK, and class 1 integron genes in multiple-antimicrobial-resistant clinical isolates of Acinetobacter baumannii-Acinetobacter calcoaceticus complex[J]. Int J Antimicrob Agents, 2009, 33(1):27-32.
[17] SWICK MC, MORGAN-LINNELL SK, CARLOSN KM. Expression of multidrug efflux pump genes acrAB-tolC, mdfA, and norE in Escherichia coli clinical isolates as a function of fluoroquinolone and multidrug resistance[J]. J Antimicrob Agents Chemother, 2011, 55(2):921-924.
(编辑 卓选鹏)
Relationship between efflux pump and gene expression of non-multidrug resistant and multidrug resistantAcinetobacterbaumannii
LIU Ze-shi1, HU Rui2, ZHANG Yi1, CHEN Zheng-li3, GENG Yan1, XUE Li1
(1. Department of Medical Clinical Laboratory, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2. Department of Intensive Care Unit, Xibei Women and Children’s Hospital, Xi’an 710061; 3. Department of Clinical Laboratory,the First Hospital of Hebei Medical University, Shijiazhuang 050031, China)
Objective To explore the efflux pump phenotype, genotype and gene expressions of multidrugAcinetobacterbaumannii(MDRAB) and non-multidrug resistantAcinetobacterbaumannii(N-MDRAB). Methods K-B method was used to detect 120 strains ofAcinetobacterbaumanniiincluding 96 multidrug resistant strains and 24 non-multidrug resistant strains. We detected efflux pump genotype and gene expressions of multidrug and non-multidrug resistantAcinetobacterbaumanniiwith broth microdilution method by the addition of carbonyl cyanide chlorobenzene hydrazone pump inhibitors with Sylvia Valdezate method. Strains whose MIC decreased to 1/4 or less of the original values were positive ones. Characteristics of efflux pump protein gene sequence were studied by PCR amplification and sequencing. Results TheAcinetobacterbaumanniiresistance rate of 96 strains to cephalosporins, beta-lactams, penicillium carbon alkenes, aminoglycosides, quinolones, tetracyclines, tetracyclines, sulfas, and polymyxins was 73.96%-97.92%, 76.04%-92.71%, 40.63%-42.71%, 92.71%-98.96%, 93.75%-98.96%, 98.96%, 79.17%, and 0. TheAcinetobacterbaumanniiresistance rate of 24 strains was 16.52%-20.43%, 11.22%-15.65%, 0, 17.83%-18.26%, 20.43%-23.39%, 14.78%, 19.57%, and 0. There were 34 positive efflux pump phenotypes in 96 multidrug resistantAcinetobacterbaumanniistrains, including 33 adeB strains, 32 adeR strains, 33 adeS strains, 33 adeJ strains, 0 adeE strains, 33 abeMstrains, with positive detection rate of 97.06%, 94.12%, 97.06%, 97.06%, 0, and 97.06%, respectively. Positive efflux pump phenotype was not detected in 24 multidrug resistantAcinetobacterbaumanniistrains, but in 12 adeB strains, 20 adeR strains,16 adeS strains,18 adeJ strains, 0 adeE strains, and 16 abeM strains, with a positive detection rate of 50%, 83.33%, 66.67%, 75%, 0, and 66.67%, respectively. By sequence comparison, the sequence homology of adeB, adeR, adeS, adeJ, and abeM genes was 100% in the Genbank. Conclusion The efflux pump genes exist both in multidrug and non-multidrug resistantAcinetobacterbaumannii.
Acinetobacterbaumannii; multidrug resistance; efflux pump; carbonyl cyanide chlorobenzene hydrazone; genotype; phenotype
2016-01-09
2016-04-19
耿燕. E-mail: wsw87679358@163.com
R378.99
A
10.7652/jdyxb201606009
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161010.1814.014.html(2016-10-10)
