大鼠骨髓间充质干细胞与树枝状两亲性多肽自组装凝胶支架的生物相容性
2016-12-08宋玉林汪文玉陈伟高
陈 睿,宋玉林,汪文玉,吴 凯,陈伟高
(南昌大学第二附属医院骨科,江西南昌 330000)
◇基础研究◇
大鼠骨髓间充质干细胞与树枝状两亲性多肽自组装凝胶支架的生物相容性
陈 睿,宋玉林,汪文玉,吴 凯,陈伟高
(南昌大学第二附属医院骨科,江西南昌 330000)
目的 研究大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)与树枝状两亲性多肽自组装凝胶支架的生物相容性。方法 获取大鼠BMSCs,传至第3代行流式细胞术表面抗原检测及成脂分化诱导鉴定干细胞。设计含双链-IKVAV活性集团的树枝状两亲性多肽,用固相合成法合成多肽,质谱仪(MS)测其分子量,高效液相色谱仪(HPLC)测其纯度;将10 mg/mL树枝状两亲性多肽溶液在兔膝关节滑液作用下自组装为凝胶支架,透射电镜观察凝胶超微结构;1×109/L的BMSCs悬液分别接种于凝胶内部(三维培养体系)及多聚赖氨酸包被的盖玻片表面(二维培养体系),CCK-8法绘制细胞生长曲线。DEAD/LIVE双标染色,荧光显微镜观察BMSCs在三维多肽凝胶中成活及增殖情况。结果 分离获取的细胞高表达CD29、CD90,不表达CD34、CD45,经成脂诱导2周出现脂滴,油红O染色成红色。MS测得合成多肽相对分子质量为2 344.2,与其理论值一致;HPLC分析其纯度为95.15%;透射电镜观察凝胶由多孔纳米纤维构成,纳米纤维直径为5~7 nm,长度为数百纳米至数微米;CCK8试验示三维体系中细胞增殖率明显高于二维培养体系(P<0.05)。DEAD/LIVE双荧光染色后显示三维培养体系中细胞生存、增殖情况良好,未出现明显的细胞毒性导致细胞死亡。结论 含-IKVAV活性基团的树枝状两亲性多肽与BMSCs具有良好的细胞相容性并能促进其增殖。
骨髓间充质干细胞;-IKVAV;树枝状两亲性多肽;细胞相容性
随着我国交通和工业的快速发展,脊髓损伤发生率不断增加,治疗及康复困难,导致患者劳动能力不同程度丧失,造成患者家属极度身心痛苦,给社会带来严重经济负担,是迫切需要解决的问题。
目前,仿生脊髓再生是治疗脊髓损伤的有效方法。脊髓组织工程(tissue engineering)是仿生脊髓再生的理想技术[1]。两亲性多肽凝胶因具备高度仿生结构和良好的生物相容性成为脊髓组织工程材料的优先选择[2]。树枝状两亲性多肽因在线性多肽的基础上通过赖氨酸支化使其能同时携带多个一种或多种活性表位,从而能为细胞提供更多的生物信号而被重视[3]。骨髓间充质干细胞(BMSCs)由于其具有多向分化潜能、低免疫原性、易获性等优点而成为脊髓组织工程的理想种子细胞。本实验通过设计及合成树枝状两亲性多肽,自组装形成多孔纳米凝胶支架,研究大鼠BMSCs与其生物相容性研究,为进一步的脊髓组织工程构建提供实验基础。
1 材料与方法
1.1 实验动物 健康4周龄SD大鼠5只,健康3月龄日本大耳白兔3只,均由南昌大学医学院动物中心提供。结构式为IKVAV-KIKVAV-K KLLLAAA(K)-C16H31O 两亲性分支多肽委托上海波泰公司合成。
1.2 主要试剂与仪器 DMEM-F12培养基、FBS(Gibco北美);2.5 g/L胰蛋白酶-0.2 g/L(EDTA)(Gibco公司,美国);Ⅰ型胶原酶、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(IBMX)、油红O染色剂(Sigma公司,美国);吲哚美辛(Alexis公司,美国);兔抗大鼠CD29、CD34、CD45、CD90多克隆抗体(BD公司,美国);碘化丙啶(propidium iodide, PI),钙黄绿素乙酰氧基甲酯(Calcein-AM)(Invitrogen公司,美国);0.1 mol/L KCl、0.1 mol/L HCl(国药集团)。
倒置相差显微镜、荧光倒置显微镜(Olympus公司,日本);透射电子显微镜(transmission electron microscope, TEM) (JEM, Japan);流式细胞仪(BD公司,美国);CO2培养箱、多功能酶标仪(Thermo公司,美国)。
1.3 BMSCs的分离培养与鉴定
1.3.1 BMSCs的获取 采用脊髓脱臼法处死健康4周龄SD大鼠,置入750 mL/L乙醇浸泡10 min;无菌条件下取出股骨及胫骨,PBS清洗3次;剪刀剪去股骨及胫骨两端骨骺,用DMEM-F12培养基冲洗骨髓腔,反复吹打冲洗液制备成单细胞悬液。1 000 r/min离心5 min,弃去上清液,以含有100 mL/L FBS的DMEM-F12完全培养基重悬细胞,以1×109/L的细胞密度接种于25 cm2培养瓶中,置于37 ℃、CO2饱和湿度培养箱中培养。原代培养过程中,48 h后半量更换新鲜培养液,以后每2 d全量更换新鲜培养液,待细胞铺满培养瓶底至细胞融合成单层,密度长至80%融合时,用2.5 g/L胰蛋白酶消化,按1∶2的比例进行传代培养。每天在倒置相差显微镜下观察细胞形态和生长状况,传至第3代供实验用。
1.3.2 流式细胞术检测BMSCs表面抗原 取第3代BMSCs,胰蛋白酶消化,离心1 000 r/min×5 min,弃上清,加少量PBS吹打均匀,调整细胞密度为1×109个/L,将细胞悬液移入EP管(100 μL/管),每管分别加入含有FITC标记的-CD29、-CD34、-CD45、-CD90流式单克隆抗体各5 μL,以同型FITC-IgG抗体为阴性对照,避光室温孵育45 min,PBS洗涤2次以去除未结合的抗体,离心弃上清后,以每管500 μL PBS重悬均匀,流式细胞仪进行检测分析。
1.3.3 BMSCs的体外定向诱导分化 取第3代BMSCs胰蛋白酶消化,按1×108/L浓度接种于置有盖玻片的6孔培养板上,待细胞贴壁融合较多时,将培养基更换为成脂诱导培养基(高糖DMEM,100 mL/L FBS,1 μmol/L地塞米松,10 μmol/L胰岛素,0.5 mmol/L IBMX,200 μmol/L吲哚美辛),阴性对照用100 mL/L FBS的完全培养基培养,每周换液2~3次。定期观察细胞形态变化,培养2周后取细胞爬片,PBS清洗后40 g/L多聚甲醛固定5 min,洗涤后加入油红O工作液染色15 min,PBS洗涤2次后行显微镜观察。
1.4 树枝状两亲性肽凝胶的制备 采用空气栓塞法处死健康3月龄日本大耳白兔,使用含双抗的PBS溶液彻底清洗四肢,750 mL/L乙醇浸泡后使用无菌手术器械分离切开膝关节,当关节囊切口后使用无菌注射器收集关节液,完毕后放置于4 ℃冰箱中待用。
10 mg(IKVAV)2-PA多肽置入装有600 μL 0.1 mol/L KCl溶液血清瓶中,使用0.1 mol/L HCl溶液及三蒸水调节多肽溶液浓度及pH值,将溶液pH值调至5,浓度为1%(质量分数)后涡旋机反复震荡形成澄清的临界状态下自组装溶液。500 μL 1%(质量分数)临界多肽溶液加入到等体积关节液中形成多肽自组装凝胶。50 μL 1%(质量分数)临界多肽溶液与等体积关节液充分混合形成凝胶涂布于金属滤网上,脱水,临界点干燥,磷酸钨染色,作TEM观察。
1.5 树枝状两亲性多肽自组装凝胶与BMSCs细胞的相容性检测 将300 μL 1%(质量分数)临界多肽溶液加入到300 μL 1×107/L细胞悬液中数秒后形成凝胶,吸去多余液体后加入500 μL完全培养基形成三维培养体系,置于37 ℃、50 mL/L CO2孵箱中培养。分别于第3、5、7天进行Calcein-AM和PI染色,观察每孔板中加入含1/10体积2 μmol/L、4 μmol/L的Calcein-AM和PI的细胞培养基,置于37 ℃孵箱孵育15 min,再用PBS洗涤2遍。在荧光显微镜下,先使用490 nm激发波长观察绿色的活细胞,然后用545 nm激发波长观察红色的死细胞。观察各个时间点细胞形态特征、活细胞和死细胞数量。每组随机选取3个视野下拍摄的绿色荧光和红色荧光图片通过2名实验者用Photoshop点计数工具进行细胞计数,统计学作图软件制作柱状图。
取生长状态良好的第3代BMSCs,血清消化后用关节液重悬细胞制成密度为1×107/L细胞悬液。将96孔板随机分为2组。对照组:加入100 μL 1×107/L细胞悬液,待8 h后细胞完全贴壁后吸去关节液,加入100 μL完全培养基形成二维培养体系。实验组:加入100 μL 1×107/L细胞悬液后每孔加入100 μL 1%(质量分数)临界多肽溶液,数秒后形成凝胶,吸去多余液体后加入100 μL完全培养基形成三维培养体系。成胶后再每孔加入100 μL细胞悬液。每组5个复孔,共接种4块96孔板。置于37 ℃、50 mL/L CO2孵箱中培养。分别在1、3、5、7 d各取出一板,于实验组和对照组分别加入CCK8 10 μL,孵箱中培养2 h,酶标仪检测450 nm处A值。将每天平均A值用统计学作图软件在坐标纸上绘出实验组和对照组的增殖曲线。

2 结 果
2.1 BMSCs光镜下的形态学观察 原代细胞接种于培养瓶后,细胞呈圆形,大小不一,悬浮于培养液中。48 h后开始有细胞贴壁,呈梭形、多角形(图1A)。通过换液逐渐除去不贴壁的杂质细胞。3、4 d后可见放射状排列的细胞集落,伸出长短不一突起(图1B)。当培养到第8天左右细胞融合至90%,细胞呈现漩涡状、鱼群样排列。传代后细胞贴壁生长,细胞形态均一,呈梭形生长,细胞生长旺盛。传代时间稳定约6 d(图1C、1D、1E、1F)。

图1 原代及传代培养的BMSCs细胞形态Fig.1 Morphological observation of first-generation and third- generation rat BMSCs (inverted phase contrast microscope)
2.2 流式细胞术检测BMSCs表面抗原的表达结果 选取的第3代BMSCs经4种流式抗体结合后上机检测,结果显示,BMSCs表达CD29(阳性率99.88%)、CD90(阳性率99.36%),不表达或极低表达CD34(阳性率1.15%)、CD45(阳性率1.52%)(图2)。

图2 第3代BMSCs流式细胞术检测表面抗原的表达情况Fig.2 Detection of surface antigens of third-generation BMSCs by flow cytometry
2.3 BMSCs的成脂诱导和油红O染色结果 BMSCs在成脂诱导培养基中培养后,第2天即可看到细胞骨架收缩,第3天后可见透亮脂滴开始增多变大。诱导2周后脂滴形成较多,融合为较大脂滴(图3A),经油红O染色后可见脂滴被染成红色(图3B)。
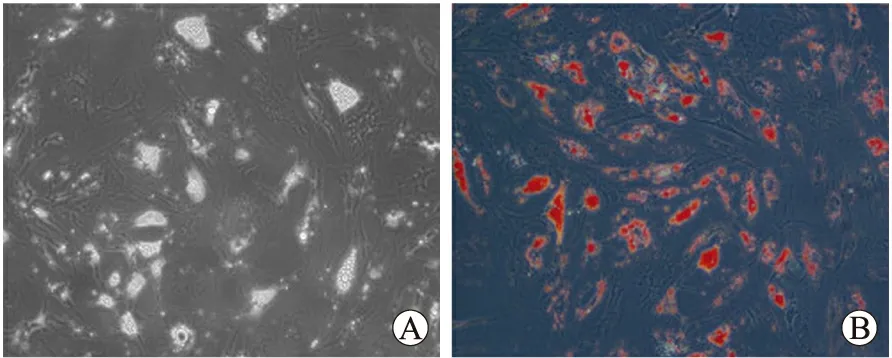
图3 BMSCs成脂诱导2周油红O染色结果Fig.3 Oil red O staining after induction to adipogenic differentiation for two weeks (inverted phase contrast microscope, ×200)
2.4 肽的检测结果 肽分子结构见图4A,MS示其平均分子质量为2 344.2,与其理论设计肽分子质量一致(图4B);HPLC显示合成的树枝状两亲性多肽的纯度为95.15%(图4C);表明所合成的多肽为本实验目标肽。

图4 两亲性树枝状多肽检测结果Fig.4 The detection results of the branched peptide-amphiphile
2.5 肽自组装凝胶及检测结果 当在1%(质量分数)多肽溶液中加入等体积的关节液促发其自组装,数秒后形成透明多肽凝胶紧贴于瓶壁,晃动血清瓶凝胶不脱落(图5A)。TEM观察凝胶由纳米纤维构成,纳米纤维直径为5~7 nm,长度为构100~1 500 nm(图5B)。
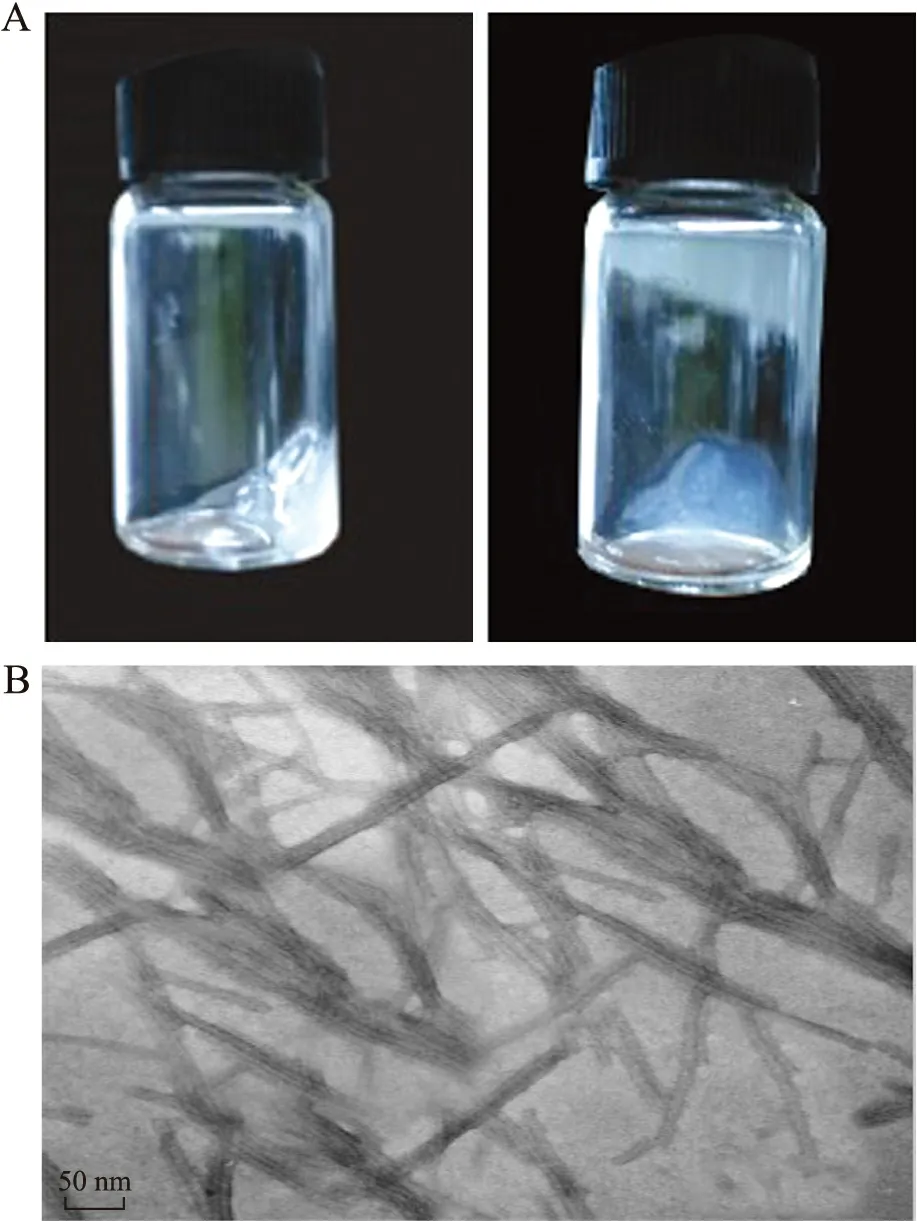
图5 自组装纳米凝胶检测结果Fig.5 The detection results of self-assembling nanofiber hydrogel
2.6 树枝状两亲性多肽凝胶与BMSCs细胞相容性 将300 μL 1%(质量分数)临界多肽溶液加入到300 μL 1×107/L细胞悬液中数秒后形成凝胶构建细胞三维培养体系,8 h后活细胞向四周发出不规则突起,逐渐变为多角形或梭形恢复为正常细胞形态,死细胞未伸长呈圆形(图6)。Calcein-AM和PI染色,细胞点计数第1、3、5天活细胞与死细胞数目,随着培养天数的增加三维体系中活细胞数目明显增多且差异有统计学意义(P=0.018),但未出现更多的细胞死亡,差异无统计学意义(图7)。CCK结果显示,第3天BMSCs开始出现明显增殖,细胞在三维培养中增殖活性明显高于二维体,差异有统计学意义(P=0.026),当到第7天二维培养体系细胞达到一个平台期不再出现细胞分裂增殖,但三维体系中细胞增殖情况仍然继续(图8)。

图6 BMSCs在纳米纤维凝胶中生长8 h后Fig.6 The BMSCs living in the nanofiber hydrogel after 8 h

图7 细胞三维培养下Calcein-AM和PI染色结果Fig.7 The calcein-AM and PI staining results of cells in three-dimensional culture
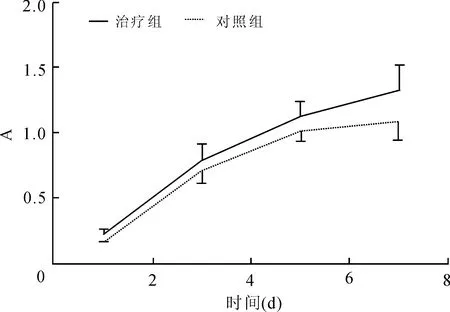
图8 CCK8检测实验组和对照组BMSCs增殖曲线Fig.8 BMSCs’ growth curves in experimental group and control group by CCK8 test
3 讨 论
脊髓损伤后的治疗及康复一直是世界性的难题,是当今迫切需要解决的问题。正常脊髓由功能性微血管、完整血脊髓屏障、细胞外基质、神经细胞及诱导因子等构成[4]。目前,脊髓损伤研究的热点一直集中于脊髓组织工程的构建。
脊髓组织工程是仿生脊髓再生的理想技术。树枝状两亲性多肽自组装后形成高宽比的圆柱形纳米支架材料具有如下优点:①可通过肽分子赖氨酸位点进行支化;②携带多个功能基团或抗原表位,该功能基团位于自组装纳米纤维表面,易于与受体结合,执行复杂生物功能;③生物相容性好[5]。因此,树枝状两亲性多肽是目前构建脊髓组织工程支架材料的良好选择。
脊髓组织工程大多以神经干细胞作为种子细胞,然而有活力的神经干细胞主要从胚胎或新生哺乳动物脑或脊髓中获取,其取材受到伦理限制,必须考虑既合法又不违背伦理及易获取等特点。骨髓基质干细胞(bone marrow stromal cells, BMSCs)可以克服这些缺点,它可以从哺乳动物自身骨髓获取,通过基因修饰可产生多种生长因子,如neurotrophin-3(NT-3)、angiopoietin-1(Ang-1)及VEGF等;NT-3可通过酪氨酸激酶受体-3(NTPK-3/TrkC)诱导神经前体细胞分化为神经元,通过转分化(transdifferentiation)诱导BMSCs分化为功能性神经元[6]。所以,BMSCs才是较为理想的种子细胞。
本实验合成的树枝状多肽特点在于:①含有长链的烷基尾C16H31O-,该结构可以提高肽对离子敏感度并调节自组装纳米纤维直径和长度。②含有A3L3(AAALLL),一方面与烷基起协同效应,另一方面使活性区域伸出纤维表面。③肽分子羧基末端引入3个赖氨酸分支单元,分别插入IKVAV活性集团。优点在于:①由于高电荷赖氨酸树枝大分子提供空间位阻,使多肽分子互相分离,改善活性结构与整合素受体结合。②肽分子在生理盐溶作用下自组装形成高宽比的纳米纤维,其分支结构置于纳米纤维表面,增强结合能力,而且携带多个活性结构。③IKVAV具有能够促进细胞粘附、神经突触形成、血管再生等作用[7]。
将多肽溶解形成临界多肽溶液。当加入等体积兔膝关节液后由于关节液内各种离子的存在,多肽通过分子内非共价键(氢键、疏水键、范德华力等)自组装为三维多孔纳米纤维凝胶支架。凝胶由高宽比的三维纳米纤维组成,含水量高达99.5%,对细胞有良好的机械支撑作用,蛋白质、生物因子、氧气等通过在凝胶中弥散作用足够满足大量细胞生存[8]。
由20世纪70年代FRIEDENSTEIN等采用差异贴壁法首次从骨髓中分离培养BMSCs,该法至今仍是培养BMSCs的常用方法。本实验采用该方法获取的BMSCs后,通过形态学观察、表面抗原检测和定向诱导分化,验证获取的细胞为BMSCs。将BMSCs与多孔纳米纤维凝胶支架组合构建三维培养体系后,由于自组装三维多肽凝胶为细胞的生长与繁殖提供了更大的生长空间和-IKVAV活性表位。CCK-8结果显示细胞在三维培养中增殖活性明显高于二维体,且到达平台期时细胞数量也明显增多。DEAD/LIVE试剂盒是通过钙黄绿素乙酰氧基甲酯(Calcein-AM)和碘化丙啶(PI)分别将活细胞胞质和死细胞核染成绿、红色,可进行细胞标记,也用于检测细胞存活率[9]。三维培养体系通过染色后显示,随着培养天数的增加,细胞健康程度明显升高,提示多肽凝胶与BMSCs具有良好的生物相容性。而第1天中有一部分细胞死亡主要考虑自组装过程中溶液离子浓度及pH值变化所致。
综上所述,本实验通过构建以BMSCs为种子细胞、树枝状两亲性多肽为支架材料的三维培养体系,充分说明了树枝状两亲性多肽自主装凝胶支架对BMSCs具有良好的生物相容性,为今后进一步的脊髓组织工程模块构建提供基础。
[1] VALARMATHI MT, DAVIS JM, YOST MJ, et al. A three-dimensional model of vasculogenesis[J]. Biomaterials, 2009, 30(6):1098-1112.
[2] 元亮亮,梁鹏. 自组装多肽纳米纤维支架的结构特点及应用优势[J]. 中国组织工程研究, 2013, 17(29):5379-5386.
[3] HARRINGTON DA, CHENG EY, GULER MO, et al. Branched peptide-amphiphiles as self-assembling coatings for tissue engineering scaffolds[J]. J Biomed Mater Res A, 2006, 78(1):157-167.
[4] ABRAMS MB, NILSSON I, LEWANDOWSKI SA, et al. Imatinib enhances functional outcome after spinal cord injury[J]. PLoS One, 2012, 7(6):e38760.
[5] GUDLUR S, SUKTHANKAR P, GAO J, et al. Peptide nanovesicles formed by the self-assembly of branched amphiphilic peptides[J]. PLoS One, 2012, 7(9):e45374.
[6] ZHANG YJ, ZHANG W, LIN CG, et al. Neurotrophin-3 gene modified mesenchymal stem cells promote remyelination and functional recovery in the demyelinated spinal cord of rats[J]. J Neurol Sci, 2012, 313(1-2):64-74.
[7] YAMADA M, KADOYA Y, KASAI S, et al. Ile-Lys-Val-Ala-Val (IKVAV)-containing laminin alpha1 chain peptides form amyloid-like fibrils[J]. FEBS Lett, 2002, 530(1-3):48-52.
[8] MA W, FITZGERALD W, LIU QY, et al. CNS stem and progenitor cell differentiation into functional neuronal circuits in three-dimensional collagen gels[J]. Exp Neurol, 2004, 190(2):276-288.
[9] ZHOU S, CUI Z, URBAN J. Dead cell counts during serum cultivation are underestimated by the fluorescent live/dead assay[J]. Biotechnol J, 2011, 6(5):513-518.
(编辑 卓选鹏)
Compatibility between rat bone marrow mesenchymal stem cells and self-assembling branched peptide-amphiphile nanofiber hydrogel scaffolds
CHEN Rui, SONG Yu-lin, WANG Wen-yu, WU Kai, CHEN Wei-gao
(Department of Orthopedics Surgery, the Second Affiliated Hospital of Nanchang University, Nanchang 330000, China)
Objective To study the compatibility between bone marrow mesenchymal stem cells (BMSCs) and self-assembling branched peptide-amphiphile nanofiber hydrogel scaffolds. Methods First, we obtained BMSCs from rats by whole marrow adherence method and then detected surface antigens using flow cytometry, and induced adipogenic differentiation to identify these stem cells. We designed the branched peptide-amphiphile containing double-IKVAV epitopes. The peptide whose molecular weight (MW) and purity were detected by mass spectrometer (MS) and high performance liquid chromatograph (HPLC), respectively, was synthesized with solid phase method. The 10 mg/mL peptide solution was triggered to form self-assembling branched peptide-amphiphile nanofiber hydrogel under the effect of the rabbit knee joint synovial fluid. The self-assembly hydrogel was examined with transmission electron microscope (TEM). 1×109/L BMSCs were seeded in three-dimensional (3D) hydrogels (experimental group, EG) or surface of coverslips (control Group, CG). A growth curve of the cells was obtained according to CCK-8. After double-labeling with DEAD/LIVE, the survival and proliferation of the BMSCs living in three-dimensional (3D) hydrogels were observed by fluorescence microscope. Results The cells we obtained highly expressed CD29 and CD90, but did not express CD34 or CD45. Lipid droplets were generated after induction to adipogenic differentiation for two weeks, and oil red O staining was positive. MS showed that molecular weight of the peptide was 2 344.2, which was identical to that in theory. HPLC testified that the peptide purity was 96%.
bone marrow mesenchymal stem cell; -IKVAV; branched peptide amphiphile; cytocompatibility
2016-01-01
2016-04-19
国家自然科学基金资助项目(No.81360271);江西省教育厅科学技术研究重点项目(No.GJJ14054)
Supported by the National Natural Science Foundation of China (No.81360271) and Key Science and Technology Research Programs of Jiangxi Provincial Education Department (No.GJJ14054)
宋玉林. E-mail: songyulin2001@163.com
R318
A
10.7652/jdyxb201606007
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161010.1800.012.html(2016-10-10)
TEM showed that the hydrogel was composed of nanofibers with 5-7 nm in diameter and hundreds of nanometers to several microns in length. CCK8 test showed that BMSCs proliferated more actively in 3D hydrogel than in 2D culture (P<0.05). Observed under fluorescence microscope after DEAD/LIVE kit staining, the cells survived and proliferated in good condition, the hydrogel had no cytotoxicity to the cells. Conclusion The self-assembled hydrogel containing double-IKVAV epitopes can provide survival environment for BMSCs and promote their proliferation.
