骨骼肌线粒体蛋白输入机制的运动适应性研究进展
2016-12-08张媛丁树哲
张媛 丁树哲
1南京体育学院运动健康科学系(南京 210014)2华东师范大学体育与健康学院(上海 200062)
骨骼肌线粒体蛋白输入机制的运动适应性研究进展
张媛1丁树哲2
1南京体育学院运动健康科学系(南京 210014)2华东师范大学体育与健康学院(上海 200062)
线粒体具有基因半自主性,99%的线粒体蛋白均由nDNA编码,需要经过转录、翻译,通过存在于线粒体膜上的蛋白输入机制(PIM:protein import machinery)输入至线粒体的不同区域,发挥功能。线粒体蛋白输入路径主要包括:1)线粒体基质蛋白输入;2)线粒体外膜蛋白输入;3)线粒体内膜蛋白输入;4)线粒体膜间隙蛋白输入等4个通路。PIM是线粒体生物发生的物质保障,是维持骨骼肌线粒体发挥正常功能的重要环节。骨骼肌线粒体PIM的运动适应性研究将进一步揭示运动性线粒体生物发生的分子机制及运动诱发线粒体与其它细胞器之间的相互作用。
骨骼肌;线粒体蛋白输入;运动适应
线粒体是真核细胞中普遍存在的最重要的细胞器之一,同时也是机体自由基产生和清除的重要器官。线粒体生物发生是细胞内的重要分子事件,其指细胞中新的线粒体形成过程,是在一个细胞生命周期中线粒体的增殖、系统发生和个体发生过程。线粒体的特殊性在于:其具有基因半自主性,即线粒体蛋白受细胞核基因(nDNA)和线粒体基因(mtDNA)双重调控,在分别通过细胞质、线粒体核糖体翻译后形成存在于线粒体不同区域的线粒体蛋白,随后在维持线粒体乃至整个细胞功能中发挥重要作用。线粒体生物发生过程非常复杂,99%的线粒体蛋白均由nDNA编码,需要经过转录、翻译,通过存在于线粒体膜上的PIM输入至线粒体内,最终在呼吸链和线粒体不同区域装配为参与线粒体生物发生的不同蛋白。线粒体蛋白输入机制是线粒体生物发生的重要物质保障,其对维持线粒体稳态发挥重要作用[1]。
1 线粒体PIM概述
真核细胞含有多个细胞器以及被膜包围的间隙,大多数蛋白在细胞质内合成,约一半以上需要通过转移或穿过至少一层细胞膜到达其目的地。线粒体蛋白大约有1000(酵母)到1500(人体)种,其中约1%受线粒体DNA编码,这部分蛋白在线粒体基质中由线粒体核糖体合成,无需转运直接在线粒体中发挥作用,而其余约99%的线粒体蛋白均由细胞核DNA编码,这部分蛋白则需在胞质中由细胞质核糖体合成携带特定信号序列的前体蛋白,而后必须通过存在于线粒体膜的PIM输入至线粒体不同区域发挥作用[2-5]。尽管线粒体在生物代谢中具有重要作用,但由于细胞可选择进行无氧代谢,因此线粒体呼吸链蛋白以及线粒体ATP合成酶并非对细胞存活至关重要,然而,线粒体蛋白输入、折叠机制却与细胞的存活质量密切相关[3,6,7]。对线粒体PIM近二十多年的研究始于发现酵母线粒体的相关PIM组件蛋白,随着研究不断深入,更多线粒体PIM组件蛋白及蛋白输入通路被发现[8,9],而对高等动物线粒体PIM的研究仅仅处于起步阶段[10]。线粒体PIM的复杂性体现在:1)线粒体自身的特殊性决定了线粒体PIM的复杂性,线粒体不同的区域划分决定了PIM必然存在不同的路径及机制;2)蛋白输入过程是一个动态事件,其决定了其整个过程是一个耗能的过程;3)PIM涉及到一个复杂的蛋白体系,其中包含诸多蛋白,每个蛋白在PIM中均发挥着不同的作用;4)由于PIM与线粒体内、外膜均密切联系,因此可能与线粒体呼吸链、线粒体融裂及线粒体自噬等过程存在某种关联[11,12];5)线粒体蛋白输入过程与邻近细胞器密切相关,如细胞核、内质网等[13,14]。
2 线粒体PIM主要通路及重要组件
对PIM的研究起初认为所有线粒体前体蛋白输入线粒体只通过一个主要通路或机制,其称为前体蛋白序列通路[8]。这一通路主要涉及:线粒体前体蛋白末端含有的氨基酸序列,这些氨基酸小段序列引导前体蛋白与线粒体外膜、内膜上转移酶相互作用,最终输入至线粒体不同区域。随着更多的PIM组件蛋白及新的蛋
白输入通路被发现,一些新的机械性理论也随即出现,如氧化应激调节性输入,呼吸链超复合物的形成和一系列转移酶的调节机制等。基于目前研究现状,线粒体蛋白输入路径主要有5种(如图1)。
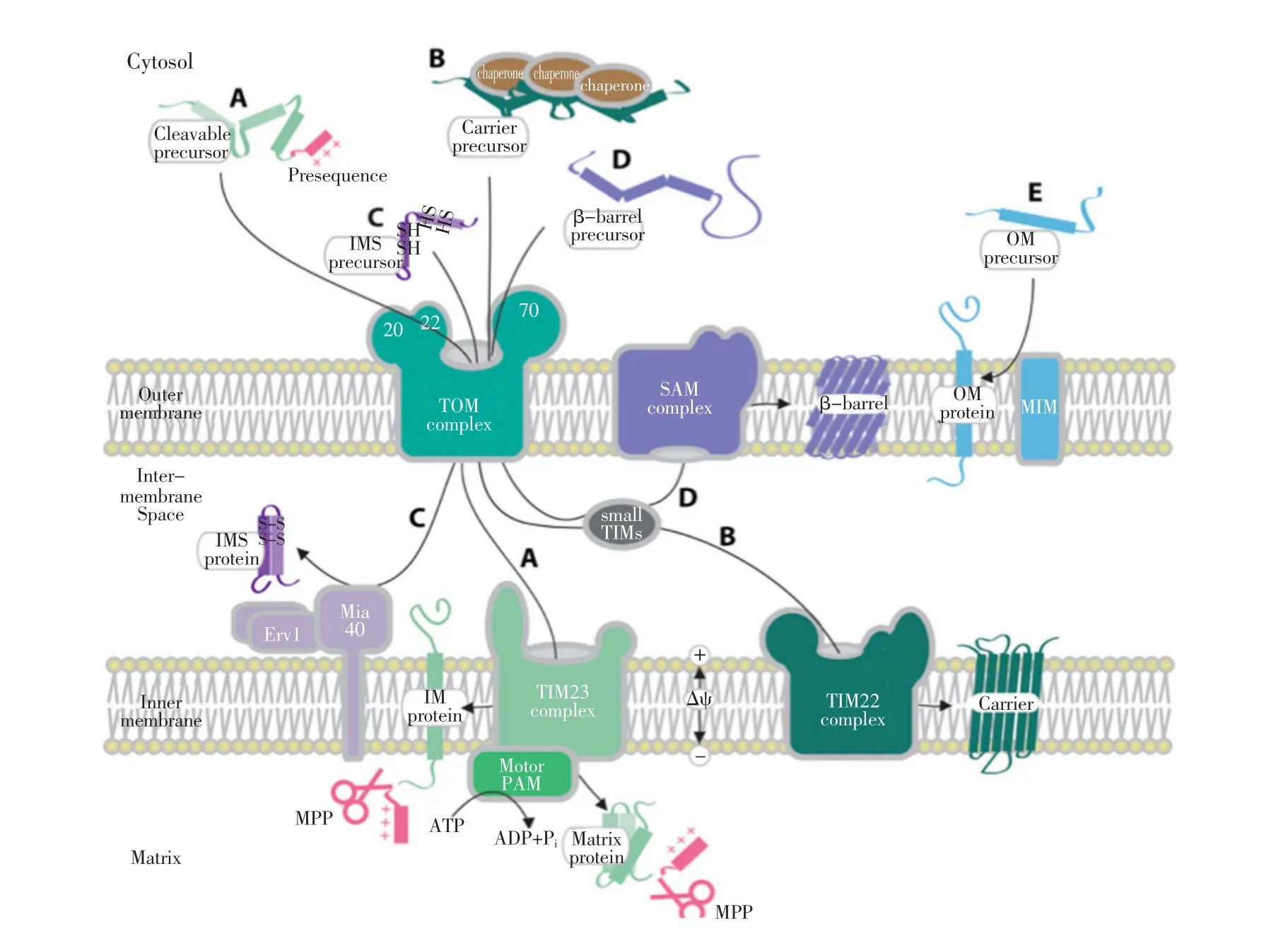
图1 线粒体蛋白输入通路[5]
2.1 在细胞质伴侣蛋白协助下,输入至线粒体基质或内膜的蛋白输入通路
前体蛋白的N末端含有小段可(或不可)切割的氨基酸前体序列,此序列将决定前体蛋白输入至线粒体的不同区域,前体蛋白在所含特定氨基酸序列指引下输入至线粒体基质或线粒体内膜,最终形成线粒体基质蛋白及线粒体呼吸链各组件的内膜蛋白(见图1A)。这一通路历经PIM组件最多,包括细胞质伴侣蛋白,如热休克蛋白70(Hsp70)[15]、线粒体外膜转移酶(TOM,Translocases of Outter Membrane)复合物,线粒体内膜转移酶复合物TIM23(Translocases of Inner Membrane 23)以及线粒体加工肽酶MPP(Mitochondrial Processing Peptidase)等。
2.2 线粒体内膜蛋白输入通路
含有多个信号序列或含有前体样序列的前体蛋白,输入至线粒体内膜,最终形成一些代谢转运小蛋白,如Tim9、Tim10以及Tim22、Tim23等线粒体内膜蛋白(见图1B),此过程需要在线粒体膜电位的协助下完成[16]。
2.3 线粒体膜间隙蛋白输入通路
蛋白序列中含有半胱氨酸(线粒体膜间隙信号序列)的前体蛋白,输入至线粒体膜间隙,在线粒体内膜蛋白Mia40、Erv1协助下最终形成转运小蛋白的输入通路(见图1C)[17,18]。
2.4 线粒体外膜蛋白(β桶状蛋白)输入通路
β桶状前体蛋白C即前体蛋白C末端含有β样信号序列,此类前体蛋白输入至线粒体外膜最终形成线粒体外膜上β桶状蛋白,如Tom40,Sam50[19]。β桶状前体蛋白首先经过线粒体蛋白输入的“门户”通道——TOM复合物,而后在TOM复合物内侧与TIM复合物伴侣蛋白相结合,最终到达位于线粒体外膜负责分类合成不同线粒体外膜蛋白的SAM(Sorting and Assembly Machinery)复合物(见图1D)[20]。
2.5 线粒体外膜蛋白(含α螺旋跨膜结构)输入通路
此类线粒体外膜蛋白的输入通路目前只得到部分阐明,如通过线粒体输入(MIM,mitochondrial import)复合物的输入路径(见图1E)[21,22]。
3 运动与线粒体PIM组件蛋白表达
3.1 线粒体PIM主要组件蛋白
线粒体PIM的多种通路决定了其具有诸多组件蛋白,这些组件蛋白通过不同的方式形成PIM的主要构成成分。例如,外膜转移酶TOM复合物被誉为线粒体蛋白输入的“门户”,其含有一个主要由β桶蛋白
Tom40组成的400kDa大小的非特异性蛋白输入孔,因此Tom40是TOM复合物的核心组件[23]。TOM复合物还含有3个受体蛋白,Tom20、Tom22及Tom70负责识别、协助前体蛋白靠近Tom40通道[24-26]。此外,线粒体内膜转移酶TIM22复合物是负责转运标定至线粒体内膜的前体蛋白,含有特定序列的前体蛋白在一定机制作用下选择通过Tim22孔道最终合成线粒体内膜蛋白。除了TIM22复合物通道外,线粒体大部分前体蛋白的N末端含有带正电荷的前体序列,这些蛋白均被靶定至线粒体内膜或基质,TIM23复合物是负责将前体蛋白输入至线粒体基质的重要线粒体内膜通道,其由4个主要蛋白组件构成:Tim23、Tim17、Tim50以及Tim21[27,28]。
3.2 线粒体PIM组件蛋白与疾病
线粒体PIM组件蛋白表达与线粒体PIM功能及线粒体自身功能密切相关,如耳聋肌张力障碍综合症(DDS,Deafness Dystonia Syndrome),又名Mohr-Tranebjaerg综合症,是典型的由于线粒体内膜蛋白Tim8变异导致的生理疾病[29]。研究提示:造成DDS的主要原因是由于Tim8变异后导致TIM23复合物生物合成受损,而TIM23复合物是所有线粒体基质蛋白以及部分内膜蛋白得以输入的必经通道[30]。其次,mtHsp60是位于线粒体基质的伴侣蛋白,它在参与折叠并合成线粒体基质蛋白中发挥重要作用。细胞中mtHsp60缺失直接造成线粒体含量减少,线粒体结构异常呈肿胀状,主要分布在细胞核周围,并且线粒体氧化磷酸化水平、丙酮酸代谢、脂肪酸氧化等线粒体代谢功能均显著降低,其降低的程度与mtHsp60缺失程度密切相关[31]。此外,阿尔茨海默症(AD)与线粒体蛋白输入的关系也是研究的热点,目前由线粒体因素直接导致AD的论证还不充分,但认为淀粉样前体蛋白(APP)裂解后形成的β-淀粉样蛋白(Aβ)沉积所形成的老年斑是AD发病的重要原因,而Aβ可通过线粒体TOM复合物输入至线粒体内导致线粒体呼吸受损[32]、ROS生成增多[33]以及线粒体破裂[34]。
3.3 肌纤维收缩对线粒体PIM组件蛋白表达的影响
运动或慢性肌肉收缩活动均可诱导线粒体生物发生,诸多研究表明肌纤维收缩可诱导线粒体蛋白输入机制组件蛋白表达增加[35-37]。Ornatsky等发现骨骼肌收缩刺激可使细胞质伴侣蛋白Hsp60、Hsp70,线粒体基质伴侣蛋白mtHsp70水平升高,线粒体基质蛋白cpn10 mRNA水平升高[36]。同样,Takahashi等的研究表明,大鼠骨骼肌经过7天电刺激收缩后,其Tom20、mtHsp70以及线粒体输入刺激因子(MSF,Mitochondrial import Stimulatory Factor)等蛋白水平显著升高,同时伴随苹果酸脱氢酶(MDH,malic dehydrogenase)、线粒体转录因子A(Tfam,mitochondrial transcription factor A)等线粒体基质蛋白输入率增加。由此提示:线粒体PIM组件蛋白表达量与PIM功能可能呈正相关[35,38]。此外,肌收缩刺激使线粒体蛋白输入基质发生适应性改变在细胞培养实验中也得以证实,其中以线粒体外膜蛋白Tom20的适应性变化最为明显,在C2C12细胞中过量表达Tom20可提高MDH等线粒体蛋白输入率,相反,若用反义寡核苷酸抑制Tom20蛋白的过量表达,MDH的输入率也会相应降低[39]。除Tom20外,肌纤维收缩对其它PIM组件蛋白分子的作用机制还有待进一步研究。总之,长期肌肉收缩通过作用于蛋白合成和分解双向信号通路,完成对新生线粒体的调节,与此同时部分PIM组件蛋白表达上调,以此满足新生线粒体对蛋白的需求。然而,线粒体PIM组件蛋白表达与PIM功能是否具有正相关性还有待证实。
4 运动与线粒体PIM功能
Hood研究团队[38]最先采用同位素示踪技术得以实现对骨骼肌线粒体PIM功能的检测,即通过同位素35S标记目标蛋白,跟踪目标蛋白输入至线粒体不同区域,计算其所占比例,从而反映所跟踪PIM通道的蛋白输入功能。检测不同的线粒体PIM通道功能需要不同的目标蛋白,如鸟氨酸氨甲酰基转移酶(OTC,ornithine transcarboxylase)是肝组织中尿素循环所需要的5种酶之一,常用同位素35S标记的OTC蛋白检测线粒体基质蛋白输入通路、同位素35S标记的线粒体外膜蛋白Tom40检测线粒体外膜蛋白输入通路、同位素35S标记的线粒体内膜蛋白Tim23检测线粒体内膜蛋白输入通路。具体检测方法如下:
4.1 线粒体基质蛋白输入通路功能检测
OTC是尿素循环所需要的5种酶之一,由于其参与的反应过程在线粒体基质中进行,当OTC蛋白经细胞核合成后,其最终将通过线粒体PIM被输入至线粒体基质,因此其通常被用来检测线粒体基质蛋白输入通路功能,这条通路包含线粒体外膜TOM40孔道、线粒体内膜TIM23孔道以及线粒体基质中的相关伴侣蛋白,如Hsp60、Hsp70等,是线粒体PIM中重要的通路之一。具体方法:将新鲜提取线粒体样品与含同位素35S标记的OTC前体蛋白(pOTC,precursor OTC)于30° C水中共同孵育15~20 min,pOTC则可通过线粒体TOM40孔道、TIM23孔道最终输入至线粒体基质。需要说明的是:细胞核合成的pOTC蛋白分子量为39kDa,而pOTC一旦输入至线粒体基质,线粒体基质中的伴侣、修饰蛋白将pOTC修饰为成熟OTC蛋白(mOTC,mature OTC),mOTC蛋白分子量为36kDa,比pOTC小3kDa。因此,15~20 min水浴后,离心沉淀线粒体,SDS跑胶分离蛋白,最终可观察到两条OTC蛋白条带(见
图2):pOTC即为未输入至线粒体基质的前体蛋白,而mOTC则为已输入至线粒体基质的成熟蛋白。通过计算一定时间内mOTC含量/(pOTC+mOTC)总含量的比值,即可得出OTC蛋白的输入率,从而反映此线粒体基质蛋白输入通路的功能状态。
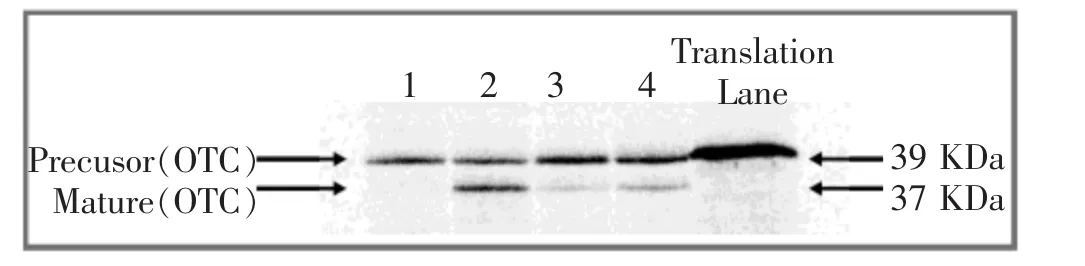
图2 OTC蛋白输入检测结果示意图(Translation Lane为无线粒体样本的阴性对照)[44]
4.2 线粒体外膜蛋白输入通路功能检测
Tom40蛋白是线粒体外膜蛋白,可用做检测线粒体外膜蛋白输入通路功能的目标蛋白。Tom40蛋白经细胞核合成后,其最终将通过线粒体PIM外膜输入通路被输入至线粒体外膜,6分子Tom40将进一步组装形成非特异性蛋白输入孔,这一孔道是所有线粒体蛋白进入线粒体的必经之路,因此,Tom40是线粒体外膜TOM复合物的核心组件[40]。线粒体外膜蛋白输入通路功能的检测方法与OCT蛋白检测方法相似,不同之处在于:由于Tom40最终输入至线粒体外膜,因此可采用检测Tom40蛋白在0 min、5 min、10 min、15 min等不同时间点的输入量(见图3),计算出Tom40蛋白的输入率,从而实现对线粒体外膜输入通路的功能检测。如图3所示:0~15 min期间,检测到线粒体Tom40蛋白的输入量呈递增趋势。
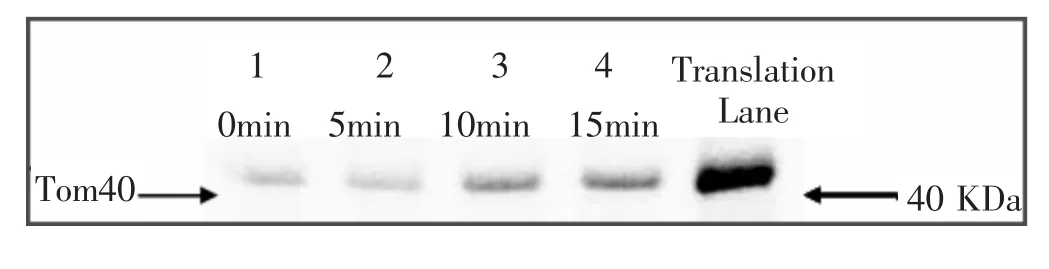
图3 Tom40蛋白输入检测结果示意图(Translation Lane为无线粒体样本的阴性对照)[44]
4.3 运动对线粒体PIM功能的影响
有关运动对线粒体PIM功能影响的研究报道较少,相关研究发现:每天3 h慢性电刺激大鼠骨骼肌肌肉收缩,连续7天后线粒体外膜Tom40的输入率与安静组相比显著增加,与此同时,线粒体外膜TOM复合物组件蛋白Tom22、Tom40蛋白含量也显著增加[41]。慢性电刺激骨骼肌可提高MDH、Tfam等多个线粒体基质蛋白输入率[35,42]。这一变化部分原因是由于与之相关的PIM通道组件蛋白表达增加,并且伴随细胞色素c氧化酶活性及ATP生成量均显著提高。相反,Singh等[43]的研究表明:去神经处理骨骼肌3天、7天和14天后,其肌膜下(SS,subsarcolemmal)线粒体OTC输入率分别降低29%、42%和50%,肌纤维间(IMF,intermyofibrillar)线粒体OTC输入率分别降低13%、19%及29%。研究还发现:线粒体OTC蛋白输入率与线粒体态3呼吸呈高度正相关,其相关系数为0.95,提示线粒体基质蛋白输入功能与线粒体呼吸密切相关,进一步证实线粒体PIM对维持正常线粒体功能至关重要。Zhang等[44]发现促凋亡基因Bax和Bak双基因敲除小鼠的骨骼肌线粒体基质蛋白OTC、线粒体外膜蛋白Tom40输入率分别显著下降37%和34%,当Bax/Bak双基因敲除小鼠进行6周耐力运动后,其骨骼肌内线粒体含量增加28%,同时伴随线粒体蛋白输入功能恢复至正常水平。因此,线粒体PIM具有一定的可塑性,运动训练可通过对PIM组件蛋白表达的调节,或优化线粒体内、外蛋白环境,进而改善线粒体PIM功能。
5 线粒体PIM研究展望
线粒体PIM是线粒体膜上的“守卫”,其肩负蛋白输入的重任,除了是线粒体生物发生必不可少的环节,同时对维持线粒体内、外蛋白稳态至关重要。有报道显示:应激相关激活转录因子-1(ATFS-1)进入线粒体的效率可调节线粒体非折叠蛋白反应(UPRmt)水平。通过研究ATFS-1在线粒体UPRmt发生时与细胞核之间的通信机制,发现线粒体ATFS-1蛋白的输入率对线粒体UPR的激活具有调节作用[45],即若ATFS-1蛋白通过线粒体PIM过程受阻,其将反向输入至细胞核中作为辅激活转录因子,激活其下游调控的多个参与UPRmt的基因表达,最终实现对UPRmt的调节,同时对线粒体PIM功能进行反馈性调节。由此提示:线粒体PIM可作为调节细胞某些分子事件的“指示开关”,其状态与启动细胞核相关基因转录密切相关[46]。
[1]Vogtle FN,MeisingerC.Sensing mitochondrial homeostasis:the protein import machinery takes control[J].Dev Cell,2012,23(2):234-236.
[2]Schmidt O,Pfanner N,Meisinger C.Mitochondrial protein import:from proteomics to functional mechanisms[J].Nat Rev Mol Cell Biol,2010,11(9):655-667.
[3]Neupert W,Herrmann JM.Translocation of proteins into mitochondria[J].Annu Rev Biochem,2007,76(1):723-749.
[4]Endo T,Yamano K.Transport of proteins across or into the mitochondrial outer membrane[J].Biochim Biophys Acta,2010,1803(6):706-714.
[5]Harbauer AB,Zahedi RP,Sickmann A,et al.The protein importmachineryof mitochondria-aregulatoryhubin metabolism,stress,and disease[J].Cell Metab,2014,19(3):357-372.
[6]Lill R,Muhlenhoff U.Maturation of iron-sulfur proteins in eukarotes:mechanisms,connected processes,and diseases[J]. Annu Rev Biochem,2008,77(1):669-700.
[7]Shutt TE,McBride HM.Staying cool in difficult times:mitochondrialdynamics,qualitycontrol and the stress response[J].Biochim Biophys Acta,2013,1833(2):417-424.
[8]Chacinska A,Koehler CM,Milenkovic D,et al.Importing Mitochondrial Proteins:Machineries and Mechanisms[J].Cell,2009,138(4):628-644.
[9]Turakhiya U,von der Malsburg K,Gold VA,et al.Protein Import by the Mitochondrial Presequence Translocase in the Absence of a Membrane Potential[J].J Mol Biol,2016,428(6):1041-1052.
[10]Wenz LS,Opaliński L,Wiedemann N,et al. Cooperation of protein machineries in mitochondrial protein sorting [J].Biochim Biophys Acta,2015,1853(5):1119-1129.
[11]Kulawiak B,Hopker J,Gebert M,et al.The mitochondrial protein import machinery has multiple connections to the respiratory chain[J].Biochim Biophys Acta,2013,1827(5):612-626.
[12]Lazarou M,Jin SM,Kane LA,et al.Role of PINK1 binding to the TOM complex and alternate intracellular membranes in recruitment and activation of the E3 ligase Parkin[J].Dev Cell,2012,22(2):320-333.
[13]Kornmann B,Currie E,Collins SR,et al.An ER-mitochondria tethering complex revealed by a synthetic biology screen[J]. Science,2009,325(5939):477-481.
[14]McBride HM.Mitochondrial-ER tethering:the inheritance of a functional unit[J].Curr Biol,2011,21(23):R949-R951.
[15]Mapa K,Sikor M,Kudryavtsev V,et al.The conformational dynamics of the mitochondrial Hsp70 chaperone[J].Mol Cell,2010,38(1):89-100.
[16]Rehling P,Model K,Brandner K,et al.Protein insertion into the mitochondrial inner membrane by a twin-pore translocase [J].Science,2003,299(5613):1747-1751.
[17]Bien M,Longen S,Wagener N,et al.Mitochondrial disulfide bond formation is driven by intersubunit electron transfer in Erv1 and proofread by glutathione[J].Mol Cell,2010,37(4):516-528.
[18]Mordas A,Tokatlidis K.The MIA pathway:a key regulator of mitochondrial oxidative protein folding and biogenesis[J].Acc Chem Res,2015,48(8):2191-2199.
[19]H?hr AI,Straub SP,Warscheid B,et al.Assembly of β-barrel proteins in the mitochondrial outer membrane[J].Biochim Biophys Acta,2015,1853(1):74-88.
[20]Qiu J,Wenz LS,Zerbes RM,et al. Coupling of mitochondrial import and export translocases by receptor -mediated supercomplex formation[J]. Cell,2013,154(3):596-608.
[21]Becker T,Wenz LS.Kruger V,et al.The mitochondrial import protein Mim1 promotes biogenesis of multispanning outer membrane proteins[J].J Cell Biol,2011,194(3):387-395.
[22]Dimmer KS,Papic D,Schumann B,et al.A crucial role for Mim2 in the biogenesis of mitochon-drial outer membrane proteins[J].J Cell Sci,2012,125(14):3464-3473.
[23]Becker L,Bannwarth M,Meisinger C,et al. Preprotein translocase of the outer mitochondrial membrane:reconstituted Tom40 forms a characteristic TOM pore [J]. J Mol Biol,2005,353(5):1011-1020.
[24]Saitoh T,Lgura M,Obita T,et al. Tom20 recognizes mitochondrial presequences through dynamic equilibrium among multiple bound states [J]. EMBO J,2007,26 (22):4777-4787.
[25]Yamano K,Yatsukawa Y,Esaki M,et al.Tom20 and Tom22 share the common signal recognition pathway in mitochondrial protein import[J].J Biol Chem,2008,283(7):3799-3807.
[26]Yamamoto H,Fukui K,Takahashi H,et al.Roles of Tom70 in import of presequence-containing mitochondrial proteins[J].J Biol Chem,2009,284(46):31635-31646.
[27]WaegemannK,Popov-CeleketicD,NeupertW,etal. Cooperation of TOM and TIM 23 complexesduring translocation of proteins into mitochondria[J].J Mol Biol,2015,427(5):1075-1084.
[28]Schulz C,Lytovchenko O,Melin J,et al.Tim50's presequence receptor domain is essential for signal driven transport across the TIM23 complex[J].J Cell Biol,2011,195(4):643-656.
[29]KoehlerCM,LeuenbergerD,MerchantS,etal.Human deafness dystonia syndrome is a mitochondrial disease[J]. Proc Natl Acad Sci USA,1999,96(5):2141-2146.
[30]Roesch K,Hynds PJ,Varga R,et al.The calcium-binding aspartate/glutamatecarriers,citrinandaralar1,arenew substrates for the DDP1/TIMM8a-TIMM13 complex[J].Hum Mol Genet,2004,13(18):2101-2111.
[31]Huckriede A,Heikema A,Sjollema K,et al.Morphology of the mitochondria in heat shock protein 60 deficient fibroblasts from mitochondrial myopathy patients[J].Virchows Arch,1995,427(2):159-165.
[32]Hansson Petersen CA,Alikhani N,Behbahani H,et al.The amyloid b-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae[J]. Proc Natl Acad Sci USA,2008,105(35):13145-13150.
[33]Ittner LM and Gootz J.Amyloid-β and tau-α toxic pas de deux in Alzheimer’s disease[J].Nat Rev Neurosci,2011,12(2):65-72.
[34]Itoh K,Nakamura K,Iijima M,et al.Mitochondrial dynamics in neurodegeneration[J].Trends Cell Biol,2013,23(1):64-71.
[35]Gordon JW,Rungi AA,Inagaki H,et al.Effects of contractile activity on mitochondrial transcription factor A expression in skeletal muscle[J].J Appl Physiol,2001,90(1):389-396.
[36]Ornatsky OI,Connor MK,Hood DA. Expression of stress proteins and mitochondrial chaperonins in chronically stimulated skeletal muscle[J]. Biochem J,1995,311(1):119
123.
[37]Takahashi M,Hood DA.Chronic stimulation-induced changes in mitochondria and performance in rat skeletal muscle[J].J Appl Physiol,1993,74(2):934-941.
[38]TakahashiM,ChesleyA,FreyssenetD,etal.Contractile activity-induced adaptations in the mitochondrial protein import system[J].Am J Physiol,1998,274(1):C1380-C1387.
[39]Grey JY,Connor MK,Gordon JW,et al.Tom20-mediated mitochondrial protein import in intact muscle cells during differentiation[J].Am J Physiol,2000,279(5):C1393-C1400.
[40]Rao S,Schmidt O,Harbauer AB,et al.Biogenesis of the preprotein translocase of the outer mitochondrial membrane:protein kinase A phosphorylates the precursor of Tom40 and impairs its import[J].Mol Biol Cell,2012,23(9):1618-1627.
[41]Joseph AM,Ljubicic V,Adhihetty PJ,et al.Biogenesis of the mitochondrial Tom40 channel in skeletal muscle from aged animals and its adaptability to chronic contractile activity[J]. Am J physiol Cell Physiol,2010,298(6):C1308-C1314.
[42]TakahashiM,ChesleyA,FreyssenetD,etal.Contractile activity-induced adaptations in the mitochondrial protein import system[J].Am J Physiol Cell Physiol,1998,274(1):C1380-C1387.
[43]Singh K,Hood DA.Effect of denervation-induced muscle disuse on mitochondrial protein import[J].Am J Physiol Cell Physiol,2011,300(1):C138-C145.
[44]Zhang Y,Iqbal S,O'Leary MF,et al.Altered mitochondrial morphology and defective protein import reveal novel roles for Bax and/or Bak in skeletal muscle[J].Am J Physiol Cell Physiol,2013,305(5):C502-C511.
[45]Nargund AM,Pellegrino MW,Fiorese CJ,et al.Mitochondrial import efficiency of ATFS-1 regulates mitochondrial UPR activation[J].Science,2012,337(6094):587-590.
[46]Haynes CM,Fiorese CJ,Lin YF.Evaluating and responding to mitochondrial dysfunction:the mitochondrial unfolded-protein response and beyond[J].Trends Cell Biol,2013,23(7):311-318.
2016.03.10
江苏省教育厅自然科学基金项目(编号:JY1402)
张媛,Email:beibei82506@126.com
