miRNA在子宫内膜异位症中的研究进展
2016-12-07黄玲
黄玲
(秭归县人民医院妇产科,湖北 宜昌 443600)
王玎
(三峡大学仁和医院妇产科,湖北 宜昌 443002)
miRNA在子宫内膜异位症中的研究进展
黄玲
(秭归县人民医院妇产科,湖北 宜昌 443600)
王玎
(三峡大学仁和医院妇产科,湖北 宜昌 443002)
子宫内膜异位症(endometriosis,EMs)是育龄期妇女的常见病,发病机制尚不清楚。其病变广泛,极具侵袭性和复发性,常呈现恶性临床行为。微小RNA(microRNA,miRNA)在细胞增殖、分化和凋亡等生理病理过程中起着十分重要的调控作用。miRNA参与子宫内膜异位症细胞生长和增殖、黏附侵袭以及血管的形成,在子宫内膜异位症的发生发展、恶性转化、复发和不孕等过程中扮演重要角色。就miRNA在子宫内膜异位症发病机制中的作用及其诊断价值作一综述。
子宫内膜异位症;微小RNA;发病机制;诊断
子宫内膜异位症(endometriosis,EMs)是指子宫内膜组织在子宫腔被覆内膜以外的部位生长、浸润。全球超过7000万女性患有此病,在育龄妇女中的发病率约为5%~15%,且近年来临床发病率呈明显上升趋势。EMs的临床表现主要为进行性痛经和不孕,患者不孕率高达30%~40%[1,2]。miRNA是一类约为18~25个核苷酸长度的非编码小RNA,它通过不完全碱基互补的方式与特定的靶基因mRNA的3'非编码区(3'UTR)结合。在转录后水平通过促进靶mRNA的降解和(或)抑制翻译过程而负性调控基因表达,在细胞增殖、细胞死亡和肿瘤形成等生物过程中起着重要的作用[3]。研究证明,miRNA通过调控作用而实现对于子宫内膜异位症的调节[4],其差异性表达谱的研究对EMs机制的阐明及其早期诊断具有重要意义。
1 microRNA在子宫内膜异位症中的表达及其可能机制

表1 microRNA在子宫内膜异位症中的表达谱
Wang等[5]通过TaqMan microRNA芯片检测发现miR-199和miR-122在子宫内膜异位症患者血清中呈上调表达,而miR-145*、miR-141*、miR-542-3p和miR-9*呈下调表达。分析与EMs相关异位内膜细胞的miRNA表达谱的5篇文献[5~9],与EMs明显相关的miRNA表达情况见表1。
子宫内膜异位症的病因机制复杂尚不明确,但是多数学者都认为在子宫内膜异位症病灶形成的基本病理过程包括子宫内膜基质细胞(endometriotic cyst stro- mal cells, ESC)的黏附、侵袭和血管生成等病理过程[10]。最新研究[11~15〗]显示,多种miRNA影响着ESC的凋亡、侵袭和血管生成,可能参与了子宫内膜异位症的病理生理过程,见表2。
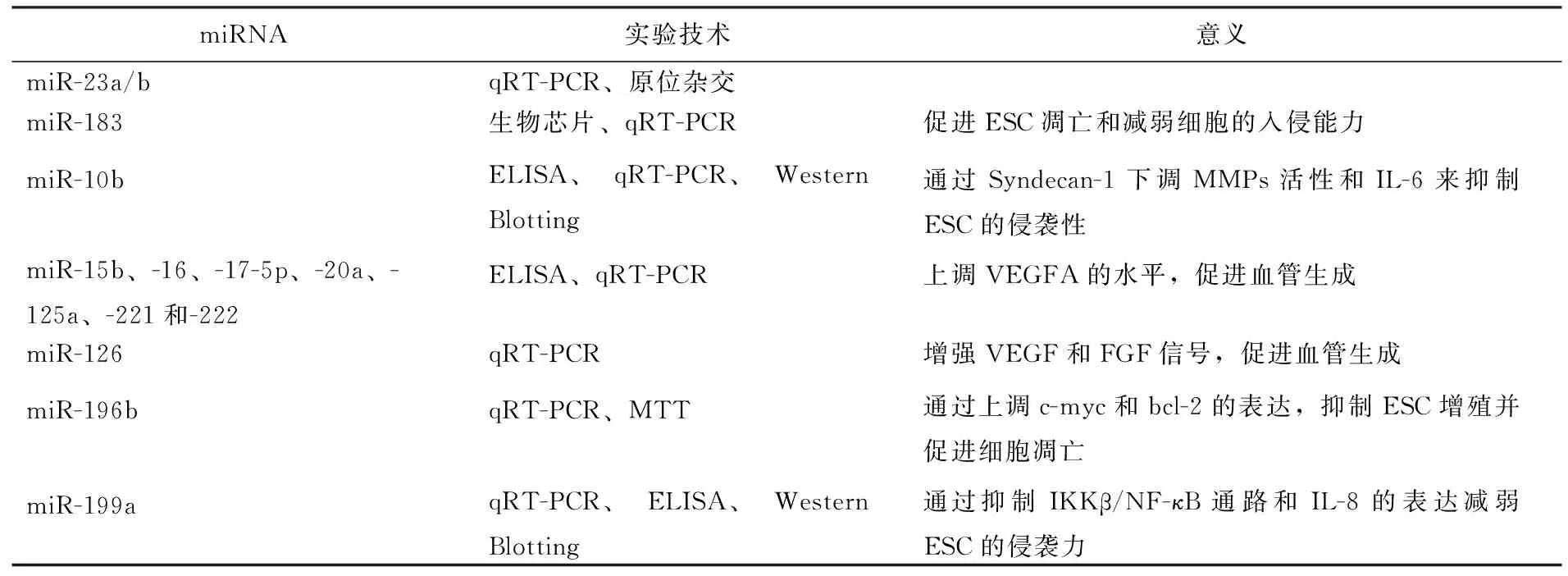
表2 miRNA在子宫内膜异位症发生发展过程中的意义
2 应用microRNA对子宫内膜异位症的诊断及预后判断
2.1 microRNA在子宫内膜异位症诊断中的应用
子宫内膜异位症的女性按通常的经验诊断会延迟6~12年,这一延迟增加了疾病的严重程度,可视化腹腔镜的内膜异位损伤是子宫内膜异位症诊断的金标准,但是其准确率也仅有70%~75%[16]。最近研究表明,miRNA在人体循环和血清、唾液、精液和尿液等体液中能够作为疾病的诊断标记物,开启了疾病研究的新时代[17]。同样,miRNA可以作为一种非侵入性的诊断子宫内膜异位症的生物标志物,用于子宫内膜异位症早期诊断和病情进展监测。Jia等[18]采用基因芯片的方法,发现子宫内膜异位症患者血清中有27种miRNA的表达水平与正常女性有明显差异。通过Real time PCR检测后发现,miR-17-5p,miR-20a和miR-22呈显著下调表达,测得其接受者操作特性曲线(receiver operating characterist-ic curve, ROC曲线)下面积分别为0.74、0.79和0.85,表明这些miRNAs是对诊断子宫内膜异位症有意义的血清标志物。Shen等[7]通过实时定量RT-PCR研究发现,与正常子宫内膜相比miR-23a和miR-23b在 EMs中的表达明显下调,他们的表达水平与核受体超家族NR5A1基因(nuclear receptor familyNR5A1)的 mRNA水平呈负相关,miR-23a和miR-23b的超表达抑制了正常ESC中类固醇生成因子1 (steroidogenic factor 1, SF-1)的表达。因此,miR-23a和miR-23b可以作为卵巢子宫内膜异位症诊断潜在的生物标志物。Wang等[5]运用TaqMan microRNA芯片对子宫内膜异位症患者和正常人的血清中miRNA的表达水平进行了对比分析,发现miR-199和miR-122在子宫内膜异位症患者血清中表达上调,而miR-145*、miR-141*、miR-542-3p和miR-9*表达下降。并进一步验证了miR-122、miR-145*、miR-542-3p和miR-199a联合检测的ROC曲线下面积为0.994,其敏感性和特异性分别为96.00%和93.22%,证明其可以用于子宫内膜异位症的检测。综上可知,患者组织或血清中miRNA的表达水平可以用于子宫内膜异位症早期诊断,其中特异性的血清miRNA检测可以作为子宫内膜异位症无创诊断的首选方法。
2.2 子宫内膜异位引起不孕的miRNAs表达谱
有研究报道子宫内膜异位和不孕之间存在着密切的联系[19],其机制仍然存在着争议。miRNA在女性卵母细胞生长、受精卵着床、胚胎发育中起着重要作用[20],而子宫异位症患者大量miRNA表达水平异常,因此,推测miRNA在子宫内膜异位症导致的女性不孕的各个环节都可能起到作用,如卵母细胞和胚胎发展、受精卵着床等过程。Ruan等[21]选择了36例经腹腔镜检查和病理证实并排除其他因素的不孕子宫内膜异位症患者,并按照美国生育协会的分类标准分成Ⅰ~Ⅱ级17例和Ⅲ~Ⅳ级19例。通过qRT-PCR技术分别检测其子宫内膜组织中miRNA的表达水平,发现miR-29c、miR-200a及miR-145在子宫内膜异位症中表达水平明显高于正常组;在Ⅰ~Ⅱ级和Ⅲ~Ⅳ级子宫内膜异位症中,miR-29c、miR-200a和miR-145的平均表达水平差异没有统计学意义。对采用了辅助生殖技术的子宫内膜异位症组的妇女进行了妊娠结果的随访,发现妊娠组miR-29c、miR-200a和miR-145三种miRNA的表达水平均低于而非妊娠组,且两组之间有统计学差异(P<0.05)。因此,作者认为miR-29c、miR-200a及miR-145表达的上调在子宫内膜异位导致的不孕中起着重要作用。
2.3 子宫内膜异位症引起恶性转化的miRNAs表达谱
子宫内膜异位症具有种植、转移和复发等恶性肿瘤的病理特征。大样本的人群研究显示,子宫内膜异位症增加了妇女患卵巢癌的风险[20],提示早期的恶性改变可能发生于异位的子宫内膜组织中。Iorio等[22]研究发现从子宫内膜异位症发展为卵巢子宫内膜样癌的临床标本中miR-125a和miR-125b表达缺失,而原癌基因ErbB-2的细胞膜受体水平升高。miR-125a和miR-125b是肿瘤抑制性miRNA,能通过抑制ErbB-2的细胞膜受体来抑制肿瘤细胞的转移和浸润。因此,猜想miR-125a和miR-125b在子宫内膜异位症发展为卵巢癌的过程中起抑制作用。上皮间质转化(Tepithelial-mesenchymal transition, EMT)是指上皮细胞转换成为具有间质细胞表型细胞的过程,它是一个可逆的生物过程,与子宫内膜异位症的发生发展密切相关,在恶性细胞的转化中也起到重要作用。在子宫内膜异位症中,miR-1、miR-21、miR-141和miR-194都参与EMT的调控[23]。此外,血管生成是由VEGF诱导,与炎症反应、肿瘤形成等病理生理过程密切相关。在子宫内膜异位症中miR-15b、miR-16、miR-17-5p、miR-20a、miR-125a、miR-221和miR-222等[12]诸多miRNA通过调节VEGF的生成而调控新的血管生成。由上可知,miRNA在子宫内膜异位症相关肿瘤发生过程中,可能在血管生成、EMT等方面起到一定作用,但具体机制还需要大量实验研究来进一步探究。
3 结语
miRNA具有高度保守性、时序表达特异性和组织特异性,成熟后很快与蛋白结合形成沉默复合体,因而不易被RNA酶降解。从组织和血清等样本中都可检测到miRNA的存在,使得miRNA成为疾病诊断的新的生物标志物。在子宫内膜异位症的粘附、种植、血管生成等病理改变中,miRNA在异位内膜组织、细胞和血清中的表达具有特异性。准确地证实并确定子宫内膜异位症相关的一个或几个标志性miRNA,将极大地促进子宫内膜异位症早期诊断技术的发展。子宫内膜异位症相关miRNA研究的发展不仅有利于其发病机制的阐述,也将为子宫内膜异位症的诊断及治疗提供新的思路。
[1]Bulun,S E.Endometriosis[J]. N Engl J Med,2009,360(3):268~279.
[2] Nyholt D R, Low S-K, Anderson C A, et al. Genomewide association meta- analysis identifies new endometriosis risk loci [J], Nature Genetics, 2012, 44(12) : 1355~1359.
[3] Zhang H, Chen Z, Wang X, et al. Long non-coding RNA:a new player in cancer [J]. J Hematol Oncol, 2013,37(6):17.
[4] Pan Q, Chegini N. MicroRNA signature and regulatory functions in the endome- trium during normal and disease states[J].Semin Reprod Med,2008,26(6): 479~493.
[5] Wang W T, Zhao Y N, Han B W, et al. Circulating microRNAs identified in a genomewide serum microRNA expression analysis asnoninvasive biomarkers for endome- triosis[J].J Clin Endocrinol Metab,2013,98(1):281~289.
[6] Ohlsson Teague E M, Van der Hoek K H, Van der Hoek M B, et.al. MicroRNA- Regulated Pathways Associated with Endometriosis[J]. Molecular Endocrinology, 2009,23(2): 265~275.
[7] Shen L C, Yang S Y, Huang W, et al. MicroRNA23a and MicroRNA23b Deregula- tion Derepresses SF-1 and Upregulates Estrogen Signaling in Ovarian Endometriosis [J].J Clin Endocrinol Metab,2013,98(4):1575~1582.
[8] Shi X Y, Gu L,Chen J,et al.Downregulation of miR-183 inhibits apoptosis and enhances the invasive potential of endometrial stromal cells in endometriosis [J].Int J Mol Med,2014,33(1):59~67.
[9] Piotr L, Radoslaw C, Mariusz K, et al.MicroRNAs expression profiling of eutopic proliferative endometrium in women with ovarian endometriosis[J].Reproductive Biology and Endocrinology,2013,11(1):78~84.
[10] Burney R O, Giudice L C. Pathogenesis and pathophysiology of endometriosis [J]. Fertil Steril,2012,98(3):511~519.
[11] Cornelia S , Nadja K , Burkhard G, et al. Targeting of syndecan-1 by micro- ribonucleic acid miR-10b modulates invasiveness of endometriotic cells via dysregulation of the proteolytic milieu and interleukin-6 secretion[J].Fertil Steril, 2013,99(3):871~881.
[12] Braza-Boils A, Gilabert-Estellés J, Ramón LA,et al.Peritoneal fluid reduces angiogenesis-related microRNA expression in cell cultures of endometrial and endometriotic tissues from women with endometriosis[J]. PLoS One,2013,8(4): e62370~62379.
[13] Fish J E, Santoro M M, Morton S U, et al. miR-126 regulates angiogenic signaling and vascular integrity[J].Dev Cell,2008,15(2):272~284.
[14] Wakana A, Kaei N, Chisato N, et al. miR-196b targets c-myc and Bcl-2 expression, inhibits proliferation andinduces apoptosis in endometriotic stromal cells[J]. Human Reproduction, 2013,28(3):750~761.
[15] Dai L, Gu L Y , Di W. MiR-199a attenuates endometrial stromal cell invasiveness through suppression of the IKKb/NF-kB pathway and reduced interleukin-8 expression[J]. Molecular Human Reproduction,2012,18(3):136~145.
[16] Matsuzaki S, Canis M, Pouly J L, et al. Relationship between delay of surgical diagnosis and severity of disease in patients with symptomatic deep infiltrating endometriosis[J].Fertil Steril,2006,86(5):1314~1316.
[17] Silva S S, Lopes C, Teixeira A L, et al. Forensic miRNA: Potential biomarker for body fluids[J]. Forensic Sci Int Genet,2015,14: 1~10.
[18] Jia S Z, Yang Y P, Lang J H, et al.Plasma miR-17-5p,miR-20a and miR-22 are downregulated in women withendom endometriosis[J].Human Reproduction,2013, 28(2): 322~330.
[19] Gupta S, Goldberg J M, Aziz N, et al. Pathogenic mechanisms in endometriosis- associated infertility [J]. Fertil Steril,2008,90(2): 247~257.
[20] Teague E M, Print C G, Hull M L. The role of microRNAs in endometriosis and associated reproductive conditions[J]. Human Reproduction Update, 2010,16(2): 142~165.
[21] Ruan Y, Qian W P, Zhang C H, et al. Study on microRNA expression in endometrium of luteal phase and its relationship with infertility of endometriosis [J]. Zhonghua Fu Chan Ke Za Zhi,2013,48(12):907~910.
[22] Iorio M V,Visone R,Di L G,et al.MicroRNA signatures in human ovarian cancer [J]. Cancer Res,2007,67(18):8699~8707.
[23] Ohlsson T, Van der Hoek, Perry N, et al.MicroRNA-regulated pathways associated with endometriosis[J]. Mol Endocrinol,2009,23(2):265~275.
[编辑] 刘阳
2016-07-19
湖北省教育厅科研计划项目(D20151202)。
黄玲(1967-),女,主治医师,主要从事妇科疾病及病理研究;通信作者:王玎,877831259@qq.com。
R711.1
A
1673-1409(2016)36-0081-04
[引著格式]黄玲,王玎. miRNA在子宫内膜异位症中的研究进展[J]. 长江大学学报(自科版),2016,13(36):81~84.
