三角褐指藻对不同形态铁的吸收和利用
2016-12-07董万礼黄舒元史大林袁东星
董万礼,黄舒元,史大林,袁东星
(厦门大学环境与生态学院,滨海湿地生态系统教育部重点实验室,福建 厦门361102)
三角褐指藻对不同形态铁的吸收和利用
董万礼,黄舒元,史大林,袁东星*
(厦门大学环境与生态学院,滨海湿地生态系统教育部重点实验室,福建 厦门361102)
分别向天然海水中添加不同浓度的FeCl3、铁的乙二胺四乙酸络合物(Fe-EDTA)和铁的去铁胺络合物(Fe-DFO),对三角褐指藻(Phaeodactylum tricornutum)进行培养,研究其对不同形态铁的吸收和利用.每天测定藻细胞密度及体系液相中和藻细胞内外的铁浓度.结果表明:不同浓度的FeCl3和Fe-EDTA均可促进三角褐指藻生长,不同浓度的Fe-DFO均会抑制其生长.FeCl3培养体系中,铁主要分布在藻细胞外;Fe-EDTA和Fe-DFO的培养体系中,铁主要存在于液相中.液相铁浓度均随培养时间的增加而减少,细胞内外铁浓度均随培养时间的增加而增加.3种形态铁的三角褐指藻生物可利用性由高到低依次为FeCl3>Fe-EDTA>Fe-DFO.该结果可为海水中铁的生物可利用性研究提供参考.
天然海水;铁;三角褐指藻;生物可利用性
铁是浮游植物生长所必需的微量元素,对其光合作用、呼吸作用、固氮作用、叶绿素合成、无机盐吸收和细胞氧化还原等过程有重要影响[1].全球近45%的碳是由海洋浮游植物通过光合作用固定的[2],而光合作用很大程度上依赖于铁[3].铁在地壳中的丰度达5.6%,仅次于氧、硅和铝,是地壳的主要组成元素[4],但在海洋中尤其是大洋表层,溶解态铁的浓度很低,超过99%的溶解态铁以有机络合态形式存在[5].
20世纪80年代,Martin等[6]提出了著名的“铁假说”,低浓度铁对浮游植物初级生产力的限制作用越来越被人们所重视.铁的缺乏会阻碍浮游植物对氮、磷等元素的吸收,使其不能合成吸收主要营养盐所需的酶[7].除了铁的浓度,铁的形态也会影响浮游植物的生长.浮游植物(特别是硅藻)对三价铁吸收和利用的机制已被揭示[8-9].Lis等[10]的系统研究发现,浮游植物对铁的吸收速率常数与细胞表面积的大小紧密相关:在细胞表面积相同的情况下,若底物为去铁胺络合物(Fe-de-feroxamine,Fe-DFO),铁的吸收速率常数是以非螯合态铁(Fe′)为底物时的1/1 000;而以其他含铁化合物为底物时,铁的吸收速率常数均在Fe′与Fe-DFO之间.
三角褐指藻(Phaeodactylum tricornutum)属于硅藻门(Bacillariophyta)[11],具有繁殖快、生长迅速、适应性强、易于培养等特点,富含蛋白质、不饱和脂肪酸及多糖等多种高价值活性物质,常被用作人工育苗中的基础饵料.目前关于铁和三角褐指藻的研究,大多集中在不同浓度铁对三角褐指藻生长、光合作用和生化组成等方面的影响[12-13];而关于三角褐指藻对不同形态铁的吸收利用方式和途径、不同形态的铁在培养体系中的分布和浓度变化情况及其对三角褐指藻生长的影响,研究得还不多.99%以上的溶解态铁在海水中与有机配位体络合,但迄今对有机配位体的具体化学结构了解十分有限,仅知参与络合铁的官能团主要有氧肟酸、羧基和儿茶酚[8,10].
本研究以FeCl3、铁的乙二胺四乙酸络合物(Fe-EDTA)和Fe-DFO分别代表离子态铁、羧基官能团络合态铁和氧肟酸盐型铁载体络合态铁,向天然海水中添加不同浓度的上述3种铁化合物,对三角褐指藻进行培养,每天测定藻细胞密度及体系液相中和藻细胞内外的铁浓度,探讨三角褐指藻对不同形态铁的吸收和利用情况.
1 材料与方法
1.1材 料
实验所用的三角褐指藻由厦门大学近海海洋环境科学国家重点实验室海洋微型生物保种中心提供.按浮游植物f/2培养液的配方但不加痕量金属配制三角褐指藻的培养液.加铁培养前,将三角褐指藻置于p H 8.0的培养液中驯化20代左右,始终保持在对数生长期内接种,以维持藻的活力.
所用的天然海水取自厦门鼓浪屿附近海域,先后经0.45和0.22μm的微孔滤膜过滤.为避免灭菌过程中引入铁,采用微波炉灭菌法:向1 L的方形培养瓶中加入800 m L已过滤的天然海水,旋松瓶盖,放入微波炉中,高温加热至瓶壁上凝结出水珠;将培养瓶取出后立即放入冰水混合物中降温至室温,旋紧瓶盖后放在藻种培养室备用[12].实验器皿均为非玻璃材质,先在0.5%(体积分数,下同)HNO3溶液中浸泡过夜,取出后将器皿表面附着的酸溶液清洗干净,再用超纯水清洗3次;重复上述过程,晾干备用.
1.2设备及试剂
颗粒细胞计数仪(Z2,美国Beckman Coulter公司),离心机(Sigma3K15,德国Sigma公司),微波炉(NN-H965WF,日本Panasonic公司),石墨炉原子吸收光谱仪(Nov AA400P,德国Analytik Jena公司), C18净化柱(SupelcleanENVI-18,500 mg/6 m L,美国Supelco公司).甲磺酸去铁胺(DFO)购自美国Bio Vision公司,65%(质量分数)浓HNO3购自德国Merck公司,其余试剂购自美国Sigma-Aldrich公司和国药集团化学试剂有限公司.Fe-EDTA和Fe-DFO溶液分别由FeCl3标准使用液和逐级稀释的EDTA-2Na和DFO溶液配制而得,当铁的质量浓度为1 mg/ L,EDTA-2Na和DFO溶液的质量浓度分别为7.31和23.46 mg/L时,EDTA-2Na和DFO与铁的摩尔比分别为1.1∶1和2∶1.
1.3方 法
1.3.1三角褐指藻的培养与计数
向灭过菌的天然海水中添加质量浓度分别为0, 200,400,600,800,1 000μg/L(以铁计,下同)的FeCl3、Fe-EDTA和Fe-DFO溶液,以1 mol/L NaOH溶液调节p H至8.0,静置过夜.接种的初始藻细胞密度为1.0×104m L-1.培养条件:温度20℃,盐度27,光照强度5 000 lx,光暗周期14 h∶10 h.每天上午9点左右摇匀藻液,取10 m L用Z2颗粒细胞计数仪计数.
1.3.2草酸-EDTA洗液的除铁
草酸-EDTA洗液中含有一定量的铁,经石墨炉原子吸收光谱(GFAAS)法测定,其中铁的质量浓度约为30μg/L.使用前需将洗液中的铁尽量去除,方法如下[13]:配制1 L含125 mmol/L草酸钠、375 mmol/L NaCl、12.5 mmol/L KCl的母液,加入2 mmol/L菲咯嗪溶液2.14 m L(经计算可知,母液中菲咯嗪与铁的摩尔比约为12∶1),生成菲咯嗪-铁络合物;静置过夜,过C18净化柱,利用其对菲咯嗪-铁络合物的吸附作用将母液中大部分的铁截留在柱上;取400 m L净化后的母液,加入9.306 g EDTA-2Na,调节p H至7.0后用蒸馏水定容至500 m L.除铁后,草酸-EDTA洗液中铁的质量浓度降至10μg/L以下.
1.3.3铁的分离和测定
参照Franklin等[14]的分类和分离方法,将培养体系中的铁分为液相铁、细胞内铁和细胞外铁,经离心、洗脱和消解等预处理过程分离和收集各部分铁.具体方法为:取30 m L混匀藻液于50 m L离心管中,8 000 r/min离心10 min,取5 m L上清液,滴加50μL浓HNO3,测定液相铁;弃去剩余的上清液,向藻细胞沉淀中加入10 m L草酸-EDTA洗液,振荡约5 min,洗脱吸附在藻细胞表面的铁,8 000 r/min离心10 min,取5 m L上清液;弃去剩余上清液,留下藻细胞沉淀,重复上述步骤3次(共4次),将每次取出的上清液混合(共20 m L),滴加50μL浓HNO3,测定细胞外铁;向藻细胞沉淀中加入2 m L浓HNO3和1 m L HClO4,转移至聚四氟乙烯烧杯中,静置过夜,于电热板上240℃加热消解,至溶液呈澄清透明状;冷却后转移至10 m L离心管中,用0.5%HNO3溶液定容至10 m L,测定细胞内铁.所有样品均设平行样,数据取平均值.铁的测定采用GFAAS法.
1.3.4稳态铁吸收速率的计算
生物可利用性指的是某化合物可被浮游植物吸收利用的程度,含铁化合物的生物可利用性由稳态铁的吸收速率(对数生长期藻类对铁的吸收速率)表征[15].由单位细胞内铁浓度和生长速率计算而得,即
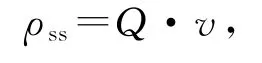
其中,ρss为稳态铁吸收速率(fmol/(cell·d)),Q为单位细胞内铁浓度(fmol/cell),v为生长速率(d-1).
1.4数据分析
所有数据用Stata s统计软件(Release 13.0,美国Stata公司)处理,用平均值±标准差表示.先对3组实验数据进行方差分析,再使用最小显著差异t-检验(LSD t-test)对3组实验数据进行两两比较,p<0.05表示有显著差异.
2 结果与讨论
2.1不同浓度及形态的铁对三角褐指藻生长的影响
以培养时间为横坐标,藻细胞密度的对数值为纵坐标,绘制三角褐指藻的生长曲线,如图1所示:三角褐指藻从培养的第2天开始进入对数期,第5天开始进入平台期.根据三角褐指藻对数生长期的细胞数可计算出其生长速率(表1).从表1可以看出:加入不同质量浓度的FeCl3和Fe-EDTA后,三角褐指藻的生长速率均比对照组高;加入不同质量浓度的Fe-DFO后,三角褐指藻的生长速率均比对照组低.实验结果说明:与对照组相比,实验组不同质量浓度的FeCl3和Fe-EDTA均促进三角褐指藻的生长;而无论质量浓度高低,Fe-DFO的加入均抑制三角褐指藻的生长.
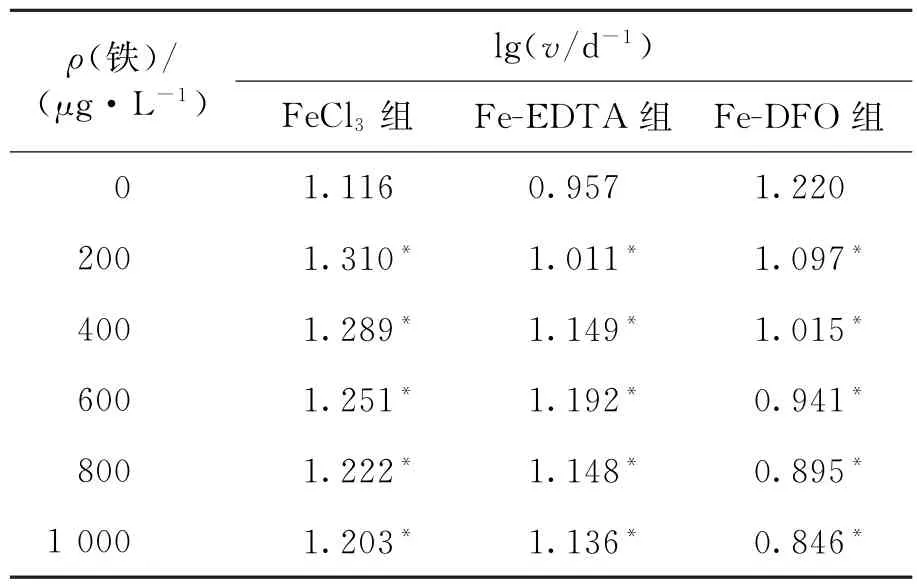
表1 不同培养体系中三角褐指藻的生长速率Tab.1 The growth rate of P.tricornutum in different cultivation systems
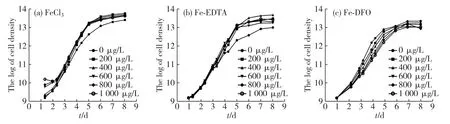
图1 不同培养体系中三角褐指藻的生长曲线Fig.1 The growth curve of P.tricornutumin in different cultivation systems
早在20世纪80年代,Martin等[6]就提出并证明了铁可以促进浮游植物生长的观点.三角褐指藻是一种典型的硅藻,铁对三角褐指藻生长影响的相关研究较多,但大多以Fe3+为研究对象.蒋汉明等[16]的研究结果表明,当Fe3+浓度为0.5μmol/L时,三角褐指藻生长异常缓慢,增加Fe3+的浓度,三角褐指藻的生长速率加快.朱明远等[17]的研究证明,随着铁浓度的增加,三角褐指藻的生长有加快的趋势.不同形态的铁对三角褐指藻生长的影响也不同.蔡阿根等[18]的研究指出,铁的富里酸和EDTA络合物比胶体氢氧化铁更有利于促进三角褐指藻的生长.
向培养体系中加入FeCl3后,铁会以沉淀胶体和溶解态的形式存在,其中沉淀胶体态铁占绝大部分,其可通过光降解、热力学还原、酶降解等过程转化成液相铁,从而被三角褐指藻吸收利用[19-20].本研究中加入FeCl3后,三角褐指藻的生长速率均高于对照组.
向培养体系中添加不同质量浓度的Fe-EDTA后,三角褐指藻的生长速率增大,这是由于Fe-EDTA虽具有非细胞渗透和非生物可利用性[8],但其会在光照等条件下发生解离反应,产生最易被浮游植物吸收和利用的Fe′[9].本研究发现,加入不同浓度的Fe-EDTA后,实验组中易被三角褐指藻吸收利用的铁浓度均比对照组高,更有利于三角褐指藻的生长.
本研究中添加不同浓度的Fe-DFO后,三角褐指藻的生长速率减小,这是由于Fe-DFO极稳定,不会因光照等条件发生解离反应,体系中几乎不存在Fe′,铁主要以Fe-DFO的形式被三角褐指藻吸收和利用.另有研究表明:在相同的运载体运输情况下, Fe-DFO在细胞表面被还原的速率更低;同时,过量的DFO会与藻细胞膜表面的运载体竞争二价铁,减少细胞对二价铁的吸收,降低三角褐指藻对铁的吸收速率[8,21-22].因此,Fe-DFO的加入抑制了三角褐指藻的生长.
2.2FeCl3培养体系中不同形态铁的分布及浓度变化趋势
添加不同质量浓度的FeCl3后,铁主要分布在藻细胞外.在三角褐指藻整个生长过程中,液相铁的质量浓度随着培养时间的增加而逐渐减少,细胞内铁质量浓度随着培养时间的增加而逐渐增加,细胞外铁质量浓度基本保持不变(见图2).可能的原因如下:添加不同质量浓度的FeCl3后,大部分铁立即形成胶体并被吸附到藻细胞表面,少部分铁存留在液相中,故培养初期细胞外铁质量浓度占回收的总铁质量浓度的比例较高,液相及细胞内铁所占比例较低;随着培养时间的增加,三角褐指藻将细胞外的铁吸收到细胞内,液相铁扩散至细胞表面以达到新的平衡,故细胞内质量铁浓度随培养时间的增加而增加,液相铁质量浓度随培养时间的增加而减少,而细胞外铁质量浓度基本保持不变.对照组回收的总铁质量浓度约为60μg/L,除了天然海水和草酸-EDTA洗液带入的铁外,铁的污染源还可能来自实验中所用到的容器,如培养瓶、离心管、移液枪枪头、GFAAS法测定使用的进样杯等,虽然各器皿均经过酸处理,但仍无法将铁完全除净.

图2 FeCl3培养体系中不同形态铁的变化Fig.2 The variation of different iron forms in FeCl3cultivation system
2.3Fe-EDTA培养体系中不同形态铁的分布及浓度变化趋势
向培养体系中加入不同质量浓度的Fe-EDTA后,当三角褐指藻处于调整期和对数期时,铁主要存在于液相中;进入平台期后,铁主要被吸附到藻细胞的表面;随着培养时间的增加,液相铁质量浓度显著减少,细胞外和细胞内铁质量浓度逐渐增加(见图3).这是因为加入不同质量浓度的Fe-EDTA后,过量的EDTA可以防止体系中的铁形成沉淀,从而使大部分铁存在于液相中.在培养初期,铁主要存在于液相中,随着培养时间的增加,Fe-EDTA解离反应产生的Fe′逐渐被吸附到藻细胞表面并被三角褐指藻吸收利用,液相铁的浓度质量减少,细胞外和细胞内铁质量浓度增加.
2.4Fe-DFO培养体系中不同形态铁的分布及浓度变化趋势
向培养体系中加入Fe-DFO后,铁的分布及质量浓度变化趋势(见图4)与Fe-EDTA培养体系基本一致,但由于三角褐指藻对Fe-DFO的吸收速率比Fe′低[12],故在相同的培养时间下,Fe-DFO培养体系细胞外和细胞内铁质量浓度均比Fe-EDTA培养体系低,液相铁质量浓度比Fe-EDTA培养体系高.
上述结果显示,三角褐指藻对铁的吸收是一个循序渐进的过程,主要分为两个阶段:第一阶段是细胞表面的吸附作用,第二阶段将细胞表面的铁运送到细胞内.这与Shaked等[8]提出的浮游植物对铁吸收的二价铁模型相一致.
2.5总铁回收率
根据培养体系中各部分铁的量之和与添加铁的量,可计算出体系中添加的总回收率.FeCl3、Fe-EDTA和Fe-DFO培养体系的总铁回收率范围依次为93.3%~129.7%,88.8%~121.4%和96.9%~123.1%,回收率均较高.
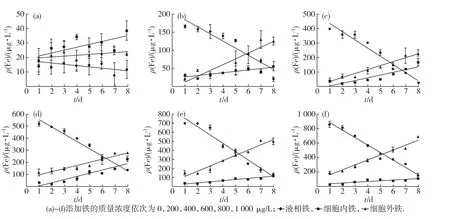
图3 Fe-EDTA培养体系中不同形态铁的变化Fig.3 The variation of different iron forms in Fe-EDTA cultivation system
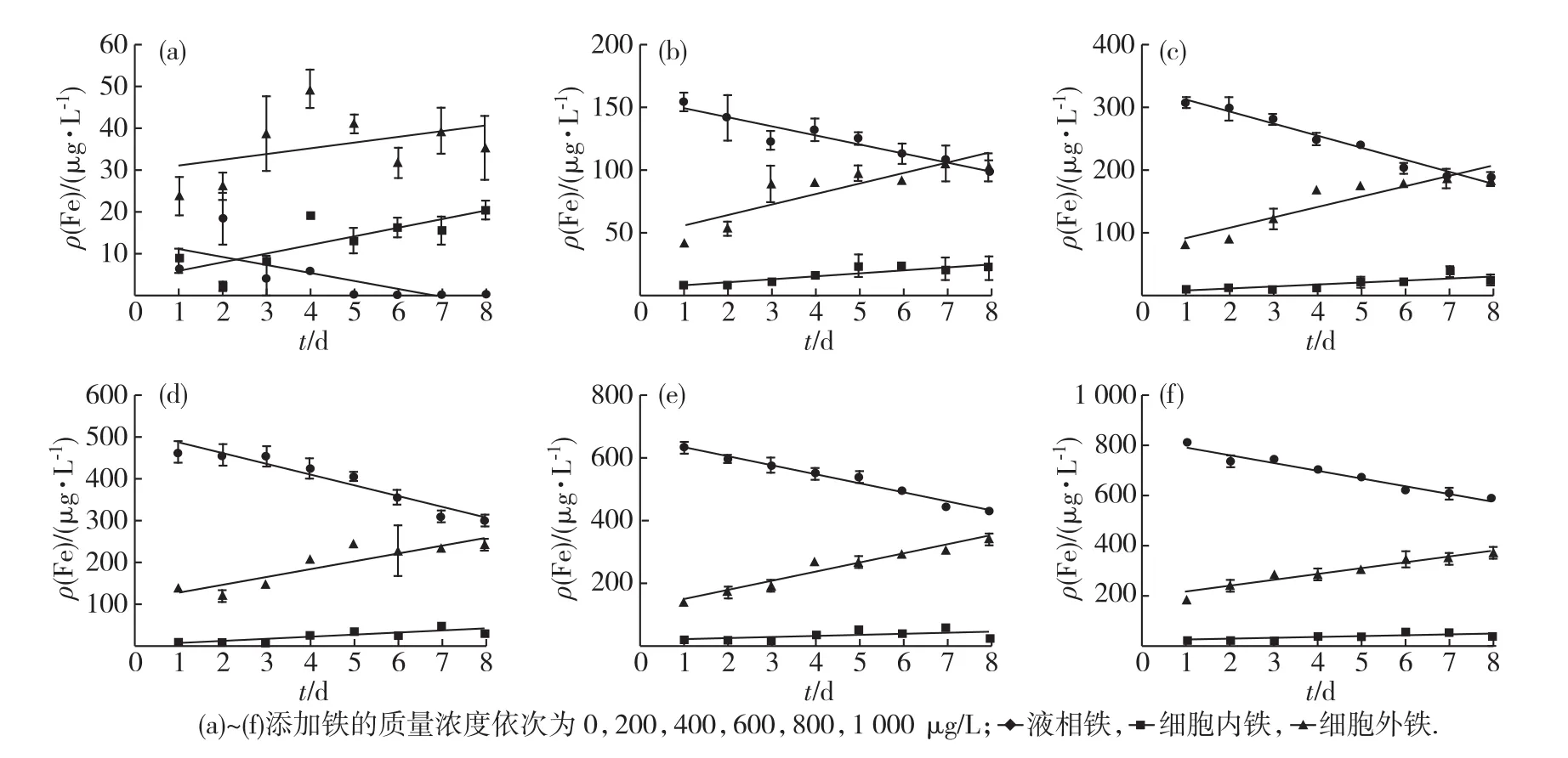
图4 Fe-DFO培养体系中不同形态铁的变化Fig.4 The variation of different iron forms in Fe-DFO cultivation system
2.63种形态铁的生物可利用性比较
以培养第4天的藻细胞密度及液相中和藻细胞内外铁浓度的数据,计算得到不同浓度的FeCl3、Fe-EDTA和Fe-DFO培养体系中三角褐指藻Q及ρss,如表2所示.
当添加铁的质量浓度相同时,FeCl3组三角褐指藻的Q最高,相应的ρss最大;Fe-DFO组Q和ρss均最小.随着铁质量浓度的增加,各组中三角褐指藻Q及ρss均呈增加趋势.由单因素方差分析可知,FeCl3、Fe-EDTA和Fe-DFO 3组的Q和ρss的F值分别为4.10和7.36,p值均<0.05;进一步经过LSD t-检验可知, 3组间Q和ρss均有显著差异,如表3所示.
当添加铁的质量浓度相同时,FeCl3、Fe-EDTA和Fe-DFO组中易被三角褐指藻吸收和利用的铁浓度依次降低.故在其他培养条件一致的情况下,FeCl3组三角褐指藻Q和ρss最大,Fe-EDTA组次之,Fe-DFO组最低.对三角褐指藻而言,3种形态铁的生物可利用性由高到低依次为FeCl3>Fe-EDTA>Fe-DFO.
Lis等[10]将前人关于硅藻、蓝藻等浮游植物对不同形态铁的吸收和利用情况进行了比较和总结,指出大多数浮游植物对Fe′的吸收速率最高,对Fe-DFO的吸收速率最低.本研究结果表明三角褐指藻对FeCl3、Fe-EDTA和Fe-DFO 3种形态铁的吸收利用情况与大多数浮游植物的吸收利用情况一致.

表2 三角褐指藻对数期单位细胞内铁浓度(Q)及稳态铁吸收速率(ρss)Tab.2 The intracellular iron concentration per cell(Q)and iron absorption rate at steady state(ρss)in the exponential phase of P.tricornutum

表3 不同培养体系之间Q和ρss的统计值Tab.3 The statistical values of Q andρssbetween different cultivation systems
3 结 论
本研究发现,不同质量浓度的FeCl3和Fe-EDTA均可促进三角褐指藻的生长,不同质量浓度的Fe-DFO均会抑制三角褐指藻的生长.向培养体系中加入不同质量浓度的FeCl3、Fe-EDTA和Fe-DFO后,铁主要存在于液相.液相铁质量浓度均随培养时间的增加而减少,细胞内外铁质量浓度均随培养时间的增加而增加(除FeCl3体系中细胞外铁基本保持不变外).3种形态铁的三角褐指藻生物可利用性由高到低依次为FeCl3>Fe-EDTA>Fe-DFO.本研究利用不同形态铁培养三角褐指藻,根据藻的生长及铁的分布与浓度变化趋势判断不同形态铁的生物可利用性,为进一步研究海水中铁的生物可利用性提供了理论依据和数据参考.
[1] GEIDER R J,LA ROCHE J.The role of iron in phytoplankton photosynthesis,and the potential for iron-limitation of primary productivity in the sea[J].Photosynthesis Research,1994,39(3):275-301.
[2] FALKOWSKI P G,BARBER R T,SMETACEK V.Biogeochemical controls and feedbacks on ocean primary production[J].Science,1998,281(5374):200-207.
[3] GREENE R M,GEIDER R J,FALKOWSKI P G.Effect of iron limitation on photosynthesis in a marine diatom [J].Limnology and Oceanography,1991,36(8): 1772-1782.
[4] TAYLOR S R.Abundance of chemical elements in the continental crust:a new table[J].Geochimicaet Cosmochimica Acta,1964,28(8):1273-1285.
[5] MILLERO F J.Solubility of Fe(Ⅲ)in seawater[J].Earth and Planetary Science Letters,1998,154(1):323-329.
[6] MARTIN J H,GORDON R M.Northeast Pacific iron distributions in relation to phytoplankton productivity[J]. Deep Sea Research Part A:Oceanographic Research Papers,1988,35(2):177-196.
[7] SOHM J A,WEBB E A,CAPONE D G.Emerging patterns of marine nitrogen fixation[J].Nature Reviews Microbiology,2011,9(7):499-508.
[8] SHAKED Y,KUSTKA A B,MOREL F M M.A general kinetic model for iron acquisition by eukaryotic phytoplankton[J].Limnology and Oceanography,2005,50(3): 872-882.
[9] MOREL F M M,KUSTKA A B,SHAKED Y.The role of unchelated Fe in the iron nutrition of phytoplankton [J].Limnology and Oceanography,2008,53(1):400-404.
[10] LIS H,SHAKED Y,KRANZLER C,et al.Iron bioavailability to phytoplankton:an empirical approach[J].The International Society for Microbial Ecology Journal, 2015,9(4):1003-1013.
[11] 陈峰,姜悦.微藻生物技术[M].北京:中国轻工业出版社,1999:32-33;44-45;151-155.
[12] Kosakowska A,Lewandowska J,Ston J,et al.Qualitative and quantitative composition of pigments in Phaeodactylum tricornutum(Bacillariophyceae)stressed by iron [J].Biometals,2004,17:45-52.
[13] Allen A E,LaRoche J,Maheswari U,et al.Whole-cell response of the pinnate diatom Phaeodactylum tricornutum to iron starvation[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2008,105(30):10438-10443.
[14] KELLER M D,BELLOWS W K,GUILLARD R R L. Microwave treatment for sterilization of phytoplankton culture media[J].Journal of Experimental Marine Biology and Ecology,1988,117(3):279-283.
[15] TANG D,MOREL F M M.Distinguishing between cellular and Fe-oxide-associated trace elements in phytoplankton[J].Marine Chemistry,2006,98(1):18-30.
[16] FRANKLIN N M,STAUBER J L,MARKICH S J,et al.p H-dependent toxicity of copper and uranium to a tropical freshwater alga(Chlorella sp.)[J].Aquatic Toxicology,2000,48(2/3):275-289.
[17] MALDONADO M T,PRICE N M.Reduction and transport of organically bound iron by Thalassiosira oceanica (Bacillariophyceae)[J].Journal of Phycology,2001,37 (2):298-310.
[18] 蒋汉明,张凤珍,孙凌云,等.Fe3+对三角褐指藻生长和脂肪酸组成的影响[J].食品科学,2005,26(6):43-46.
[19] 朱明远,牟学延.铁对三角褐藻生长,光合作用及生化组成的影响[J].海洋学报,2000,22(1):110-116.
[20] 蔡阿根,李文权,陈慈美.海水中有机络合态的铁对三角褐指藻光合作用的影响[J].海洋通报,1993,12(1): 30-34.
[21] WELLS M L,ZORKIN N G,LEWIS A G.The role of colloid chemistry in providing a source of iron to phytoplankton[J].Journal of Marine Research,1983,41(4): 731-746.
[22] KUMA K,NISHIOKA J,MATSUNAGA K.Controls on iron(Ⅲ)hydroxide solubility in seawater:the influence of p H and natural organic chelators[J].Limnology and Oceanography,1996,41(3):396-407.
[23] LIS H,SHAKED Y.Probing the bioavailability of organically bound iron:a case study in the Synechococcusrich waters of the Gulf of Aqaba[J].Aquatic Microbial Ecology,2009,56(2/3):241-253.
[24] SHAKED Y,LIS H.Disassembling iron availability to phytoplankton[J].Frontiers in Microbiology,2012,3 (123):1-26.
Absorption and Utilization of Different Forms of Iron by Phaeodactylum tricornutum
DONG Wanli,HUANG Shuyuan,SHI Dalin,YUAN Dongxing*
(Key Laboratory of the Coastal and Wetland Ecosystems,Ministry of Education, College of the Environment and Ecology,Xiamen University,Xiamen 361102,China)
To investigate the bioavailability and effect of different iron species on the growth of Phaeodactylum tricornutum,different concentrations of FeCl3,Fe-EDTA and Fe-deferoxamine(Fe-DFO)were added into natural seawater to serve as the iron sources.Cell population and iron concentration in different culture systems were measured every day.The results showed that FeCl3and Fe-EDTA at all the test concentrations promoted the growth of P.tricornutum,while Fe-DFO at all concentrations inhibited the growth.When FeCl3was added to the culture system,iron was mainly distributed on the surface of the algae cells.However,with Fe-EDTA or Fe-DFO in the culture system the iron was mainly in the liquid phase.As the incubation time increased,the concentration of iron in liquid phase decreased,while that of intracellular and extracellular iron increased.In summary,our results demonstrated that the bioavailability of the three forms of iron to P.tricornutum was in the order of FeCl3>Fe-EDTA>Fe-DFO,which provides
for further study on the bioavailability of iron in the seawater.
seawater;iron;Phaeodactylum tricornutum;bioavailability
X 55
A
0438-0479(2016)06-0869-07
10.6043/j.issn.0438-0479.201602009
2016-02-16 录用日期:2016-05-31
国家自然科学基金(41176075)
yuandx@xmu.edu.cn
董万礼,黄舒元,史大林,等.三角褐指藻对不同形态铁的吸收和利用[J].厦门大学学报(自然科学版),2016,55(6): 869-875.
DONG W L,HUANG S Y,SHI D L,et al.Absorption and utilization of different forms of iron by Phaeodactylum tricornutum[J].Journal of Xiamen University(Natural Science),2016,55(6):869-875.(in Chinese)
