负载型CuO/TiO2催化剂催化CO2加氢制甲醇
2016-12-06刘超恒郭晓明钟成林李亮华玉喜毛东森卢冠忠上海应用技术大学化学与环境工程学院应用催化研究所上海201418
刘超恒 郭晓明 钟成林 李亮 华玉喜 毛东森 卢冠忠(上海应用技术大学化学与环境工程学院,应用催化研究所,上海201418)
负载型CuO/TiO2催化剂催化CO2加氢制甲醇
刘超恒郭晓明*钟成林李亮华玉喜毛东森*卢冠忠
(上海应用技术大学化学与环境工程学院,应用催化研究所,上海201418)
采用浸渍法制备了CuO/TiO2负载型催化剂,并将其用于CO2加氢制甲醇反应。重点考察了铜的负载量对催化剂性能的影响,并对其物化性能和催化性能之间的关系进行了讨论。结果发现,随着铜负载量的增加,催化剂中金属铜的比表面先增加后减小,当铜的负载量为10%(质量百分数)时达到最大值。催化剂的表面碱性位数量随铜含量的增加持续减小,中等碱位和强碱位的强度下降。当铜的负载量不高于10%时,CO2的转化率与铜的比表面积呈线性关系。甲醇选择性与催化剂的表面碱位性质有关,过强的碱性位会降低甲醇选择性。
CuO/TiO2;负载量;铜的比表面;碱性;二氧化碳加氢;甲醇
大气中二氧化碳(CO2)浓度的上升是导致全球气候变暖的主要原因。CO2催化加氢制甲醇既可减少CO2的排放又可得到清洁能源甲醇,因此被认为是CO2有效利用的最佳途径[1-2]。基于该过程在环境和能源问题上的重要意义,诺贝尔化学奖获得者Olah提出了“甲醇经济”的概念[3]。全球首家CO2加氢制甲醇的商业化工厂已经在冰岛建立并于2011年末开始运营[4]。
性能优良的催化剂是实现CO2加氢制甲醇反应的关键。大量研究表明[5-12],以ZrO2作载体或助剂的铜基催化剂表现出良好的CO2催化加氢性能。TiO2与ZrO2同为ⅣB族元素的氧化物,性质较为相似,因此,近年来TiO2负载或改性的铜基催化剂也开始受到人们的关注。Zhang等[13]比较了助剂SiO2、TiO2和SiO2-TiO2对CuO-ZnO-Al2O3催化剂的影响,发现助剂的添加增加了CuO的分散度,其中添加SiO2-TiO2的催化剂表现出最高的催化性能。于杨等[14]在CuO-ZnO/ZrO2中添加TiO2,发现适量TiO2的添加促进铜与载体的相互作用,提高了铜活性中心的数量,从而提高了CO2的转化率和甲醇选择性。Xiao等[15]在CuO-ZnO体系中引入TiO2、ZrO2和TiO2-ZrO2复合氧化物,结果显示,TiO2、ZrO2或TiO2-ZrO2的引入不但提高了CuO的分散度,还增加CO2的吸附量,从而改善了催化性能。上述研究都是采用共沉淀法引入TiO2,且是在较复杂的三组分或四组分催化剂体系中考察TiO2的作用。Bando等[16]采用浸渍法制备了Al2O3、SiO2和TiO2(P25)负载的铜基催化剂,发现Cu/TiO2催化剂上合成甲醇的频率转换因子(TOF)较高。他们用原位红外技术对反应中间产物进行了检测,但并没有就催化剂的表面性能进行深入探讨。
负载型催化剂体系有利于从分子和原子水平研究催化剂的表面性质,并便于催化反应机理的讨论[17]。因此,本文采用浸渍法制备了负载型简单二组分CuO/TiO2催化剂,将其应用于CO2加氢制甲醇反应。重点考察了铜负载量对催化剂表面物理化学性能尤其是铜的比表面和表面碱性的影响,并结合催化反应机理探讨了物化性能与催化性能之间的关系。
1 实验部分
1.1催化剂的制备
CuO/TiO2催化剂采用等体积浸渍法制备。具体步骤如下:按所需质量配制一定浓度的Cu(NO3)2溶液,加入到金红石相TiO2中,混合均匀,室温下浸渍6 h,在110℃的烘箱中干燥过夜,再置于400℃的马弗炉中焙烧4 h,得到CuO/TiO2催化剂。铜的负载量分别为1%、4%、7%、10%和15%(金属铜相对于载体TiO2的质量百分数)。为方便起见,所制备的催化剂标示为x%CT,其中x%表示铜的含量。参照用纯CuO粉末由Cu(NO3)2在500℃焙烧分解制得。
上述所用试剂均为分析纯,金红石相TiO2购自Aladdin化学试剂有限公司,其余试剂购自国药集团化学试剂有限公司。
1.2催化剂的表征
催化剂的晶相结构测定在荷兰帕纳科公司生产的PW3040/60X Pert PRO型多晶X射线衍射仪上进行。辐射源为Cu Kα射线,Ni滤波片,工作电压为40 kV,工作电流为40 mA,2θ扫描角度为20°~60°,扫描速率为4°·min-1。
催化剂的BET比表面在美国麦克公司生产的ASAP2020 M+C型多功能吸附仪上采用N2吸附法测得。测试前催化剂在200℃真空脱气10 h。
采用N2O反应滴定法测定经还原后催化剂中金属Cu的表面积[7]。首先,将200 mg的催化剂在300℃、H2/He气氛下还原1 h,然后用He气吹扫并冷却至60℃,再切换到1%的N2O/He混合气(体积分数),用质谱仪(OmniStar 200)记录生成的N2信号。
催化剂的表面电子态及元素组成采用X射线光电子能谱(ESCALAB 250Xi)测定,以Al Kα (1 486.6 eV)为激发源,键合能以C1s(284.6 eV)校准。
氢气程序升温还原(H2-TPR)实验在自建装置上进行。催化剂装量为30 mg,还原气为10%的H2/N2混合气(体积分数),还原气流速为50 mL·min-1,升温速率为5℃·min-1,用热导池检测器(TCD)检测耗氢量。反应器出口装有5 A分子筛以除去反应中生成的水。
催化剂的CO2程序升温脱附测试(CO2-TPD)在自建装置上进行,用质谱仪(OmniStar 200)检测脱附气体信号。称取100 mg催化剂,在300℃用10%(体积分数)的H2/N2混合气还原1 h。He吹扫降温至50℃,在此温度下吸附CO2(30 mL·min-1)1 h,再用He(30 mL·min-1)吹扫至基线走平,然后以5℃·min-1的升温速率升温至550℃。CO2的脱附量采用CO2脉冲法定量,催化剂表面的碱性位数量对应CO2的脱附量。
1.3催化剂的评价
催化剂性能的评价在加压微型固定床流动反应装置上进行,反应器为内径为5 mm、长为300 mm的不锈钢管。反应前催化剂先在10%的H2/N2混合气中于300℃预还原3 h。然后冷却到反应温度,将气体切换至原料气(nCO∶nH=1∶3),缓慢升压至3.022MPa。反应产物用气相色谱仪(6820,Agilent)进行在线检测,碳分子筛填充柱和TCD用于CO2、CO的分离、检测,Porapak Q柱和氢火焰离子化检测器(FID)用于甲醇等有机物的分离和检测。为避免反应产物的冷凝,反应器出口至色谱仪进样口之间的连接管用加热带保温至140℃以上。根据所测定的反应尾气中各组分的含量,以碳原子的物质的量计算CO2的转化率和产物中各物质的选择性,计算公式如下:
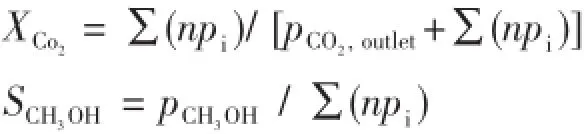
式中pi为反应尾气中某含碳物种的分压,n代表含碳物种中的碳原子数目。
2 结果与讨论
2.1催化剂的结构和织构性质
图1是TiO2载体及CuO/TiO2催化剂的XRD图。在2θ为27.4°,36.1°,41.3°,54.4°及56.7°处的衍射峰为金红石相TiO2的特征衍射峰(JCPDS No.21-1276)。与载体TiO2相比较,CuO/TiO2催化剂中TiO2的衍射峰位置没有发生改变,仅是强度有所减小,这说明铜的负载没有破坏TiO2的晶体结构。2θ为35.6°和38.8°的衍射峰对应CuO的物相(JCPDS 80-1268)。当铜的负载量较低时,没有CuO的衍射峰出现,表明CuO高度分散在载体TiO2的表面。当铜的含量达到7%时,CuO的衍射峰开始出现,且其强度随着铜含量的进一步增加而增强,这意味着CuO的分散度逐步降低。
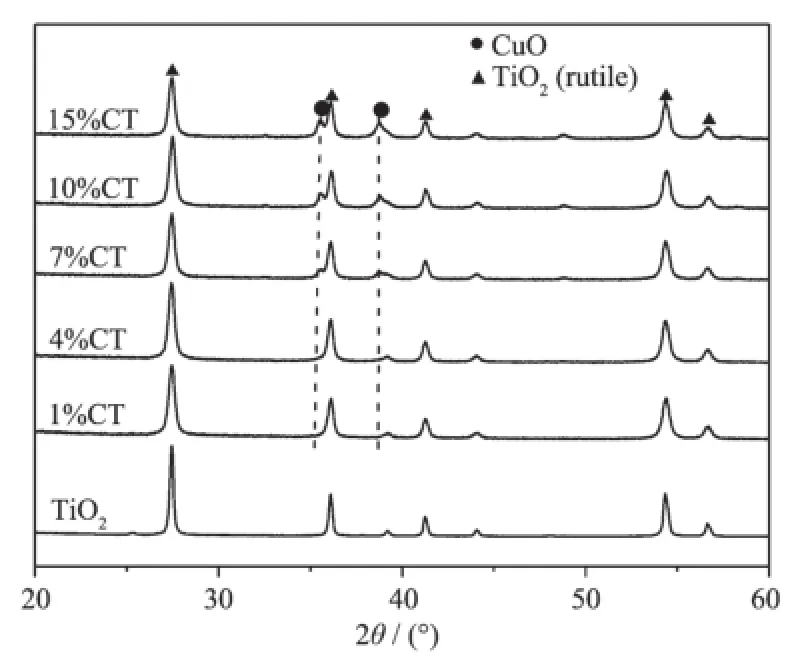
图1 不同铜含量Cu/TiO2催化剂的XRD图Fig.1XRD patterns of Cu/TiO2catalysts with different Cu contents
TiO2载体及CuO/TiO2催化剂的BET比表面积如表1所示。随着铜负载量的升高,催化剂的BET比表面积下降,从1%CT的40 m2·g-1减小到15% CT的30 m2·g-1。这是因为负载CuO后,CuO占据了TiO2的部分表面及堵塞了其部分孔道所致。经还原后样品中铜的比表面积(SCu)及分散度(DCu)也在表1中列出。SCu随着铜含量的升高先增大后减小,当铜含量为10%时达到最大。DCu则随着铜含量的增加持续减小,这与XRD的结果是一致的。SCu的变化与催化剂中铜的含量及铜在TiO2载体上的分散状态有关。当负载量小于10%时,铜含量的增加占主导地位,分散度虽有所下降,但铜的比表面仍然是增加的。但当铜的负载量大于10%时,分散度下降的影响超过了铜含量的增加,因而比表面反而下降。
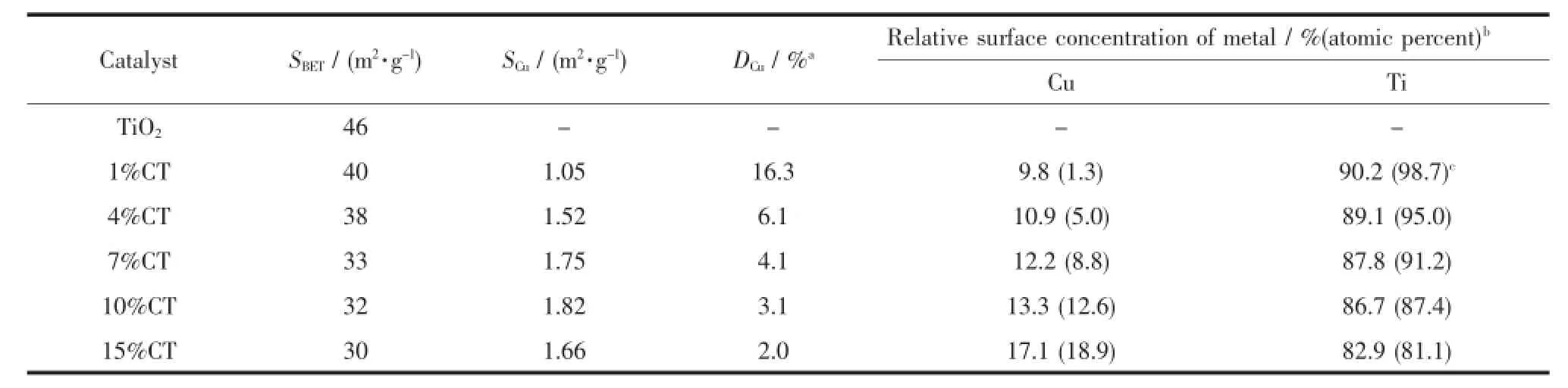
表1 不同铜含量Cu/TiO2催化剂的物化性能Table 1Physicochemical properties of Cu/TiO2catalysts with different Cu contents
2.2催化剂的表面电子态及元素组成
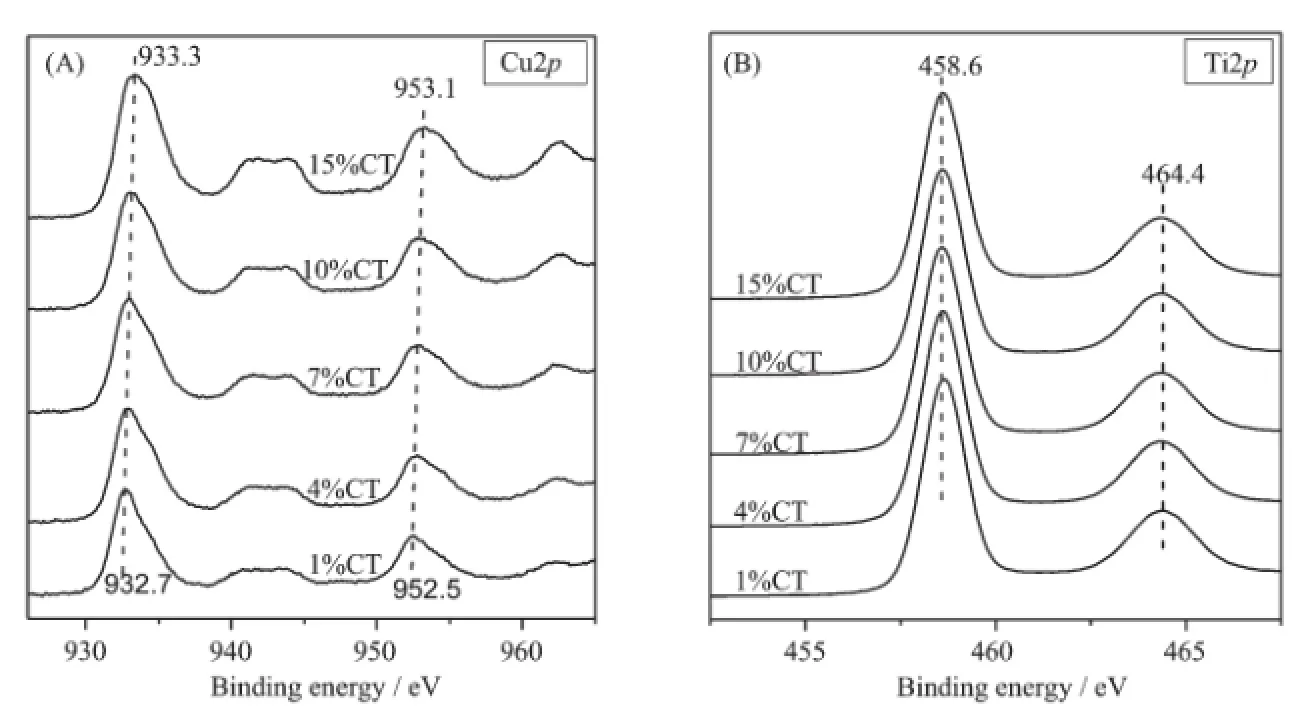
图2 不同铜含量Cu/TiO2催化剂的XPS图谱Fig.2XPS spectra of CuO/TiO2catalysts with different CuO loadings:(A)Cu2p core electrons and(B)Ti2p core electrons
采用XPS技术研究了催化剂的表面电子态和表面组成。如图2(A)所示,Cu2p3/2和Cu2p1/2的特征峰分别出现在932.7~933.3 eV和952.5~953.1 eV处,其结合能略小于纯CuO中相应的结合能(Cu2p3/2933.5 eV,Cu2p1/2953.5 eV)[18]。这是因为CuO的Fermi能级比TiO2低,TiO2上的电子会部分转移到负载的CuO上,导致Cu2+的电子云密度增大,结合能降低[18]。该结果也表明催化剂中CuO与TiO2之间存在相互作用。由图还可以看到,随着CuO负载量的增加,Cu2+结合能逐渐增大。这可解释为CuO负载量的增加降低了CuO在TiO2上的分散度,削弱了CuO与TiO2之间相互作用,因而结合能逐渐增大。位于942.5 eV处的谱峰归属为Cu2p3/2的携上伴峰,这进一步表明Cu是以Cu2+的形式存在[19]。催化剂中Ti2p3/2和Ti2p1/2的谱图如图2(B),由图可见,CuO的负载量对Ti4+的结合能影响甚微。其原因可能在于CuO-TiO2之间的相互作用导致的电荷偏移对Ti4+内层电子的影响不够显著,因而其键和能没有明显变化。由XPS确定的催化剂表面金属相对含量如表1所示。当Cu的负载量较低时,表面Cu的相对含量明显高于理论添加量;随着Cu的负载量增加,表面Cu的相对含量逐渐趋同于理论添加量。
2.3催化剂的还原性能
CuO/TiO2催化剂及非负载的CuO粉体的H2-TPR曲线如图3所示。所有样品均呈现一个还原峰。通常,CuO还原峰温度的高低反映CuO分散度的大小,还原峰温度越高,分散度越小[20]。由图可见,还原峰温度随着铜负载量的增加而升高,表明CuO的分散度逐步减小,粒径增大,这与XRD的结果相一致。从样品1%CT到15%CT,还原峰面积的增大则与单位质量催化剂中CuO含量的增加有关,且氢气的消耗量近似等于CuO的理论负载量。与非负载的CuO (还原峰温度大约为285℃)相比,CuO/TiO2中CuO的还原峰温度大大降低。这可归结于两方面的因素,一是载体TiO2对CuO起到了分散的作用,降低了CuO的晶粒尺寸,从而降低还原温度;二是CuO/ TiO2催化剂中CuO与载体之间存在相互作用,促进了CuO的还原[10,21]。
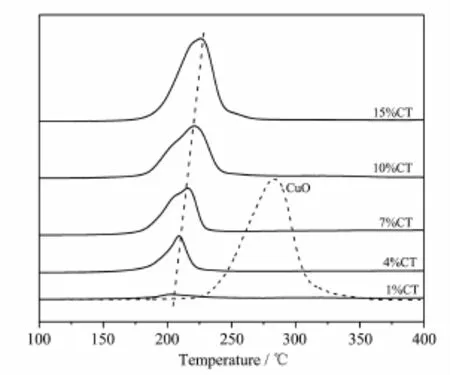
图3 不同铜含量Cu/TiO2催化剂的H2-TPR图Fig.3TPR profiles of Cu/TiO2catalysts with different Cu contents
2.4催化剂的表面碱性
采用CO2作探针分子研究金属氧化物的表面碱性,通常可检测到3种碱性位的存在[22-23]。第一种是表面的羟基(-OH),该碱性位属于Brönsted碱位,吸附CO2后形成碳酸氢盐;第二种为Lewis酸碱对,此处即Ti4+-O2-,CO2以双齿吸附形式吸附在Ti4+-O2-位上;第三种是表面配位不饱和的O2-(标记为c.u.s. O2-),属Lewis碱位,CO2以单齿形式吸附在c.u.s.O2-上[9,23-25]。碱位的强度依如下次序增强:-OH<Ti4+-O2-<c.u.s.O2-。图4是不同铜含量Cu/TiO2催化剂的CO2-TPD图。由图可见,CO2的脱附可分为低温和高温2个区域。低温脱附区对应羟基位上(弱碱位)CO2的脱附,温度范围约为50~150℃。改变铜的负载量,低温区的脱附温度变化不大,表明弱碱位的强度变化不大。高温脱附区则对应Ti4+-O2-(中等碱位)和c.u.s.O2-(强碱位)上CO2的脱附。2种碱性位的脱附峰发生重叠,说明这2种碱性位强度较接近。高温区的脱附温度随着铜负载量的增加明显降低,例如,样品1%CT的脱附温度区间为285~540℃,而15%CT的脱附区间出现在255~420℃(见表2),这表明中等碱位和强碱位的强度显著减弱。王嵩等[26]研究了CuO-TiO2-ZrO2催化剂上CO2的脱附,也发现Cu含量的增加导致高温区的脱附温度降低。中等碱位和强碱位强度的变化可能与Cu和TiO2载体之间的相互作用有关。
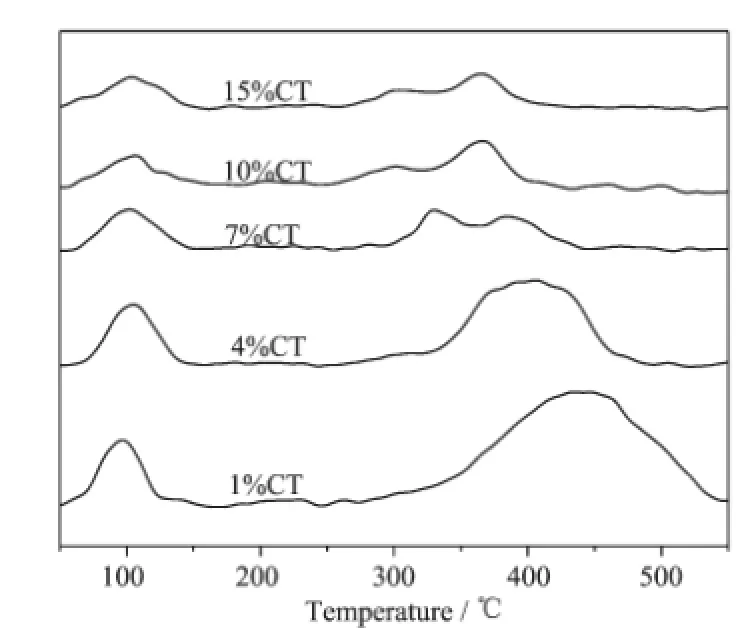
图4 不同铜含量Cu/TiO2催化剂的CO2-TPD图Fig.4TPD profiles of Cu/TiO2catalysts with different Cu contents
催化剂表面的碱性位数目如表2所示。随着铜负载量的增加,低温区的碱性位数目略有减少,由2.95 μmol·g-1减为1.65 μmol·g-1;而高温区的碱位数目显著降低,由样品1%CT的16.9 μmol·g-1降至15%CT的2.58 μmol·g-1。这可解释为随着铜负载量的增加,催化剂的BET比表面有所下降,同时载体TiO2表面更多的碱性位被铜所覆盖。该实验结果也说明CO2的吸附主要是靠载体TiO2来完成的,Cu本身不具有吸附CO2的作用[16,26]。Gao等[27]认为弱碱位上吸附的CO2在常见的催化反应条件下(180~280℃)容易脱附,很难进一步加氢,对加氢反应有贡献的是中等碱位和强碱位(有效碱性位)。值得注意的是,本文中样品15%CT的中等碱位和强碱位数目远小于文献报道的CuO-ZnO-Al2O3(77.5 μmol·g-1)催化剂[27]及CuO-ZrO2(14.1 μmol·g-1)催化剂。
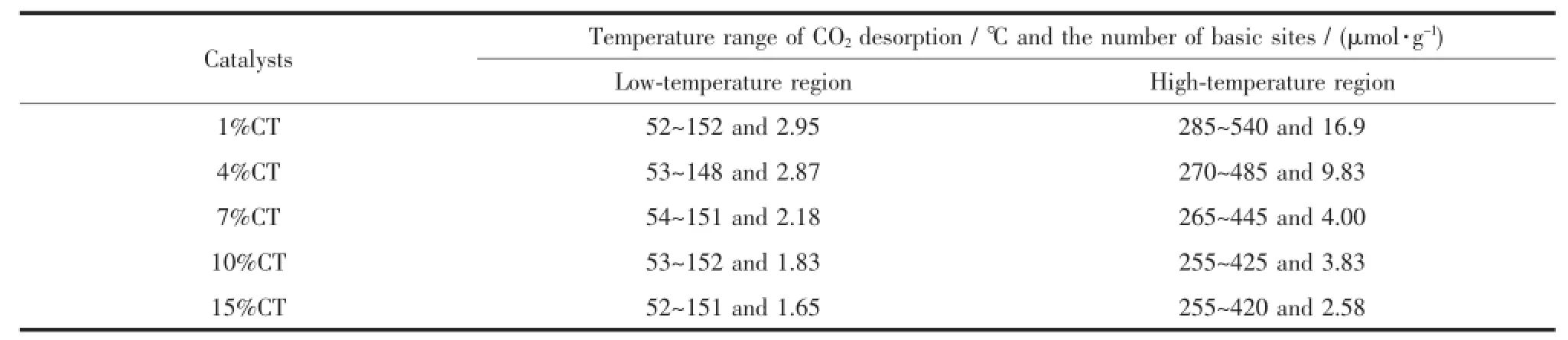
表2 Cu/TiO2催化剂上CO2的脱附温度及碱位数目Table 2Temperature range of CO2desorption(℃)and the number of basic sites over Cu/TiO2catalysts
2.5催化剂的催化性能
Cu/TiO2催化剂的催化活性和甲醇选择性如表3所示。反应测试中,尾气中的碳含量与原料气中的碳含量之比即碳平衡率为90%~95%。随着铜负载量的增加,CO2的转化率先增大后减小,当铜含量为10%时,CO2转化率达到最大值。甲醇选择性则随铜含量的增加有一台阶式的变化。当铜的负载量为1%时,甲醇选择性为57.8%;当铜含量增加到4%时,甲醇选择性显著增加为77%;进一步增加铜含量,选择性基本不变。甲醇的收率也是先增大后减小,当铜的负载量为10%时达到最大值。
反应机理的研究表明[29-31],铜基催化剂用于CO2加氢反应时涉及2个活性中心。一个是铜,另一个则是所谓的“载体”如Al2O3、ZrO2及TiO2等。其中,Cu充当吸附解离H2的角色,“载体”则起到吸附活化CO2的作用。Cu上的原子H通过溢流作用到达“载体”表面对活化中间体进行加氢。尽管对活化中间体的种类和反应路径等问题还存在争议,但“双活性位”概念已经被广泛接受[9,28]。根据上述反应机理,对CO2加氢合成甲醇反应而言,铜的比表面积(SCu)是一关键参数。研究人员对SCu与催化活性之间的关系进行了广泛探讨。一些作者报道,甲醇收率与SCu之间存在线性关系[6,32]。然而,Sun等[33]指出,甲醇产率虽然随SCu增加而增加,但两者并非线性关系。Arena等[5]最近的工作也给出了类似的结果。最近我们的研究发现,CO2的转化率(不是甲醇收率)与SCu之间存在线性关系[28]。Gao等[27]研究了一系列类水滑石结构的CuO-ZnO-Al2O3催化剂,也得到相同的结果。本实验中,CO2转化率和SCu之间的关系如图5所示。可以看到,除样品15%CT外,CO2的转化率与铜的比表面之间存在线性相关。这可解释为当Cu的含量不高于10%时,用于吸附CO2的碱性位是足量的,而铜的活性位相对不足,因此,转化率由铜的活性位即铜的比表面所决定。SCu的增加会导致解离的原子H增加,因而有更多的H通过溢流到达“载体”表面并对吸附的碳物种进行加氢反应,从而提高CO2的转化率。当Cu的含量达到15%时,样品15% CT上CO2的转化率对SCu偏离了图5中的线性关系。可能的原因有二:一是如CO2-TPD的结果所示,15%CT表面的有效碱位数量很少,此时铜的活性位可能相对过量,转化率受控于碱性位的数量.二是随着铜负载量的增加,CuO与TiO2之间相互作用减弱,降低了单位Cu活性位的活性。

表3 不同铜含量Cu/TiO2催化剂的催化剂性能Table 3Catalytic property for hydrogenation of CO2to methanol over Cu/TiO2catalysts with different Cu contents
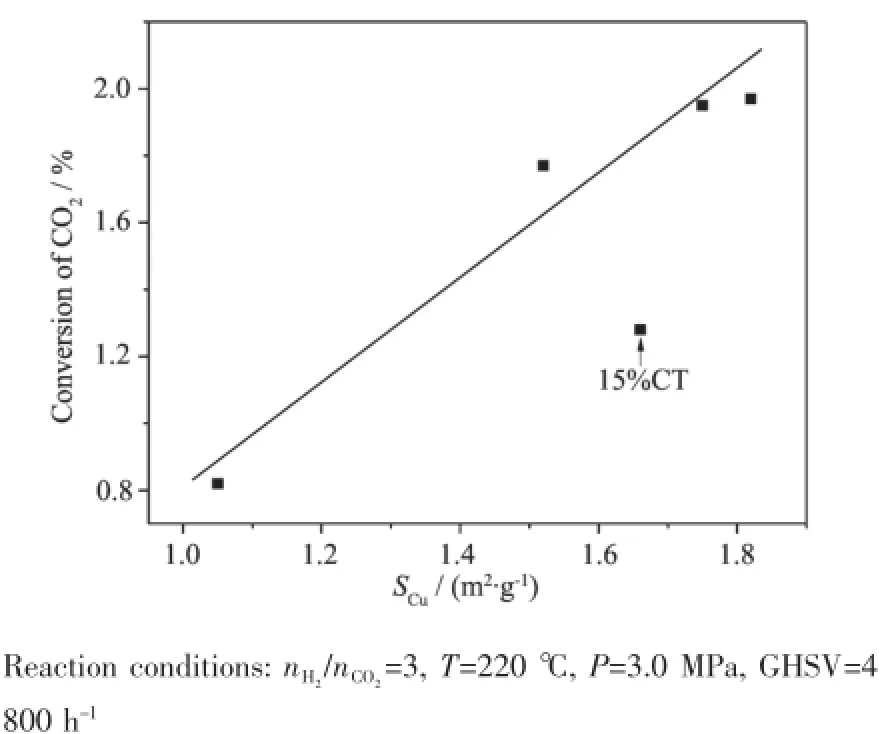
图5 CO2转化率与铜比表面之间的关系Fig.5Relationship between the CO2conversion and Cu surface area
早期对甲醇选择性的解释多是从铜活性位的性质出发,且观点很不一致[34-36]。双活性位反应机理的研究表明,CO2吸附在载体上形成含碳中间体,该中间体可进一步加氢形成甲醇,也可分解形成逆水汽反应的产物CO,也就是说甲醇和CO是通过同一个中间体形成的[9,28-29]。因此,载体的表面性质尤其是表面碱性直接影响含碳中间体的性质,并进而影响催化反应的选择性。我们在研究La掺杂的CuO-ZrO2催化剂时发现,吸附在强碱位上的含碳中间体更倾向于进一步加氢生成甲醇而不是分解形成CO[28]。Gao等[27]也报道,甲醇选择性与强碱位的比例呈线性关系。然而,载体上的碱性位强度也不能太强。例如,王冠男等[12]在考察铬助剂对Cu/ZrO2/CNTs-NH2催化剂的影响时发现,碱性位太强会形成超强吸附的CO2,反而不利于甲醇形成。本文中,当铜的负载量为4%~15%时,甲醇选择性为77%~79.9%,较高的甲醇选择性表明这些样品的碱性位强度处于一个比较合适的范围,有利于甲醇的生成。对样品1%CT而言,CO2-TPD的结果揭示其高温脱附区温度为285~540℃,可能由于其碱性位过强,导致吸附的含碳中间体不易进一步活化加氢,因此,其甲醇选择性反而明显低于其它样品。
图6为10%CT催化剂上CO2转化率和甲醇选择性随反应温度的变化。在温度高于240℃时检测到少量甲烷和二甲醚。由图可见,随着反应温度的升高,CO2的转化率增大,而甲醇的选择性则持续减小。这可从热力学和动力学2个方面加以解释。二氧化碳加氢过程涉及2个平行反应,即甲醇合成和逆水汽反应(RWGS)[33]。甲醇合成反应是一放热过程,而逆水汽反应是一吸热反应,反应温度的升高有利于CO的生成。另外,相对于甲醇合成反应,RWGS反应具有较高的表观活化能[21,37]。这意味着随反应温度的上升,CO生成速率的增加快于甲醇生成速率的增加。因此,在测试温度范围内,随温度的升高,图6CO2转化率和甲醇选择性随反应温度的变化
Fig.6Effects of temperature on conversion of CO2(solid symbols)and selectivity of methanol (open symbols)over 10%CT CO2的转化率增大,而甲醇的选择性减小。
3 结论
随着催化剂中铜负载量的增加,CuO的分散度降低且还原难度增加,经还原后催化剂中金属铜的比表面先增加后减小。铜的负载量显著影响催化剂的表面碱性,随着铜含量的增加,各种碱性位的数量均减小,中等碱位和强碱位的强度降低。当铜的负载量不高于10%时,用于吸附CO2的碱性位过量,而铜的活性位相对不足,CO2转化率由铜的比表面决定。当铜的负载量高于10%时,CO2转化率与铜的比表面偏离线性关系。甲醇选择性则与催化剂的表面碱位强度有关,过强的碱位会降低甲醇的选择性。当铜的负载量为10%时,CO2的转化率、甲醇选择性及甲醇收率均达到最大值。此外,本文的结果也为CO2加氢制甲醇的“双活性位”机理提供了佐证。
[1]Wang W,Wang S P,Ma X B,et al.Chem.Soc.Rev.,2011, 40:3703-3727
[2]ZHANG Jian-Xiang(张建祥),ZHAO Yan-Qiao(赵彦巧), CHEN Ji-Xiang(陈吉祥),et al.Natural Gas Chem.Ind. (天然气化工),2004,29(6):43-46
[3]Olah G A,Goeppert A,Prakash G K S.J.Org.Chem.,2009, 74:487-498
[4]Halper M,Renew.Energy Focus,2011,12:56-58
[5]Arena F,Barbera K,Italiano G,et al.J.Catal.,2007,249: 185-194
[6]Soczyński J,Grabowski R,Olszewski P,et al.Appl.Catal. A,2006,310:127-137
[7]Guo X M,Mao D S,Lu G Z,et al.J.Catal.,2010,271:178-185
[8]Guo X M,Mao D S,Wang S,et al.Catal.Commun.,2009, 10:1661-1664
[9]Gao P,Li F,Zhan H J,et al.J.Catal.,2013,298:51-60
[10]ZHUANG Hui-Dong(庄会栋),BAI Shao-Fen(白绍芬),LIU Xin-Mei(刘欣梅),et al.J.Fuel Chem.Technol.(燃料化学学报),2010,38(4):462-467
[11]ZHAO Yun-Peng(赵云鹏),JING Tao(荆涛),TIAN Jing-Zhi (田景芝).Natural Gas Chem.Ind.(天然气化工),2007,32 (5):9-11
[12]WANG Guan-Nan(王冠男),CHEN Li-Min(陈礼敏),GUO Yuan-Yuan(郭园园),et al.Acta Phys.-Chim.Sin.(物理化学学报),2014,30(5):923-931
[13]Zhang L X,Zhang Y C,Chen S Y.Appl.Catal.A,2012, 415-416:118-123
[14]YU Yang(于杨),HAO Ai-Xiang(郝爱香),CHEN Hai-Bo (陈海波),et al.Petrochem.Technol.(石油化工),2014,43 (5):511-516
[15]Xiao J,Mao D S,Guo X M,et al.Appl.Surf.Sci.,2015, 338:146-153
[16]Bando K K,Sayama K,Kusama H,et al.Appl.Catal.A, 1997,165:391-409
[17]DONG Lin(董林),YAO Xiao-Jiang(姚小江),CHEN Yi (陈懿).Chin.J.Catal.(催化学报),2013,34(5):851-864
[18]Xu S P,Du A J,Liu J C,et al.Int.J.Hydrogen Energy, 2011,36:6560-6568
[19]HAN Qi-Wei(韩骐伟),ZHU Bao-Lin(朱宝林),TIAN Jing (田晶),et al.Chinese J.Inorg.Chem.(无机化学学报), 2014,30(3):573-578
[20]Zhang Y P,Fei J H,Yu Y M,et al.Energy Convers.Manage., 2006,47:3360-3367
[21]Melián-Cabrera I,López Granados M,Fierro J L G. J.Catal.,2002,210:273-284
[22]Liu Z,Cortés-Concepción J A,Mustian M,et al.Appl. Catal.A,2006,302:232-236
[23]Díez V K,Apesteguía C R,Di Cosimo J I.Catal.Today, 2000,63:53-62
[24]TANG Xiao-Bo(汤小波),Noritatsu T,XIE Hong-Juan (解红娟),et al.J.Fuel.Chem.Tech.(燃料化学学报), 2014,42(6):704-709
[25]Verziu M,Cojocaru B,Hu J C,et al.Green Chem., 2008,10:373-381
[26]WANG Song(王嵩),MAO Dong-Sen(毛东森),GUO Xiao-Ming(郭晓明),et al.Acta Phys.-Chim.Sin.(物理化学学报),2011,27(11):2651-2658
[27]Gao P,Li F,Zhao N,et al.Appl.Catal.A,2013,468: 442-452
[28]Guo X M,Mao D S,Lu G Z,et al.J.Mol.Catal.A,2011,345: 60-68
[29]Arena F,Italiano G,Barbera K,et al.Appl.Catal.A, 2008,350:16-23
[30]Bianchi D,Chafik T,Khalfallah M,et al.Appl.Catal. A,1995,123:89-110
[31]Fisher I A,Bell A T.J.Catal.,1997,172:222-237
[32]Chinchen G C,Denny P J,Parker D G,et al.Appl.Catal., 1987,30:333-338
[33]Sun Q,Zhang Y L,Chen H Y,et al.J.Catal.,1997,167:92 -105
[34]Fujita S,Moribe S,Kanamori Y,et al.Appl.Catal.A, 2001,207:121-128
[35]Toyir J,Piscina P R,Fierro J L G,et al.Appl.Catal. B,2001,34:255-266
[36]Wang J B,Lee H K,Huang T J.Catal.Lett.,2002,83:79-86
[37]Yoshihara,J,Campbell C T.J.Catal.,1996,161:776-782
Methanol Synthesis from CO2Hydrogenation over Supported CuO/TiO2Catalysts
LIU Chao-HengGUO Xiao-Ming*ZHONG Cheng-LinLI LiangHUA Yu-XiMAO Dong-Sen*LU Guan-Zhong
(Research Institute of Applied Catalysis,School of Chemical and Environmental Engineering,Shanghai Institute of Technology,Shanghai 201418,China)
CuO/TiO2catalysts were prepared by the impregnation method and used for methanol synthesis from CO2hydrogenation.The influences of Cu loading amount on the properties of CuO/TiO2were investigated,and the relationship between the physicochemical and catalytic properties was discussed.The results show that the copper surface area increases first and then decreases with increasing Cu loading amount,and a maximum is obtained as Cu loading amount is 10%(w/w).Moreover,with the increase in Cu loading,the amount of basic sites decreases continuously accompanied by a decline in the strength of the medium and strong basic sites.For catalysts with Cu loading of no more than 10%,the CO2conversion increase linearly with the increase in the copper surface area.The methanol selectivity is related to the surface basicity,and an excessive basicity leads to a decrease in methanol selectivity.
CuO/TiO2;loading amount;copper surface area;basicity;CO2hydrogenation;methanol
O643
A
1001-4861(2016)08-1405-08
10.11862/CJIC.2016.192
2016-04-20。收修改稿日期:2016-06-29。
上海市教委科研创新项目(No.13YZ117)、上海市科委自然科学基金(No.13ZR1441200)和国家自然科学基金(No.21273150,21502116)资助。
*通信联系人。E-mail:guoxiaoming@sit.edu.cn;dsmao@sit.edu.cn
