基于半刚性V型3,5-吡啶二甲酰腙类配体构筑的锌螺旋配位聚合物的合成、晶体结构和荧光性质
2016-12-06石凤湘吴文士黄妙龄华侨大学材料科学与工程学院厦门360凯里学院凯里5560
石凤湘 吴文士 黄妙龄(华侨大学材料科学与工程学院,厦门360)(凯里学院,凯里5560)
基于半刚性V型3,5-吡啶二甲酰腙类配体构筑的锌螺旋配位聚合物的合成、晶体结构和荧光性质
石凤湘1,2吴文士*,1黄妙龄1
(1华侨大学材料科学与工程学院,厦门361021)
(2凯里学院,凯里556011)
合成了配体N,N′-二(吡啶-2′-甲亚基)-3,5-吡啶二甲酰肼(bpmphz,1)及其锌的螺旋配位聚合物({[Zn2(bpmphz)(Ac)2]· CH3OH·H2O}n,2),利用元素分析、红外光谱、荧光光谱、热重和X射线粉末衍射等手段进行了表征。1和2晶体都属于正交晶系,1为Pcca空间群,晶胞参数:a=2.016 3(1)nm,b=1.002 34(6)nm,c=1.995 86(8)nm,V=4.033 6(4)nm3,Z=8,分子间通过氢键形成一维超分子链状结构;2为P212121空间群,晶胞参数:a=1.094 88(6)nm,b=1.173 12(6)nm,c=2.168 6(1)nm,V=2.785 5(3)nm3,Z= 4,配合物通过配位键形成三维超分子网状结构,结构中包含一种单股右手螺旋。1和2均能发射荧光,最大发射波长分别为470和510 nm。
晶体结构;锌配位聚合物;荧光性质
0 引言
配位聚合物因具有丰富多样的拓扑结构及其在发光、催化、吸附、磁性等方面具有潜在的应用价值而备受关注。其中螺旋配位聚合物由于其特殊的结构特征和在许多研究领域(光学器件、不对称催化、仿生材料、磁性材料、传感器等方面)具有潜在的应用前景已经成为配位化学和材料科学的研究热点之一[1-7]。螺旋配位聚合物可以看成一条特殊的非线性链[8],常见的超分子作用力如分子间氢键、π-π堆积作用、配位键、憎水效应等都有可能是螺旋构象形成的驱动力。螺旋配合物的一个重要特征是它具有轴向手性,它的手性来源于它的超分子结构,其构筑可以通过金属离子和配体之间某种特定的结合而形成。通常选用有角度的结点和线型的结点构筑螺旋结构。由于金属离子配位角度变化较小,文献中多采用有机配体作为有角度的结点,利用构象和几何形状的灵活性去合理选择或设计具有一定角度的配体,调节配体配位点之间间隔基团的长度和刚柔性以适合形成螺旋结构。所选用的配体可以是手性的也可以是非手性的。其中,选用V型有机配体与金属离子配位是合成螺旋配位聚合物的重要策略之一[9-14]。文献中报道较多的为羧酸类、酰胺类V型有机配体,其中研究柔性配体较多,半刚性的配体报道较少。本文选用的V型非手性配体为三吡啶二酰腙双Schiff碱类,具有一定转折角度的半刚性结构。配体中3,5-吡啶二甲酰基吡啶环上的N原子配位点使其具有类似三角形配体的3个配位方向,分子链中有可旋转的单键,具有一定的柔性,使得配体分子可能具有不对称的3个方向配位驱动力,与锌(Ⅱ)离子配位合成得到了一种三维网状结构的手性螺旋配位聚合物。本文中我们报道它们的合成、结构、热分析和荧光性质。
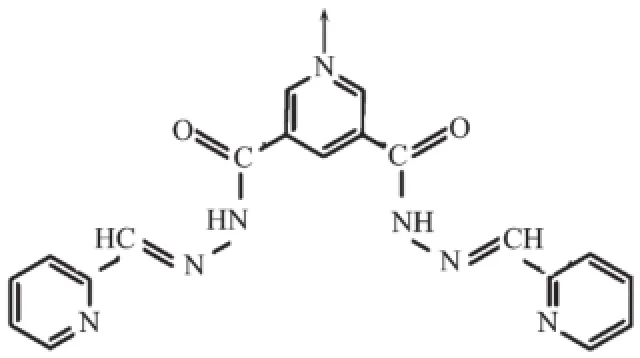
Scheme 1
1 实验部分
1.1主要仪器与试剂
Agilent Gemini E X射线单晶衍射仪(测定化合物1);Bruker P4 X射线单晶衍射仪(测定化合物2);EA 1112 CHNS元素分析仪;Perkin Elmer Spectrum 2000傅里叶变换红外光谱仪(KBr压片),光谱范围4 000~400 cm-1;F-4500荧光光度计;DTG-60H热分析仪(在N2气氛中,升温速率10℃·min-1);Smart Lab 3kw粉末X-ray衍射仪(光源为Cu Kα射线,λ= 0.154 1 nm,工作电压为40 kV,管电流为30 mA,扫描速率为10°·min-1)。3,5-吡啶二甲酸(AR),2-吡啶甲醛(AR),水合肼(AR),乙酸锌(AR),所有试剂均未进一步提纯。
1.2配体bpmphz(1)的合成
配体bpmphz的合成方法参照本课题组文献[15],甲醇重结晶得白色针状晶体。产率为43.1%。主要的红外吸收峰,IR(KBr,cm-1):3 508 m,3 396s,3 186m,3 045m,1 655vs,1 560s,1 467m,1 437m,1 278vs,1 080m,780m,727m。元素分析按C20H19N7O3计算值(%):C,59.25;H,4.72;N,24.18。实测值(%):C,59.28;H,4.75;N,24.13。反应式如下:
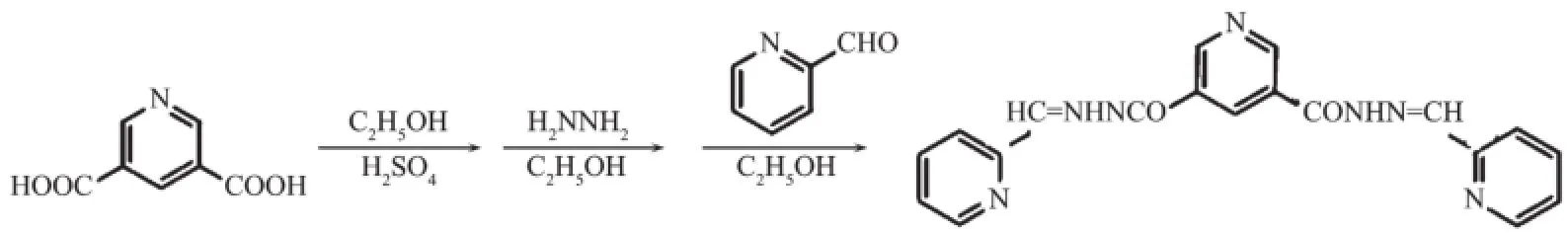
1.3配位聚合物{[Zn2(bpmphz)(Ac)2]·CH3OH· H2O}n(2)的合成
称取20 mg(约0.1 mmol)bpmphz和40 mg(约0.2 mmol)乙酸锌分别溶于10 mL甲醇中,混合后搅拌过滤,放置几天,得浅黄色晶体。产率56.3%。主要的红外吸收峰,IR(KBr,cm-1):3 439w,3 080vw,1 602 m,1 566m,1 474m,1 465w,1 336s,1 128w,1 078w, 775w,670vw。元素分析按Zn2C24H25N7O8计算值(%):C,43.01;H,3.76;N,14.63。实测值(%):C,43.57;H,3.68;N,14.71。
1.4晶体结构的测定
选取大小分别为0.50 mm×0.30 mm×0.20 mm (1)和0.18 mm×0.12 mm×0.08 mm(2)的单晶,采用Mo Kα射线(λ=0.071 073 nm),分别于293(2)K(1)和153(2)K(2),在θ=2.87°~25.00°(1)和θ=3.16°~27.48°(2)范围内收集到全部衍射点。衍射强度经Lp因子校正,并进行了经验吸收校正,晶体结构由直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正,氢原子坐标由差值Fourier合成法或理论加氢找出。1和2的结构解析和精修采用SHELXL-97[16]或SHELXL-2014[17]和Olex 1.2程序包[18]。1和2的主要晶体学数据列于表1。
CCDC:1425589,1;1033001,2。

表1 化合物1和2的晶体学数据和结构精修参数Table 1Crystal data and structure parameters of the compounds 1 and 2
2 结果与讨论
2.1化合物1(配体bpmphz)的晶体结构
化合物1的结构见图1,其主要键长和键角见表2。其中,羰基O1-C7和O2-C13键长分别为0.122 3(3)和0.122 0(3)nm,属典型的C=O双键,表明酰腙为酮式结构。N3-C7和N5-C13键长分别为0.134 6(3)和0.134 3(3)nm,比一般的C-N单键(0.147~0.150 nm)短得多,接近C=N双键键长(0.134~0.138 nm)。亚胺基N2-C6和N6-C14的键长都是0.126 5(3) nm,比正常的C=N键长要短。N2-N3和N5-N6的键长分别为0.138 2(3)和0.138 0(3)nm,比正常的N=N键长要长。C5-C6和C14-C15的键长分别为0.146 8(3)和0.146 5(3)nm,比正常的C-C键长要短。这些都是由于形成了大的π共轭体系缘故,即Py-C=N-N-C= O形成π共轭体系,该共轭作用正是该化合物呈现荧光性质的原因。
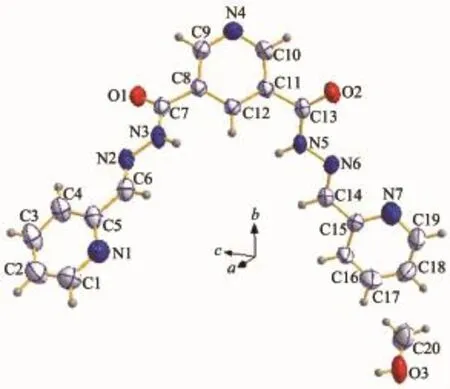
图1 化合物1的分子结构(椭球率30%)Fig.1Molecular structure of compound 1 showing 30% probability displacement ellipsoids

表2 化合物1的主要键长及键角Table 2Selected bond lengths(nm)and bond angles(°)for compound 1
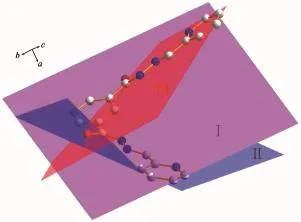
图2 化合物1分子的3个共轭平面Fig.2Three conjugate planes of compound 1
化合物1分子中有3个共轭平面(图2),一个是中间的3,5-吡啶二甲酸缩合的吡啶环平面(C8,C9,N4,C10,C11,C12)(简称Ⅰ平面),另外2个是与3,5-吡啶二甲酸缩合的2个2-吡啶甲醛及水合肼缩合的2个链(PyC=N-NCO)分别形成2个面。即O1,C7,N2,N3和C6与缩合的2-吡啶甲醛的吡啶环(C1, C2,C3,C4,C5,N1)几乎共平面(简称Ⅱ平面),各原子与其最小二乘平面距离的平均偏差值为0.006 13 nm;同样,O2,C13,N5,N6和C14与2-吡啶甲醛的吡啶环(C15,C16,C17,C18,C19,N7)几乎共平面(简称Ⅲ平面),各原子与其最小二乘平面距离的平均偏差值为0.003 87 nm。Ⅱ、Ⅲ平面与Ⅰ平面的二面角分别为30.7(1)°和24.4(1)°。
化合物1的晶体中存在5种氢键,均形成的是分子间氢键。如客体甲醇分子的羟基与亚胺基之间的氢键(N3-H3…O3ii,O3-H3B…N6iii,D-A分别为0.281 8(3),0.310 0(3)nm);羰基与亚胺基的H原子及客体甲醇羟基的H原子之间的氢键(N5-H5…O1i,O3-H3B…O2iii,D-A分别为0.288 1(2),0.290 0(3) nm);羰基与希夫碱C=N的碳原子上的H原子之间的弱氢键(C14-H14…O1i,D-A为0.336 3(3)nm)。通过分子间的氢键作用,化合物1形成一维的超分子链状结构(图3)。氢键的键长和键角见表3。
2.2化合物2的晶体结构
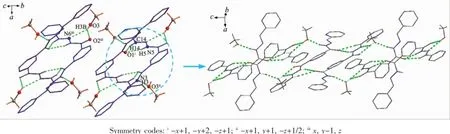
图3 化合物1中氢键作用及由氢键构筑的一维超分子链状结构Fig.31D supramolecular chain via hydrogen bonds in crystal of compound 1

表3 化合物1的氢键参数Table 3Parameters of hydrogen bonds for compound 1
化合物2的每一个最小的不对称单元中包含2个锌离子(Zn2+),1个配体bpmphz,2个醋酸根、1个甲醇和1个水。如图4a所示,2个中心锌离子均为五配位,但配位环境却不同。其中锌离子Zn1周围有5个原子与之配位,分别来自于1个配体bpmphz上的2个氮原子(N1、N2)、1个氧原子(O1),及另外1个配体bpmphz的1个氮原子(N4iii)和醋酸根1个氧原子(O2),键角O-Zn1-N和N-Zn1-N均偏离正常的四方锥键角(表4),因此,这5个原子在锌离子周围形成一个畸变的四方锥配位环境(图4b)。其中N4iii在顶点,N1、N2、O1、O2在底部(扭转角∠O1-O2-N1-N2=17.25°)。另外一个中心锌离子Zn2周围的5个原子,来自于1个配体上的2个氮原子(N6、N7)和1个氧原子(O4),1个醋酸根的1个氧原子(O3iv)以及另外一个醋酸根1个氧原子(O5)配位。键角O-Zn2-O、O-Zn2-N和N-Zn2-N偏离正常的正三角双锥体键角(表4),因此,这5个原子在锌离子周围也形成一个畸变的三角双锥配位环境(图4b)。O3iv、O5、N6位于三角双锥的赤道平面,O4和N7远远偏离此平面,因此位于三角双锥的两极,键角∠O4-Zn2-N7为148.95°。
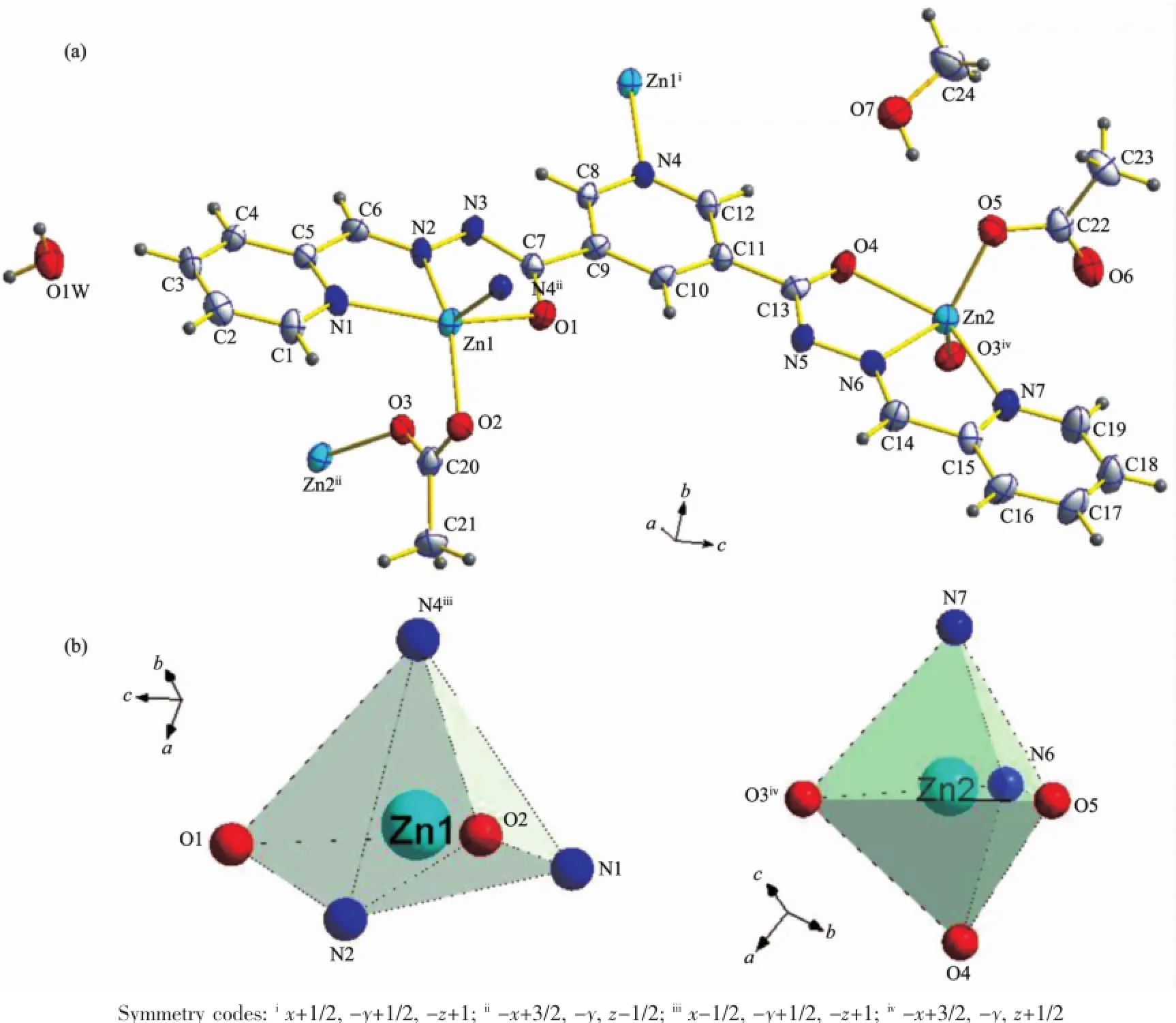
图4 化合物2的结构:(a)Zn2+离子的配位环境(30%的椭球率);(b)两个Zn2+离子配位多面体图Fig.4Structures of 2:(a)Coordination environment of Zn2+ion(showing 30%probability displacement ellipsoids); (b)Coordination polyhedron of two Zn2+ions
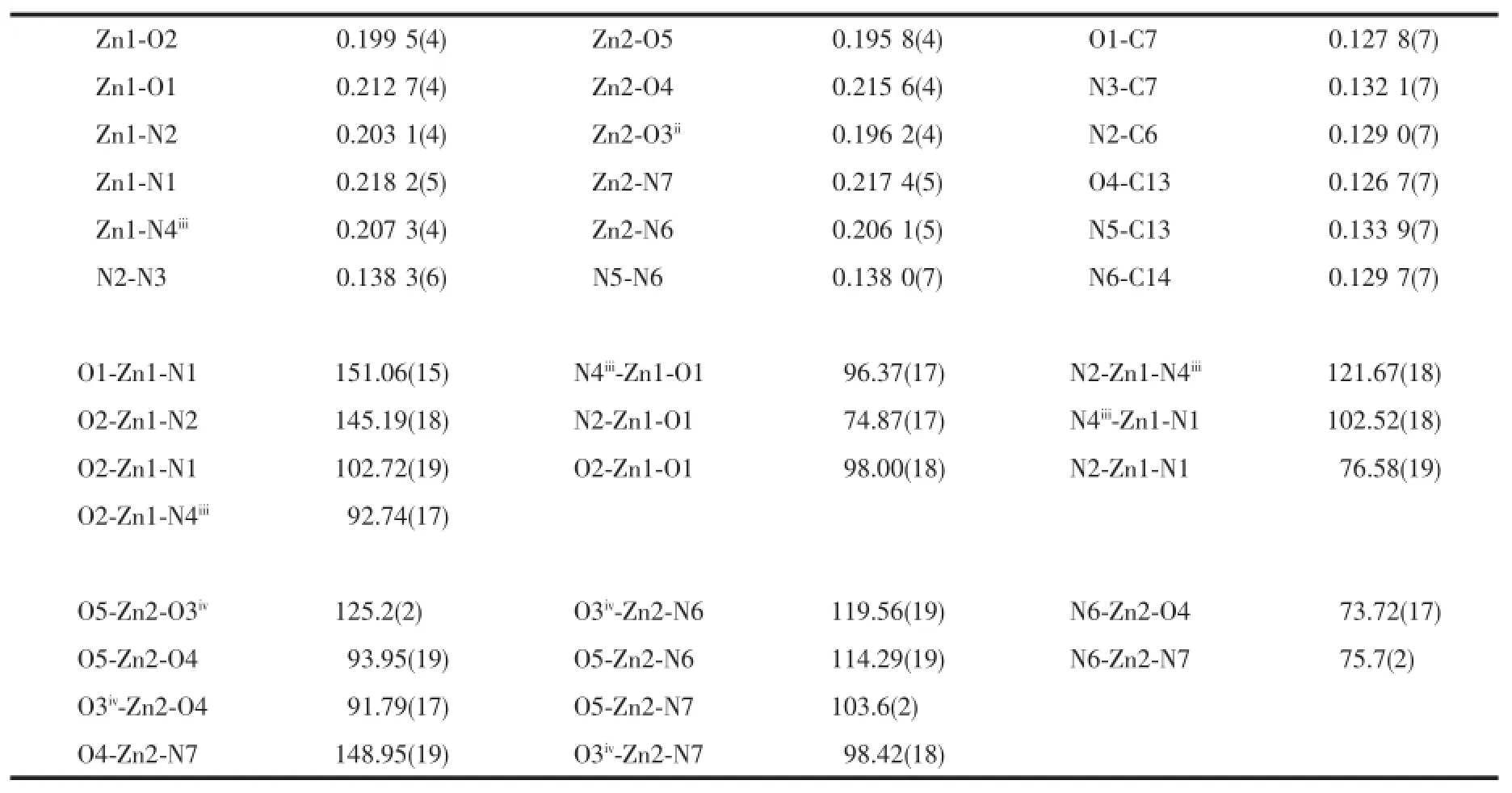
表4 化合物2的键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)for compound 2
Zn-N键键长在0.203 1(4)~0.218 2(5)nm之间(表4),属于正常Zn-N配位键。Zn-O键键长在0.195 8(4)~0.215 6(4)nm之间,其中Zn1-O2为0.199 5(4)nm,Zn2-O3键长为0.196 2(4)nm,O2和O3来自于双齿桥联的醋酸根,与同类相比偏短,类似报道的键长多数在0.198~0.202 nm[19];Zn2-O5键长为0.195 8(4)nm,O5来自于单齿配位的醋酸根,与同类相比也偏短,类似报道的键长多数在0.196~0.199 nm[20],说明此配合物中双齿桥联和单齿配位较稳定。
形成配位化合物后,配体分子的共面性增强(图5)。配体分子中的Ⅱ平面、Ⅲ平面中各原子与其最小二乘平面距离的平均偏差值分别为0.005 79、0.003 63 nm(未配位之前分别为0.006 13、0.003 87 nm),Ⅱ、Ⅲ平面与Ⅰ平面的二面角分别为4.5(2)°和3.3(2)°(未配位之前分别为30.7(1)°、24.4(1)°),可见形成配合物后共面性增强,且Ⅲ平面与Ⅰ平面几乎共面。羰基O1-C7及O4-C13的键长分别为0.127 8(7)、0.126 7(7)nm,与未配位之前的羰基C=O键长(0.122 3(3)、0.122 0(3)nm)相比略长;同样,亚胺基N2-C6及N6-C14的键长分别为0.129 0(7)、0.129 7(7) nm,比未配位之前的键长(0.126 5(3)nm)略长。由于羰基的O1、O4以及亚胺基的N2、N6参与配位,共面性增强,双键键长变长,配合物配体中的羰基IR特征吸收峰在IR谱图上消失了。

图5 化合物2中配体分子的3个共轭平面Fig.5Three conjugate planes of the ligand in compound 2
与锌离子Zn1配位的原子来源于2个配体,与锌离子Zn2配位的原子来源于第3个配体,Zn1与Zn2通过醋酸根双齿桥联连接起来,每个配体与3个锌离子配位,整个分子通过配位键形成三维变形蜂窝网状超分子结构(图6a,图中省略了氢原子和客体甲醇及水分子)。该三维网格中孔穴由单股右手螺旋链构成(图6b,图中省略了部分原子),其螺旋周期为1.094 88(6)nm。相邻孔穴螺旋链有两种排列方式:沿b轴方向相邻的螺旋链通过Zn1-N4配位键连接(见图6c);沿c轴方向相邻的螺旋链通过C7-C9共价键连接(图6d)。

图6 化合物2的结构:(a)三维网状结构沿a轴观察的透视图;(b)网络结构中包含的右手单股螺旋;(c)沿b轴方向相邻的螺旋链通过Zn1-N4配位键连接;(d)沿c轴方向相邻的螺旋链通过C7-C9共价键连接Fig.6Structures of 2:(a)3D supramolecular net structure viewed along the crystallographic a axis;(b)Supramolecular structure contains single-stranded right-handed helical chain;(c)Neighboring helical chain connection through Zn1-N4 coordination bond along the crystallographic b axis(d)Neighboring helical chain connection through C7-C9 covalent bond along the crystallographic c axis

表5 化合物2的氢键键长(nm)和键角(°)Table 3Parameters of hydrogen bonds for the compound 2
配合物晶体中也存在弱的氢键作用,增强了结构的稳定性。化合物2晶体中弱的氢键作用见图7。客体甲醇的O原子分别与相邻2个配体链端吡啶环碳上的H原子形成了C-H…O弱氢键(C1-H1…O7iii,D-A为0.334 0(9)nm;C16-H16…O7v,D-A为0.335 0(10)nm);客体甲醇氧上的H原子与相邻单齿配位的醋酸根参与配位的O原子形成了C-H…O弱氢键(O7-H7…O5,D-A为0.300 5(7)nm);客体水的H原子分别与相邻配体链端吡啶环碳上的H原子及单齿配位的醋酸根未参与配位的O原子形成了O-H…O弱氢键(O1W-H1X…O1ii,D-A为0.311 5(7)nm;O1W-H1Y…O6vi,D-A为0.287 7(8) nm)。氢键的键长和键角见表5。客体甲醇和客体水以氢键作用填充在网络孔隙中,如图7所示。
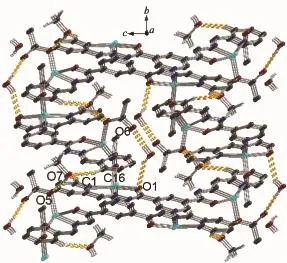
图7 化合物2中配体分子间氢键作用(虚线)Fig.7Hydrogen bonding(dash line)between the ligand molecules in compound 2
2.3化合物2的TGA和XRD的分析
化合物2的DTA-TGA分析表明(图8),在130℃之前有2个小的吸热峰,失重约9.94%,可以认为是由于晶体失去了表面吸附水和结晶水及甲醇导致的(理论值7.46%)。在330℃之后配位聚合物骨架逐渐坍塌。400℃时失重45.54%,在此过程中,分子间作用力、分子间氢键以及分子内化学键都发生了强烈地断裂。640℃后逐渐趋于恒重,残重24.97%,估计残余物为氧化锌ZnO(理论值24.28%)。
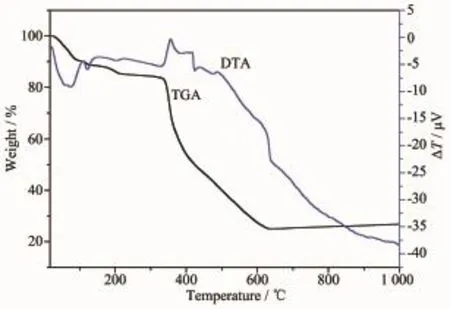
图8 化合物2的DTA-TGA图Fig.8DTA-TGA curves of compound 2
此外,对化合物2进行了粉末XRD表征,来验证配位聚合物的纯度。结果如图9所示,粉末XRD图与单晶结构模拟图基本吻合,表明了所得的配位聚合物粉末为纯相。
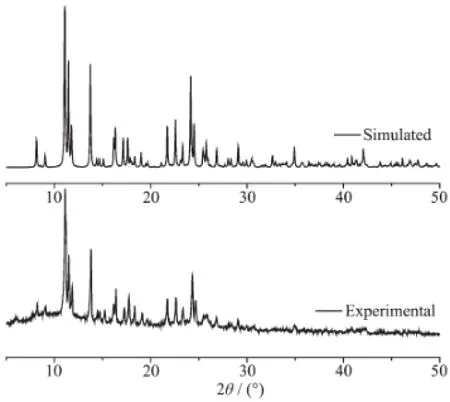
图9 化合物2的粉末X射线衍射图Fig.9Experimental and simulated PXRD patterns of compound 2
2.4化合物1和2的紫外可见光谱及分析
对配体及其配位聚合物进行了固体紫外可见漫反射测试,结果如图10、11所示。从图10中可以看到,275、345 nm的吸收带为配体共轭体系的π→π*电子跃迁,n→π*电子跃迁被宽的吸收带淹没;形成锌配合物2后(图11),π→π*电子跃迁分别红移至340、410 nm。
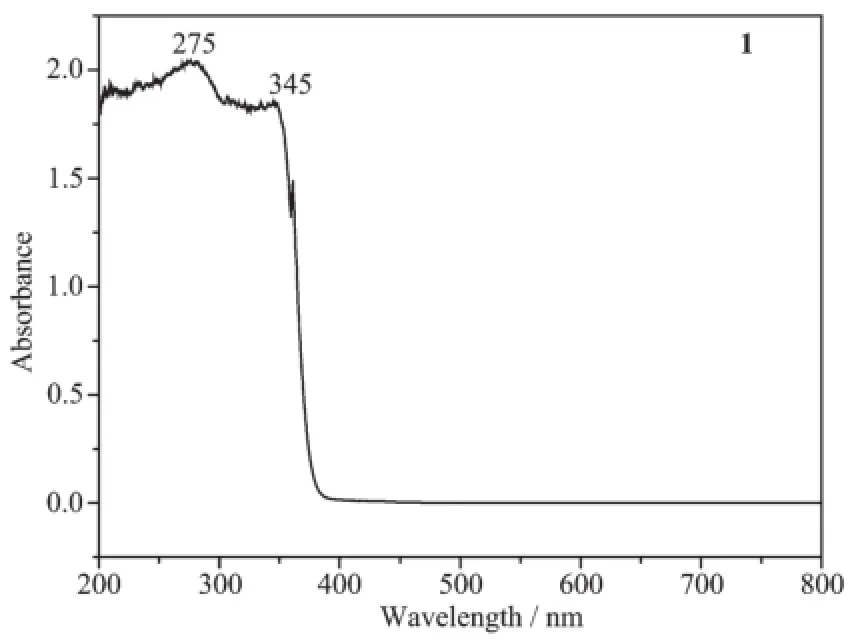
图10 化合物1的紫外-可见光谱图Fig.10UV-Vis spectrum of compound 1
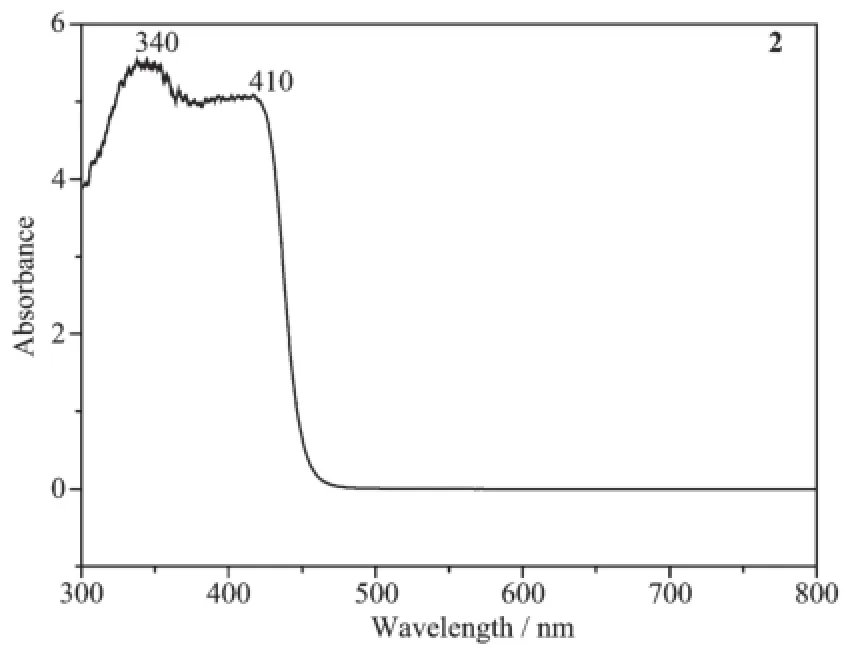
图11 化合物2的紫外-可见光谱图Fig.11UV-Vis spectrum of compound 2
2.5化合物1和2的荧光性质及分析
Zn2+锌离子是d10型电子结构,此类金属配位化合物发光类型属于金属微扰的配体发光,即L*-L型。从图12可以看出,在固态状态下用波长为390 nm的光作为激发光,配体1具有荧光,最大发射波长为470 nm,该发射峰可归结为配体中的π*→π电子转移。当配体与锌离子配位形成配合物2后,其固体荧光性质发生了较大变化,用波长为397 nm的光作为激发光,该配合物最大发射波长为510 nm,相对于配体有40 nm的红移,这主要是由于配体内部的电子跃迁造成的,由于形成配合物后配体分子共面性增强而发生了红移。

图12 化合物1和2的固态室温荧光发射光谱图Fig.12Fluorescent emission spectra of the compounds 1 and 2 in the solid state at room temperature
[1]Sadhukhana D,Raya A,Butcherbet R J,et al.Inorg.Chim. Acta,2011,376:245-254
[2]Moon S Y,Park K H,Lee H,et al.J.Mol.Struct.,2013,1048: 282-286
[3]WAN Hong-Xiang(万洪祥),JU Wei-Wei(鞠伟伟),ZHANG Yu(张宇),et al.Chinese J.Inorg.Chem.(无机化学学报), 2014,30(1):85-92
[4]Mihalcea I,Zill N,Mereacre V,et al.Cryst.Growth Des., 2014,14(9):729-4734
[5]Wen Y H,Sheng T L,Xue Z Z,et al.Cryst.Growth Des., 2014,14(12):6230-6238
[6]Jahromi B T,Kharat A N,Zamanian S.Chin.Chem.Lett., 2015,26:137-140
[7]Wu W P,Liu P,Liang Y T,et al.J.Solid State Chem.,2015, 228:124-130
[8]Khlobystov A N,Blake A J,Champness N R,et al.Coord. Chem.Rev.,2001,222:155-192
[9]Goswami A,Bala S,Pachfule P,et al.Cryst.Growth Des., 2013,13(12):5487-5498
[10]Yang G S,Liu C B,Liu H,et al.J.Solid State Chem.,2015, 225:391-401
[11]Wang X L,Chen N L,Liu G C,et al.Inorg.Chim.Acta, 2015,432:128-135
[12]Li L,Liu C B,Yang G S,et al.J.Solid State Chem.,2015, 231:70-79
[13]Zhang Z L,Yao X Q,An N,et al.Inorg.Chem.Commun., 2014,45:127-130
[14]Wang X L,Chen N L,Liu G C,et al.Inorg.Chim.Acta, 2014,421:473-480
[15]Huang Y M,Wu W S,Wang X Y.Acta Crystallogr.Sect.E, 2012,E68:m783
[16]Sheldrick G M.SHELXL-97,Program for the Refinement of Crystal Structures,University of Göttingen,Germany,1997.
[17]Sheldrick G M.Acta Crystallogr.Sect.A,2008,A64:112-122
[18]Bourhis L J,Dolomanov O V,Gildea R J,et al.Acta Crystallogr.Sect.A,2015,A71:59-75
[19](a)Peng X H,Tang H L,Qin W W,et al.Discuss.Faraday Soc.,2011,40:5271-5277 (b)Li W H.J.Chem.Cryst.,2011,41:1198-1201 (c)Lu X P,Zhu M L,Lu L P.Acta.Crystallogr.Sect.E, 2009,E65:m729-m730 (d)Wenzenberg S J,Escudero-Adan E C,Benet-Buchholz J,et al.Chem.Eur.J.,2009,15:5695-5700 (e)Wang C Y.J.Coord.Chem.,2009,62(17):2860-2868 (f)Kumar D K,Das A,Dastidar P.CrystEngComm,2007,9: 548-555 (g)Toh N L,Nagarathinam M,Vittal J J.Angew.Chem.Int. Ed.Engl.,2005,44:2237-2241
[20](a)Prince R B,Okada T,Moore J S.Angew.Chem.,1999, 111:245-249 (b)Nelson J C,Saven J G,Moore J S,et al.Science,1997, 277:1793-1796 (c)Karle I L,Ranganathan D,Haridas V.J.Am.Chem.Soc., 1997,119(12):2777-2783 (d)Dai Y J,Katz T J,Nichols D A.Angew.Chem.,1996,108: 2230-2232 (e)Kimizuka N,Kawasaki T,Hirata K,et al.J.Am.Chem. Soc.,1995,117(23):6360-6361 (f)Geib S J,Vicent C,Fan E,et al.Angew.Chem.,1993,105: 83-85
Syntheses,Crystal Structures and Luminescence Properties of Zinc Helical Coordination Polymer Based on Semirigid V-Shaped Pyridine-3,5-dimethylhydrazones
SHI Feng-Xiang1,2WU Wen-Shi*,1HUANG Miao-Ling1
(1College of Materials Sciences&Engineering,Huaqiao University,Xiamen,Fujian 361021,China)
(1Kaili University,Kaili,Guizhou 556011,China)
The ligand N,N′-bis((2′-pyridyl)methylene)pyridine-3,5-dicarbohydrazide(bpmphz,1),and its Zinc(Ⅱ)helical coordination polymer{[Zn2(bpmphz)(Ac)2]·CH3OH·H2O}n(2),were synthesized and theirs crystal structures were determined by X-ray diffraction analysis.The ligand 1 crystalizes in orthorhombic,space group Pcca with a=2.016 3(1)nm,b=1.002 34(6)nm,c=1.995 86(8)nm,V=4.033 6(4)nm3,Z=8,Mr=405.42,Dc=1.335 g·cm-3,μ= 0.095 mm-1,and features 1D layer structure.The complex 2 crystalizes in orthorhombic,space group P212121with a=1.094 88(6)nm,b=1.173 12(6)nm,c=2.168 6(1)nm,V=2.785 5(3)nm3,Z=4,Mr=670.25,Dc=1.598 g·cm-3,μ= 1.782 mm-1,and features 3D layer structure.They have been characterized by elemental analysis,IR,UV-Vis spectra and thermogravimetric and the fluorescence property of the compounds were investigated,which results showed that the compounds 1 and 2 exhibit luminescence with emission maximum at 470 and 510 nm at room temperature,respectively.CCDC:1425589,1;1033001,2.
crystal structure;Zn(Ⅱ)coordination polymer;fluorescence properties
O614.24+1
A
1001-4861(2016)08-1327-10
10.11862/CJIC.2016.171
2015-12-09。收修改稿日期:2016-05-29。
福建省厦门市科技计划项目(No.3502Z20133025)、中央高校基本科研业务费、福建省教育厅基金(No.JA14261)和华侨大学交叉学科培育建设基金(No.JB-JC1003)资助项目。
*通信联系人。E-mail:wws@hqu.edu.cn
