泰国斗鱼神经肽Y基因的克隆及组织表达研究
2016-12-06吴沅沅吴静娴劳键潼李广丽陈华谱
吴沅沅,贺 超,洪 广,吴静娴,劳键潼,李广丽,陈华谱,黄 海
(1.广东海洋大学 水产学院 海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.海南热带海洋学院, 海南 三亚 572022)
泰国斗鱼神经肽Y基因的克隆及组织表达研究
吴沅沅1,贺 超1,洪 广1,吴静娴1,劳键潼1,李广丽1,陈华谱1,黄 海2
(1.广东海洋大学 水产学院 海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.海南热带海洋学院, 海南 三亚 572022)
利用Smart-RACE的方法,从泰国斗鱼(Betta splendens)脑中克隆得到了神经肽Y(Neuropeptide Y,NPY)的cDNA全长序列.泰国斗鱼NPY基因的 cDNA序列为506bp,其中开放读码框300bp,编码99个氨基酸.氨基酸比对分析显示NPY成熟肽的氨基酸序列较保守.通过系统进化树分析,泰国斗鱼NPY与鲈形目鲈鱼等的亲缘关系最近,但鱼类的NPY分子进化分为两个相对独立的分支,显示出独特的特点.利用RT-PCR进行泰国斗鱼雌雄个体的组织分布分析,结果发现泰国斗鱼NPY mRNA的主要在脑中高表达,并显示出明显的组织特异性及性别差异性.本研究为开展NPY分子进化及后续的功能研究提供了研究基础.
泰国斗鱼;神经肽Y;序列分析;组织分布
0 引言
神经肽Y(Neuropeptide Y,NPY)由36个氨基酸残基组成,并在进化上十分保守.胰多肽家族除了NPY外,还包括神经肽YY(PYY)、四足动物的胰多肽(PP)和鱼胰多肽Y等[1].目前,NPY已经在众多脊椎动物中开展了生理功能的研究,并证实其在摄食、能量代谢、生殖调控、生殖行为、血压调节、交感神经和节律调节中具有重要的生理功能[2-4].其中NPY在摄食与能量代谢中的生理功能最受关注,被认为是上游摄食神经内分泌调控的主导因子之一,发挥着促进摄食的关键性作用[5].
鱼类是种类最多的脊椎动物群体,并逐渐成为生理研究的重要研究对象.目前,NPY基因已经在金鱼[6],虹鳟[7],石斑鱼[8],罗非鱼[9],鳜鱼[10],大西洋鳕[11]、象鲨鱼[12]、鳗鲡[13]和牙鲆[14]等鱼类中克隆鉴定出来,并展开了组织分布相关的研究.在众多的结果中发现,NPY主要分布在脑中,外周组织中也有分布,但存在着物种间的差异性.例如,在鳜鱼中,NPY在脑中的表达最高,其次为肾脏和肝脏,而其他组织表达量相对较低[10].在斜带石斑鱼中,NPY除了在脑中高表达外,在眼睛、胸腺、胃和卵巢等外周组织中的表达量也较高[8];在鳗鲡中,NPY除了在脑中高表达外,性腺和肠的表达量也较高,而脾脏和胃的表达量较低[13];在牙鲆中,只在脑中检测到NPY的表达[14].从中可看出,作为神经内分泌调控因子的NPY 主要表达于中枢神经系统中,而在外周组织中的分布具有明显的物种差异性.这可能是由于鱼类的种类繁多,生理特性具有多样性,从而导致不同鱼类之间的NPY的表达分布存在着差异,因此,为了更好地了解鱼类NPY的生理功能,还需要在更多的鱼类中开展进一步的研究.
泰国斗鱼(Betta splendens)是一种小型热带淡水观赏鱼类,因其色彩艳丽、体形多姿,容易饲养,备受众多消费者青睐.但目前对泰国斗鱼研究尚少,关于它的内分泌调控机理尚未清楚.本文以泰国斗鱼为研究对象,利用现代分子克隆技术手段,克隆鉴定出神经肽Y的cDNA序列,并开展了序列分析及组织分布研究,为探讨NPY基因在泰国斗鱼中的生理功能提供研究基础.
1 材料与方法
1.1实验鱼
实验中所用到的泰国斗鱼购买于广东省湛江市霞山区花鸟市场,经冰上深度麻醉处理后,将其脑、性腺、垂体、心脏、肌肉、肝、肾、脾、肠等组织器官取出,并立即置于液氮保存,用于总RNA提取.
1.2试剂
总RNA提取试剂使用的Trizol Reagent(Life, USA); 去除基因组DNA用的DNaseⅠ和反转录用的The ReverTra Ace-、肾、脾、肠等组织器官取出神经和节律调节中具有重要的生理功能it试剂盒(TOYOBO,Japan);基因克隆的Smart-RACE试剂盒(Takara,Japan);Taq酶和载体pTZ7R/T购于中国天根公司;质粒提取和胶回收试剂盒为中国东盛公司产品, 其余化学试剂均为国产分析纯试剂.
1.3引物
通过NCBI 基因库的序列搜索,获得其他相近鱼类NPY基因cDNA序列.通过比对分析,根据保守序列,设计出用于泰国斗鱼NPY基因的SMART-RACE 克隆的引物.

表1 泰国斗鱼NPY基因的克隆与定量分析中所用到的引物
1.4总RNA提取
根据TrizolGCACAGTGT试剂盒(Life, USA)说明书的要求操作,利用注射器将各组织捣碎匀浆.提取总RNA后利用核酸测定仪和琼脂糖凝胶电泳进行浓度与完整度的检测.
1.5分子克隆
利用泰国斗鱼全脑的总RNA作为模板,根据Smart-RCAE 试剂盒(Takara,Japan)的操作步骤,合成NPY基因5因端和3和端的第一链cDNA,通过序列重合来拼接,获得cDNA序列全长. 然后设计开放阅读框全长设计全长特异引物进行全长验证.
1.6序列分析
利用DNAtools 6.0 软件预测出泰国斗鱼NPY基因的开放读码框(Open Reading Frame, ORF),并翻译成相应的氨基酸序列.用NCBI blast比对软件对不同脊椎动物的NPY蛋白前体序列进行同源性分析.利用SignalIP 3.0 网站上预测基因的信号肽.clustalx 1.8和Mega 4.0的软件构建蛋白的系统进化树[15-16].
1.7 组织分布
取泰国斗鱼各组织的总RNA 1 ug,根据DNaseⅠ的使用方法,先去除基因组DNA,然后按照First Strand cDNA Synthesis Kit ReverTra Ace-α(TOYOBO, Japan)的说明书进行合成第一链cDNA模板.利用泰国斗鱼NPY基因的特异引物(图1),并以β以的特异引物基因作为内参进行组织分布的半定量检测.反应体系为25 μ5,循环反应条件为:94℃预变性4 min,94℃变性30 s,58℃退火30 s,72℃延伸1 min,40个循环,、72℃延伸1 min,取8in的pcr产物,进行1%的琼脂糖凝胶电泳,天能Tanon2500R凝胶成像分析系统进行拍照与半定量分析.

图1 泰国斗鱼NPY基因的cDNA序列及其氨基酸序列
2 结果
2.1泰国斗鱼NPY基因的全长cDNA序列
如图1所示,利用Smart-Race分子克隆技术,从泰国斗鱼的脑组织中克隆获得泰国斗鱼NPY基因cDNA全长序列为506 bp,其中5中非编码区36 bp,3p非编码区170 bp,开放阅读框(ORF) 300 bp,编码了含有99个氨基酸的前体蛋白,其N端为含有28个氨基酸残基的信号肽,信号肽之后是含有36个氨基酸残基的NPY成熟肽.

图2 不同脊椎动物NPY蛋白前体的氨基酸序列比对
起始密码子和终止密码子用方框标示;前体蛋白信号肽用下划线表示;NPY的36个氨基酸成熟肽序列用粗体与灰色背景表示.
2.2泰国斗鱼NPY的氨基酸序列比对及同源性分析
不同物种的NPY氨基酸序列比对分析显示,不仅各物种NPY蛋白前体的氨基酸残基数目相似,而且NPY成熟肽的氨基酸序列从低等的鱼类到高等的人类都具有很高的保守性(图2).
泰国斗鱼NPY蛋白前体的氨基酸序列与其他物种的NPY序列进行同源性分析显示,泰国斗鱼NPY与鲈鱼NPY的氨基酸同源性最高,达到97%;与罗非鱼和青鱂的同源性分别达到94%和92%;与鸡、小鼠和人的同源性均达到70%以上,但与斑马鱼、金鱼和中华倒刺鲃等少数鱼类的同源性只有60%左右(表2).
NCBI数据库中各鱼类NPY蛋白前体序列的登陆号分别为:nDic(鲈鱼):CAB64932.1;nRac(军曹鱼):AGN03939.1;nSer(鰤鱼):BAN10296;nEpi(斜带石斑鱼):AAT48713.1;nPse(美洲拟鲽):ACH42755.1;nChe(波纹唇鱼):AJP08708.1;nPoe(多育苔花鳉):JAO59368.1;nSin (鱖鱼):ABS83815.1;nMon(黄鳝):AEX97166.1;nGad(大西洋鳕):ABB79923.1;nLeu (虾虎鱼):BAK09590.2;nHom (人类):NP _000896.1;nRat(褐家鼠):NP_036746.1;nGal(鸡):NP_990804.1;nCar(银鲫):AFB69326.1;nSpi(中华倒刺鲃):ABE73783.1;nCte(草鱼):AGI44276.1;nMyx(胭脂鱼):ABQ53144.1;nDan(斑马鱼):AAI62071.1;nTac(黄颡鱼):AGM46557.1;下划线部分为NPY 成熟肽.
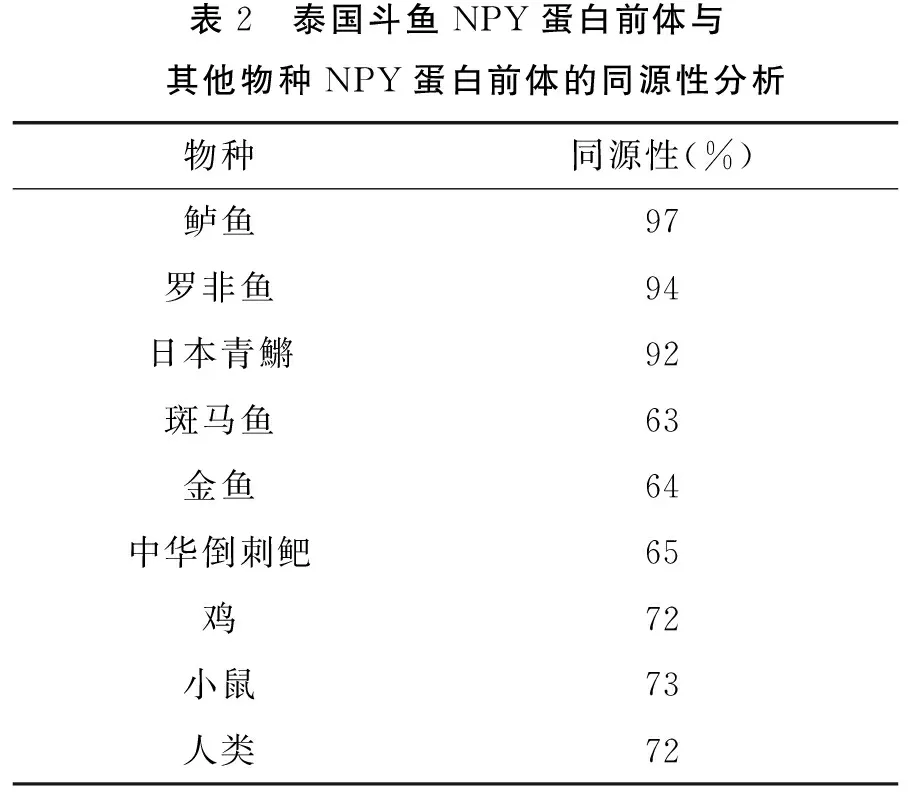
表2 泰国斗鱼NPY蛋白前体与 其他物种NPY蛋白前体的同源性分析物种同源性(%)鲈鱼97罗非鱼94日本青鱂92斑马鱼63金鱼64中华倒刺鲃65鸡72小鼠73人类72
2.3 泰国斗鱼NPY 蛋白的系统进化树分析
利用邻接法构建泰国斗鱼等脊椎动物NPY 的系统进化树(图3),结果显示,鱼类的NPY蛋白分为明显的两个进化分支:一支是由泰国斗鱼、鲈鱼、军曹鱼和斜带石斑鱼等绝大多数鱼类组成,并与鸡、小鼠和人类等高等脊椎动物相聚类;另一支由斑马鱼、金鱼和黄颡鱼等鱼类组成,并独立于泰国斗鱼和人类等物种的聚类.根据系统进化树,泰国斗鱼的NPY与鲈鱼和军曹鱼的亲缘关系较近,但与斑马鱼、金鱼和黄颡鱼等鱼类的进化亲缘关系较远,甚至比人类的亲缘关系还要远.

图3 不同脊椎动物NPY的系统进化树分析
系统树中结点处数值代表10,000次评估的自举检验置信度.各物种的NPY蛋白在NCBI数据库中登陆号分别为:Dicentrarchuslabrax(鲈鱼):CAB64932.1;Rachycentroncanadum(军曹鱼):AGN03939.1;Seriolaquinqueradiata(鰤鱼):BAN10296.1;Poeciliopsisprolifica(多育若花鳉):JAO59368.1;Lateolabraxjaponicus(花鲈):AIK01745.1;Epinepheluscoioides(斜带石斑鱼):AAT48713.1;Cheilinusundulatus(波纹唇鱼):AJP08708.1;Pseudopleuronectesamericanus(美洲拟鲽):ACH42755.1;Sinipercachuatsi(鳜鱼):ABS83815.1;Monopterusalbus(黄鳝):AEX97166.1;Micropterussalmoides(加州鲈):ALC04308.1;Gadusmorhua(大西洋鳕):ABB79923.1;Leucopsarionpetersii(虾虎鱼):BAK09590.2;Gallusgallus(鸡):NP_990804.1;Homosapiens(人类):NP_000896.1;Rattusnorvegicus(褐家鼠):NP_036746.1;Tachysurusfulvidraco(黄颡鱼):AGM46557.1;Myxocyprinusasiaticus(胭脂鱼):ABQ53144.1;Daniorerio(斑马鱼):AAI62071.1;Ctenopharyngodonidella(草鱼):AGI44276.1;Carassiusgibelio(银鲫):AFB69326.1;Spinibarbussinensis(中华倒刺鲃):ABE73783.1.2.4泰国斗鱼NPY基因的组织分布
利用RT-PCR半定量的方法分析NPY基因在泰国斗鱼雌雄个体不同组织中的表达情况.在雌性中,NPY在脑中的表达量最高,其次是肾脏、垂体、肝脏和性腺,而在胃、心脏、肌肉和肠中均未检测到表达信号.在雄性中,NPY在脑中的表达量最高,其次是垂体和性腺,而在肝脏、肾脏、脾脏、心脏、肌肉和肠中均没有检测到表达信号.
B为全脑,P为垂体,L为肝脏,Go为性腺,K为肾脏,S为脾脏,H为心脏,M为肌肉,I为肠.β肠肉组织中的基因为内参对照.
3 讨论
NPY蛋白前体从低等的鱼类到高等的人类中,蛋白前体序列的长度与大小相似,并在N端具有与蛋白分泌相关的信号肽序列,属于典型的分泌型蛋白[17].本研究利用现代分子克隆技术获得泰国斗鱼NPY基因的cDNA序列全长,并进行序列结构分析,结果表明泰国斗鱼NPY成熟肽和其他物种的NPY成熟肽一样,均由36个氨基酸残基组成[5-14],并保持着较高的序列同源性,显示出保守的结构特征,从而预示着泰国斗鱼NPY和其他物种的一样,具有保守的生理功能[1-3].

图4 泰国斗鱼NPY mRNA在不同组织中的表达情况
NPY蛋白前体的同源性和系统进化树分析结果显示,NPY分子进化具有独特之处.泰国斗鱼与鲈鱼等的同源性均达到90%以上,但与斑马鱼、金鱼和黄颡鱼等部分鱼类的同源性较低,甚至低于与高等哺乳动物的同源性,显示出鱼类NPY分子进化的差异[18-19].另外,通过分子系统进化树的结果,发现鱼类的NPY分子在进化上分成了两个相对独立的进化分支.泰国斗鱼、鲈鱼等鱼类与人类的亲缘关系比与斑马鱼的还要近.如此显著的进化差异与通常的物种进化地位不相符[20].根据同源性和系统进化树的结果,本文克隆获得的泰国斗鱼NPY序列与其他绝大多数物种(包括低等到高等脊椎动物)相聚类,应属于传统的NPY家族成员.但在斑马鱼等鱼类的另一个分支中,同样含有高保守的36个氨基酸NPY成熟肽,也符合NPY家族成员的特征.因此,在脊椎动物中可能存在两种NPY亚型,但由于在物种进化过程中可能发生了基因的缺失而导致NPY亚型的丢失.造成不同物种的NPY在同源性和进化上显示出了明显的差异,这与在建鲤鱼中的推论相一致[21].
在泰国斗鱼中,NPY基因具有显著的组织表达特异性,预示NPY在不同组织中发挥着不同的生理功能[3-4].同时,NPY也显示出性别表达差异,从而表明NPY在雌雄个体中的功能差异,这与鳗鲡等鱼类的研究结果相似[13].泰国斗鱼NPY基因在脑中的表达量最高,与其他物种的NPY表达情况相一致[10-14],表明NPY在发挥上游神经内分泌调控功能上的保守性.NPY在鱼类脑中的高表达是共性,但在其他组织中的表达情况却存在种间差异.在鳜鱼中,NPY在脑中表达最高,其次为肾脏和肝脏,其他组织表达量相对较低[10].在斜带石斑鱼中,NPY除脑组织外,在眼睛、胸腺、胃和卵巢等组织中同样具有较高的表达量[8];在鳗鲡中,NPY在脑、性腺和肠的表达量较高,而脾脏和胃的表达量较低[13].不同鱼类NPY的表达差异性说明了NPY除了在神经内分泌调控上具有重要作用外,还可能发挥着其他生理功能,其作用机制还有待深入研究.
本文从泰国斗鱼中克隆鉴定出NPY基因的cDNA序列全长,并进行序列分析及其在雌雄个体不同组织中的分布研究,结果表明泰国斗鱼NPY具有保守的结构特征,其组织表达具有显著的组织表达特异性及性别差异性,这为深入探讨NPY基因的分子进化及生理功能提供了初步的研究基础.
[1]Hoyle CHV. Neuropeptide families and their receptors: evolutionary perspectives [J].Brain Research, 1999, 848: 1-25.
[2]Dan L. Evolution of neuropeptide Y, peptide YY and pancreatic polypeptide [J].Regulatory Peptides, 1996, 62: 1-11.
[3]Cerdá-Reverter JM, Larhammar D. Neuropeptide Y family of peptides: structure, anatomical expression, function, and molecular evolution [J].Biochemistry and Cell Biology, 2000, 78: 371-392.
[4]Borbély, Scheich B, Helyes Z. Neuropeptides in learning and memory [J].Neuropeptides, 2013, 47: 439-50.
[5]Gumbs MCR, Heuvel JKVD, Fleur SEL. The effect of obesogenic diets on brain Neuropeptide Y [J].Physiology and Behavior, 2016, 162: 161-173.
[6]Blomqvist AG, Soderberg C, Lundell I, et al. Strong evolutionary conservation of neuropeptide Y: sequences of chicken, goldfish, and Torpedo marmorata DNA clones [J].Proceedings of the National Academy of Sciences, 1992, 89: 2350-2354.
[7]Doyon C, Gilmour KM, Trudeau VL, et al. Corticotropin-releasing factor and neuropeptide Y mRNA levels are elevated in the preoptic area of socially subordinate rainbow trout [J].General and Comparative Endocrinology, 2003, 133: 260-271.
[8]Rong C, Li W, Lin H. cDNA cloning and mRNA expression of neuropeptide Y in orange spotted grouper, Epinephelus coioides [J].Comparative Biochemistry and Physiology, 2005, 142: 79-89.
[9]Carpio Y, Acosta J, Morales A, et al. Cloning, expression and growth promoting action of Red tilapia (Oreochromis sp.) neuropeptide Y [J].Peptides, 2006, 27: 710-718.
[10]Liang XF, Li GZ, Yao W, et al. Molecular characterization of neuropeptide Y gene in Chinese perch, an acanthomorph fish [J].Comparative Biochemistry and Physiology, 2007, 148: 55-64.
[11]Kehoe AS, Volkoff H. Cloning and characterization of neuropeptide Y (NPY) and cocaine and amphetamine regulated transcript (CART) in Atlantic cod (Gadus morhua) [J].Comparative Biochemistry and Physiology, 2007, 146: 451-461.
[12]Larsson TA, Tay BH, Sundstr?m G, et al. Neuropeptide Y-family peptides and receptors in the elephant shark, Callorhinchus milii confirm gene duplications before the gnathostome radiation [J].Genomics, 2009, 93: 254-260.
[13]Li S, Zhao L, Xiao L, et al. Structural and functional characterization of neuropeptide Y in a primitive teleost, the Japanese eel (Anguillajaponica ) [J].General and Comparative Endocrinology, 2012, 179: 99-106.
[14]Wang Q, Tan XG, Du SJ, et al. Characterization, tissue distribution, and expression of neuropeptide Yin olive flounder Paralichthys olivaceus [J].Chinese Journal of Oceanology and Limnology, 2015, 33: 553-558.
[15]Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. [J].Nucleic Acids Research, 1994, 22: 4673-4680.
[16]Kumar S, Tamura K, Nei M. MEGA3: Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment [J].Briefings in Bioinformatics, 2004, 5: 150-163.
[17]Sundstr?m G, Larsson TA, Brenner S, et al.. Evolution of the neuropeptide Y family: New genes by chromosome duplications in early vertebrates and in teleost fishes [J].General and Comparative Endocrinology, 2008, 155: 705-716.
[18]Mathieu M, Tagliafierro G, Bruzzone F, et al. Neuropeptide tyrosine-like immunoreactive system in the brain, olfactory organ and retina of the zebrafish, Danio rerio, during development [J].Developmental Brain Research, 2003, 139: 255-265.
[19]Narnaware YK, Peter RE. Effects of food deprivation and refeeding on neuropeptide Y (NPY) mRNA levels in goldfish [J].Comparative Biochemistry and Physiology, 2001, 129: 633-637.
[20]谢平. 生命的起源-进化理论之扬弃与革新[M].北京:科学出版社,2014.
[21]Tang Y, Li H, Li J, et al. Characterization and expression analysis of two distinct neuropeptide Ya paralogues in Jian carp (Cyprinuscarpio var. Jian) [J].Fish Physiology and Biochemistry, 2014, 40: 1709-1719.
(编校:李由明)
Molecular Cloning and Tissue Expression of Neuropeptide Y in Thailand Betta,Bettasplendens
WU Yuan-yuan1, HE Chao1, HONG Guang1,WU Jing-xian1,LAO Jian-tong1, LI Guang-li1, CHEN Hua-pu1, HUANG Hai2
(1. Fisheries College, Guangdong Ocean University, Zhanjiang Guangdong 524088, China; 2.Hainan Tropical Ocean University, Sanya Hainan 572022, China )
The cDNA sequences of Thailand betta(Bettasplendens) neuropeptide Y (NPY) were cloned with the rapid-amplification of cDNA ends (RACE). The NPY cDNA sequence contains 506 bp nucleotides with the open reading frame (ORF) of 300 bp, encoding a putative protein of 99 amino-acid residues. The sequence alignment shows low similarity in the NPY precursor proteins among vertebrates, but is highly conservative in the NPY mature peptide domains. According to the phylogenetic analysis, the Thailand betta NPY was more closely related to other perciformes fishes, while the molecular evolution of fish NPY develops into two distinct branches. Tissue distribution analysis by RT-PCR revealed that the Thailand betta NPY showed the evident tissue-specific profiles in both male and female. The preliminary information is provided by the present study for the molecular evolution and functional study of NPY.
bettasplendens; neuropeptide Y; sequence analysis; tissue distribution
2016-09-27
海南省科技合作专项(KJHZ2015-08);广东省海洋渔业科技推广专项(A201408A06);广东海洋大学“海之帆—起航计划”大学生科技创新培育专项(hzfqhjhzrkx2015b15)
陈华谱(1983-),男,广东湛江人,广东海洋大学水产学院讲师,博士,研究方向为鱼类生理与繁殖.
S917.4
A
1008-6722(2016) 05-0011-06
10.13307/j.issn.1008-6722.2016.05.03
