主-被动靶向细胞内还原引发释放的聚合物纳米胶束抗癌药物
2016-12-06袁建超宋开润骆雯博
袁建超,宋开润,骆雯博
(西北师范大学化学化工学院,甘肃兰州 730070)
主-被动靶向细胞内还原引发释放的聚合物纳米胶束抗癌药物
袁建超,宋开润,骆雯博
(西北师范大学化学化工学院,甘肃兰州 730070)
先用开环聚合(ROP)合成大分子的RAFT试剂(PCL-SS-DMP),然后采用可逆加成-断裂链转移(RAFT)法,合成了亲水性的N-(2-羟丙基)甲基丙烯酰胺(HPMA)和主动靶向配体叶酸单体丙烯酰胺-叶酸(AA-FA),制备了具有主动靶向还原敏感性的两亲性嵌段共聚物(PCL-SS-b-PHPMA-b-PFA),用核磁共振(1HNMR)对其结构进行表征.此共聚物在水溶液中可自组装形成聚合物胶束,由透射电子显微镜(TEM)和动态光散射(DLS)表征可知胶束为尺寸约100 nm 的球形颗粒,用DLS观察到胶束粒径在10 mmol 二硫苏糖醇作用下随时间的增加而逐渐增大.以抗癌药物阿霉素(DOX)为模型药物,研究载药胶束在模拟人体环境中的控释行为.用四氮唑盐还原法(MTT)研究不同浓度的聚合物胶束对人宫颈癌HeLa细胞的细胞毒性,并评价载药胶束在细胞中的抗癌效果.结果表明,PCL-SS-b-PHPMA-b-PFA可作为包载DOX的一种新型纳米材料,载药胶束的体外释放呈明显的还原依赖性,且具有较好的体外抗肿瘤活性,有望成为理想的抗肿瘤药物载体.
主动靶向;还原敏感性;聚合物胶束;阿霉素;细胞毒性
聚合物胶束是近20年来快速发展起来的一种新型纳米载体[1],是由两亲性的聚合物在水中达到临界胶束浓度(CMC)后自组装形成的,具有疏水性内核和亲水性外壳的核-壳结构[2-3].聚合物胶束载药范围广、结构稳定、具有良好的通透性和滞留效应(EPR),能够使药物有效地到达靶点且性能可以精确控制以及聚合物链上具有多种功能基团,疏水性核具有良好的载药及控制药物释放的能力,亲水外壳可以提高胶束的稳定性[4-7].
还原响应性的聚合物胶束是近年来的研究热点[8].氧化还原响应的聚合物胶束通常在聚合物的主链、侧链或交联结构中存在二硫键.二硫键是一种广泛存在于人体的化学键,在体液循环和细胞外介质中能够稳定存在[9-12].谷胱甘肽(GSH)是一种还原性物质,能使二硫键断裂生产硫醇,在细胞外液中含有微摩尔量的GSH,而在细胞内液中GSH的浓度高达10 mmol·L-1左右,是细胞外液的100~1 000倍,从而使得药物在细胞内选择性释放成为可能[13-16].另外,肿瘤细胞中GSH谷胱甘肽(GSH)的浓度远远高于正常组织环境,所以二硫键容易断裂.因此,利用肿瘤细胞内外的谷胱甘肽的浓度差异,使含有二硫键的聚合物胶束实现抗癌药物的控制释放[17-18].
靶向给药的原理是通过药物释放体系选择性地与靶组织在细胞上发生反应,使药物能够可控性的分布[19-20].叶酸(FA)-叶酸受体(FR)靶向系统是由受体介导的内吞途径进入细胞,研究发现叶酸受体在许多组织中难以检测到,并且正常组织中的叶酸受体表达仅限于一些难于进入血液循环的上皮细胞顶膜,但是在肿瘤表面则发现叶酸受体过度表达,如宫颈癌、子宫内膜、直肠癌、乳腺癌、肺癌、肾细胞癌、脑转移上皮癌和神经内分泌癌,因此可以利用叶酸受体进行肿瘤特异性治疗[21-23].以纳米粒子为载体,FA作为靶向配体制成的主动靶向体系,具有毒副作用小,稳定性好,长效缓释以及靶向性等优点[24].然而,具有还原响应性的被动靶向载体已被大量研究,带有叶酸主动靶向还原响应的聚合物胶束应用于载药体系的很少[25],因此有必要继续研究具有这种良好性能的药物载体.
聚己内酯(PCL)是一种疏水性聚合物,可用于组织工程的人体支架、药物释放系统等[26].本文用可逆加成-断裂链转移(RAFT)聚合合成了一种新的主动靶向的还原响应聚合物药物载体,聚合物PCL-SS-b-PHPMA-b-PFA以聚叶酸(PFA)作为主动靶向基团,聚N-(2-羟丙基)甲基丙烯酰胺(PHPMA)作为亲水性的外壳,PCL作为疏水核,自组装形成主动靶向的聚合物胶束,并将其应用于阿霉素(DOX)的药物传输体系中,检测了胶束的还原降解能力与DOX的体外释放实验.同时以HeLa宫颈癌细胞为模型,研究聚合物载药胶束的体外释药.
1 实验部分
1.1 试剂与仪器
N-(2-羟丙基)甲基丙烯酰胺(HPMA)、叶酸(FA,99%)、ε-己内酯(98%)、锌酸亚锡(99%)、烯丙基胺(98%)、双(2-羟基乙基)二硫醚(BHEDS,90%)、2,2′-偶氮二异丁腈(AIBN,99%)、N,N-二环己基碳二亚胺(DCC,99%)、4-二甲基氨基吡啶(DMAP,99%)等均购自北京百灵威科技有限公司;RAFT试剂DMPA的合成参考文献[27];核磁共振氢谱(1HNMR)和碳谱(13CNMR)用Brücker AM 400 型核磁共振仪测定.
1.2 合成部分1.2.1 叶酸功能化单体的合成 称取叶酸(500.0 mg,1.13 mmol)和N,N-二环己基碳二亚胺(233.0 mg,1.13 mmol)溶解于20 mL的DMSO中,置于55 ℃的油浴锅中反应6 h,待叶酸全部转化为叶酸活化酯,然后置于室温,加入4-二甲基氨基吡啶(276.0 mg,2.26 mmol),待完全溶解后,加入烯丙基胺(129 mg,2.26 mmol)反应24 h,过滤除去固体产物(N,N′-二环己基脲)后加入乙酸乙酯沉淀,抽滤,真空干燥,得到叶酸功能化单体380.9 mg,产率70%.1HNMR(400 MHz,DMSO-d6):δ8.61(s,1H,-CH- of heterocyclic),7.61(d,J=8.6 Hz,2H,-CH2NHC6H2H2CONHCH(COOH)CH2CH2CO-),6.63(d,J=8.6 Hz,2H,-CH2NHC6H2H2CONHCH(COOH)CH2CH2CO-),5.87(m,1H,-NHCH2CH=CH2),5.28(dd,J=34.3,13.9 Hz,2H,-NHCH2CH=CH2),4.46(s,2H,-CH2NHC6H4CONHCH(COOH)CH2CH2CO-),4.19(m,1H,-CH2NHC6H4CONHCH(COOH)CH2CH2CO-),3.41(s,2H,-NHCH2CH=CH2),2.23(t,J=7.4 Hz,2H,-CH2NHC6H4CONHCH(COOH)CH2CH2CO-),1.92(m,2H,-CH2NHC6H4CONHCH(COOH)CH2CH2CO-).13CNMR(100 MHZ,DMSO-d6):δ175.42,174.93,166.34,162.43,156.83,154.95,151.00,148.81,136.35,132.52,129.04,122.23,119.31,111.63,53.33,46.35,41.65,32.11,28.06.
1.2.2 合成RAFT引发剂DMP-BHEDS 称取双(2-羟基乙基)二硫醚(0.5 g,2.24 mmol),DMP(0.95 g,4.48 mmol)和4-二甲基氨基吡啶(0.273 g,2.24 mmol)溶解在二氯甲烷后置于冰浴中,搅拌20 min后加入N,N-二环己基碳二亚胺(0.924 g,4.48 mmol).在冰浴中反应24 h,过滤除去固体产物后,粗产物用石油醚/乙酸乙酯(5∶1)混合溶剂进行柱色谱分离,得到0.88 g纯单体化合物(DMP-BHEDS),产率为 93.6%.
1.2.3 合成大分子引发剂DMP-SS-PCL 氮气保护下,将ε-己内酯(5.7 g,50 mmol),DMP-BHEDS(0.5 g,1 mmol)和锌酸亚锡(48 mg,0.12 mmol)溶解于10 mL甲苯中,在110 ℃下聚合24 h.反应完毕后加入15 mL二氯甲烷稀释,然后加入冷甲醇沉淀,滤出固体,用冷甲醇洗涤3次,室温减压干燥,得PCL-SS-PCL 产物4.35 g,产率76.3%.1HNMR(400 MHz,CDCl3):δ0.87(CH3C11H22-S-(C=S)-S-),1.38(-OCH2CH2CH2CH2CH2COO-),1.64(-OCH2CH2CH2CH2CH2COO-),2.30(-OCH2CH2CH2CH2CH2COO-),2.91(-COOCH2CH2-SS-CH2CH2COO-),4.06(-OCH2CH2CH2CH2CH2COO-),4.34(-COOCH2CH2-SS-CH2CH2COO-),1.25(CH3(CH2)9CH2-S-(C=S)-S-),3.27(CH3(CH2)10CH2-S-(C=S)-S-),分子量为5.1×103g·mol-1.
1.2.4 合成聚合物PCL-SS-b-PHPMA 称取DMP-SS-PCL大分子RAFT试剂(0.1 g,22 μmol),N-(2-羟丙基)甲基丙烯酰胺(0.095 g,0.67 μmol)和AIBN(1.0 mg,6.2 μmol)加入到10 mL Shleck瓶,在1 mL的二甲基亚砜中溶解,抽真空充氮气循环3~5次,在60 ℃ 聚合反应24 h.聚合完后加入正己烷沉淀,过滤,用无水甲醇溶解沉淀物,最后用分子量为3 000的超滤浓缩离心管离心,除去小分子即得目标高分子.得产物0.08 g,产率63.8%,分子量为1.2× 104g·mol-1.
1.2.5 合成聚合物PCL-SS-b-PHPMA-b-PFA 称取PCL-SS-b-PHPMA(0.10 g,7.4 μmol),叶酸(32 mg,66.6 μmol)和AIBN(0.25 mg,1.48 μmol),加入到Shleck瓶中,用1 mL的DMSO溶解,抽真空充氮气循环3~5次,密封后置于温度为70 ℃的油浴中,反应24 h.用乙酸乙酯与石油醚沉淀,用分子量为3 000的超滤浓缩离心管进行离心,除去小分子,产率约70%,分子量为1.6×104g·mol-1.
1.3 胶束的制备及形貌表征
将10 mg 的聚合物溶解于1 mL DMF中,搅拌2 h,然后在室温搅拌下将10 mL去离子水缓慢滴加至上述溶液中.滴加完毕后,将混合液继续搅拌过夜,然后在去离子水中透析(分子量截留3 000)24 h,得到聚合物胶束溶液.采用动态光散射(DLS)在37 ℃对上述制备的聚合物胶束的粒径及粒径分布进行检测.
1.4 纳米胶束的还原响应性测定
为了测定PCL-SS-b-PHPMA和PCL-SS-b-PHPMA-b-PFA胶束降解后粒径变化情况,用动态光散射仪(DLS)追踪模拟细胞内的GSA的还原水平下的PCL-SS-b-PHPMA和PCL-SS-b-PHPMA-b-PFA胶束粒径随时间的变化.聚合物胶束溶液(10.0 mL,1 mg·mL-1)置于两个不同的条件:① 250 mL磷酸缓冲液(100 mmol·L-1,pH=7.4)中;② 250 mL含有10 mmol·L-1DTT的磷酸缓冲液(100 mmol·L-1,pH=7.4)中,并在37 ℃下搅拌,每隔一段时间取样测其粒径.
1.5 载DOX胶束的制备、胶束载药量(DLC%)、包封率(DLE%)及体外释放
取5 mg 的聚合物和2 mg的 DOX加到2 mL DMF中搅拌2 h,然后在室温缓慢搅拌下将5 mL去离子水滴加至上述溶液中.将混合液继续搅拌过夜,然后在去离子水中透析(分子量截留3 000)24 h,得到载药胶束溶液.配置0.1 mg·mL-1的DOX溶液,然后分别准确配制一系列浓度梯度的DOX溶液,紫外光谱测定480 nm 处的吸光度,得到DOX的标准曲线.
载药量和药物包封率的测定:称取5 mL上述方法制备的载药胶束,转入截留分子量为 3 000的透析袋中,放在磷酸缓冲液中透析出游离的DOX,测定480 nm处吸光度,与DOX标准工作曲线对照,计算出载药胶束中的载药量(DLC,%)和DOX的包封率(DLE,%),计算公式如下:

1.6 细胞毒性试验
采用四氮唑盐还原法(MTT)对Hela细胞株进行试验:取处于生长对数期的宫颈癌Hela细胞,将细胞浓度调为每毫升2×104个,在96孔培养板中每孔加入90 μL,边缘孔用无菌PBS填充.在5% CO2,37 ℃孵育,培养箱中放置待贴壁后再加药.对于高分子聚合物载阿霉素无叶酸胶束、载阿霉素有叶酸胶束和游离阿霉素,均分别设定浓度为0.01,0.1,0.5,1,10,20 μg·mL-16个梯度.实验组与对照组均设4个复孔,加药后细胞在37 ℃二氧化碳培养箱内继续培养48 h,取出离心,然后弃去96孔板内的上清培养液,小心用PBS冲洗2~3次后,每孔加人20 μL 0.5%的MTT溶液,置于37 ℃二氧化碳培养箱内继续培养4 h.终止培养,小心吸去孔内培养液.每孔加入150 μL的DMSO,置摇床上低速振荡10 min.在酶标仪570 nm测定各孔的吸光OD值. 细胞生长抑制率按以下公式计算:
存活率(% )=(实验组平均OD 值/对照组平均OD值)×100%.
采用Logit 法计算IC50值:

其中,X为最大浓度;I为稀释倍数的对数;P为抑制率的总和;Pm和Pn分别为最大值和最小值.
2 结果与讨论
2.1 通过RAFT聚合合成嵌段共聚物
通过酯化双(2-羟基乙基)二硫醚得到DMP-BHEDS的氢谱和碳谱分别见图1A和B.PCL-SS-b-PHPMA-b-PFA嵌段共聚物通过连续的RAFT合成,包含靶向配体与还原敏感性的二硫键.首先,合成疏水性的大分子RAFT试剂PCL-SS-DMP,按[PCL]∶[DMP-BHEDS]∶[辛酸亚锡]为50∶1∶0.12的比例在110 ℃下开环聚合,得到PCL-SS-DMP,δ=4.34(a)和2.92(b)处的峰为4个亚甲基(-COOCH2CH2SSCH2CH2COO-)的积分面积;δ=1.26(h)处为DMPA的(CH3(CH2)9CH2CH2S-)9个亚甲基积分的面积;δ=4.06(g)处为己内酯的(-OCH2CH2CH2CH2CH2COO-)的积分面积.通过计算核磁谱图峰相关峰的积分面积之比a∶h∶g =4∶18∶90可知嵌段中己内酯的平均聚合度为45.PCL-SS-DMP作为大分子RAFT试剂,用RAFT聚合HPMA单体,按[PCL-SS-DMP)]∶[HPMA]∶[AIBN]为1∶60∶0.2的比例在70 ℃下聚合,得到PCL-SS-b-PHPMA,该聚合物的1HNMR谱图见图2A,δ=3.98处为PCL(-OCH2CH2CH2CH2CH2COO-)的积分面积;δ=3.63处为HPMA的(CH3CH(OH)CH2NH-)积分面积,通过计算核磁谱图峰相关峰的积分面积之比可知嵌段中HPMA的平均聚合度为5.

图1 DMP-BHEDS的1HNMR(A)和13CNMR(B)
PCL-SS-b-PHPMA作为RAFT试剂,用RAFT聚合AA-FA单体,按[PCL-SS-b-PHPMA]∶[AA-FA]∶[AIBN]为1∶10∶0.2的比例在70 ℃下聚合,得到PCL-SS-b-PHPMA-b-PFA,该聚合物的1HNMR谱图见图2B,δ=4.06处的峰为PCL的亚甲基(-OCH2CH2CH2CH2CH2COO-)的峰,δ=8.64(h)为叶酸杂环氢的峰.通过计算核磁谱图峰相关峰的峰面积之比可知嵌段中HPMA的平均聚合度为9.
2.2 胶束的制备
胶束制备通过溶剂交换法.图3a所示动态光散射(DLS)测量聚合物2形成的纳米胶束平均粒径为132 nm,且分布较窄.图3b为胶束的TEM,可以看出,胶束呈比较规则的球形,并且大小约为110 nm,小于用DLS所测得平均粒径,这是因为TEM所测得的胶束粒径为该胶束因脱水而发生收缩之后的值.
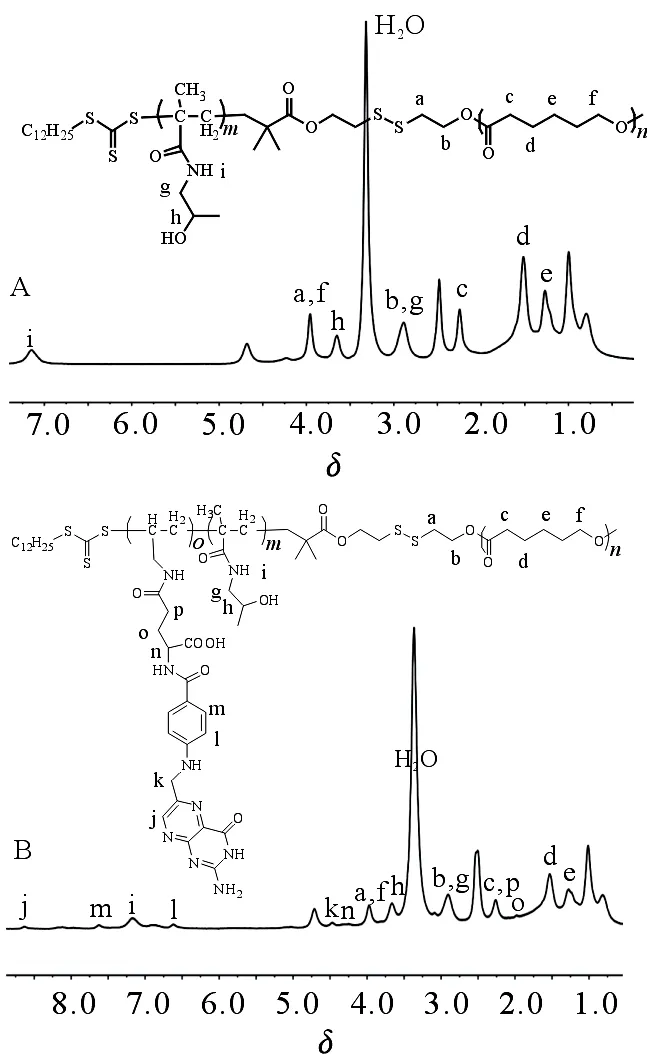
图2 聚合物PCL-SS-b-PHPMA(A)和PCL-SS-b-PHPMA-b-PFA(B)的1HNMR

图3 聚合物胶束2(1 mg·mL-1)的粒径分布(a)及透射电镜(b)
2.3 纳米胶束的还原响应性能测试
图4为PCL-SS-b-PHPMA-b-PFA聚合物胶束粒径随时间的变化,从图4可以看出,随着时间的增加,胶束粒径逐渐增大.随着DTT加入后时间的延长,胶束的粒径由132 nm增至797 nm,并且在35 nm处出现小峰.推测是由于在DTT的还原作用下,胶束中二硫键发生断裂.
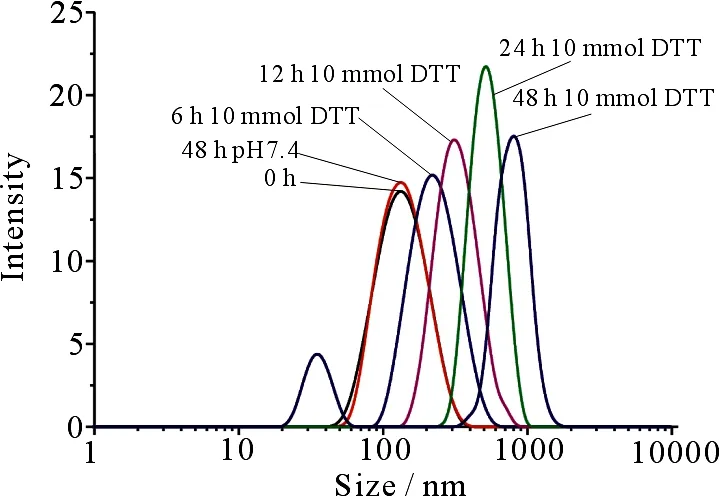
图4 PCL-SS-b-PHPMA-b-PFA胶束粒径随时间的变化
2.4 胶束载药量(DLC%)、包封率(DLE%)和体外释放
通过透析法测定胶束载药量与包封率,先用透析法分离载入胶束的DOX和游离的DOX,然后测定载入胶束中的DOX的量,用紫外分光光度计测定480 nm处DOX的吸光度,测得最大吸光度为0.327,与DOX的标准曲线对照,得到聚合物胶束2中载入的DOX为1.23 mg,包封率为61.5%,载药量为19.7%(表1).

表1 聚合物胶束载DOX的性质
注:a紫外分光光度计测定阿霉素载药量;b动态光散射测定粒径
载DOX的胶束在不同介质中的释放曲线见图5,在pH=7.4的释放介质中,胶束药物释放缓慢,48 h后累计释放量大约23%.但是在含有10 mmol·L-1DTT的pH=7.4的释放介质中,胶束释放药物较快,5 h后56.6%的DOX得到释放,且在48 h后,累计释药量达到90%.聚合物胶束2在还原性条件下的快速释放,推测是二硫键断裂使胶束结构破坏的作用.
2.5 体外细胞毒性试验
聚合物胶束对Hela细胞的毒性见图6a,可以看出,不同质量浓度的空白聚合物胶束的细胞存活率均大于93%,说明所制备的聚合物胶束无细胞毒性,具有良好的生物相容性.图6b为载药聚合物胶束及游离的DOX对Hela细胞的抗肿瘤活性,可以看出,当药物含量相同时,与游离的DOX相比,载药的纳米聚合物胶束的细胞存活率更高,说明DOX是从纳米聚合物胶束中缓慢释放出来的,可降低细胞的毒性.游离的DOX载药聚合物胶束均能在一定程度上抑制细胞的生长,以叶酸为靶向的聚合物胶束对HeLa细胞的抑制作用强于没有带靶向基团的聚合物胶束,说明靶向基团叶酸在聚合物载药系统抑制Hela细胞的增殖过程中有重要的作用.并且,载DOX的聚合物PCL-SS-b-PHPMA-b-PFA胶束对Hela细胞有较低的IC50,其值为0.52 μg·mL-1,并且这种PCL-SS-b-PHPMA-b-PFA胶束的IC50值接近于游离DOX的IC50(0.75 μg·mL-1).
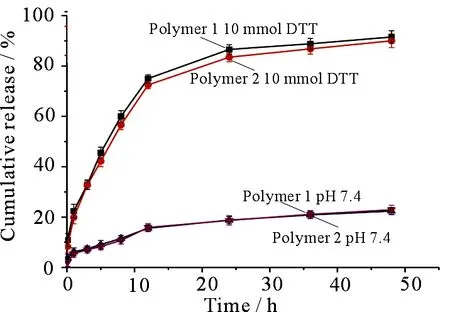
图5 PCL-SS-b-PHPMA(Polymer 1) 和PCL-SS-b-PHPMA-b-PFA(Polymer 2)载药胶束释放率-时间曲线

图6 游离DOX,载DOX的PCL-SS-b-PHPMA-b-PFA胶束和载PCL-SS-b-PHPMA胶束对HeLa细胞的抗肿瘤活性
3 结论
采用RAFT方法合成了一种新型的具有还原敏感性的两亲性嵌段共聚物PCL-SS-b-PHPMA-b-PFA,该聚合物在水溶液中自组装形成具有核/壳结构的聚合物胶束,且胶束粒径受还原作用的影响,表现出良好的还原响应性.这种胶束作为抗癌药物阿霉素的运输载体,具有较好的载药能力及生物相容性,10 mmol DTT还原条件下有利于药物在癌细胞处有效的富集以提高治疗效果,增强了对肿瘤细胞的生长抑制作用.研究表明,阿霉素/PCL-SS-b-PHPMA-b-PFA载药胶束在增强药物抗肿瘤活性的同时显著降低其毒副作用,作为抗癌药物的靶向传递载体具有广阔的应用前景.
[1] NGUYEN D H,CHOI J H,JOUNG Y K,et al.Disulfide-crosslinked heparin-pluronic nanogels as a redox-sensitive nanocarrier for intracellular protein delivery[J].JBioactCompatPol,2011,26:287.
[2] ABOLMAALI S S,ALI T,YOUSE G,et al.Sequential optimization of methotrexate encapsulation in micellar nano-networks of polyethyleneimine ionomer containing redox-sensitive cross-links[J].IntJNanomedicine,2014,9:2833.
[3] GONG J,CHEN M W,ZHENG Y,et al.Polymeric micelles drug delivery system in oncology[J].JControlRelease,2012,159:312.
[4] KUTTY R V,TAY C Y,LIM C S,et al.Anti-migratory and increased cytotoxic effects of novel dual drug-loaded complex hybrid micelles in triple negative breast cancer cells[J].NanoRes,2015,8:2533.
[5] KOYAMATSU Y C,HIRANO T,MAEDA M,et al.pH-responsive release of proteins from biocompatible and biodegradable reverse polymer micelles[J].JControlRelease,2014,173:89.
[6] JENNIFER L,SHAWN C O,CHRISTOPHER K,et al.PEG-graft density controls polymeric nanoparticle micelle stability[J].ChemMater,2014,26:2847.
[7] 杨卓理,李馨儒,杨可伟,等.聚乙二醇-聚乳酸共聚物胶束溶液的冷冻干燥及胶束体外释药动力学研究[J].化学学报,2007,65(19):2169.
[8] ZHONG Y N,YANG W J,SUN H L,et al.Ligand-directed reduction-sensitive shell-sheddable biodegradable micelles actively deliver doxorubicin into the nuclei of target cancer cells[J].Biomacromolecules,2013,14:3723.
[9] SUN Y,YAN X L,YUAN T M,et al.Disassemblable micelles based on reduction-degradable amphiphilic graft copolymers for intracellular delivery of doxorubicin[J].Biomaterials,2010,31(27):7124.
[10] LUO Z,CAI K Y,HU Y,et al.Redox-responsive molecular nanoreservoirs for controlled intracellular anticancer drug delivery based on magnetic nanoparticles[J].AdvMater,2012,24:431.
[11] LEE H,LEE Y S,LEE K D,et al.Development of disulfide core-crosslinked pluronic nanoparticles as an effective anticancer-drug-delivery system[J].MacromolBiosci,2011,11:1264.
[12] LIU J,PANG Y,HUANG W,et al.Redox-responsive polyphosphate nanosized assemblies:a smart drug delivery platform for cancer therapy[J].Biomacromolecules,2011,12:2407.
[13] HWANG C,SINSKEY A J,LODISH H F.Oxidized redox state of glutathione in the endoplasmic reticulum[J].Science,1992,257:1496.
[14] HONG R, HAN G,JODEPH M F,et al.Glutathione-mediated delivery and release using monolayer protected nanoparticle carriers[J].JAmChemSci,2006,128:1078.
[15] HASSAN S M,RECHNITZ G A.Determination of glutathione and glutathione reductase with a silver sulfide membrane electrode[J].AnalChem,1982,54:1972.
[16] LOMAESTRO B M,MALONE M.Glutathione in health and disease:pharmacotherapeutic issues[J].AnnPharmacother,1995,29:1263.
[17] SAITO G,SWANSON J A,LEE K D.Drug delivery strategy utilizing conjugation via reversible disulfide linkages:role and site of cellular reducing activities[J].AdvDrugDeliverRev,2003,55:199.
[18] DONG H Q,DONG C Y,XIA W J,et al.Self-assembled,redox-sensitive,H-shaped pegylated methotrexate conjugates with high drug-carrying capability for intracellular drug Delivery[J].MedChemCommun,2014,5:147.
[19] CRISTINA M,ROGER S.Folic acid conjugates for nuclear imaging of folate receptor-positive cancer[J].JNuclMed,2011,52:1.
[20] LU Y J,PHILIP S L.Advances in microscopy and complementary imaging techniques to assess the fate of drugs ex vivo in respiratory drug delivery:an invited paper[J].AdvDrugDeliverRev,2012,64:342.
[21] YOU Y Z,KALEBAILA K K,BROCK S L.Temperature-controlled uptake and release in PNIPAM-modified porous silica nanoparticles[J].ChemMater,2008,20(10):3354.
[22] LEE E S,N A K,BAE Y H.Polymeric micelle for tumor pH and folate-mediated targeting[J].JControlRelease,2003,91(1):103.
[23] LI P,WANG Y,ZENG F,et al.Synthesis and characterization of folate conjugated chitosan and cellular uptake of its nanoparticles in HT-29 cells[J].CarbohydRes,2011,346:801.
[24] YUAN J C,XU W B,CHEN J J,et al.Dual passively active tumor-targeting micelles for pH-triggered intracellular anticancer drug release[J].JBilactCompatPol,2014,29:415.
[25] LI Y,LIN J Y,WU H J,et al.Orthogonally functionalized nanoscale micelles for active targeted codelivery of methotrexate and mitomycin C with synergistic anticancer effect[J].MolPharm,2015,12:769.
[26] REN T B,FENG Y,ZHANG Z H,et al.Shell-sheddable micelles based on star-shaped poly(3-caprolactone)-SS-poly(ethyl glycol) for intracellular drug release[J].SoftMatter,2011,7:2329.
[27] JOHN T L,DEBBY F,RONALD S.Functional polymers from novel carboxyl-terminated trithiocarbonates as highly efficient RAFT agents[J].Macromolecules,2002,35:6754.
(责任编辑 陆泉芳)
Active-passive targeting polymeric nanosized micelles for redox-triggered intracellular anti-cancer release
YUAN Jian-chao,SONG Kai-run,LUO Wen-bo
(College of Chemistry and Chemical Engineering,Northwest Normal University,Lanzhou 730070,Gansu,China)
A novel of active-passive targeting redox-sensitive amphiphilic block copolymer PCL-SS-b-PHPMA-b-PFA is synthesized by ring-opening polymerization (ROP) and reversible addition fragmentation chain transfer radical(RAFT) polymerization.The block copolymer is characterized by1HNMR.Nanosized micelles are formed by self-assembly when the PCL-SS-b-PHPMA-b-PFA is dissolved in water solution.The nanosized micelles are characterized by transmission electron microscopy (TEM) and dynamic light scattering (DLS).The assembled micelles are regularly spherical in the shape with an average size of 100 nm.The diameters of the micelles increased with increasing the time are studied by DLS under 10 mmol·L-1dithiothreitol(DTT) microenvironments.The drug delivery behaviors of the micelles embedding anti-cancer drug DOX in a simulated human body environment are studied.The MTT is used to evaluate cytotoxicity of the polymeric micelles.The in vitro antitumor activity is evaluated in human HeLa cells,then the nanosized micelles used as the carrier of the DOX are studied.The in vitro antitumor activity is evaluated in HeLa cells.The results show that PCL-SS-b-PHPMA-b-PFA micelles exhibite redox-sensitive behavior because of the presence of SS in the feed.The amphiphilic block copolymer PCL-SS-b-PHPMA-b-PFA is one of novel and ideal biomaterials as DOX nano-carrier,DOX loaded micelles present sustained release profiles and achieve higher anti-tumor activity.It is a promising anti-cancer drug carrier.
active targeting;redox-sensitivities;polymer micelles;DOX;cell cytotoxicity
10.16783/j.cnki.nwnuz.2016.06.015
2016-04-08;修改稿收到日期:2016-07-02
国家自然科学基金资助项目(21364011,20964003)
袁建超(1964—),男,山东菏泽人,教授,博士,博士研究生导师.主要研究方向为靶向抗肿瘤高分子药物、金属有机催化和配位聚合、生物高分子材料等.E-mail:jianchaoyuan@nwnu.edu.cn
TQ 317.5;R 945
A
1001-988Ⅹ(2016)06-0078-07
