双歧杆菌分泌型黏附素对内毒素血症大鼠肠道自由基和细胞间黏附分子的影响
2016-12-06钟世顺张振书李淑梅
钟世顺 张振书 李淑梅
1.福建医科大学省立临床医学院福建省立医院消化内镜中心,福建福州350001;2.南方医科大学南方医院消化内科,广东广州510515;3.南京军区福州总医院476临床部内一科,福建福州350002
双歧杆菌分泌型黏附素对内毒素血症大鼠肠道自由基和细胞间黏附分子的影响
钟世顺1张振书2李淑梅3
1.福建医科大学省立临床医学院福建省立医院消化内镜中心,福建福州350001;2.南方医科大学南方医院消化内科,广东广州510515;3.南京军区福州总医院476临床部内一科,福建福州350002
目的探讨双歧杆菌分泌型黏附素对内毒素血症大鼠肠道自由基和细胞间黏附分子(ICAM-1)的影响。方法将雄性SD大鼠72只随机分为对照组(24只)、内毒素血症模型组(24只)和黏附素预处理组(预处理组,24只)。建模成功后6 h及1、4、7 d,各组分别取6只大鼠剖杀,生化方法检测各时间点肠道组织中超氧化物歧化酶(SOD)、丙二醛(MDA)及髓过氧化物酶(MPO)含量,并应用酶联免疫吸附试验测定肠道ICAM-1的变化。结果和对照组相比,模型组大鼠肠黏膜MDA、MPO、ICAM-1含量显著增高(P<0.05),SOD含量明显降低(P<0.05),与模型组相比,黏附素预处理组大鼠回肠组织中MDA、MPO、ICAM-1含量明显降低(P<0.05),SOD含量明显升高(P<0.05)。结论氧化损伤在内毒素血症肠损伤中发挥一定作用,双歧杆菌分泌型黏附素可减轻肠道的氧化损伤,对肠黏膜屏障具有一定的保护作用。
双歧杆菌;黏附素;内毒素血症;自由基;细胞间黏附分子
全身炎性反应综合征和多脏器功能障碍综合征时,肠道既是启动器官,也是最易受损的靶器官。内毒素是革兰阴性菌细胞壁的主要成分之一,其主要化学成分为脂多糖(Liposaccharide,LPS)。当来自于肠道和感染部位的内毒素大量进入体内引起大量氧自由基生成,可导致肠黏膜损害,完整性受到破坏。黏附素是微生物表面的一类生物大分子,通常为蛋白质或糖蛋白,与微生物的黏附可能密切相关。目前对双歧杆菌黏附素的研究尚较少,本实验采用腹腔注射LPS法建立内毒素血症大鼠模型,观察双歧杆菌分泌型黏附素对内毒素血症大鼠肠道自由基和细胞间黏附分子(intercellular adhesion molecule,ICAM-1)浓度变化的影响,以评价其在内毒素血症时对肠黏膜屏障损伤的保护作用。
1 对象与方法
1.1主要试剂和材料
青春型双歧杆菌株1027经API20A及TAB系统(英国)和多次生化鉴定确定。LPS(E.coli.O111:B4 Sigma公司);超氧化物歧化酶(Superoxide dismutase, SOD)、丙二醛(Methane dicarboxylic aldehyde,MDA)及髓过氧化物酶(Myeloperoxidase,MPO)检测试剂盒均购自南京建成生物工程研究所;大鼠ICAM-1酶联免疫吸附试验(Enzyme-linked immuno sorbent assay, ELISA)试剂盒购自上海百蕊生物科技有限公司。
1.2实验方法
1.2.1双歧杆菌分泌型黏附素的提取、纯化将双歧杆菌接种于硫乙醇酸盐液体培养基,置入厌氧培养箱37℃培养48 h,离心收集培养上清液,经过饱和硫酸铵沉淀,Superdex 75柱凝胶过滤,Q-Sepharose FF离子交换层析后,收集第1峰的成分,相对分子质量为16 000[1]。冻干保存。
1.2.2实验动物和分组4~6周龄健康SD大鼠72只,购于上海斯莱克实验动物有限责任公司(实验动物合格证号:0051443),清洁级,雌雄不限,体重220~300 g。采用简单随机抽样法将实验动物分为3组:模型组(24只):腹腔注射LPS(5 mg/kg),造模前后正常喂养;双歧杆菌黏附素预处理组(24只):建模前7 d开始给予正常喂养加黏附素5 mg/(kg·d)灌胃,第8天腹腔注射LPS(5 mg/kg)后继续黏附素5 mg/(kg·d)灌胃直至处死动物;对照组(24只):腹腔注射生理盐水(1 mL/kg),造模前后始终给予正常喂养。建模成功判断标准:腹腔注射LPS后,除人为处死外,SD大鼠7 d内不因其他原因死亡。
1.2.3标本的采集和处理各组分别于腹腔注射LPS后6 h及1、4、7 d麻醉下腹腔切开,迅速取出小肠末端距回盲部5 cm的回肠组织,生理盐水冲洗后,液氮保存备用。
1.2.4SOD、MDA、MPO和ICAM-1的测定回肠组织SOD活性采用黄嘌吟氧化酶法,硫代巴比妥酸法检测MDA的含量,分光光度法测定MPO活性。应用ELISA法测定肠道ICAM-1的变化,具体操作严格按照试剂盒说明进行。
1.3统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
表1 各组大鼠造模后各时点肠组织SOD、MDA、MPO及ICAM-1含量的变化(s)
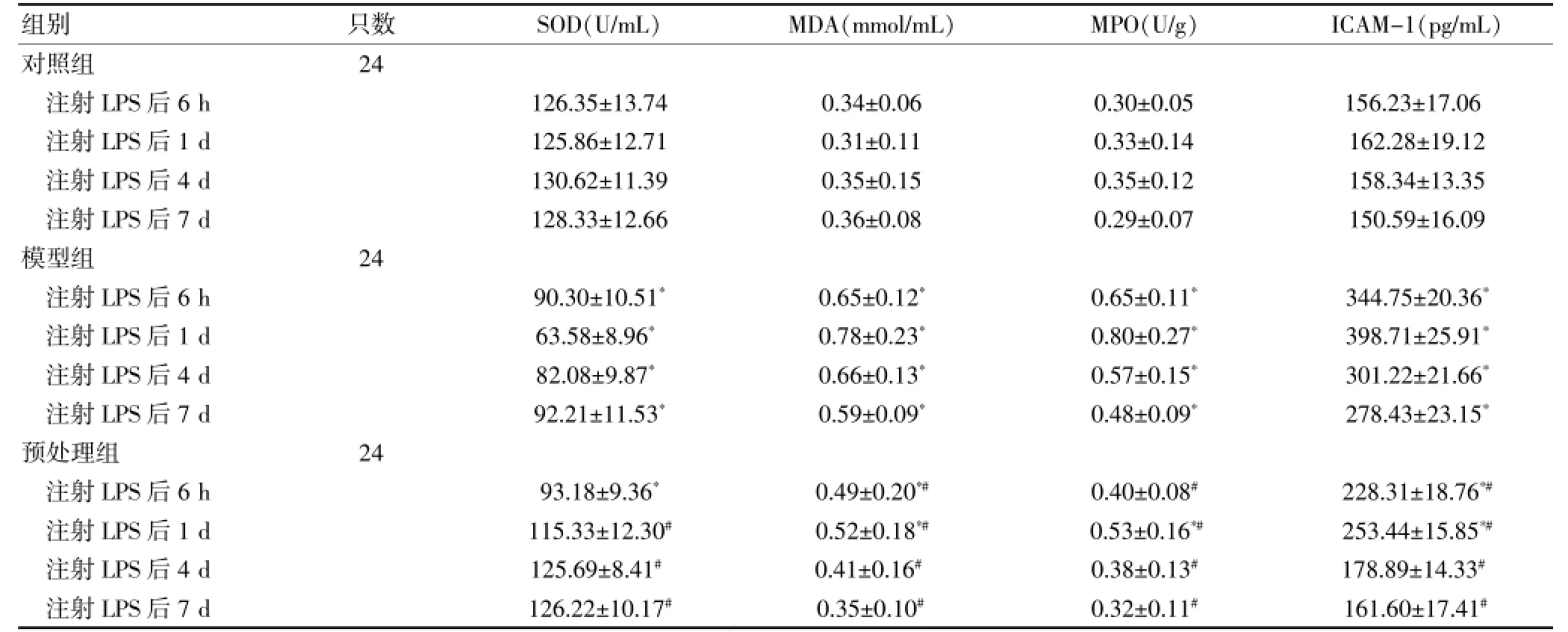
表1 各组大鼠造模后各时点肠组织SOD、MDA、MPO及ICAM-1含量的变化(s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;LPS:脂多糖;SOD:超氧化物歧化酶;MDA:丙二醛;MPO:髓过氧化物酶
组别只数S O D(U / m L ) M D A(m m o l / m L ) M P O(U / g ) I C A M -1(p g / m L )对照组注射L P S后6 h注射L P S后1 d注射L P S后4 d注射L P S后7 d模型组注射L P S后6 h注射L P S后1 d注射L P S后4 d注射L P S后7 d预处理组注射L P S后6 h注射L P S后1 d注射L P S后4 d注射L P S后7 d 2 4 1 2 6 . 3 5 ± 1 3 . 7 4 1 2 5 . 8 6 ± 1 2 . 7 1 1 3 0 . 6 2 ± 1 1 . 3 9 1 2 8 . 3 3 ± 1 2 . 6 6 0 . 3 4 ± 0 . 0 6 0 . 3 1 ± 0 . 1 1 0 . 3 5 ± 0 . 1 5 0 . 3 6 ± 0 . 0 8 0 . 3 0 ± 0 . 0 5 0 . 3 3 ± 0 . 1 4 0 . 3 5 ± 0 . 1 2 0 . 2 9 ± 0 . 0 7 1 5 6 . 2 3 ± 1 7 . 0 6 1 6 2 . 2 8 ± 1 9 . 1 2 1 5 8 . 3 4 ± 1 3 . 3 5 1 5 0 . 5 9 ± 1 6 . 0 9 2 4 9 0 . 3 0 ± 1 0 . 5 1*6 3 . 5 8 ± 8 . 9 6*8 2 . 0 8 ± 9 . 8 7*9 2 . 2 1 ± 1 1 . 5 3*0 . 6 5 ± 0 . 1 2*0 . 7 8 ± 0 . 2 3*0 . 6 6 ± 0 . 1 3*0 . 5 9 ± 0 . 0 9*0 . 6 5 ± 0 . 1 1*0 . 8 0 ± 0 . 2 7*0 . 5 7 ± 0 . 1 5*0 . 4 8 ± 0 . 0 9*3 4 4 . 7 5 ± 2 0 . 3 6*3 9 8 . 7 1 ± 2 5 . 9 1*3 0 1 . 2 2 ± 2 1 . 6 6*2 7 8 . 4 3 ± 2 3 . 1 5*2 4 9 3 . 1 8 ± 9 . 3 6*1 1 5 . 3 3 ± 1 2 . 3 0#1 2 5 . 6 9 ± 8 . 4 1#1 2 6 . 2 2 ± 1 0 . 1 7#0 . 4 9 ± 0 . 2 0*#0 . 5 2 ± 0 . 1 8*#0 . 4 1 ± 0 . 1 6#0 . 3 5 ± 0 . 1 0#0 . 4 0 ± 0 . 0 8#0 . 5 3 ± 0 . 1 6*#0 . 3 8 ± 0 . 1 3#0 . 3 2 ± 0 . 1 1#2 2 8 . 3 1 ± 1 8 . 7 6*#2 5 3 . 4 4 ± 1 5 . 8 5*#1 7 8 . 8 9 ± 1 4 . 3 3#1 6 1 . 6 0 ± 1 7 . 4 1#
模型组各时点回肠组织中SOD含量均明显低于对照组,差异有统计学意义(P<0.05),双歧杆菌黏附素预处理组除注射LPS后6 h时点外,其余各时点回肠组织中SOD含量虽较对照组有所降低,但差异无统计学意义(P>0.05);而注射LPS后1、4、7 d后双歧杆菌黏附素预处理组回肠组织中SOD含量均较模型组明显升高,差异均有统计学意义(P<0.05)。模型组各时点回肠组织中MDA、MPO含量均明显高于对照组,差异有统计学意义(P<0.05);双歧杆菌黏附素预处理组各时点回肠组织中MDA、MPO含量虽较对照组有所升高,但却明显低于模型组,差异有统计学意义(P<0.05)。见表1。
腹腔注射LPS后,模型组各时点回肠组织中ICAM-1表达均明显高于对照组,差异有统计学意义(P<0.05),双歧杆菌黏附素预处理组各时点回肠组织中ICAM-1表达虽较对照组有所升高,但却明显低于模型组,差异有统计学意义(P<0.05)。见表1。
3 讨论
肠道在多器官功能障碍的发生发展中起重要作用[2],它不仅是阻止肠腔内细菌、毒素等有害物质侵入体内的重要屏障,也是调节机体应激反应、生成炎症介质的重要器官。当发生内毒素血症时,肠黏膜屏障受损,其机制可能与缺氧、炎症介质释放、氧自由基增多、细胞凋亡等有关[3-5],此时可发生大量细菌、内毒素移位,从而导致多器官功能衰竭,甚至死亡[6]。
双歧杆菌是一种人体肠道中最重要的生理菌,目前关于其在减轻内毒素血症、调节脂质代谢、抑制氧化损伤、减轻肠道炎性反应、保护肠屏障功能等方面的作用特点已有较多报道[7-10]。但双歧杆菌活菌制剂也存在一些不足之处,比如制造与保存活菌制剂的难度较大,由于局部气体和生长底物的不足,活菌难以足量繁殖,且如果该菌穿过肠壁,还可能促进败血症的发生等[11-13]。无细胞制剂则可有效克服以上缺陷,因此,我们尝试应用从双歧杆菌培养上清液中纯化出的一种分子量为16 kD的蛋白质[14]——双歧杆菌分泌型黏附素,观察其对肠黏膜屏障的保护作用,结果发现:双歧杆菌分泌型黏附素可抑制内毒素对肠上皮细胞的损害作用,对缺血-再灌注后大鼠肠黏膜屏障也具有防护作用,能减轻肠缺血再灌注损伤[15-16],但双歧杆菌分泌型黏附素是否可抑制肠道氧自由基生成尚不清楚。本实验采用腹腔注射LPS法建立内毒素血症大鼠模型,观察双歧杆菌分泌型黏附素对内毒素血症大鼠肠道自由基和ICAM-1的浓度变化的影响,评价双歧杆菌分泌型黏附素对内毒素血症时肠道损伤的保护作用。
当发生内毒素血症时,氧自由基大量生成,与生物膜中的脂类物质发生作用,导致脂质过氧化反应,产生大量包括MDA在内的醛类产物,造成生物膜系统损伤和细胞内氧化磷酸化障碍,导致肠黏膜屏障损伤[17-19]。MDA可降低细胞膜流动性,使细胞通透性增加,可作用于细胞膜上的蛋白质分子,使之变性,促进炎性渗出和水肿,是肠组织的脂质过氧化物的代表性产物。MDA含量的高低可能在一定程度上反映了氧自由基对组织、细胞损伤的程度。MPO是一种主要存在于中性粒细胞中的酶,在单核细胞和巨噬细胞中也少量存在。MPO含量的多少可间接反映组织炎症浸润程度,可作为评价肠道炎症严重程度的指标[20]。SOD是一种源于肌体的活性物质,能消除生物体在代谢过程中产生的有害物质,如清除氧自由基,抑制组织中的脂质过氧化反应,稳定细胞膜,维持细胞内氧自由基处于一种无害的低水平状态。SOD的活力高低可反映机体清除自由基的能力。本研究发现:LPS模型组各时点肠组织MDA、MPO含量均显著高于对照组,而SOD含量则均明显低于对照组,说明内毒素血症时氧自由基和脂质过氧化引起的氧化损伤可能是造成肠黏膜损伤中的机制之一;使用双歧杆菌分泌型黏附素预处理后,各时点回肠组织中MDA、MPO含量明显低于LPS模型组,SOD含量虽较对照组有所降低,但却明显高于LPS模型组,使机体清除氧自由基的能力增强,减轻了肠黏膜的病理损伤,从而达到保护机体肠道正常生理功能的目的。
ICAM-1是一类位于细胞膜表面的糖蛋白分子,是位于血管内皮细胞表面的一种重要黏附分子,体内分布广泛,在炎症和免疫反应中发挥重要作用。组织局部黏附分子表达上调是中性粒细胞黏附、激活的基础,而中性粒细胞过度激活可导致组织损伤[21]。本实验中,大鼠腹腔注射LPS后,肠道组织ICAM-1表达上调,使中性粒细胞聚集,释放炎症介质,加重肠组织损伤。双歧杆菌分泌型黏附素预处理后,ICAM-1表达下调,说明双歧杆菌分泌型黏附素可能通过抑制ICAM-1的生成或释放,降低中性粒细胞聚集,减少炎症介质的释放,从而发挥对肠道的保护作用。
综上所述,在大鼠内毒素血症肠损伤模型中,大鼠肠组织MDA和MPO含量增加,SOD活性下降,使肠组织内氧自由基生成过多或清除能力下降,引起脂质过氧化反应,造成氧化损伤,可能是内毒素血症肠损伤的发病机制之一。双歧杆菌分泌型黏附素可通过提高SOD活性进而抑制脂质过氧化损伤,同时通过抑制ICAM-1介导的炎性反应在一定程度上维护了肠黏膜屏障功能的稳定。双歧杆菌分泌型黏附素可能对防治肠源性感染发展为多器官功能衰竭,减少机体的继发损伤起到一定的作用。
[1]郑跃杰,潘令嘉,王立生,等.双歧杆菌黏附素的提纯及鉴定[J].世界华人消化杂志,2002,10(10):1149-1151.
[2]LjungdahlM,LundholmM,KatouliM,etal.Bacterialtranslocation in ex-terimental shock is dependent in the intestinal flora[J].Scand J Gastroenterol,2000,35(4):389-397.
[3]Jing K,Sun M.Effects of intestinal trefoil factor on Tolllike receptors 2 and 4 expression in intestinal tissue in young rats with endotoxemia[J].Chin J Contemp Pediatr, 2011,13(12):985-988.
[4]Ozdemir D,Cilaker S,Tugyan K,et al.The effect of Rho kinase inhibitor Y-27632 on endotoxemia-induced intestinal apoptosis in infant rats[J].J Mol Histol,2012,43(1):81-87.
[5]Li HM,Wang YY,Wang HD,et al.Berberine protects against lipopolysaccharide-inducedintestinal injury inmice via alpha 2 adrenoceptor-independent mechanisms[J]. Acta Pharmacol Sin,2011,32(11):1364-1372.
[6]Liong MT.Safety of probiotics:translocation and infection[J]. Nutr Rev,2008,66(4):192-202.
[7]刘伯阳,姚淑娟,夏美玲.青春双歧杆菌对2型糖尿病模型大鼠肠道菌群和脂质代谢的影响[J].中国微生态学杂志,2009,21(10):877-879.
[8]王玮,李金梅,马文旭,等.双歧杆菌对内毒素损伤幼年大鼠抗氧化作用的影响[J].世界华人消化杂志,2006,14(29):2844-2848.
[9]Rodes L,Saha S,Tomaro-Duchesneau C,et al.Microencapsulated Bifidobacterium longum subsp.infantis ATCC 15697 favorably modulates gut microbiota and reduces circulating endotoxins in F344 rats[J].Biomed Res Int, 2014,2014:602832.
[10]Moya-Pérez A,Neef A,Sanz Y.Bifidobacterium pseudocatenulatum CECT 7765 Reduces Obesity-Associated Inflammation by restoring the Lymphocyte-Macrophage Balance and Gut Microbiota Structure in High-Fat Diet-Fed Mice[J].PLoS One,2015,10(7):e0126976.
[11]Alberte A,de La Fuente R,Avellaneda C,et al.[Post-ERCP bacteriemia due to Lactobacillus casei:a case history][J].Enferm Infecc Microbiol Clin,2003,21(4):215.
[12]Salvana EM,Frank M.Lactobacillus endocarditis:case report and review of cases reported since 1992[J].J Infect,2006,53(1):e5-e10.
[13]Koch S,Hufnagel M,Huebner J.Treatment and prevention of enterococcal infections——alternative and experimental approaches[J].Expert Opin Biol Ther,2004,4(9): 1519-1531.
[14]钟世顺,张振书,王继德,等.纯化黏附素介导的双歧杆菌黏附肠上皮细胞的研究[J].解放军医学杂志,2003, 28(10):907-908.
[15]钟世顺,李淑梅,张振书.双歧杆菌分泌型黏附素对肠上皮细胞形态学的影响[J].世界华人消化杂志,2011, 19(8):836-840.
[16]钟世顺,宋京翔,张振书,等.双歧杆菌黏附素对大鼠肠缺血再灌注损伤的防护作用[J].中华内科杂志,2011, 50(10):863-867.
[17]王丽杰,孙莹,孙梅.银杏苦内酯B对内毒素血症幼年大鼠肠氧化损伤的保护作用[J].中国医科大学学报,2012, 41(8):700-704.
[18]李军华,周薇.α-硫辛酸对溃疡性结肠大鼠模型脂质过氧化损伤的保护作用[J].湖北科技学院学报:医学版,2014,28(4):277-279.
[19]Hakansson A,Molin G.Gut Microbiota and Inflammation[J]. Nutrients,2011,3(6):637-682.
[20]Nagib MM,Tadros MG,ElSayed MI,et al.Anti-inflammatory and anti-oxidant activities of olmesartan medoxomil ameliorate experimental colitis in rats[J].Toxicol Appl Pharmacol,2013,271(1):106-113.
[21]周静,于成功.ICAM-1在炎症性肠病发病中的作用[J].胃肠病学,2013,18(5):307-309.
Effect of bifidobacteria adhesin on the intestinal free radical and intercellular adhesion molecule in rat with endotoxaemia
ZHONG Shishun1ZHANG Zhenshu2LI Shumei3
1.Department of Digestive Endoscopy,Provincial Clinic Medical College,Fujian Medical University,Fujian Provincial Hospital,Fujian Province,Fuzhou350001,China;2.Department of Gastroenterology,Nanfang Hospital,Southern Medical University,Guangdong Province,Guangzhou510515,China;3.First Department of Internal Medicine,the 476th Clinical Department,Fuzhou General Hospital of Nanjing Military Region,Fujian Province,Fuzhou350002, China
Objective To investigate the effect of bifidobacteria adhesin on the intestinal free radical and intercellular adhesion molecule(ICAM-1)in rat with endotoxaemia.Methods Seventy-two male SD rats were randomly divided into control group(n=24),endotoxaemia model group(n=24)and pretreatment group of bifidobacterial adhesin(pretreatment group,n=24).The rats were sacrificed at 6 h,1 d,4 d and 7 d after inducing model respectively by equal number.The superoxide dismutase(SOD),malonyldialdehyde(MDA)activity and the content of myeloperoxidase(MPO)were measured by biochemical methods.The content of ICAM-1 was measured by ELISA.Results The content of MDA,MPO and ICAM-1 markedly increased in the model group than that of the control group,but SOD decreased(P<0.05).In pretreatment group,SOD activity was significantly higher,but the content of MDA,MPO and ICAM-1 were lower than those of the model group(P<0.05).Conclusion Oxidative damage plays a role in intestinal injury during endotoxemia. Bifidobacterial adhesin may relieve intestinal oxidative damage,and has a protective effect on gut barrier.
Bifidobacteria;Adhesin;Endotoxaemia;Free radical;Intercellular adhesion molecule
R644
A
1673-7210(2016)06(b)-0012-04
福建省青年人才资助项目(2006F3107)。
(2016-03-07本文编辑:任念)
