延龄草对LPS诱导大鼠肝损伤的保护作用及机制*
2016-12-06詹光杰肖本见杨年安
詹光杰, 肖本见, 杨年安
(1. 生物资源保护与利用湖北省重点实验室, 2. 湖北民族学院科技学院, 3. 风湿疾病发生与干预湖北省重点实验室, 恩施 445000)
延龄草对LPS诱导大鼠肝损伤的保护作用及机制*
詹光杰1,2△, 肖本见2, 杨年安3
(1. 生物资源保护与利用湖北省重点实验室, 2. 湖北民族学院科技学院, 3. 风湿疾病发生与干预湖北省重点实验室, 恩施 445000)
目的:研究延龄草(TTM)对脂多糖(LPS)诱导大鼠氧化应激与肝损伤的保护作用。方法:SD大鼠60只,按体重随机分成TTM高、中、低剂量组、模型组、地塞米松磷酸钠(DEX)对照组及空白对照组(n=10)。TTM高、中及低剂量组按(8、4、2)g/(kg·d)TTM灌胃,模型组、DEX对照组及空白对照组灌胃等量蒸馏水,每隔5 d,TTM高、中、低剂量组、模型组、DEX对照组按1 mg/kg腹腔注射LPS,DEX对照组同时腹腔注射DEX(5 mg/kg),空白对照组注射等量生理盐水。30 d后,测定大鼠胸腺指数、脾脏指数,对血清一氧化氮合酶(NOS)、超氧化物歧化酶(SOD)活性与一氧化氮(NO)、谷胱甘肽(GSH)、硫代巴比妥酸反应产物(TBARS)、白细胞介素6(IL-6)、IL-10及肿瘤坏死因子α(TNF-α)含量,肝组织SOD、谷胱甘肽过氧化氢酶(GSH-Px)活性与GSH、TBARS含量进行检测。结果:与模型组相比,TTM高剂量组在(19~30)d体重显著降低(P<0.05),TTM高、中、低剂量组胸腺指数,TTM高剂量组脾脏指数显著降低(P<0.05),TTM高、中、低剂量组血清NOS活性与TBARS、NO含量显著降低(P<0.05),TTM高剂量组血清SOD活性及中、高剂量组GSH含量显著上升(P<0.05),TTM高、中剂量组血清IL-6、TNF-α含量显著降低,IL-10含量显著升高(P<0.05),TTM中、高剂量组肝脏TBARS含量显著降低,TTM各剂量组肝脏SOD活性与中、高剂量组GSH-Px活性,高剂量组GSH含量显著升高(P<0.05)。结论:TTM对LPS所致大鼠的胸腺、脾脏萎缩有一定的延缓作用,能有效降低血清中NOS活性,减少NO生成,提升SOD、GSH-Px活性与GSH含量,减轻脂质过氧化,降低IL-6、TNF-α过量分泌、提升IL-10含量,有抗炎护肝的功能。
延龄草;脂多糖;肝损伤;抗氧化;抗炎
【DOI】 10.13459/j.cnki.cjap.2016.04.022
机体受到某些有害因子的刺激后会产生过多活性氮自由基(reactive nitrogen species,RNS)和活性氧自由基(reactive oxygen species,ROS)等活性分子,过量的活性分子通过多种途径对核酸、蛋白质和脂质等生物大分子进行攻击,造成机体不同程度损伤,是导致衰老和疾病的重要因素[1]。引发的氧化应激可直接或间接作用于肝细胞,改变细胞膜通透性,破坏酶的活性,造成肝细胞坏死、损伤及凋亡,致使肝功能受损[2]。延龄草(Trillium tschonoskii Maxim,TTM)又名头顶一颗珠,为百合科延龄草属植物延龄草干燥根茎与成熟的果实,是湖北恩施地区土家族、苗族应用较多的一种珍稀药材,常被当地人奉为“神药”[3]。其含有甾体皂苷、黄酮苷及倍半萜苷等活性成分,具有抗炎镇痛、抗氧化、提高免疫力、抗衰老等功效[4,5]。本实验拟建立细菌脂多糖(lipopolysaccharide,LPS)诱导大鼠氧化应激和肝损伤模型,通过测定相关指标,研究延龄草提取物不同浓度灌胃对大鼠肝损伤与炎症的干预作用,并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验动物
9~10周龄SPF级健康雄性SD大鼠,体质量(210~230)g,购自湖北省实验动物研究中心[生产许可证号:SCXK(鄂)2008-0005]。分笼饲养于安静、干燥、通风的环境中,自由饮水,通用饮料喂养,自由光照,温度25℃±3℃。
1.2 药品与试剂
TTM由湖北省恩施市板桥乡中药材生产基地提供,采用水提醇沉淀法制成含生药30%的液体,瓶装密封消毒贮存于4℃备用[4]。LPS(大肠杆菌血清型055:B5)购自Sigma公司;地塞米松磷酸钠注射液(Dexamethasone,DEX),规格2 mg/ml,购自浙江仙琚制药股份有限公司;大鼠一氧化氮合酶(nitric oxide synthase,NOS)、一氧化氮(nitric oxide,NO)、谷胱甘肽过氧化氢酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购于南京建成生物工程研究所;白细胞介素6(interleukin-6,IL-6)、IL-10及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自晶美公司;BCA 蛋白定量分析试剂盒购自美国 Thermo Fisher 公司;其他分析纯试剂及实验用耗材购自湖北恩施乐之塬科技公司。
1.3 实验仪器
全自动生化分析仪(日本Hitachi公司),电动玻璃匀浆机(宁波新芝科技股份有限公司),紫外-可见分光光度计(美国Beckman公司),精密电子天平(上海精密科学仪器有限责任公司),全自动酶标仪(美国Thermo公司),低温冷冻离心机(美国Beckman公司)。
1.4 实验动物造模、分组与处理
SD大鼠60只,适应性饲养5 d后,按体重随机分成TTM高、中、低剂量组、模型组、DEX对照组及空白对照组(n=10)。每6 d为一个实验周期,TTM高、中及低剂量组按(8、4、2)g/(kg·d)TTM灌胃,模型组、DEX对照组及空白对照组灌胃等量蒸馏水。每隔5 d,TTM高、中、低剂量组、模型组、DEX对照组按1 mg/kg腹腔注射LPS,DEX对照组同时腹腔注射DEX(5 mg/kg),空白对照组注射等量生理盐水[6]。每天观察大鼠活动情况,称取体重,自由饮食,连续饲养30 d。
1.5 胸腺、脾脏指数测定
末次注射LPS后,各组大鼠禁食12 h(可饮水),精确称量,按3.5 ml/kg腹腔注射水合氯醛溶液麻醉[6]。心脏取血后,取胸腺、脾脏,预冷生理盐水冲洗拭干,迅速精确称取质量,计算胸腺、脾脏指数。胸腺(脾脏)指数=胸腺(脾脏)质量(g)/体质量(g)×100。
1.6 血清及肝脏相关指标检测
1.6.1 血清NOS、SOD活性,NO、GSH、TBARS、IL-10、IL-6及TNF-α的含量检测 将大鼠血液收集于促凝管中,于4℃,3 000 r/min离心10 min后 -80℃保存备用。血清中NOS、SOD活性及NO、GSH、硫代巴比妥酸反应产物(thiobarbituric acid reactive substances, TBARS)含量的检测参考试剂盒说明书及文献[6]进行;IL-10、IL-6及TNF-α的检测参考试剂盒说明书采用双抗体夹心ELISA。
1.6.2 肝脏SOD、GSH-Px活性和GSH、TBARS含量检测 取肝脏,预冷生理盐水冲洗拭干,迅速精确称取1 g肝组织后剪碎,制备成10%匀浆,于4℃,3 000 r/min离心15 min,取上清-80℃保存备用。各项检测操作参照文献[6]及检测试剂盒说明书进行。
1.7 统计学处理
2 结果
2.1 大鼠一般行为学观察与体重变化
实验全程,空白对照组大鼠精神状态良好,进食正常,反应能力与行为无明显异常。每次注射LPS后,大鼠会不同程度出现行动迟缓、精神不振、畏寒、怕光等现象,经过3 h后逐渐恢复正常。TTM高、中剂量组与DEX对照组恢复较快,模型组恢复最缓慢,各组生存率100%。各组体重均有不同程度增加。较空白对照组,DEX对照组在(13~30)d期间,模型组在(19~30)d期间体重显著降低(P<0.05);较模型组,TTM高剂量组在(19~30)d期间显著降低(P<0.05,表1),其它时段体重变化无明显差异。

Tab. 1 Changes in body weight of rats during the experiment (g, ±s, n=10)
LPS: Lipopolysaccharide; DEX; Dexamethasone; TTM: Trillium tschonoskii Maxim
*P<0.05vsnormal control group;#P<0.05vsLPS control group
2.2 TTM对大鼠胸腺、脾脏指数的影响
与空白对照组相比,模型组及TTM高、中、低剂量组胸腺、脾脏指数增加显著(P<0.05),DEX对照组无明显变化;与模型组相比,DEX对照组胸腺、脾脏指数明显减小(P<0.05),TTM能有效抵制胸腺增生,高、中、低剂量组胸腺指数显著降低(P<0.05),而TTM对脾脏增生的抑制作用仅高剂量组作用显著(P<0.05),中、低剂量组脾脏指数变化无统计学意义(表2)。

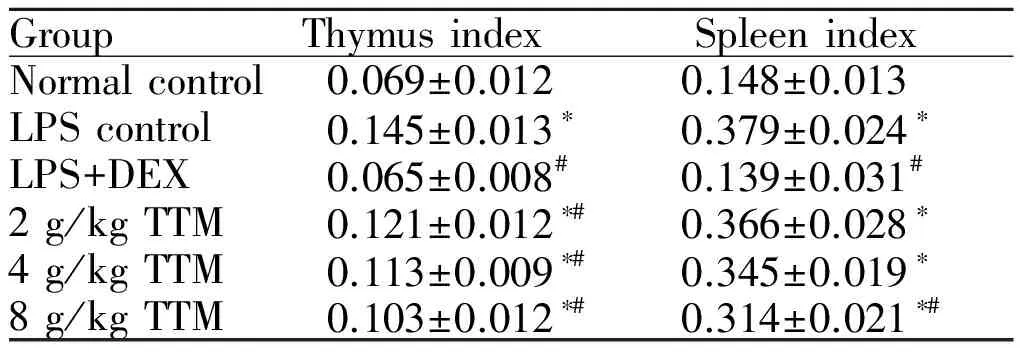
GroupThymusindexSpleenindexNormalcontrol0.069±0.0120.148±0.013LPScontrol0.145±0.013∗0.379±0.024∗LPS+DEX0.065±0.008#0.139±0.031#2g/kgTTM0.121±0.012∗#0.366±0.028∗4g/kgTTM0.113±0.009∗#0.345±0.019∗8g/kgTTM0.103±0.012∗#0.314±0.021∗#
*P<0.05vsnormal control group;#P<0.05vsLPS control group
2.3 TTM对大鼠血清NOS、SOD活性及NO、GSH、TBARS含量的影响
与空白对照组相比,模型组NOS活性与NO、TBARS含量显著升高, SOD活性与GSH含量显著下降(P<0.05),DEX对照组GSH含量明显降低(P<0.05),TTM各剂量组GSH活性及中、低剂量组SOD活性显著下降(P<0.05),TTM低剂量组NO、TBARS含量显著升高(P<0.05),其它差异无统计学意义;与模型组相比,DEX对照组NOS活性与NO、TBARS含量显著降低,而SOD活性及GSH含量显著升高(P<0.05),TTM各剂量组NOS活性及NO、TBARS含量显著降低,TTM高剂量组SOD活性与中、高剂量组GSH含量显著上升(P<0.05,表3)。
2.4 TTM对大鼠血清IL-10、IL-6及TNF-α含量的影响
与空白对照组相比,模型组IL-6、TNF-α含量显著升高,IL-10含量显著下降(P<0.05),DEX对照组IL-10含量明显降低(P<0.05),TTM中、低剂量组IL-10含量显著下降,TTM低剂量组IL-6、TNF-α含量显著升高(P<0.05),其它差异无统计学意义;与模型组相比,DEX对照组IL-6、TNF-α含量显著降低,IL-10含量显著升高(P<0.05),TTM高、中剂量组IL-6、TNF-α含量显著降低,IL-10含量则显著升高(P<0.05,表4)。
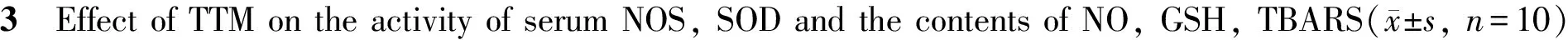
Tab.
NOS: Nitricoxide synthase; SOD: Superoxide dismutase; NO: Nitricoxide; GSH: Glutathione; TBARS: Thiobarbituric acid reactive substances; LPS: Lipopolysaccharide; DEX: Dexamethasone; TTM: Trillium tschonoskii Maxim
*P<0.05vsnormal control group;#P<0.05vsLPS control group

GroupIL⁃10TNF⁃αIL⁃6Normalcontrol88.3±4.590.6±5.2101.6±6.8LPScontrol51.7±4.1∗125.4±5.6∗138.3±5.3∗LPS+DEX53.5±4.4#96.3±4.4∗93.8±7.5∗2g/kgTTM52.8±4.3#115.7±4.8#128.1±7.8#4g/kgTTM62.6±4.8#107.6±3.8#110.6±8.1#8g/kgTTM75.7±4.6#95.8±4.5#93.4±6.5#
IL-10: Interleukin-10; TNF-α: Tumor necrosis factor α; IL-6: Interleukin-6; LPS: Lipopclysaccharide; DEX: Dexamethasone; TTM: Trillium techonoskii Maxim
*P<0.05vsnormal control group;#P<0.05vsLPS control group
2.5 TTM对大鼠肝组织GSH-Px、SOD活性及TBARS、GSH含量的影响
与空白对照组相比,模型组、DEX对照组、TTM各剂量组TBARS含量显著升高,模型组GSH-Px、SOD活性及GSH含量显著下降(P<0.05),DEX对照组与TTM低剂量组GSH-Px、SOD活性明显降低(P<0.05),其它差异无统计学意义;与模型组相比,DEX对照组TBARS含量显著降低,GSH含量显著升高(P<0.05),TTM中、高剂量组TBARS含量显著降低,TTM各剂量组SOD活性和中、高剂量组GSH-Px活性,高剂量组的GSH含量显著升高(P<0.05,表5)。
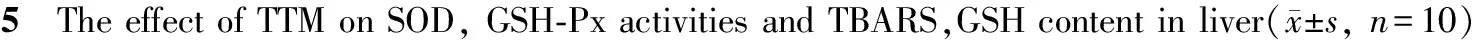
Tab.
GSH-Px: Glutathione peroxidase; SOD: Superoxide dismutase; TBARS: Thiobarbituric acid reactive substances; GSH: Glutathione; LPS: Lipopclysaccharide; DEX: Dexamethasone; TTM: Trillium techonoskii Maxim
*P<0.05vsnormal control group;#P<0.05vsLPS control group
3 讨论
LPS是由革兰阴性杆菌产生的一类内毒素,可造成机体内ROS、RNS等自由基大量产生,并通过激活免疫巨噬细胞、释放炎症因子等途径引发全身多器官损伤,作为主要清除内毒素的肝脏是最易受损的器官之一[7]。及时补充外源性的抗氧化剂可有效抑制或减轻LPS诱发的机体损伤[6,8]。
大鼠注射LPS后,会出现急性氧化应激反应,大脑海马最易受损,也是应激最为敏感的区域,LPS刺激可导致大脑皮层中5-羟色胺(5-HT)和去甲肾上腺素(NE)含量升高[9]。本实验中大鼠一般行为学的改变,推测是LPS进入大鼠体内后,5-HT和NE含量增加所致。TTM高、中剂量组有较好恢复,表明TTM能影响海马中5-HT合成和NE释放而抗氧化应激。注射LPS后,对大鼠体重变化均有影响,模型组尤其显著,表明LPS已对机体造成了损伤,高剂量TTM对造成的损伤有较好抑制作用。DEX对照组体重变化与相启森[6]研究一致,是因高剂量DEX可诱导瘦素的分泌,导致体重下降[6,10]。TTM对胸腺、脾脏萎缩有一定的延缓作用,TTM高剂组最为突出,表明大剂量TTM在改善免疫器官功能方面更有效,有助于T 细胞功能增强,迟发型过敏反应升高[11]。
LPS进入肝脏后还可诱使巨噬细胞-Kupffer细胞发生氧化应激,产生大量的活性自由基(如NO),引起脂质过氧化[12],NOS是NO生成的限速酶,直接影响NO的产生[6],TBARS涵盖了大部分氧化损伤产生的醛酮类物质, 是衡量脂质过氧化损伤的重要指标[13]。本实验结果显示,注射LPS后,大鼠NOS活性和NO、TBARS含量显著升高,叶挺梅[14]研究认为这主要是因NOS表达增高所致。高、中剂量TTM灌胃能显著降低LPS诱导所致NO含量与NOS活性的升高,表明TTM可通过调节NOS活性来减少NO的释放。TTM灌胃还可降低血清、肝组织中TBARS含量,尤以中、高剂量TTM显著,提示高剂量TTM能有效抑制脂质过氧化反应,减轻自由基对肝的损伤。
Kupffer细胞氧化应激时可刺激GSH合成,增强SOD、GSH-Px抗氧化活性,但活性自由基超过机体自身抗氧化能力时,GSH耗竭,SOD、GSH-Px抗氧化活性下降[15]。本实验结果表明LPS诱导氧化应激严重影响了机体自身的抗氧化体系。TTM灌胃干预后,高剂量TTM对LPS诱导引起的机体抗氧化能力下降有较好的修复作用,推测其机制是TTM通过提高内源性抗氧化物含量和氧化酶活性来完成的。
LPS进入机体后,还可通过与特异性Toll样受体(Toll-like receptors,TLRs)结合,激活NF-κB 释放进入细胞核,启动炎性因子基因表达[16],NF-κB适度活化有利于增强机体防御能力,活化过度则对机体造成损伤[17],炎性因子IL-10、IL-6及TNF-α的含量高低可体现炎症反应状态[9,18]。本实验结果显示,模型组IL-6、TNF-α急剧增加,抗炎因子IL-10含量显著降低,与前人[18]研究结果一致。表明TTM对LPS引起的炎症损伤有较好的恢复作用,抗炎机制值得进一步研究。
研究发现延龄草提取物有抗炎、抗氧化的降酶保肝作用。
[1] Garcia-Garcia A, Rodriguez-Rocha H, Madayiputhiya N,etal. Biomarkers of protein oxidation in human disease[J].CurrMolMed, 2012, 12(6): 681-697.
[2] Adibhatla RM, Hatcher JF. Lipid oxidation and peroxidation in CNS health and disease: from molecular mechanisms to therapeutic opportunities[J].AntioxidRedoxSignal, 2010,12 (1): 125-169.
[3] 张 女曼, 李志勇, 廖朝林, 等. 民族药头顶一颗珠的文献考证与鉴定[J]. 时珍国医国药, 2011, 22(10): 2504-2506.
[4] 詹光杰, 黄发军, 肖本见. 头顶一颗珠对D-半乳糖所致小鼠衰老模型的影响[J]. 中国现代医药学杂志, 2013, 15(10): 1-4.
[5] 钟 灵, 王振富. 头顶一颗珠对烧伤大鼠微血管反应性及抗氧化酶的影响[J]. 中国应用生理学杂志, 2011, 27(4): 483-484.
[6] 相启森. 鼠尾草酸抗氧化、抗肿瘤生物学及其分子机制研究[D]. 西安: 西北农林科技大学, 2013: 64-81.
[7] Delsesto D, Opal SM. Future perspectives on regulating pro-and anti-inflammatory responses in sepsis[J].ContribMicrobiol, 2011, 17(1): 137-156.
[8] Kim ID, Ha BJ. The effects of paeoniflorin on LPS-induced liver inflammatory reactions[J].ArchPharmRes, 2010, 33 (6): 959-966.
[9] 孙耀贵, 程 佳, 李宏全, 等. 柴术抗激颗粒对LPS诱导大鼠神经-内分泌-免疫相关因子调节机制研究[J]. 中国农业科学, 2014, 47(23): 4718-4725.
[10]Lerario DD, Ferreira SR, Miranda WL,etal. Influence of dexamethasone and weight loss on the regulation of serum leptin levels in obese individuals[J].BrazJMedBiolRes, 2001, 34 (4): 479-487.
[11]莫碧文, 张贞贞, 韦江红, 等. 脂多糖对哮喘大鼠气道炎症、气道重塑及TLR4表达的影响[J]. 中国应用生理学杂志, 2013, 29(2): 153-157.
[12]Kim TH, Lee SH, Lee SM. Role of Kupffer cells in pathogenesis of sepsis-induced drug metabolizing dysfunction[J].FEBSJ, 2011, 78(13): 2307-2317.
[13]葛存锦, 郑世华, 仝巧云. 酒精性脂肪肝中8-OHdG与TBARS的表达及维生素E的干预实验[J]. 世界华人消化杂志, 2014, 22(28): 4312-4316.
[14]叶挺梅, 徐 策, 高 琴, 等. 两种败血症休克模型大鼠心肌细胞一氧化氮合酶活性的改变[J]. 中国应用生理学杂志, 2007, 23(2): 194-198.
[15]卜亚男. 罗格列酮对脓毒症大鼠急性肝损伤保护作用的研究[D]. 大连: 大连医科大学, 2014: 17-22.
[16]Arbour NC, Lorenz E, Schutte BC,etal. TLRs mutations are associated with endotoxin hyporesponsiveness in humans[J].NatGenet, 2000, 25(2): 187-191.
[17]郭 隽, 张立实, 彭双清. NF-κB在MT对LPS致肝脏炎症损伤保护效应中的作用[J]. 毒理学杂志, 2014, 28(5): 364-369.
[18]李立萍, 张建新, 李兰芳, 等. L-Arg对LPS诱导的急性肺损伤大鼠肺表面活性物质和肺泡巨噬细胞功能的影响[J]. 中国应用生理学杂志, 2012, 28(3): 263-266.
The protective effects and mechanisms of Trillium tschonoskii Maxim on rats’ liver damage induced by lipopolysaccharide
ZHAN Guang-jie1,2△, XIAO Ben-jian2, YANG Nian-an3
(1. Key Laboratory of Biologic Resources Protection and Utilization of Hubei Province, 2. Science and Technology College of Hubei University for Nationalities, 3.Hubei Provincial Key Laboratory of Occurrence and Intervention of Rhumatic Diseases, EnShi 445000, China)
Objective: To study the protective effects of Trillium tschonoskii maxim (TTM)on rats’ oxidative stress and hepatotoxicity induced by lipopolysaccharide (LPS). Methods: Sixty SD rats were randomly divided into TTM high, medium and low dose groups, model group, Dexamethasone (DEX) control group and blank control group with ten rats in each group. The TTM high, medium and low dose groups were treated with 8, 4, 2 g/(kg·d)TTM by intragastric administration and model group, DEX control group and blank control group were treated with the same amount of distilled water respectively. The TTM high, medium and low dose groups, model group, DEX control group were injected intraperitoneal with 1 mg/kg LPS and the DEX control group was injected intraperitoneal with 5 mg/kg DEX, the blank control group was injected with same amount of normal saline every five days. The indexes of rats’ thymus and spleen were measured in 30 days. The activities of serum nitric oxide synthase (NOS), superoxide dismutase (SOD) and the contents of nitric oxide (NO), glutathione (GSH), glucosinolates barbituric acid reaction product(TBARS), white cells interleukin-6(IL-6), IL-10 and tumor necrosis factor-α(TNF-α), the activities of liver SOD, GSH-Px and the contents of GSH and TBARS were measured. Results: TTM high dose group was significantly different in body weight in 19~30 days(P<0.05); The index of thymus in TTM high, medium and low dose groups and the index of spleen in TTM high dose group were decreased significantly compared with those of the model group. The activity of serum NOS and the contents of TBARS and NO in TTM high, medium and low dose groups were decreased significantly(P<0.05). The activity of serum SOD in TTM high dose group and the contents of GSH in TTM medium and low dose groups were increased significantly(P<0.05).The contents of serum IL-6 and TNF-α in TTM high, medium dose groups were decreased significantly and the contents of serum IL-10 were increased significantly(P<0.05).The contents of liver TBARS in TTM high, medium dose groups were decreased significantly. The activity of liver SOD in TTM high, medium and low dose groups, the activity of GSH-Px in TTM high, medium dose groups and the contents of GSH in TTM high dose group were increased significantly(P<0.05). Conclusion: TTM has a certain effect to delay the rats’ atrophy of thymus and spleen generated by LPS. It can effectively reduce the activity of NOS in serum, reduce the formation of NO, improve the activity of SOD, GSH-Px and the contents of GSH, reduce lipid peroxidation, decrease the excessive secretion of IL-6, TNF-α, increase the contents of IL-10, which can resist inflammation and protect the liver.
Trillium tschonoskii Maxim(traditional Chinese medicine); lipopolysaccharide; liver damage; antioxidant; anti-inflammatory
生物资源保护与利用湖北省重点实验室资助(PKLHB1514);林学一级学科资助
2015-06-05
2016-01-29
R285.5
A
1000-6834(2016)04-373-05
△【通讯作者】Tel: 13135832144; E-mail: zhan 323@163.com
