产前应激对子代大鼠脑缺血/再灌注后星形胶质细胞的影响*
2016-12-05王凌星黄红红陈雅芳蔡鸿潮钱家强
王凌星, 黄红红, 陈雅芳, 蔡鸿潮, 钱家强
(福建医科大学附属第二医院神经内科, 泉州 362000)
产前应激对子代大鼠脑缺血/再灌注后星形胶质细胞的影响*
王凌星, 黄红红△, 陈雅芳, 蔡鸿潮, 钱家强
(福建医科大学附属第二医院神经内科, 泉州 362000)
目的:探讨产前应激对雄性子代大鼠大脑中动脉缺血/再灌注后星形胶质细胞的影响。方法:SD孕鼠随机分为有产前应激处理(妊娠第15到21天每日3次限制活动)和无产前应激处理,并对其雄性子代大鼠采用线栓法制备大脑中动脉闭塞(MCAO)模型,共分为产前应激+假手术组、MCAO模型组、产前应激+MCAO组(n=10),于再灌注后第5天检测脑梗死体积,免疫荧光双标染色检测缺血灶边缘区星形胶质细胞形态及促红细胞生成素肝细胞受体A4(EphA4)和胶质纤维酸性蛋白(GFAP)的共表达情况,并采用Western blot检测EphA4、GFAP和神经蛋白聚糖(Neurocan)蛋白表达。结果:产前应激+MCAO组子代大鼠脑梗死体积百分比、EphA4、GFAP和Neurocan蛋白表达均较MCAO组显著增加(P均<0.05),且GFAP阳性细胞形态学改变及EphA4/GFAP共表达也较MCAO组明显。结论:产前应激可能改变子代大鼠脑缺血/再灌注后星形胶质细胞上EphA4受体的表达,促进星形胶质细胞活化,产生神经蛋白聚糖。
产前应激;子代大鼠; 脑缺血; 星形胶质细胞
【DOI】 10.13459/j.cnki.cjap.2016.04.004
脑缺血时,会出现星形胶质细胞的活化,表现为数量和形态的改变,并出现GFAP表达增加。星形胶质细胞的早期活化、迁移和增殖可以限制缺血半暗带的扩展[1],所形成的胶质瘢痕会分隔并保护未损伤组织免于损伤,抑制炎症扩散并调节细胞外环境[2]。但另一方面,胶质瘢痕构成了轴突生长的物理性障碍,而且胶质瘢痕中活化星形胶质细胞产生了具有抑制作用的细胞外基质分子,如硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycans,CSPG),对神经轴突生长形成生物化学屏障作用[3]。因此调节星形胶质细胞的活性会改变脑缺血的转归和神经功能损伤的程度。我们的前期研究表明,产前应激会加重子代大鼠缺血性卒中的神经功能损害[4],但星形胶质细胞在这个过程中的作用尚不明确,我们推测产前应激可能改变缺血后星形胶质细胞的活性而影响神经功能。尽管已有研究表明促红细胞生成素肝细胞受体A4(erythropoietin-producing hepato cellular receptor A4, EphA4)受体可以调节脊髓损伤后的星形胶质细胞活化[5,6],但关于脑缺血后EphA4受体对星形胶质细胞的影响研究较少[7],而产前应激对子代大鼠脑缺血/再灌注后星形胶质细胞EphA4受体的影响,国内外更是少见报道。本研究通过使用大鼠产前应激模型和子代大鼠缺血/再灌注模型,探讨产前应激是否会通过EphA4受体改变子代大鼠脑缺血/再灌注后星形胶质细胞的活化,影响CSPG的形成。本研究可为今后调节EphA4受体,改变产前应激对子代大鼠脑缺血/再灌注后神经功能的影响提供理论依据。
1 材料与方法
1.1 实验动物
12周龄的健康雌性SD大鼠,体重200~250 g,共15只,12周龄健康雄性大鼠15只,体重300~350 g,均购自上海斯莱克实验动物有限公司。动物饲养条件:温度为(22±1)℃,光照7:00 am—7:00 pm,自由摄取水和食物。
1.2 实验方法
产前应激模型:将大鼠按雌∶雄1∶1的比例随机合笼,以发现阴栓当日为妊娠第0天,次日为妊娠第1天。按随机数字表法将孕鼠分为有产前应激处理和无产前应激处理。参考文献方法建产前应激模型[8]:于妊娠第15到21天每日3次(分别在10:00、14:00、18:00)将孕鼠限制在塑料质地的圆柱形装置内(长19 cm,直径7 cm),每次45 min。无产前应激处理的孕鼠在整个妊娠期均饲养于塑料笼内不受干扰。除应激处理外,孕鼠不受其他打扰。所有孕鼠均自然分娩,共获得15窝仔鼠,为避免奶水不足对新生仔鼠生长发育的影响,每窝仔鼠随机留8只饲养。子代大鼠在3周龄后断乳,仅保留雄性子代大鼠(3~4只/窝)。
MCAO模型:雄性子代大鼠于2月龄(体重约250~300 g)时采用右侧颈外动脉插入线栓法[9]制造MCAO模型,大鼠于右侧大脑中动脉缺血90 min后,向外轻轻拉出栓线,建立再灌注模型。并判定模型是否成功,以动物清醒后有右眼Horner征,提尾时出现左侧前肢屈曲内收者为研究对象,并剔除蛛网膜下腔出血者。假手术组采取同样的手术过程,但线栓插入较浅,并不造成大脑中动脉闭塞。实验共分3组:产前应激+假手术组,MCAO组,产前应激+MCAO组(n=10)。
1.3 HE染色
于再灌注后第5天,每组取5只大鼠,10%水合氯醛麻醉,并使用4%中性多聚甲醛灌注内固定,于断头取脑后,从额极至枕叶切成厚度为3 mm的冠状脑切片,经脱水、透明、浸蜡,最后包埋成蜡块。每一蜡块切片行常规HE染色检测脑梗死情况。采用Image J图像软件(Media Cybernetics,Inc)计算总的梗死体积(MV)及左右半球体积(LV、RV)。根据公式[10]进行计算:梗死体积(%)=[LV-(RV-MV)]/LV×100%,以纠正脑水肿对梗死面积的影响。
1.4 免疫荧光双标染色
将脑组织的石蜡切片经二甲苯脱蜡、梯度酒精水化、微波修复后,加入胎牛血清封闭后,加兔抗EphA4抗体(Santa Cruz Biotechnology Inc.,1∶150)和小鼠抗GFAP抗体(北京博奥森生物制剂有限公司,1∶300),4℃过夜,加FITC荧光素标记的羊抗兔IgG(1∶50)和CY3标记的羊抗小鼠IgG(1∶50)混合抗体,避光室温孵育2 h,甘油封片。荧光显微镜下观察缺血灶边缘区EphA4和GFAP的表达情况并拍照。EphA4阳性细胞呈绿色荧光,GFAP阳性细胞呈红色荧光,EphA4/GFAP双阳性细胞呈淡黄色。
1.5 Western blot检测
于再灌注后第5天,每组均取5只大鼠,10%水合氯醛麻醉,于低温下开颅取缺血灶周边区,假手术组取与手术组相对应的脑区,立即放入液氮中冻存。提取总蛋白后,使用BCA法测定蛋白浓度,于10%聚丙烯酰胺凝胶电泳(SDS- PAGE)分离后,转印到硝酸纤维素膜上,并在5%脱脂奶粉封闭后分别加入一抗:EphA4(Santa Cruz Biotechnology Inc.,1∶500);GFAP(北京博奥森生物制剂有限公司,1∶200);Neurocan(北京博奥森生物制剂有限公司,1∶200); β-肌动蛋白(β-actin,北京博奥森生物制剂有限公司,1∶2000),4℃过夜,洗涤后与辣根过氧化酶标记的二抗孵育。ECL显影后扫描,使用凝胶成像处理系统(美国SYNGENE公司)行吸光度分析。以目的条带与β-actin条带吸光度之比作为目的蛋白的相对表达量。
1.6 统计学处理
2 结果
2.1 脑梗死体积测定
各组子代大鼠脑梗死情况见图1。产前应激+假手术组未见脑梗死灶。MCAO组梗死累及尾状壳核及苍白球,产前应激+MCAO组梗死范围相对弥散,尚累及胼胝体和皮质。产前应激+MCAO组梗死体积百分比(30.80±2.68)%明显大于MCAO组(16.94±1.10)%(P<0.05)。
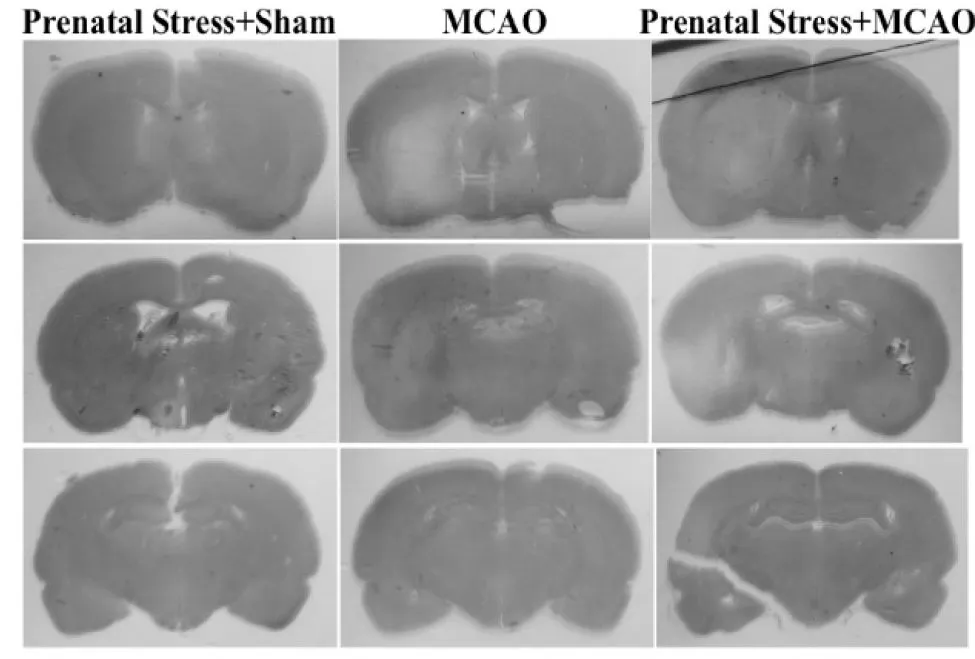
Fig. 1 Representative photographs of hematoxylin-eosin (HE) stained brain sections obtained from three experimental groups after 5 days of transient middle cerebral artery occlusion(MCAO)
2.2 EphA4/GFAP免疫荧光双标染色
缺血灶边缘区GFAP阳性细胞呈红色荧光,产前应激+假手术组的GFAP阳性细胞数量较少,胞体小且纤维纤细(图2A1),MCAO组GFAP阳性细胞数量增多且体积增大(图2B1),产前应激+MCAO组GFAP阳性细胞分枝变长且增多增粗,部分突起交织呈网状(图2C1)。缺血灶边缘区存在大量EphA4阳性细胞,呈绿色荧光(图2A2、B2、C2),且免疫荧光双标染色提示EphA4受体与GFAP阳性星形胶质细胞在缺血灶边缘区的分布有较好的一致性,两者叠加发现GFAP阳性星形胶质细胞上均有EphA4表达,信号呈淡黄色(图2A3、B3、C3)。
2.3 Western blot检测EphA4、GFAP和Neurocan蛋白表达情况
产前应激+假手术组子代大鼠缺血灶边缘区有EphA4和GFAP蛋白表达;与产前应激+假手术组比较,MCAO增加缺血灶边缘EphA4和GFAP蛋白表达,差异有统计学意义(P均<0.05);与MCAO组比较,产前应激+MCAO显著增加EphA4和GFAP蛋白表达(P均<0.05)。产前应激+假手术组全长Neurocan蛋白表达极少;与产前应激+假手术组比较,MCAO增加全长Neurocan蛋白表达,差异有统计学意义(P<0.05);与MCAO组比较,产前应激+MCAO显著增加全长Neurocan蛋白表达(P<0.05)。产前应激+假手术组、MCAO组和产前应激+MCAO组均检测出C-末端Neurocan蛋白表达,但差异无统计学意义(图3,表1)。
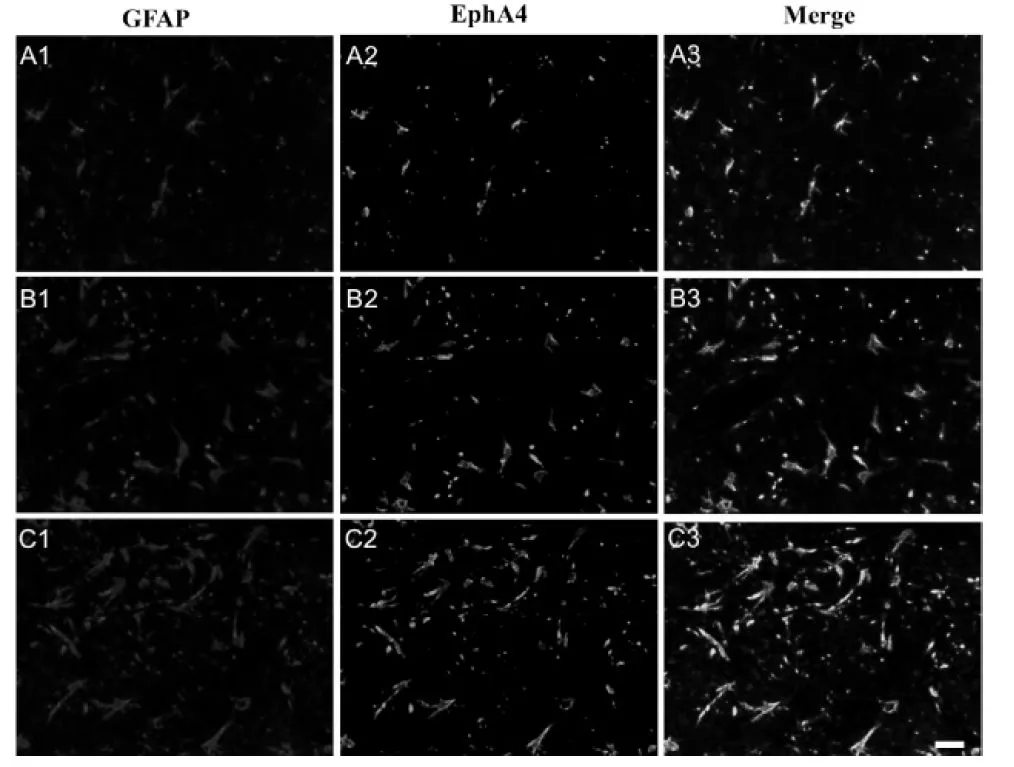
Fig. 2 Immunofluorescence double staining of GFAP and EphA4 in the peri-ischemia regions of three experimental groups after 5 days of transient middle cerebral artery occlusion (MCAO)
A1-A3: Prenatal stress+Sham group; B1-B3: MCAO group; C1-C3: Prenatal Stress+MCAO group. Scale bar=25 μm
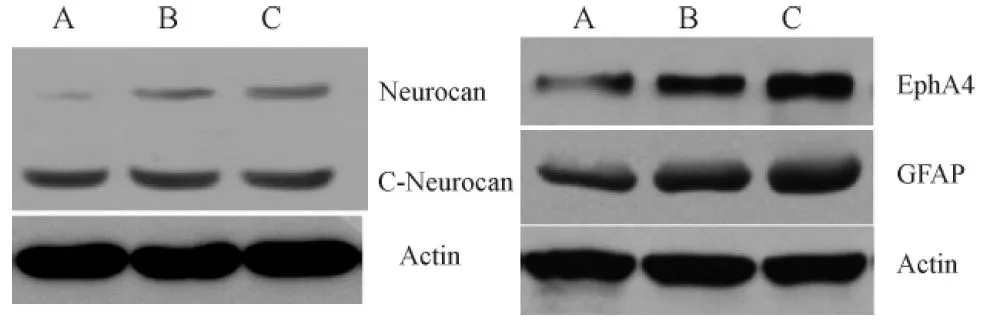
Fig. 3 Expression of Neurocan, C-Neurocan, GFAP and EphA4 in the peri-ischemia regions of three experimental groups after 5 days of transient middle cerebral artery occlusion (MCAO)
A: Prenatal stress+Sham group; B: MCAO group; C: Prenatal stress+MCAO group
3 讨论
产前应激来自生活或工作的不良事件的影响,如自然灾害、战争、失业、家人或配偶的死亡、家庭和婚姻的不和谐等。本室验前期研究[4]表明:产前应激会促进子代大鼠缺血/再灌注后24 h的神经细胞凋亡,提示围产期不良事件会影响子代缺血性卒中的预后。与前期研究结果一致,本研究发现在缺血/再灌注后5 d,产前应激+MCAO组较MCAO组具有更大的脑梗死体积,提示产前应激会产生持久影响,导致成年子代对脑缺血/再灌注的易损性,从而加重子代脑缺血损害。
星形胶质细胞是中枢神经系统最丰富的细胞类型,在生理环境下可以为神经元提供许多必须的支持性活动。在病理条件,如卒中、脊髓损伤、Alzheimer’s病等,星形胶质细胞出现快速活化,经历数量和大小上的增加(增生和肥大)。活化的星形胶质细胞不同于生理性的星形胶质细胞,具有升高的GFAP表达,已有研究表明,在脑缺血时抑制星形胶质细胞GFAP的过度表达可以保护神经元并减轻神经功能缺损[11]。本实验观察到MCAO组中GFAP阳性星形胶质细胞出现数量增加、体积增大和细胞突起增多,且产前应激+MCAO组较MCAO组改变更明显,而产前应激+假手术组则无这种改变,提示产前应激使子代的星形胶质细胞在缺血/再灌注后出现更明显的活化。我们推测星形胶质细胞的活化及GFAP表达增加可能是产前应激的子代大鼠脑梗死面积增加的原因。
Tab. 1 Quantitative results of Neurocan, C-Neurocan, EphA4 and GFAP in three experimental ±s, n=5)
MCAO: Middle cerebral artery occlusion
*P<0.05vsprenatal stress + sham group;#P<0.05vsMCAO group
已有研究表明Eph是星形胶质细胞活化的重要调节物,影响中枢神经系统损伤后或中枢神经系统疾病过程中的星形胶质细胞增殖[12]。在Eph受体家族中,EphA4受体在损伤部位的星形胶质细胞高度表达[5],并可在体外[7]和活体[6]调节星形胶质细胞活性。在EphA4基因敲除的小鼠,星形胶质细胞反应明显减少,GFAP表达减少,且CSPG染色也减少。在非人类的灵长类动物脑损伤模型中也发现EphA4受体表达在病灶部位周围活化的星形胶质细胞中明显上调,而在体外实验中EphA4受体活化介导星形胶质细胞增殖和胶质纤维酸性蛋白表达[13]。与此类似,本实验发现在MCAO组中EphA4受体表达增加且主要表达于GFAP阳性星形胶质细胞,提示MCAO增加缺血灶周边EphA4受体表达且该受体可能介导了星形胶质细胞的活化,实验还发现产前应激+MCAO组较MCAO组EphA4受体在GFAP阳性星形胶质细胞的表达更明显,提示产前应激会改变缺血后子代星形胶质细胞上EphA4受体的表达,进而调节星形胶质细胞的活化,出现GFAP表达增加及细胞形态改变。
活化的星形胶质细胞具有以损伤部位为目标的细胞迁移增加以及随后活跃的细胞增殖,并能产生CSPG,形成胶质瘢痕[14]。Neurocan是一种主要的CSPG,在成年脑组织,神经蛋白聚糖(275 kD)很快被分解为两个片段,即C-端(150 kD)和N-端(130 kD)片段。因此,在正常的成年脑组织无法检测到全长的神经蛋白聚糖,而在发育不成熟的脑组织则可以检测出全长神经蛋白聚糖及其分解片段[15],此外,在某些病理情况下,如脑外伤、癫痫的脑组织中也可以检测到全长的神经蛋白聚糖[15]。全长神经蛋白聚糖可以通过调节钙粘蛋白和整联蛋白抑制轴突延伸或再生[15]。本实验中,在MCAO组的缺血侧额顶叶检出全长神经蛋白聚糖,这与既往的研究一致[16],提示缺血可以诱导周边脑组织表达全长神经蛋白聚糖,从而调节神经网络形成。产前应激+MCAO组较MCAO组表达更多的全长神经蛋白聚糖,说明产前应激可能通过改变CSPG分泌,阻碍神经元再生,从而影响子代卒中后神经功能恢复障碍。
总之,产前应激可能增加子代大鼠缺血/再灌注后缺血灶周边星形胶质细胞上EphA4受体的表达,促进星形胶质细胞活化,分泌抑制分子,如神经蛋白聚糖,抑制神经元再生,可能导致更明显的胶质瘢痕形成,加重神经损伤。本研究表明产前应激会加重子代大鼠脑缺血/再灌注损害,为脑血管病的防治与优生优育提供新的理论依据。
[1] Rolls A, Shechter R, Schwartz M. The bright side of the glial scar in CNS repair [J].NatRevNeurosci, 2009, 10(3): 235-241.
[2] Teshigawara K, Kuboyama T, Shigyo M,etal. A novel compound, denosomin, ameliorates spinal cord injuryviaaxonal growth associated with astrocyte-secreted vimentin [J].BrJPharmacol, 2013, 168(4): 903-919.
[3] Shen LH, Li Y, Gao Q,etal. Down-regulation of neurocan expression in reactive astrocytes promotes axonal regeneration and facilitates the neurorestorative effects of bone marrow stromal cells in the ischemic rat brain [J].Glia, 2008, 56(16): 1747-1754.
[4] 王凌星, 黄红红, 陈雅芳, 等. 产前应激对成年子代大鼠缺血性卒中后细胞凋亡的影响[J]. 中国应用生理学杂志, 2015, 31(5): 427-430.
[5] Coulthard MG, Morgan M, Woodruff TM,etal. Eph/Ephrin signaling in injury and inflammation[J].AmJPathol, 2012, 181(5): 1493-1503.[6] Goldshmit Y, Spanevello MD, Tajouri S,etal. Epha4 blockers promote axonal regeneration and functional recovery following spinal cord injury in mice [J].PLoSOne, 2011, 6(9): e24636.
[7] Parmentier-Batteur S, Finger EN, Krishnan R,etal. Attenuation of scratch-induced reactive astrogliosis by novel Epha4 kinase inhibitors [J].JNeurochem, 2011, 118(6): 1016-1031.
[8] Igosheva N, Taylor PD, Poston L,etal. Prenatal stress in the rat results in increased blood pressure responsiveness to stress and enhanced arterial reactivity to neuropeptide Y in adulthood [J].JPhysiol, 2007, 582(Pt 2): 665-674.
[9] Longa EZ, Weinstein PR, Carlson S,etal. Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke, 1989, 20(1): 84-91.
[10]Swanson RA, Morton MT, Tsao-Wu G,etal. A semiautomated method for measuring brain infarct volume [J].JCerebBloodFlowMetab, 1990, 10(2): 290-293.
[11]尚 宇, 吕红梅, 顾佩菲. 异丙酚对局灶性脑缺血/再灌注星形胶质细胞GFAP表达的影响 [J]. 中国应用生理学杂志, 2009, 25(1): 16-17.
[12]Frugier T, Conquest A, McLean C,etal. Expression and activation of Epha4 in the human brain after traumatic injury [J].JNeuropatholExpNeurol, 2012, 71(3): 242-250.
[13]Goldshmit Y, Bourne J. Upregulation of Epha4 on astrocytes potentially mediates astrocytic gliosis after cortical lesion in the marmoset monkey [J].JNeurotrauma, 2010, 27(7): 1321-1332.
[14]Sofroniew MV. Molecular dissection of reactive astrogliosis and glial scar formation [J].TrendsNeurosci, 2009, 32(12): 638-647.
[15]Asher RA, Morgenstern DA, Fidler PS,etal. Neurocan is upregulated in injured brain and in cytokine-treated astrocytes [J].JNeurosci, 2000, 20(7): 2427-2438.
[16]Deguchi K, Takaishi M, Hayashi T,etal. Expression of neurocan after transient middle cerebral artery occlusion in adult rat brain [J].BrainRes, 2005, 1037(1-2): 194-199.
The effects of prenatal stress on the astrocytes after cerebral ischemia/reperfusion injury in adult offspring rats
WANG Ling-xing, HUANG Hong-hong△, CHEN Ya-fang, CAI Hong-chao, QIAN Jia-qiang
(Department of Neurology, the Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China)
Objective: To investigate the effects of prenatal stress on astrocytes after ischemia/reperfusion of cerebral middle artery in adult offspring rats. Methods: Pregnant rats were randomly assigned to prenatal stress treatment group, which was exposed to restraint three times daily in the last week of pregnancy, and no prenatal stress treatment group. Adult male offspring rats were subjected to transient focal cerebral ischemia by middle cerebral artery occlusion (MCAO). There were three groups: prenatal stress + sham group, MCAO group and prenatal stress + MCAO group (n=10). After 5 days of reperfusion, the infarct size was evaluated. The morphology of astrocytes, co-localization of erythropoietin-producing hepatocellular receptor A4 (EphA4) and glial fibrillary acidic protein (GFAP) were detected by double immunofluorescent staining. And the protein expressions of EphA4, GFAP and Neurocan in peri-ischemic regions were detected by Western blot. Results: The infarct size and the expression of EphA4, GFAP and Neurocan were significantly increased in prenatal stress + MCAO group compared with MCAO group (allP<0.05). And the morphological changes of GFAP-positive astrocytes and co-localization of EphA4/GFAP were more obvious in prenatal stress + MCAO group compared with MCAO group. Conclusion: Prenatal stress may upregulate the expression of EphA4 on astrocytes in the offspring rats after cerebral ischemia/reperfusion, which promotes the reactivity of astrocyte and increases the expression of neurocan.
prenatal stress; offspring rats; cerebral ischemia; astrocyte
福建省自然科学基金项目(2015J01449);福建省教育厅项目(JB13067);泉州市技术研究与开发项目(2012Z35);院苗圃基金(2012MP65)
2015-11-24
2016-04-04
R741.02
A
1000-6834(2016)04-301-05
△【通讯作者】Tel: 13600766682; E-mail: minghuaxin@139.com
