非小细胞肺癌骨转移患者预后影响因素分析
2016-12-05蒋晓岚王佳
蒋晓岚,王佳
(四川省医学科学院,四川省人民医院全科医学中心,成都 610072)
非小细胞肺癌骨转移患者预后影响因素分析
蒋晓岚,王佳
(四川省医学科学院,四川省人民医院全科医学中心,成都 610072)
目的 探讨非小细胞肺癌骨转移患者预后的影响因素。方法 回顾性分析148例非小细胞肺癌骨转移患者的临床资料,不同特征非小细胞肺癌患者骨转移后的生存率采用Kaplan-Meier法进行估计,并采用Log-rank检验进行单因素分析,最后采用多元逐步Cox比例风险回归模型分析影响非小细胞肺癌骨转移预后的相关因素。结果 148例非小细胞肺癌骨转移患者中位生存期为15.0个月,1、2、3年生存率为52.0%、24.3%、8.1%。单因素分析结果显示,不同肺癌病理类型、不同肿瘤分期、不同ECOG评分、不同骨转移类型、有无合并其他部位转移、有无骨性相关事件患者中位生存期比较,P均<0.05。多元Cox逐步回归分析结果显示,非肺腺癌(HR=2.22,95%CI:1.35~3.63)、ECOG评分0~1分(HR=1.93,95%CI:1.01~3.67)、多发骨转移(HR=3.03,95%CI:1.72~5.34)和合并其他部位转移(HR=2.28,95%CI:1.20~4.36)为非小细胞肺癌骨转移患者预后危险因素。结论 非小细胞肺癌骨转移患者预后危险因素为非肺腺癌、ECOG评分低、多发骨转移和合并其他部位转移。
非小细胞肺癌;骨转移;生存时间;预后影响因素
肺癌是目前全球最常见的恶性肿瘤之一,全世界每年大约有150万例被新诊断为肺癌,130万例因肺癌而死亡[1]。在我国,肺癌的发病率和病死率均排在所有癌症的第1位,年发病率约为53.6/10万,年病死率为45.6/10万[2]。受近年来诊治水平提高的影响,肺癌患者生存期相对延长,疾病后期常出现远处转移,其中最常转移的部位为骨骼。既往研究[3,4]显示30%~40%的晚期肺癌患者存在骨转移。肺癌骨转移患者3年累积生存率几乎为零[5]。因此,探讨肺癌骨转移患者预后的相关影响因素具有重要的临床意义。非小细胞肺癌为肺癌常见病理类型[6],本研究拟通过对148例非小细胞肺癌骨转移患者的随访资料进行回顾性分析,探讨非小细胞肺癌骨转移患者预后影响因素。
1 资料与方法
1.1 临床资料 选择2008年1月~2013年12月我院肿瘤科收治的非小细胞肺癌骨转移患者148例,其中男99例、女49例,年龄30~81(61.7±12.5)岁、中位年龄60岁。病理类型:腺癌98例,鳞癌42例,腺鳞癌8例。肿瘤分期:Ⅰ期16例,Ⅱ期27例,Ⅲ期30例,Ⅳ期75例。影像学分型:周围型肺癌99例,中央型肺癌49例。一般状况ECOG评分:0~1分115例,≥2分33例。单发骨转移者45例、多发骨转移者103例,最多骨转移灶有5处。全组患者共有骨转移灶313处,其中胸部77处、脊柱152处、骨盆60处、四肢骨20处、颅骨4处。影像学检查显示溶骨性骨性改变123例、成骨性病变17例、混合型骨破坏18例。148例患者中以骨转移为惟一远处癌转移灶85例,合并有其他部位转移63例(40例合并1处其他部位转移、23例合并≥2处其他部位转移)。95例患者出现了骨相关事件(病理性骨折、脊髓压迫、高钙血症和骨痛)。纳入标准:①符合非小细胞肺癌病理或细胞学诊断标准;②确诊为非小细胞肺癌骨转移(经X线、CT、磁共振成像和骨扫描等影像学检查确诊);③临床特征及随访资料完整。排除标准:①因非小细胞肺癌骨转移以外原因死亡者;②其他部位存在肿瘤。
1.2 影响因素分析方法 主要采用电话随访和门诊复查等方式收集所有患者的随访资料。统一摘录年龄、性别、吸烟史、病理类型、肿瘤分期、骨转移灶特征、骨相关事件、生化检查结果、治疗特征、末次随访时间和生存时间等。随访终点事件为死亡或随访至2015年12月31日止,随访率为100%,生存时间为确诊骨转移开始至出现终点事件或最后随访截止时间,生存时间以月为单位计算。采用SPSS19.0统计软件对数据进行统计处理。不同特征非小细胞肺癌患者骨转移后的生存率采用Kaplan-Meier法进行计算,并采用Log-rank检验进行单因素分析,最后采用多元逐步Cox比例风险回归模型(α入=0.05、α出=0.10)探讨影响非小细胞肺癌骨转移预后的相关因素。P<0.05为差异有统计学意义。
2 结果
148例非小细胞肺癌骨转移患者生存时间0~53.0个月、中位生存时间15.0个月,1、2、3年生存率分别为52.0%(77/148)、24.3%(36/148)、8.1%(12/148)。非小细胞肺癌骨转移患者预后影响因素的单因素见表1。单因素分析结果显示,不同肺癌病理类型、不同肿瘤分期、不同ECOG评分、不同骨转移类型、有无合并其他部位转移、有无骨性相关事件患者中位生存期比较,P均<0.05;不同年龄段、性别、肺癌影像学类型和骨性改变类型患者中位生存期比较,P均>0.05。多元Cox逐步回归分析结果显示,非腺癌、ECOG评分0~1分、多发骨转移和合并其他部位转移为非小细胞肺癌骨转移患者预后独立危险因素(表2)。
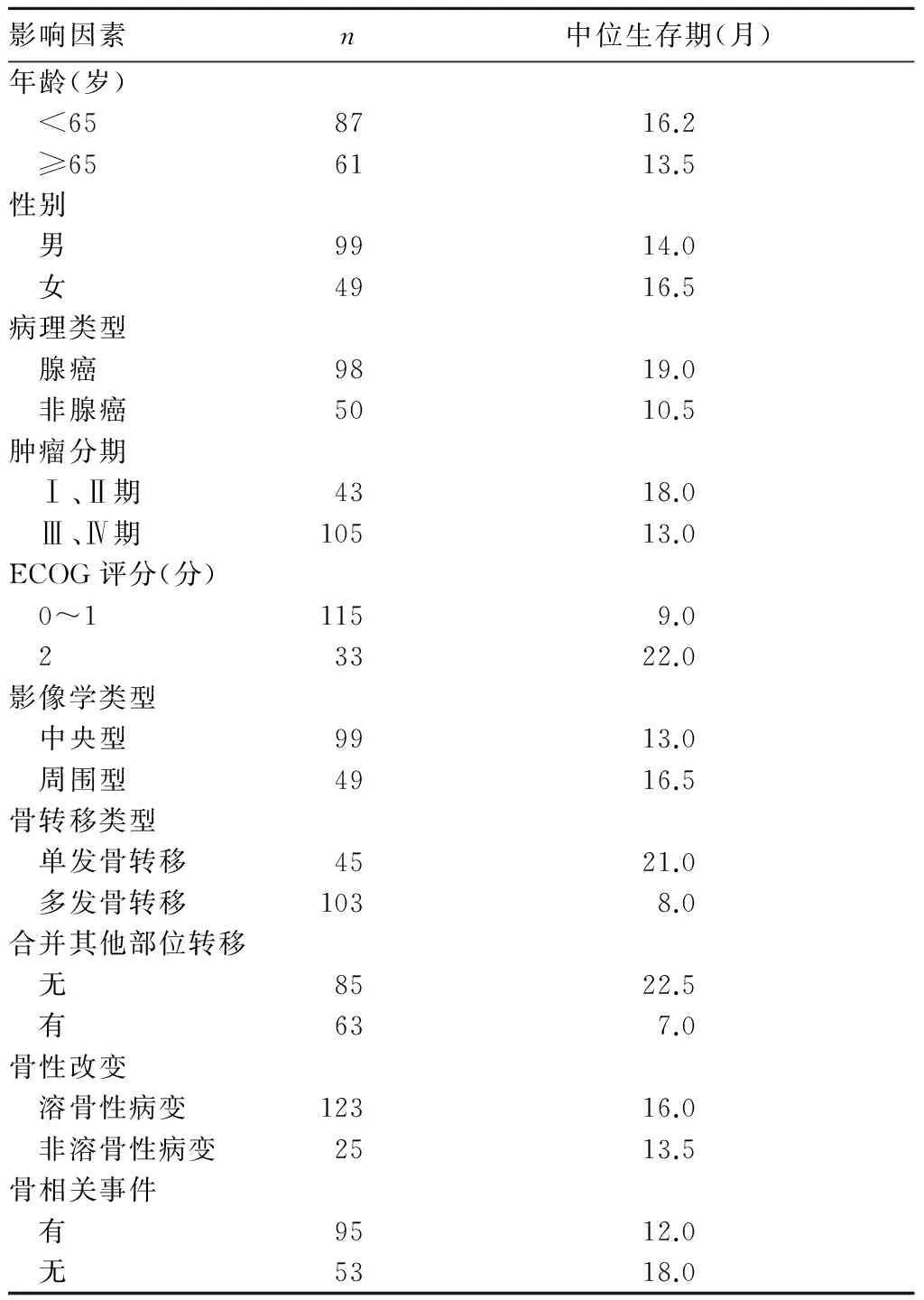
表1 非小细胞肺癌骨转移患者预后影响因素的单因素
3 讨论
由于肺循环血流比较丰富,肿瘤脱落的细胞容易通过血流循环到达全身骨骼系统,因此,骨骼是非小细胞肺癌常见的远处转移部位;同时,随着治疗水平的提高,非小细胞肺癌患者的生存期普遍得到延长,这样导致患者发生骨转移的风险也随之上升[7]。本组非小细胞肺癌患者骨转移好发部位为胸椎和腰椎等脊柱骨,这一结果与既往绝大多数文献[8~10]报道相一致。非小细胞肺癌易转移至脊柱骨和胸部骨骼的原因[11,12]可能是:椎体骨毛细血管丰富,癌细胞容易因定植而出现转移;肺癌病灶离胸部距离最近,且胸部血管较为丰富,肿瘤细胞通过血液播散向胸部骨骼几率上升。本研究还发现,相当一部分(42.6%)非小细胞肺癌骨转移患者同时合并其他部位转移,49例发生肝转移,这一结果与以往研究[13,14]一致,结果提示不论是否出现相应症状都应对肝脏等重要脏器进行检查。同时发现,非小细胞肺癌骨转移主要为溶骨性破坏(83.1%),这一结果与既往报道[15,16]一致,这主要是由于肺癌细胞转移到骨激活破骨细胞,后者释放的细胞因子促进肿瘤细胞分泌,加快骨质破坏,导致骨相关事件[17]。
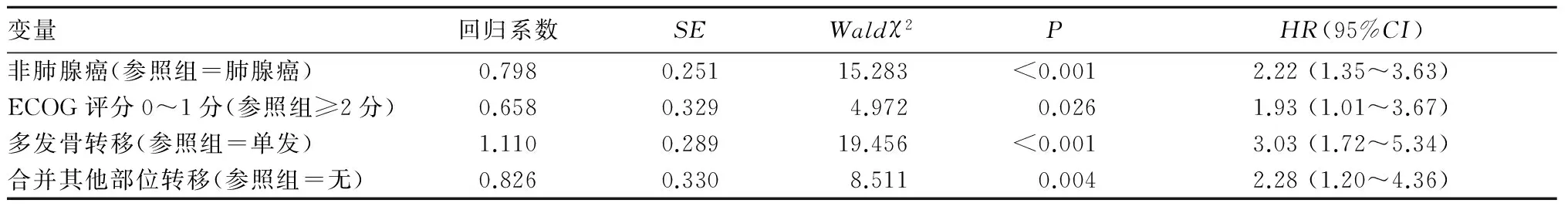
表2 非小细胞肺癌骨转移患者预后影响因素逐步Cox回归模型分析结果
本研究显示,自诊断骨转移后非小细胞肺癌骨转移患者的中位生存时间为15.0个月,1年生存率为52.0%、2年生存率为24.3%、3年生存率为8.1%,这一结果与Wang等[9]和叶骉飞等[13]的研究报道一致,结果表明非小细胞肺癌骨转移患者的预后较差。同时经多元Cox回归模型分析,本研究还发现非小细胞肺癌骨转移患者预后的危险因素为非腺癌、ECOG评分0~1分、多发骨转移和合并其他部位转移,这一结果与以往研究[4,8]结果相一致。这可能是因为:一线治疗失败后,腺癌对靶向药物表皮生长因子敏感突变的酪氨酸激酶抑制剂(EGFR-TKIs)治疗敏感,而肺鳞癌虽也能从EGFR-TKIs治疗中获益,但疗效较腺癌差;存在多处骨转移的肺癌通常预示着肺癌较为活跃,且恶性程度较高,患者的预后自然较差;体力状况ECOG评分是从患者的体力活动来了解其一般健康状况和对治疗耐受能力的指标,评分越低,表明患者治疗反应常不佳,且往往难以耐受化疗反应,患者预后风险增加[18~20]。
综上所述,非腺癌、ECOG评分低、多发骨转移和合并其他部位转移的非小细胞肺癌骨转移患者预后较差。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] 孙燕,管忠震,廖美琳,等.肺癌骨转移诊疗专家共识(2014版)[J].中国肺癌杂志,2014,17(2):57-72.
[4] 刘桢,张涛,朱亚杰,等.非小细胞肺癌骨转移的预后因素分析[J].肿瘤基础与临床,2014,27(5):413-415.
[5] 黄开荣,郑文,韩永清.肺癌伴骨转移286例预后分析[J].中国老年学杂志,2013,33(11):2669-2670.
[6] 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[7] 张慧丰,左萍萍.肺癌转移机制研究进展[J].医学研究杂志,2013,42(10):4-6.
[8] 郭庆志,吴梅娜,安彤同,等.322例非小细胞肺癌骨转移临床特点及治疗的回顾性分析[J].中国肺癌杂志,2014,17(9): 656-662.
[9] Wang Z, Ning L, Li H, et al. Clinical observation of percutaneous osteoplasty in the treatment of 92 lung cancer patients with extraspinal bone metastases[J]. Tumor, 2014,34(5):443-449.
[10] 全柳霞,张菊,万年亮.转移性骨肿瘤患者的临床特点研究[J].实用癌症杂志,2014,29(7):876-878.
[11] 黄开荣,郑文,韩永清.肺癌伴骨转移286例预后分析[J].中国老年学杂志,2013,33(11):2669-2670.
[12] Bae HM, Lee SH, Kim TM, et al. Prognostic factors for non-small cell lung cancer with bone metastasis at the time of diagnosis[J]. Lung Cancer, 2012,77(3):572-577.
[13] 叶骉飞,王斌,代丽,等.408例恶性肿瘤骨转移临床特征分析[J].中国肿瘤临床,2013,40(4):217-220.
[14] 罗会芹,姚艺玮,闫滢,等.46例骨转移为首发表现的非小细胞肺癌的预后分析[J].临床肿瘤学杂志,2014,9(19):819-823.
[15] Cetin K, Christiansen CF, Jacobsen JB, et al. Bone metastasis, skeletal-related events, and mortality in lung cancer patients: a Danish population-based cohort study[J]. Lung Cancer, 2014,86(2):247-254.
[16] 王帅,李钱,卿毅,等.223例非小细胞肺癌骨转移发生骨相关事件的临床因素与预后[J].重庆医学,2015,44(32):4504-4506.
[17] Lipton A, Cook R, Brown J, et al. Skeletal-related events and clinical outcomes in patients with bone metastases and normal levels of osteolysis: exploratory analyses[J]. Clin Oncol (R Coll Radiol), 2013,25(4):217-226.
[18] 段建春,安彤同,吴梅娜,等.晚期肺鳞癌表皮生长因子受体突变与其抑制剂疗效的关系[J].中华结核和呼吸杂志,2012,35(5):323-328.
[19] 刘宇,张幸平,吴红宇,等.258例肺癌骨转移患者的临床及治疗相关因素分析[J].中国肿瘤临床,2012,39(13):914-918.
[20] de Kock I, Mirhosseini M, Lau F, et al. Conversion of Karnofsky Performance Status (KPS) and Eastern Cooperative Oncology Group Performance Status (ECOG) to Palliative Performance Scale (PPS), and the interchangeability of PPS and KPS in prognostic tools[J]. J Palliat Care, 2013,29(3):163-169.
Prognostic factors for bone metastasis of patients with non-small-cell lung cancer
JIANGXiaolan,WANGJia
(SichuanProvincialAcademyofMedicalSciences,SichuanProvincePeople'sHospitalGeneralMedicalCenter,Chengdu610072,China)
Objective To investigate the prognostic influencing factors for bone metastasis of patients with non-small-cell lung cancer (NSCLC). Methods The clinical data from 148 cases of NSCLC patients with bone metastasis were retrospectively analyzed. The survival rates of NSCLC patients with bone metastases of different characteristics were estimated by Kaplan-Meier method, and Univariate analysis was conducted by Log-rank test. The stepwise Cox proportional hazards regression model was used to investigate the relevant prognosis factors for NSCLC patients with bone metastasis. Results The 1, 2 and 3-year survival rates of 148 cases with bone metastasis from NSCLC was 52.0%, 24.3% and 8.1% respectively with median survival time of 15.0 months. Univariate analysis showed that significant difference was found in the median survival time of NSCLC patients with bone metastasis among different kinds of pathological types, tumor staging, ECOG score, types of bone metastasis, combined with or without other parts metastasis, and having osseous related events occurrence or not (allP<0.05). Multivariable Cox regression analysis showed that, non-adenocarcinoma (HR=2.22, 95%CI:1.35-3.63), ECOG 0-1 (HR=1.93, 95%CI:1.01-3.67), multi-bone metastases (HR=3.03, 95%CI:1.72-5.34) and combined with other parts metastasis (HR=2.28, 95%CI:1.20-4.36) were prognostic risk factors. Conclusion The prognostic risk factors for patients with bone metastasis from NSCLC were non-adenocarcinoma, low ECOG score, multiple bone metastasis and combined with other part metastases.
non-small-cell lung cancer; osseous metastasis; survival time; prognostic influencing factors
国家自然科学基金资助项目(81401362);四川省卫生厅科研基金资助项目(120116)。
10.3969/j.issn.1002-266X.2016.35.030
R734.2
B
1002-266X(2016)35-0088-03
2016-03-09)
