胃癌组织Oct4表达变化及意义
2016-12-05郝美玲李春辉
郝美玲,李春辉
(承德医学院附属医院,河北承德067000)
·临床研究·
胃癌组织Oct4表达变化及意义
郝美玲,李春辉
(承德医学院附属医院,河北承德067000)
目的 探讨八聚体结合蛋白4(Oct4)在胃癌发生、发展中的作用及其机制。方法 选择60例胃癌患者手术切除的癌组织及其相应癌旁正常组织,分别应用qRT-PCR技术、Western blotting技术检测Oct4 mRNA和蛋白表达;分析胃癌组织Oct4表达与TGF-β信号通路中TβRⅡ、Smad2、Smad3、E-Cadherin效应因子及患者临床病理参数的关系。结果 胃癌组织Oct4、Smad3 mRNA和蛋白的相对表达量明显高于癌旁正常组织(P均<0.05),TβRⅡ、Smad2、E-Cadherin mRNA和蛋白的相对表达量明显低于癌旁正常组织(P均<0.05)。胃癌组织Oct4表达与TβRⅡ、Smad2、E-Cadherin蛋白表达呈负相关(r分别为-0.887、-0.912、-0.879,P均<0.01),与Smad3蛋白表达呈正相关(r=0.779,P<0.01)。胃癌组织Oct4表达变化与患者性别、年龄无关(P均>0.05),与肿瘤组织分化程度、临床分期、淋巴结转移和浆膜浸润有关(P均<0.05)。结论 胃癌组织Oct4高表达可促进胃癌的发生、发展,其机制可能与Oct4参与调节TGF-β信号通路、诱导细胞发生上皮间质转化有关。
胃癌;八聚体结合蛋白4;TGF-β信号通路;上皮间质转化
八聚体结合蛋白4(Oct4)是由Pou5F1基因编码产生、含POU结构域的转录因子家族成员,可与其他转录因子(如Sox、FoxD3等)结合,共同作用于许多下游靶基因的启动子或增强子,正/负调控下游靶基因的表达。近年研究发现,Oct4过表达与乳腺癌、前列腺癌和结肠癌等发生、发展和转移有关[1,2]。已有研究证实,TGF-β家族是体内诱导上皮间质转化(EMT)的重要原因。TGF-β信号特异性结合TGF-β受体磷酸化Smad2/Smad3复合体,Smad2/Smad3复合体与辅因子Smad4结合进入核内与靶基因特异性结合,调控特定基因的转录[3]。TβRⅡ、Smad2、Smad3作为TGF-β通路信号转导过程中至关重要的响应因子,三者表达异常可引起信号传导异常,诱导EMT的发生,引起E-钙黏着蛋白(E-Cadherin)表达异常[4]。有研究发现,Oct4能通过调节EMT和细胞骨架重组等过程,抑制乳腺癌的肺转移。但其在胃癌中的作用鲜见报道。为此,本研究探讨Oct4在胃癌发生、发展中的作用及其机制。现报告如下。
1 资料与方法
1.1 临床资料 选择2014年6月~2015年6月我院收治的胃癌患者60例,均经术后组织病理检查明确诊断,术前均未行放疗、化疗和免疫治疗。其中,男37例、女23例,年龄39~87岁、中位年龄56岁;TNM分期(2009年国际抗癌联盟分期标准):Ⅰ、Ⅱ期34例,Ⅲ、Ⅳ期26例;组织分化程度:高中分化27例,低分化33例;伴淋巴结转移31例,伴浆膜浸润37例。本研究经医院伦理委员会批准,患者均知情同意。
1.2 Oct4、TβRⅡ、Smad2、Smad3、E-Cadherin mRNA表达检测 采用qRT-PCR法。取胃癌组织及相应癌旁正常组织,TRIzol法提取总RNA,琼脂糖凝胶电泳检测RNA的完整性,并将mRNA逆转录为cDNA。逆转录反应体系20 μL:5x gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1 μL,加RNase Free dH2O至10 μL;Prime Script RT Enzyme MixI 1 μL,RT Prime Mix 1 μL,5x prime Script Buffer 2 4 μL,RNase Free dH2O 4 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 5 min。随后对cDNA进行实时定量PCR扩增。PCR扩增体系:SYBR PrimeMIX Ex Taq Ⅱ 10 μL,Forward Primer 0.8 μL,Reverse Primer 0.8 μL,ROX Reference Dye(50x) 0.4 μL,DNA masterplate 2 μL,dH2O 6 μL。PCR扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,95 ℃ 60 s,55 ℃ 30 s,72 ℃ 30 s。得出溶解曲线和扩增曲线及Ct值;以GAPDH内参作为对照,采用相对定量的2-ΔΔCt法计算Oct4、TβRⅡ、Smad2、Smad3、E-Cadherin mRNA的相对表达量。
1.3 Oct4及TβRⅡ、Smad2、Smad3、E-Cadherin蛋白表达检测 采用Western blotting法。取冻存胃癌组织及相应癌旁正常组织100 g,冰上裂解,PMSF充分匀浆,4 ℃ 5 500 r/min离心20 min,取上清。BCA法检测蛋白浓度合格后,加入上样缓冲液95 ℃水浴5 min;取30 mg蛋白进行SDS-PAGE电泳(12%分离胶+5%浓缩胶),当蛋白跑至浓缩胶与分离胶交界时,将电压由80 mV调至120 mV,当蛋白电泳跑至分离胶底部时,停止电泳;恒流130 mA转膜2 h,取出PVDF膜;用5%封闭液封闭2 h;孵育Oct4、TβRⅡ、Smad2、Smad3、E-Cadherin和GAPDH一抗2 h,置入4 ℃冰箱过夜,次日取出后复温2 h,TBST洗膜3次,每次15 min;孵育羊抗兔抗体2 h,TBST洗膜3次,每次5 min;ECL发光液显影。采用Quantity One V462图像分析软件对蛋白电泳条带的灰度值定量分析,计算蛋白的相对表达量。蛋白的相对表达量=目的蛋白灰度值/β-actin内参灰度值。
2 结果
2.1 胃癌组织与癌旁正常组织Oct4及TβRⅡ、Smad2、Smad3、E-Cadherin表达比较 胃癌组织及癌旁正常组织Oct4 mRNA相对表达量分别为4.54±0.79、1.00±0.00,Smad3 mRNA相对表达量分别为2.92±0.46、1.00±0.00,TβRⅡ mRNA相对表达量分别为0.56±0.06、1.00±0.00,Smad2 mRNA相对表达量分别为1.63±0.21、1.00±0.00,E-Cadherin mRNA相对表达量分别为0.94±0.10、1.00±0.00,胃癌组织Oct4、Smad3 mRNA相对表达量明显高于癌旁正常组织,TβRⅡ、Smad2、E-Cadherin mRNA相对表达量明显低于癌旁正常组织(P均<0.05)。胃癌组织及癌旁正常组织Oct4蛋白相对表量分别为4.54±0.54、1.73±0.22,Smad3蛋白相对表达量分别为2.92±0.39、2.58±0.31,TβRⅡ蛋白相对表达量分别为0.56±0.07、1.22±0.10,Smad2蛋白相对表达量分别为1.63±0.25、4.39±0.56,E-Cadherin蛋白相对表达量分别为0.94±0.11、1.97±0.18。胃癌组织Oct4、Smad3蛋白相对表达量明显高于癌旁正常组织,TβRⅡ、Smad2、E-Cadherin蛋白相对表达量明显低于癌旁正常组织(P均<0.05)。
2.2 胃癌组织Oct4蛋白表达与TβRⅡ、Smad2、Smad3、E-Cadherin蛋白表达的关系 Pearson相关分析显示,胃癌组织Oct4蛋白表达与TβRⅡ、Smad2、E-Cadherin蛋白表达呈负相关(r分别为-0.887、-0.912、-0.879,P均<0.01),与Smad3蛋白表达呈正相关(r=0.779,P<0.01)。
2.3 胃癌组织Oct4蛋白表达与患者临床病理参数的关系 见表1。
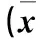
表1 胃癌组织Oct4蛋白表达与患者临床病理参数的关系±s)
3 讨论
有研究在人胚胎干细胞培养条件下,在人毛囊组织中发现Oct4阳性的上皮干细胞和黑色素干细胞均能自我修复和分化成多种细胞。动物试验发现,下调Oct4表达能促进鼠神经干细胞分化[5],异位表达Oct4基因可阻止鼠上皮祖细胞的分化,并能引起上皮细胞的异常增殖[6]。有研究还发现,胃癌、神经胶质瘤、肝癌等多种肿瘤组织中均有Oct4表达,可维持肿瘤细胞的未分化性和自我更新潜能,参与肿瘤的形成与进展。Chang等[7]研究发现,将转染Oct3/4的鼠膀胱癌细胞株(MBT-2/Oct3/4)或转染LacZ的鼠膀胱癌细胞株(MBT-2/LacZ)注入大鼠尾静脉制作肺转移动物模型,肺质量、肿瘤数目和大小明显增加,提示Oct3/4过表达能促进肿瘤细胞的侵袭和转移。因此认为,Oct4能参与成体干细胞和多种肿瘤细胞的自我更新过程,其过表达能促进肿瘤的侵袭和转移。
TGF-β超家族主要由8种蛋白构成整个Smad家族,通过可逆磷酸化对多种信号传导通路进行调节,共同担负着细胞生长、分化、凋亡等过程[8]。TβRⅡ、Smad2和Smad3作为TGF-β信号通路中的响应元件,表达异常会引起此信号通路的转导异常[9]。
EMT是上皮细胞向间充质细胞转化的过程,上皮细胞在该过程中失去细胞极性及与基底膜的连接等上皮表型,获得较高的迁移与侵袭、抗凋亡和降解细胞外基质能力等间充质表型,与肿瘤的发生、发展有关[10~12]。EMT的主要特征为细胞黏附分子(如E-Cadherin)表达减少、细胞角蛋白细胞骨架转化为Vimentin为主的细胞骨架及形态上具有间充质细胞特征等,是上皮细胞来源的恶性肿瘤细胞获得侵袭和迁移能力的重要生物学过程。肿瘤细胞发展到一定程度即可向周围组织浸润和转移,当发生EMT时,其侵袭和迁移能力更强[13]。体外实验证实,发生EMT的肿瘤细胞较正常细胞能更快地穿过Matrige(类似体内的基底膜)[14]。细胞划痕试验证实,发生EMT的肿瘤细胞能更快地使划痕愈合。研究证实,不同Smad蛋白在TGF-β诱导EMT过程中作用不同[15]。在原代培养的肝脏上皮细胞中,敲除Smad3基因能阻止EMT的发生,而敲除Smad2基因即使无TGF-β信号刺激,肝细胞也会自发出现EMT,表明smad3对EMT起促进作用,而Smad2起抑制作用[16]。
细胞发生EMT的重要标志是E-Cadherin表达减少或丢失[17]。E-Cadherin属于Ⅰ型钙黏着蛋白,其胞外结构域在相邻细胞之间以同亲性方式相互结合;胞内分别与α-联蛋白、β-联蛋白以及肌动蛋白形成复合物实现细胞的黏附[18]。E-Cadherin的减少使细胞黏着力下降,甚至极性消失,表现出许多非上皮细胞的特性。因此认为,E-Cadherin基因突变或消失是肿瘤进展和转移过程中的关键分子事件。
本研究结果显示,胃癌组织Oct4、Smad3 mRNA相对表达量明显高于癌旁正常组织,TβRⅡ、Smad2、E-Cadherin mRNA相对表达量明显低于癌旁正常组织。胃癌组织Oct4、Smad3蛋白相对表达量明显高于癌旁正常组织,TβRⅡ、Smad2、E-Cadherin蛋白相对表达量明显低于癌旁正常组织;相关分析显示,Oct4蛋白表达与TβRⅡ、Smad2蛋白表达呈负相关,与Smad3蛋白表达呈正相关;提示Oct4与TGF-β信号通路密切相关。本研究还发现,Oct4蛋白表达与肿瘤组织分化程度、临床分期、淋巴结转移及浆膜浸润有关;表明Oct4可能参与胃癌的浸润和转移。
综上所述,胃癌组织Oct4高表达与胃癌的发生、发展有关,其机制可能与Oct4参与调节TGF-β信号通路、诱导细胞发生EMT有关。
[1] Guseva D, Rizvanov AA, Salafutdinov II, et al. Over-expression of Oct4 and Sox2 transcription factors enhances differentiation of human umbilical cord blood cells in vivo[J]. Biochem Biophys Res Commun, 2014,451(4):503-509.
[2] Lin H, Sun LH, Han W, et al. Knockdown of OCT4 suppresses the growth and invasion of pancreatic cancer cells through inhibition of the AKT pathway[J]. Mol Med Rep, 2014,10(3):1335-1342.
[3] Massagué J. TGF-β signalling in context[J]. Nat Rev Mol Cell Biol, 2012,13(10):616-630.
[4] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014,15(3):178-196.
[5] Okuda T, Tagawa K, Qi ML, et al. Oct-3/4 repression accelerates differentiation of neural progenitor cells in vitro and in vivo[J]. Brain Res Mol Brain Res, 2004,132(1):18-30.
[6] Hochedlinger K, Yamada Y, Beard C, et al. Ectopic expression of Oct-4 blocks progenitor-cell differentiation and causes dysplasia in epithelial tissues[J]. Cell, 2005,121(3):465-477.
[7] Chang CC, Shieh GS, Wu P, et al. Oct-3/4 expression reflects tumor progression and regulates motility of bladder cancer cells[J]. Cancer Res, 2008,68(15):6281-6291.
[8] Lin H, Li N, He H, et al. AMPK inhibits the stimulatory effects of TGF-β on Smad2/3 activity, cell migration and epithelial to mesenchymal transition[J]. Mol Pharmacol, 2015,88(6):1062-1071.
[9] Yi EY, Park SY, Jung SY, et al. Mitochondrial dysfunction induces EMT through the TGF-β/Smad/Snail signaling pathway in Hep3B hepatocellular carcinoma cells[J]. Int J Oncol, 2015,47(5):1845-1853.
[10] Grassi ML, Palma CS, Thomé CH, et al. Proteomic analysis of ovarian cancer cells during epithelial-mesenchymal transition (EMT) induced by epidermal growth factor (EGF) reveals mechanisms of cell cycle control[J]. J Proteomics, 2016.[Epub of ahead of print]
[11] Ji Q, Liu X, Han Z, et al. Resveratrol suppresses epithelial-to-mesenchymal transition in colorectal cancer through TGF-β1/Smads signaling pathway mediated Snail/E-cadherin expression[J]. BMC Cancer, 2015(15):97.
[12] Kang H, Lee M, Jang SW. Celastrol inhibits TGF-β1-induced epithelial-mesenchymal transition by inhibiting Snail and regulating E-cadherin expression[J]. Biochem Biophys Res Commun, 2013,437(4):550-556.
[13] Ko H, Jeon H, Lee D, et al. Sanguiin H6 suppresses TGF-β induction of the epithelial-mesenchymal transition and inhibits migration and invasion in A549 lung cancer[J]. Bioorg Med Chem Lett, 2015,25(23):5508-5513.
[14] Park SY, Kim MJ, Park SA, et al. Combinatorial TGF-β attenuation with paclitaxel inhibits the epithelial-to-mesenchymal transition and breast cancer stem-like cells[J]. Oncotarget, 2015,6(35):37526-37543.
[15] Zhang L, Li Z, Fan Y, et al. Overexpressed GRP78 affects EMT and cell-matrix adhesion via autocrine TGF-β/Smad2/3 signaling[J]. Int J Biochem Cell Biol, 2015(64):202-211.
[16] Ju W, Ogawa A, Heyer J, et al. Deletion of Smad2 in mouse liver reveals novel functions in hepatocyte growth and differentiation[J]. Mol Cell Biol, 2006,26(2):654-667.
[17] Mallini P, Lennard T, Kirby J, et al. Epithelial-to-mesenchymal transition: what is the impact on breast cancer stem cells and drug resistance[J]. Cancer Treat Rev, 2014,40(3):341-348.
[18] Liu X, Yun F, Shi L, et al. Roles of signaling pathways in the Epithelial-Mesenchymal transition in cancer[J]. Asian Pac J Cancer Prev, 2015,16(15):6201-6206.
河北省医学科学研究重点课题计划(ZL20140103)。
李春辉(E-mail: chli612@126.com)
10.3969/j.issn.1002-266X.2016.40.014
R735.2
B
1002-266X(2016)40-0045-03
2016-01-12)
