血管活性肠肽对自身免疫性脑脊髓炎大鼠神经保护作用及其机制
2016-12-05杨元袁正洲吕志宇张淑江李晓红李作孝
杨元,袁正洲,吕志宇,张淑江,李晓红,李作孝
(西南医科大学附属医院,四川泸州646000)
血管活性肠肽对自身免疫性脑脊髓炎大鼠神经保护作用及其机制
杨元,袁正洲,吕志宇,张淑江,李晓红,李作孝
(西南医科大学附属医院,四川泸州646000)
目的 探讨血管活性肠肽(VIP)对自身免疫性脑脊髓炎(EAE)大鼠的神经保护作用及其相关作用机制。方法 将60只健康雌性Wistar大鼠随机分为正常对照组、模型对照组、VIP低剂量组和VIP高剂量组,每组15只。另取10只豚鼠,断颈处死,迅速分离脊髓,研磨匀浆,加入完全弗氏佐剂制备抗原,除正常对照组外均诱导建立EAE模型。自造模当日起,每隔一日VIP低、高剂量组分别腹腔注射VIP 4、16 nmol/kg,正常对照组及模型对照组同期分别腹腔注射0.8 mL生理盐水,连续5次。自造模当日起,记录各组精神、行动等一般情况,EAE潜伏期和进展期,于发病高峰期行神经病残疾评分(NDS)。于发病高峰期处死大鼠,未发病大鼠饲养8周处死,取脑组织。采用ELISA法检测脑组织匀浆IL-17A表达,采用免疫组化SP法检测胶质纤维酸性蛋白(GFAP)阳性细胞的平均光密度值(以此作为GFAP表达)。结果 正常对照组均未发病,模型对照组及VIP低、高剂量组均出现不同程度食量下降、精神萎靡、后肢无力、尾部拖地,且模型对照组症状最重,VIP高剂量组症状最轻。模型对照组及VIP低、高剂量组EAE潜伏期逐渐延长,进展期逐渐缩短;组间两两比较P<0.05或<0.01。模型对照组、VIP低剂量组高峰期NDS均高于VIP高剂量组(P均<0.01)。与正常对照组比较,模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均升高(P均<0.05)。模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均依次降低,组间两两比较P均<0.05。结论 VIP对EAE大鼠具有神经保护作用,并呈一定浓度依赖性;降低脑组织IL-17A表达、抑制星形胶质细胞活化可能是其作用机制之一。
自身免疫性脑脊髓炎;血管活性肠肽;白细胞介素17A;星形胶质细胞;大鼠
多发性硬化(MS)是一种中枢神经系统(CNS)自身免疫性疾病,其基础研究多采用自身免疫性脑脊髓炎(EAE)动物模型。MS患者Th1/Th2细胞免疫平衡被破坏,最终发生炎性细胞浸润、白质脱髓鞘、轴突变性等病理改变[1]。随着对自身免疫性疾病的进一步研究发现,由Th17细胞产生的IL-17A可通过与其受体结合加速中枢炎症反应,可能与EAE的发生有关[2,3]。研究表明,血管活性肠肽(VIP)可诱导免疫细胞增殖、分化及迁移,抑制炎性因子(IL-17A、IFN-γ、NO等)的合成及分泌,发挥免疫调节作用[4]。VIP治疗类风湿关节炎的效果较好[5],但其对MS的治疗作用及其相关机制报道较少。为此,我们于2014年6月~2015年1月进行了如下研究。
1 材料与方法
1.1 材料 动物:健康雌性Wistar大鼠60只,6~8周龄,体质量200~250 g;健康豚鼠10只,雌雄不限,6~8周龄,体质量250~300 g;均购于泸州医学院实验动物中心。试剂:VIP(0.5 mg/支)购于北京博奥森生物技术有限公司;完全弗氏佐剂(CFA)购于美国Sigma公司,IL-17A ELISA试剂盒购于广州雅怡生物科技有限公司;兔抗胶质纤维酸性蛋白(GFAP)多克隆抗体(1∶160)购于上海雅吉生物科技有限公司;免疫组化试剂盒购于武汉博士德生物工程有限公司。
1.2 免疫抗原制备 断颈处死10只豚鼠,无菌条件下迅速分离脊髓,去脊膜。称质量后移入玻璃匀浆器,与等量生理盐水混合,研磨成50%的全脊髓匀浆(WSCH)。将CFA与WSCH等体积混合,采用玻璃注射器抽打至油包水乳状,以滴在水面不散确定为合格抗原。
1.3 动物分组及EAE模型制备 将60只Wistar大鼠随机分为正常对照组、模型对照组、VIP低剂量组、VIP高剂量组,每组15只。取1.2中制备好的免疫抗原,以0.2 mL/100 g注入模型对照组及VIP低、高剂量组双侧后肢足掌皮下,正常对照组注射等量生理盐水和CFA混合液。自造模当日起,VIP低剂量组每隔一日腹腔注射VIP 4 nmol/kg(约0.2 mL),VIP高剂量组腹腔注射VIP 16 nmol/kg(约0.8 mL),正常对照组及模型对照组同期腹腔注射0.8 mL生理盐水,共5次。
1.4 相关指标观察
1.4.1 发病情况 自造模当日起,记录各组精神、行动等一般情况,EAE潜伏期(从大鼠正常饮食、活动到出现食量下降、活动能力降低的时间)和进展期(从大鼠活动能力降低到出现自伤后肢、精神极度衰弱、瘫痪、抽搐的时间)。大鼠出现爬行困难、自伤后肢、精神极度衰弱、瘫痪(单肢体、双肢体、四肢)、抽搐、濒死或死亡为发病高峰期,由同一观察者于发病高峰期采用Kono′s评分标准行神经病残疾评分(NDS)。
1.4.2 脑组织IL-17A表达 于发病高峰期处死大鼠,未发病大鼠饲养8周处死。无菌条件下采用组织剪剖开顶、枕、颈部皮肤及皮下组织,用镊子沿枕骨大孔向上打开颅骨;向下分离颈椎棘突,充分暴露脑组织;剪开侧脑室,PBS反复冲洗后取出脑组织。将脑组织与生理盐水制成体积分数为10%的脑组织匀浆,3 500 r/min离心10 min。取上清液,于-20 ℃冰箱保存。采用ELISA法检测脑组织匀浆上清液IL-17A表达。严格按照试剂盒说明书进行操作。
1.4.3 脑组织星形胶质细胞活化情况 采用免疫组化SP法。将大鼠脑组织制成石蜡切片,常规脱蜡、水化、清除内源性过氧化物酶活性、封闭组织蛋白,逐次滴加兔抗GFAP多克隆抗体一抗(以1∶160 稀释)、生物素标记的山羊抗兔IgG二抗、辣根酶标记的链霉卵白素。常规DAB显色,复染,脱水,透明,封片。于400倍光镜下观察大鼠脑组织GFAP表达情况,以细胞质染成棕黄色判定为阳性细胞。采用ImagePro Plus软件对GFAP阳性细胞的平均光密度(IOD)值进行半定量分析,以此反映脑组织星形胶质细胞活化情况。

2 结果
2.1 各组发病情况 正常对照组均未发病,模型对照组及VIP低、高剂量组均出现不同程度食量下降、精神萎靡、后肢无力、尾部拖地,造模第14~17天症状最典型,表现为双侧后肢无力拖地、行走画圈、爬行困难、自伤后肢、精神极度衰弱、瘫痪、抽搐。模型对照组症状最重,VIP高剂量组症状最轻。各组均未出现死亡。模型对照组及VIP低、高剂量组EAE潜伏期逐渐延长,进展期逐渐缩短;组间两两比较P<0.05或<0.01。模型对照组及VIP低剂量组高峰期NDS均高于VIP高剂量组(P均<0.01)。见表1。
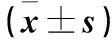
表1 模型对照组及VIP低、高剂量组EAE潜伏期、进展期及NDS比较
注:与模型对照组比较,#P<0.05,*P<0.01;与VIP低剂量组比较,△P<0.05,▲P<0.01。
2.2 各组脑组织IL-17A及GFAP表达比较 与正常对照组比较,模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均升高(P均<0.05)。模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均依次降低,组间两两比较P均<0.05。见表2。
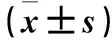
表2 各组脑组织IL-17A及GFAP表达比较
注:与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.05,△P<0.01;与VIP低剂量组比较,▲P<0.01。
2.3 NDS与脑组织IL-17A及GFAP表达的关系 模型对照组NDS与脑组织IL-17A、GFAP表达均呈正相关(r分别为0.798、0.825,P均<0.05)。
3 讨论
VIP是一种非胆碱能非肾上腺能神经递质,由28个氨基酸残基组成,属于胰高血糖素-胰泌素家族。VIP通过与其受体结合,具有调节神经血管、脑血流、皮层能量代谢、下丘脑和垂体间功能、扩张血管作用。脑内注射VIP可明显减小脑缺血后梗死体积,说明其具有神经保护作用。本研究结果显示,造模后模型对照组及VIP低、高剂量组均出现不同程度食量下降、精神萎靡、后肢无力、尾部拖地等EAE样表现,但模型对照组症状最重,VIP高剂量组症状最轻;且模型对照组及VIP低、高剂量组EAE潜伏期逐渐延长,进展期逐渐缩短;说明VIP可减缓EAE的发病进程。本研究模型对照组、VIP低剂量组NDS均明显高于VIP高剂量组,说明VIP对EAE大鼠具有一定的神经保护作用,且高剂量时效果更明显。
IL-17A是一种具有强烈促炎作用的细胞因子,其主要作用包括:①调节固有免疫症[6,7]:IL-17A作为炎症介质,参与自身免疫性炎症性疾病的发生、发展,通过作用于基因靶点产生急性期反应蛋白、炎症趋化因子等物质;同时上调组织相容性复合体-Ⅱ抗原、集落共刺激因子、T细胞刺激因子表达,促使T细胞活化,导致免疫失衡。②信号转导作用[8,9]:IL-17A作为细胞内及细胞间信使,参与信号转导过程,可促进多种炎性蛋白的转录及合成,加速免疫紊乱。星形胶质细胞作为中枢神经系统的一种非特异性抗原提呈细胞,参与复杂的免疫病理过程[10]。本研究结果显示,与正常对照组比较,模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均升高,模型对照组及VIP低、高剂量组脑组织IL-17A及GFAP表达均依次降低。说明VIP对EAE大鼠的神经保护作用可能与其降低脑组织IL-17A表达、抑制星形胶质细胞活化有关,并呈一定的浓度依赖性。EAE大鼠脑组织IL-17A表达升高,可能通过Act1转录因子激活星形胶质细胞,从而促进炎症因子释放,加速髓鞘脱失的发生、发展[11,12],同时活化的星形胶质细胞通过上调GFAP表达,形成活化的胶质斑块[13];而VIP可减轻上述反应,从而发挥神经保护作用[14]。
Abad等[15]在体外抗原激发实验中发现,VIP基因剔除 (VIP KO) 的EAE小鼠在免疫效应期未受到损害,而将髓鞘少突胶质细胞糖蛋白35-55多肽诱导的EAE小鼠VIP基因剔除后,从其体内分离出的淋巴细胞能将EAE疾病过继转移给野生型小鼠。VIP基因剔除的小鼠对EAE耐受的机制还有待进一步阐明,但在脑脊膜和脊髓内有CD4+T细胞、Th17细胞的入侵,而在中枢神经系统实质却没有免疫细胞的侵入。因此认为其可能存在淋巴细胞迁徙的免疫缺陷。
综上所述,VIP对EAE大鼠具有神经保护作用,并呈一定浓度依赖性;降低脑组织IL-17A表达、抑制星形胶质细胞活化可能是其作用机制之一。
[1] Milo R, Miller A. Revised diagnostic criteria of multiple sclerosis[J]. Autoimmun Rev, 2014,13(4-5):518-524.
[2] Adamik J, Henkel M, Ray A, et al. The IL17A and IL17F loci have divergent histone modifications and are differentially regulated by prostaglandin E2in Th17 cells[J]. Cytokine, 2013,64(1):404-412.
[3] Jafarzadeh A, Azizi SV, Nemati M, et al. Ginger extract reduces the expression of IL-17 and IL-23 in the sera and central nervous system of EAE mice[J]. Iran J Immunol, 2015,12(4):288-301.
[4] Ran WZ, Dong L, Tang CY, et al. Vasoactive intestinal peptide suppresses macrophage-mediated inflammation by downregulating interleukin-17A expression via PKA- and PKC-dependent pathways[J]. Int J Exp Pathol, 2015,96(4):269-75.
[5] Sethi V, Rubinstein I, Kuzmis A, et al. Novel, biocompatible, and disease modifying VIP nanomedicine for rheumatoid arthritis[J]. Mol Pharm, 2013,10(2):728-738.
[6] Patel DD, Kuchroo VK. Th17 cell pathway in human immunity: lessons from genetics and therapeutic interventions[J].Immunity, 2015,43(6):1040-1051.
[7] Sharma J, Balakrishnan L, Datta KK, et al. A knowledge base resource for interleukin-17 family mediated signaling[J]. J Cell Commun Signal, 2015,9(3):291-296.
[8] Krstic J, Obradovic H, Kukolj T, et al. An overview of interleukin-17A and interleukin-17 receptor a structure, interaction and signaling[J]. Protein Pept Lett, 2015,22(7):570-578.
[9] Waisman A, Hauptmann J, Regen T. The role of IL-17 in CNS diseases[J]. Acta Neuropathol, 2015,129(5):625-637.
[10] Yang JF, Tao HQ, Liu YM, et al. Characterization of the interaction between astrocytes and encephalitogenic lymphocytes during the development of experimental autoimmune encephalitomyelitis (EAE) in mice[J]. Clin Exp Immunol, 2012,170(3):254-265.
[11] Kang Z, Altuntas CZ, Gulen MF, et al. Astrocyte-restricted ablation of interleukin-17-induced Act1-mediated signaling ameliorates autoimmune encephalomyelitis[J]. Immunity, 2010,32(3):414-425.
[12] Kang Z, Wang C, Zepp J, et al. Act1 mediates IL-17-induced EAE pathogenesis selectively in NG2+glial cells[J]. Nat Neurosci, 2013,16(10):1401-1408.
[13] Yan Y, Ding X, Li K, et al. CNS-specific Therapy for Ongoing EAE by Silencing IL-17 Pathway in Astrocytes[J]. Mol Ther, 2012,20(7):1338-1348.
[14] 庄文欣,刘宗昱,王雪净,等.血管活性肠肽对帕金森病大鼠黑质胶质细胞活化及相关炎性因子释放的影响[J].解剖学报,2016,47(2):178-184.
[15] Abad C, Tan YV, Lopez R, et al. Vasoactive intestinal peptide loss leads to impaired CNS parenchymal T-cell infiltration and resistance to experimental autoimmune encephalomyelitis[J]. Proc Natl Acad Sci USA, 2010,107(45):555-560.
泸州医学院附属医院青年基金资助项目(14036)。
李作孝(E-mail: lzx3235@sina.com)
10.3969/j.issn.1002-266X.2016.40.012
R744.5
A
1002-266X(2016)40-0040-03
2016-01-05)
