荒漠植物新疆阿魏种子萌发与阿魏菇真菌的互作研究
2016-12-04,,,,,
, , , , ,
(1.新疆农业大学农学院, 乌鲁木齐 830052;2.新疆农业科学院 a.微生物应用研究所; b.生物质能源研究所, 乌鲁木齐 830091;3.鲁东大学生命科学学院, 山东 烟台 264025)
·研究报告·
荒漠植物新疆阿魏种子萌发与阿魏菇真菌的互作研究
班娜1,2a,王卉2b,张萍3,朱建军3,郝秀英2a,王芳1
(1.新疆农业大学农学院, 乌鲁木齐 830052;2.新疆农业科学院 a.微生物应用研究所; b.生物质能源研究所, 乌鲁木齐 830091;3.鲁东大学生命科学学院, 山东 烟台 264025)
对阿魏种子进行人工接种5株阿魏菇真菌的菌块和菌液,置于种子4 ℃最佳沉积温度下共培养90 d,探讨阿魏菇真菌对荒漠植物新疆阿魏种子发芽的影响,揭示阿魏菇真菌生于阿魏植物根上现象的过程和本质。结果表明,阿魏菇真菌的菌丝体生长势依次为菌丝体与种子有接触试验组gt;对照组(仅菌块)gt;菌丝体与种子无接触试验组。当接入菌块时,新疆阿魏种子发芽率依次为对照组(仅阿魏种子)gt;种子与菌丝体无接触试验组 gt;种子与菌丝体有接触试验组;当接入菌液时,新疆阿魏种子发芽率依次为对照组(仅阿魏种子)gt;1/2灭活原液试验组gt;1/2原液试验组gt;灭活原液试验组gt;原液试验组。实验表明,阿魏菇真菌的存在对新疆阿魏种子发芽是不利的,这从另一个侧面反映了在荒漠环境条件下收获的新疆阿魏种子上是不允许阿魏菇真菌定殖的,阿魏菇真菌进行水平传递,保持迅速传播优势,通过寄主开花结果死亡实现更换新的寄主,这与野外调查和生产实践中见到的自然现象一致。
新疆阿魏; 阿魏菇真菌; 种子发芽; 菌丝体; 发酵菌液
阿魏植物隶属于伞形科(Apiaceae Lindley或Umbelliferae Jussieu)芹亚科(Apioideae Drude)前胡族(Peucedaneae Drude) 阿魏亚族(Ferulinae Drude) 阿魏属(FerulaLinne),全球有150种或170余种,主要分布在欧洲南部地中海地区、非洲北部、中亚地区和亚洲西南部[1-3]。《中国植物志》上记录我国有26种,产于新疆20种[3]。《新疆植物志》上记录我国有31种,分布新疆25种[4]。由于极端多样和严酷的生存环境,本类群仍处于动荡、分化、重组和适应的复杂过程,有许多问题亟待深入研究。民间根据有无蒜臭味分为香阿魏和臭阿魏,传统用的阿魏属于臭阿魏类,具有消积、杀虫和主治痢疾等药用价值[5-6]。近年来,因发现阿魏中具有抗H 1 N 1甲型流感病毒和抗癌物质活性成分而倍受人们关注[7-8]。另外还有报道阿魏提取物能通过保持胰细胞的完整性来防治糖尿病[9]。阿魏植物属于早春类短命植物,是早春短命植物区系中独一无二的高大植物,它们常常参与形成大面积的阿魏滩蒿属荒漠,对区域生态系统的稳定起着极其重要的作用。在生产实践中,其分布较集中的地区,正是四季牧场中的春秋场,特别是春场,新萌生的植物对恢复牲畜冬瘦春乏扮演重要的角色[10-11]。但是,由于对阿魏植物资源滥采乱挖、无节制放牧和过度筑路开荒,致使脆弱生态严重失衡,栖息地被迫变迁,分布面积极度萎缩,重要物种濒临灭绝,生物多样性遭遇降低甚至丢失境地[12]。阿魏菇(PleurotusferulaeLenzi),又名阿魏侧耳、阿魏蘑,因野生寄生或腐生在中药阿魏植物肥大的根茎部,而得俗名阿魏菇。我国传统中医认为阿魏菇具有与中药阿魏相同的药物功效[13-14]。
目前,对阿魏植物与阿魏菇关系的研究主要集中在添加阿魏植物成分后对阿魏菇菌丝体生长、子实体发育和品质及功效方面[15-17],发现阿魏植物能提高阿魏菇出菇率,促进阿魏菇的生长发育和子实体的形成。但是对阿魏菇真菌生于阿魏植物根上自然现象的过程和本质,尤其是阿魏菇真菌对荒漠植物阿魏的作用几乎未见报道。本试验拟通过人工接种阿魏菇真菌到药用荒漠植物新疆阿魏(FerulasinkiangensisK.M.Shen)上,研究阿魏菇对阿魏植物种子萌发的影响,揭示其现象和作用,探索新疆特色植物资源适应荒漠极端干旱环境的机制,以期为阿魏植物和阿魏菇真菌2种资源的保护,道地阿魏药材的可持续开发利用及荒漠生态系统的恢复和稳定提供参考。
1 材料与方法
1.1 材 料
新疆阿魏种子于2013—2014年搜集自伊犁哈萨克自治州伊宁县喀什乡拜什墩山区。5个阿魏菇菌株W 1、W 2、W 3、W 4、W 5分别采集自新疆塔城地区裕民县、阿勒泰地区富蕴县、市售栽培种1、市售栽培种2和阿勒泰地区青河县。
1.2 方 法
1.2.1 培养基
培养基①:真菌活化固体培养基。去皮马铃薯200 g/L+葡萄糖20 g/L+琼脂16 g/L。
培养基②:菌块与种子萌发培养基。1/2 MS+蔗糖30 g/L +马铃薯25 g/L+琼脂6 g/L。
培养基③:真菌发酵液体培养基。去皮马铃薯25 g/L,葡萄糖20 g/L,蛋白胨3 g/L,磷酸二氢钾2 g/L,硫酸镁1 g/L。
1.2.2 阿魏菇真菌菌液制备
在无菌条件下,将在活化培养基①上长满培养皿的阿魏菇菌株用打孔器取直径为0.6 cm菌块,接入装有发酵培养基③的三角瓶中,置于24 ℃、120 r/min的摇床中,培养30 d后,将菌液过滤,上清液备用。
1.2.3 新疆阿魏种子预处理
将野外采集的新疆阿魏种子先用75%酒精冲洗30 s,再用30% H2O2溶液浸泡40 min,之后用无菌水冲洗3~6次,无菌水中浸泡24 h。
1.2.4 实验处理
1) 新疆阿魏种子与阿魏菇菌块互作:在无菌条件下,将在活化培养基①中生长至满皿的5株阿魏菇真菌,用打孔器取直径为0.6 cm的菌块,分别接种到萌发培养基②中,同时向萌发培养基②四周植入新疆阿魏种子(试验组D,即菌丝与种子无接触条件下),以D-W 1~W 5表示;未植入新疆阿魏种子的为对照组(试验组A),以A-W 1~W 5表示。另将5株真菌菌块分别接种到萌发培养基②中,置于24 ℃黑暗条件下培养至菌丝长满培养皿时,再向培养基②四周植入新疆阿魏种子(试验组E,即菌丝与种子有接触条件下),以E-W 1~W 5表示;未植入新疆阿魏种子的为对照组(试验组B),以B-W 1~W 5表示。另设一组对照(ck),为新疆阿魏种子直接植入萌发培养基②四周。依照A、B、ck、D、E处理,每组每个处理20皿,置于4 ℃沉积温度下培养90 d,重复3次,进行发芽率(90 d的结果)、菌丝生长速率等的统计和观察(每10 d统计1次)。
2) 新疆阿魏种子与阿魏菇菌液互作:将1.2.2制备的阿魏菇菌液,按原菌液试验组(H试验组)、1/2原菌液试验组(1/2 H试验组)、灭活原菌液试验组(S试验组)、1/2灭活原菌液试验组(1/2 S试验组)、发酵培养基组(ck 1)、1/2发酵培养基组(ck 2)6个处理倒入三角瓶的无菌发芽纸上,再植入消毒后的阿魏种子,每个处理组7个三角瓶,置于4 ℃黑暗条件下培养90 d,重复3次。
1.3 统计指标
1) 发芽率(%)=第90天的发芽种子数/总播种数×100%;
2) 菌丝生长速率(cm/10 d)=菌落生长半径(cm)/菌丝生长天数(10 d)。
采用 Microsoft Excel 2010软件和SPSS 11.0软件对数据进行分析处理。
2 结果与分析
2.1 无接触条件下,新疆阿魏种子对阿魏菇菌块生长的影响
在阿魏菇真菌菌块刚接入的培养皿里,进行植入新疆阿魏种子(试验组D)和未植入的(试验组A)2种处理,4 ℃下共培养90 d后,菌丝生长状况完全不同。由表1可知,在未植入新疆阿魏种子的处理中,5个阿魏菇菌株的菌丝体在低温下都能够生长,只是生长速率有差异,依次为W 1gt;W 3gt;W 2gt;W 4gt;W 5。其中:W 1菌株的菌丝生长速率最快(0.747 cm/10 d),与其它菌株的菌丝体生长速率相比存在极显著差异,并且表现为早期生长较快;W 5菌株的生长速率最慢(0.276 cm/10 d);W 2与W 5、W 3与W 4和W 5菌株之间没有显著差异,其它各菌株之间均呈极显著差异。当培养到60 d时,W 1菌株的菌丝已经长满至整个培养皿,其它4个菌株的菌丝在培养90 d时还未长满培养皿。但是,在植入新疆阿魏种子的处理中,5个阿魏菇菌株的菌丝均没有生长,如图4,图7。说明阿魏种子在萌发过程中释放了阻碍阿魏菇真菌菌丝生长的物质。
表1 4 ℃下5株阿魏菇真菌菌丝体生长速率
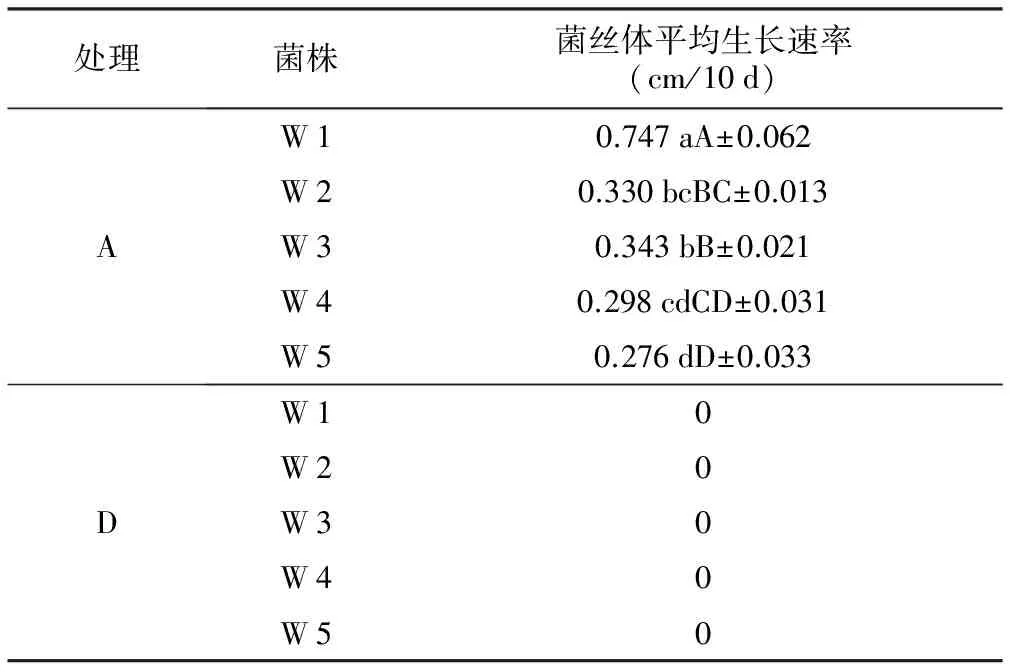
处理菌株菌丝体平均生长速率(cm/10d)AW10.747aA±0.062W20.330bcBC±0.013W30.343bB±0.021W40.298cdCD±0.031W50.276dD±0.033DW10W20W30W40W50
注:小写字母表示差异显著(plt;0.05),大写字母表示差异极显著(plt;0.01)。
2.2 有接触条件下,新疆阿魏种子对阿魏菇菌丝体生长的影响
在阿魏菇真菌菌丝体已经长满的培养皿里,进行植入新疆阿魏种子(试验组E)和未植入的(试验组B)2种处理,4 ℃下共培养90 d后,菌丝体生长势同样具有明显的差异。由表2可知,未植入新疆阿魏种子的5个阿魏菇菌株菌丝体都有生长,且菌丝体均为白色,分枝较多,呈现蓬松状;从生长量来看,W 1菌株的分枝密度及生长量最大,其余依次为W 2=W 3gt;W 4gt;W 5(如图5)。可是,在植入新疆阿魏种子后,5个菌株的菌丝体生长量显著增加,种子周围菌丝体呈白色且浓密,其中W 1生长量最大,几乎覆盖新疆阿魏植物种子的表面,其余菌株的生长量依次为W 2=W 3gt;W 4gt;W 5(如图8)。结果显示,与种子接触后,阿魏菇真菌菌丝体直接从种子里汲取营养供给自身快速生长。
表2 菌块至长满培养皿后植入和未植入种子的菌丝体长势
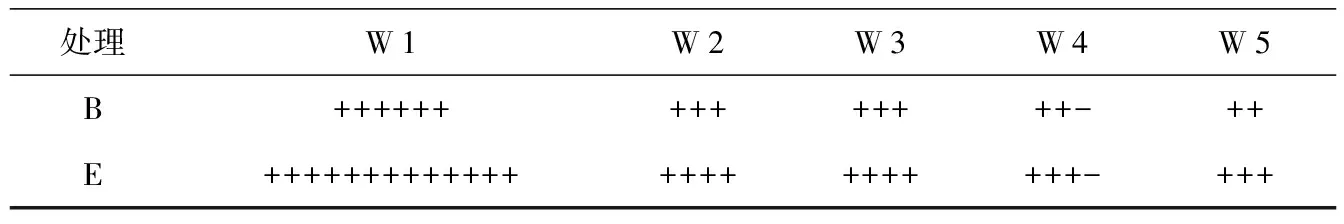
处理W1W2W3W4W5B++++++++++++++-++E++++++++++++++++++++++++-+++
2.3 阿魏菇真菌菌块对新疆阿魏种子发芽率的影响
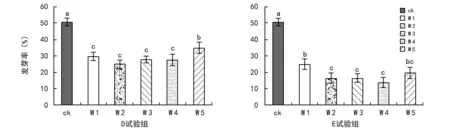
图1 阿魏菇真菌菌丝体对新疆阿魏种子发芽率的影响
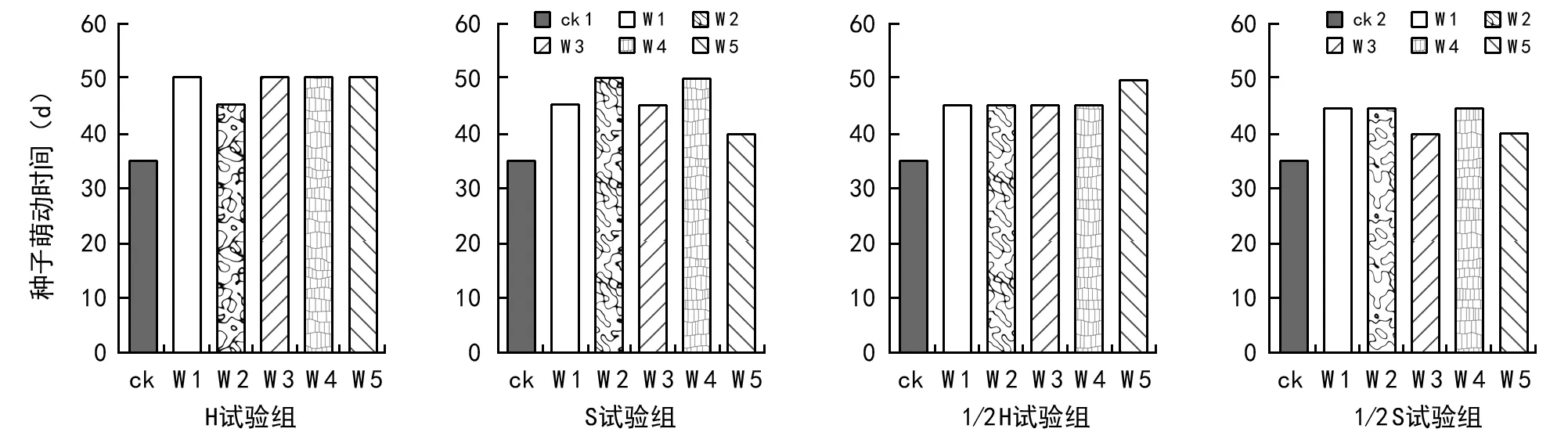
图2 阿魏菇发酵菌液对阿魏种子萌动时间的影响
同时分别将5株阿魏菇真菌菌块和新疆阿魏种子接种于培养基②上,4 ℃下共培养90 d后,新疆阿魏种子均不同程度可以萌发,但种子发芽率都较对照低,依次为ckgt;W 5gt;W 1gt;W 4gt;W 3gt;W 2(见图1 D试验组)。另分别将5株阿魏菇真菌菌块在24 ℃暗培养至培养皿中长满菌丝,再植入新疆阿魏种子,置4 ℃下共培养90 d后,种子发芽率也都较对照更低,依次为ckgt;W 1gt;W 5gt;W 2gt;W 3gt;W 4(见图1 E试验组)。方差分析:在D试验组中,ck与各菌株之间均呈显著差异,W 5与其它菌株呈显著差异,其它菌株之间没有显著性差异;在E试验组中,ck与各菌株之间差异也都呈显著水平,W 1与W 2、W 3、W 4菌株之间差异呈显著水平,与W 5差异不显著。统计得出,新疆阿魏种子发芽率为ck组gt;D试验组gt;E试验组,且种子发芽率均未达到60%(见图1,图6,图7,图8)。实验表明,无论阿魏菇真菌与阿魏植物种子是否接触,阿魏菇真菌的存在都对种子发芽产生抑制作用,尤其是当与阿魏种子有接触时,能够从种子中汲取营养,而对种子发芽的抑制作用更强。
2.4 阿魏菇真菌发酵菌液对新疆阿魏种子萌动时间和发芽率的影响
在阿魏菇真菌发酵菌液对阿魏种子萌动时间影响的4个处理中,对照试验组(ck 1、ck 2)种子萌动所需时间最短,35 d种子就可萌动,而4个试验组种子所需萌动时间都比ck延长了5~15 d(见图2)。这些表明阿魏菇真菌菌液对新疆阿魏种子萌动有延迟的效应,从而推断阿魏菇真菌在新疆阿魏种子萌发的起始阶段就已经产生明显的抑制作用。
注:“+”和“-”分别为1倍生长量和0.5倍生长量。
在阿魏菇真菌发酵菌液对新疆阿魏种子发芽率影响的4个处理中,在H试验组里ck 1种子发芽率最高,为51.39%;其次是W 3菌液处理,为27.78%;W 4菌液处理的最低,为12.96%;且W 3与W 5、W 1、W 2和W 4菌液处理之间差异不显著,其它菌液处理之间差异呈显著水平。在1/2 H试验组里ck 2种子发芽率最高,为55.56%;其次是W 5菌液处理,为35.18%;W 2菌液处理最低,为14.81%;且ck与其它菌液处理之间、W 2与W 1、W 3、W 5之间差异呈显著水平,其它菌液处理之间差异不显著。在S试验组里ck 1种子发芽率最高,为51.39%;其次是W 2菌液处理,为26.30%;W 4菌液处理的最低,为16.67%;且ck与其它菌液处理、W 2与W 4菌液处理之间差异都呈显著水平,其它菌液处理之间差异不显著。在1/2 S试验组里ck 2种子发芽率最高,为55.56%;其次是W 1菌液处理,为48.70%;W 2菌液处理的最低,为31.48%;且ck与W 1、W 1与W 5、W 2、W 3和 W 4之间差异均不显著,其它菌液处理之间差异呈显著水平。统计结果,阿魏种子发芽率基本呈现为:ck组gt;1/2 S试验组gt;1/2 H试验组gt;S试验组gt;H试验组(见图3)。实验表明,阿魏菇真菌在培养时能够产生对阿魏种子发芽的抑制物质,该物质在其发酵过程中分泌到培养液里,并耐高温、高压。由于在未灭活的阿魏菇真菌发酵液中,还有阿魏菇真菌活菌存在,其可以从种子里汲取营养,从而导致阿魏种子发芽率降得更低。
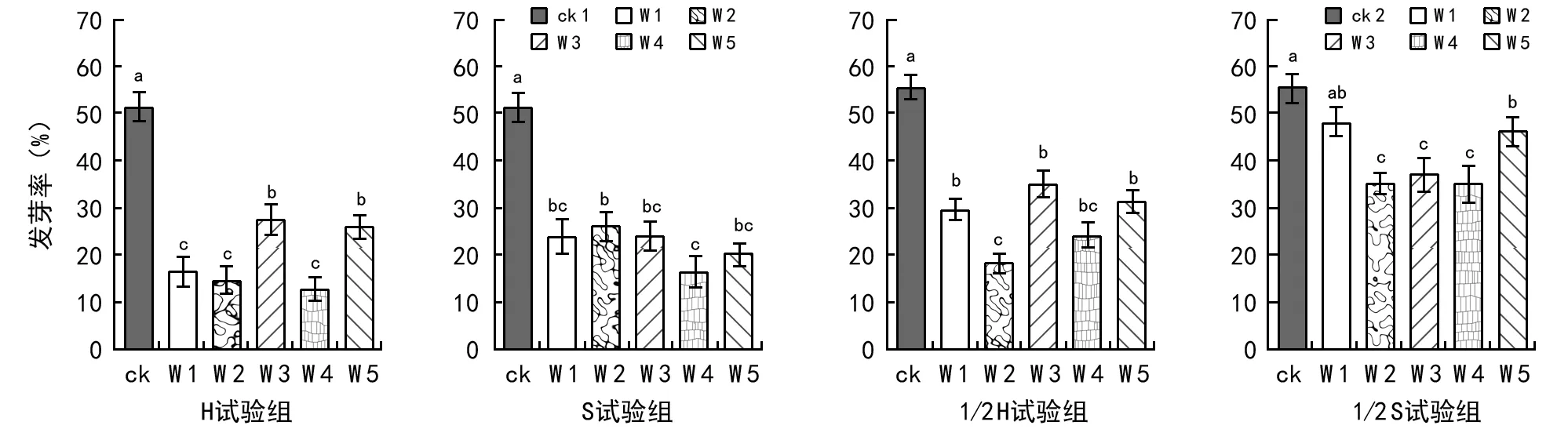
图3 阿魏菇真菌发酵菌液对阿魏种子发芽率的影响
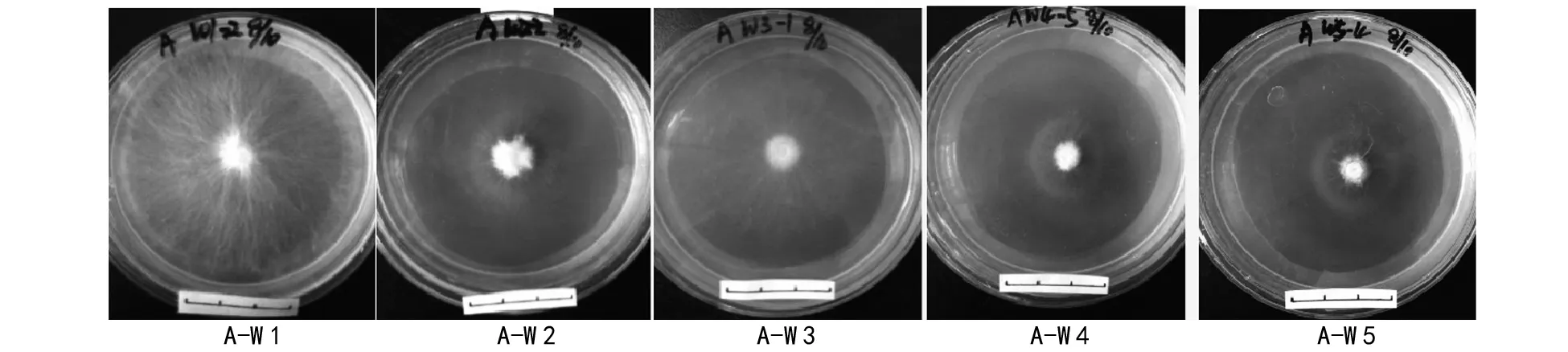
图4 4 ℃低温下仅接种菌块后菌丝生长状况(A试验组)
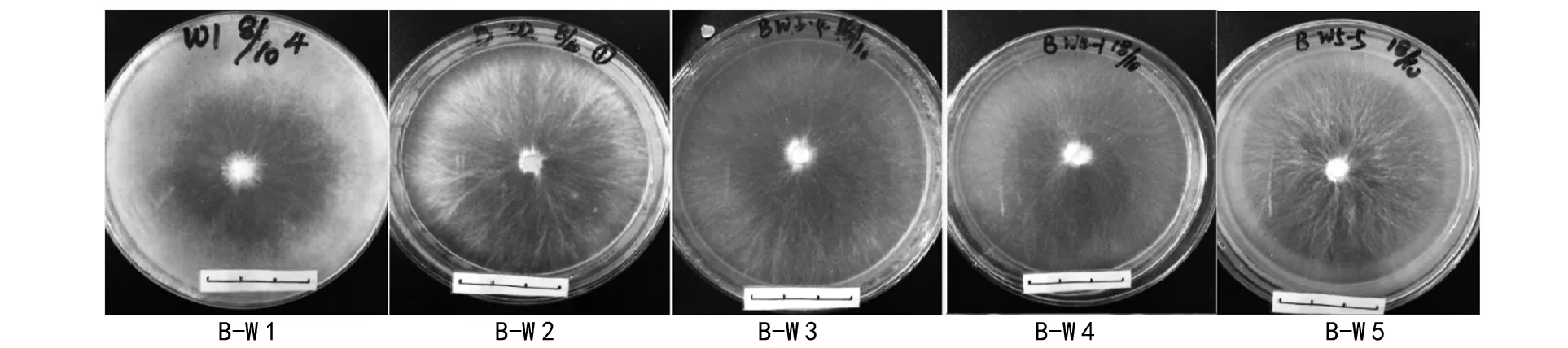
图5 菌块至长满培养皿后未植入种子的菌丝体生长状况(B试验组)
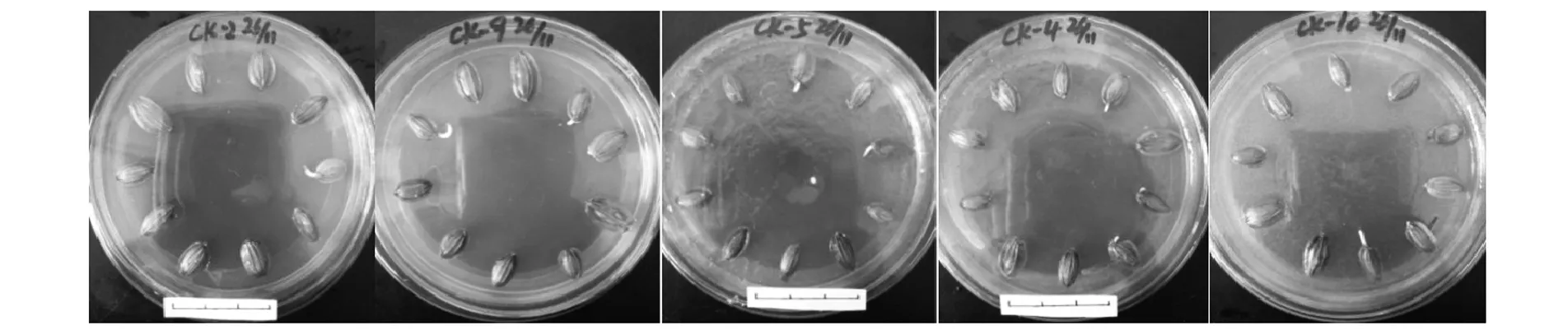
图6 新疆阿魏种子发芽状况(ck试验组)
3 讨 论
野生阿魏菇专一性地寄生或腐生在阿魏植物的根茎部,这种关系表明,阿魏植物一定对阿魏菇真菌产生了重要的影响,冯作山[15]、白羽嘉[16]、胡彩香[17]等认为,阿魏植物对阿魏菇真菌生长有较明显的促进作用。本研究则证实并揭示阿魏植物种子萌发与阿魏菇真菌生长两者互有影响,当阿魏菇真菌与阿魏种子有接触时,能够直接从种子里汲取营养提供自身迅速生长,菌株W1在4℃低温下生长增加近13倍。然而,在两者无接触的情况下,由于新疆阿魏种子具有散发蒜臭味的含硫化合物[1],通过这些挥发性物质作用于阿魏菇真菌,阻止其生长、定殖,这得到Junker R R等[18]实验研究结论的支持。
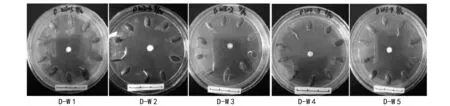
图7 4 ℃低温下同时接种菌块和种子后菌丝生长状况(D试验组)
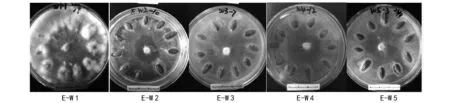
图8 阿魏菇真菌菌块长满至培养皿后植入种子的菌丝体生长状况(E试验组)
真核生物的寄生就是一种以牺牲寄主为代价的特殊共生关系,采取平衡生存策略,通过低成本达到调节种群密度的目的,即寄生共生体繁殖的自我控制,以及寄主在个体生活史中适应性降低的间接控制,与性行为(繁殖)联结完成寄主更换,实现生态系统的稳定和长期进化的停滞[19]。在这个关系中一般是寄生物从宿主上得到的营养较多,包括水分、无机盐和有机物质等[20]。本实验中,当5株阿魏菇真菌菌丝体在接触到阿魏种子时,明显看出它能从阿魏种子上吸取必需营养供自己快速生长。当两者无接触的情况下,阿魏种子发芽率依然比对照低,可能是阿魏菇真菌也能够产生某种物质抑制阿魏种子发芽。进一步实验,无论是否灭活阿魏菇真菌发酵菌液都使得荒漠植物新疆阿魏种子所需萌动时间更长、发芽率降低,这表明阿魏菇真菌在培养过程中能够分泌耐高温高压的某种物质,其能够抑制阿魏种子萌发,具体成分有待进一步研究。
在共生关系中,共生体有2种传递方式: 1) 水平传递是每一代宿主重新从周围环境获得共生体,发生在后代散布和休眠之后; 2) 垂直传递是共生体从上一代传递到下一代,或卵上,发生在后代离开母体前[21]。意味着垂直传递选择为与共生体合作,这是由于共生体适应性与宿主繁殖关联;而水平传递与来自寄主的共生体适应性耦合,特别有利于寄生共生体迅速传播,在对寄主伤害和共生体适应性之间权衡折衷[22]。研究表明,共生作用形式是互相依赖且比先前想象的更复杂,事实上不是简单地固定为一种类型,互利共生-寄生共生形成连续统一体,这些共生体同时具有正作用和负作用,共生对宿主适应性的2个组分——生存和繁殖力有差别很大影响。为此,当寄生共生作用形式转换成互利共生时,需要付出较大的代价,寄主从资源分配上将繁殖力转变成生存,这是从另一个角度来理解互利共生,即对生存正作用和对繁殖力负作用是互利共生建立的关键[23-24]。综上所述,在荒漠环境条件下新疆阿魏种子发芽期间不宜与阿魏菇真菌生活在一起,这一结论正好与野外实际观察到的情况一致,阿魏菇仅能够在开花结果期的阿魏植物根茎部上采摘得到,并无在苗期阿魏植物上的采集记录,这也从另一个方面反映阿魏菇真菌是采取水平传递方式到宿主阿魏植物上的,而不是通过种子携带进行垂直传递的。另外,我们还进行了阿魏菇菌液对新疆阿魏幼苗根部养分积累影响的研究(待发表),结论是在温和环境条件下阿魏菇菌液对阿魏幼苗根部养分积累有促进作用。因此,在阿魏植物生活史中与阿魏菇真菌的作用形式是互利共生还是寄生生活取决于环境条件、进化过程,有待深入探索研究,从而揭示阿魏菇真菌与新疆阿魏植物共生的蕴涵和意义。
通过人工接菌进行阿魏菇真菌与荒漠植物新疆阿魏种子发芽影响的研究,这是微生物与植物互作研究的传统经典方法[25]。为排除其它微生物的干扰,首先对宿主植物新疆阿魏种子表面消毒获得无菌种子,这个预处理致使种子发芽率比通常状况下大大降低,阿魏种子吸胀直接4 ℃沉积发芽率可达80%以上[26-27],无菌预处理后的不到60%,应该是消毒过程所用药剂对种子毒害造成的[28]。
4 结 论
本研究证实并揭示了阿魏植物种子发芽与阿魏菇真菌生长两者互有影响。首先,在阿魏菇真菌与阿魏种子未直接接触的情况下,阿魏种子通过挥发性物质对阿魏菇真菌生长产生阻碍作用。其次,5株阿魏菇真菌的存在均对药用荒漠植物新疆阿魏的种子发芽有抑制作用。一是阿魏菇真菌能够分泌某种耐高温、高压物质,其不仅推迟种子萌动并对种子发芽有抑制的作用,具体有待于进一步分析鉴定。二是在阿魏菇真菌与阿魏种子接触的情况下,阿魏菇真菌能够直接从种子里汲取营养供自身生长,从而使得阿魏植物种子发芽率降得更低。综上所述,在荒漠环境条件下,阿魏菇真菌的存在对阿魏植物的种子发芽是不利的,为野生抚育和人工栽培保护阿魏植物资源、道地药材的可持续开发利用、荒漠生态系统的恢复和建设提供了科学依据。
[1]Sahebkar A and Iranshahi M. Biological activities of essential oils from the genusFerula(Apiaceae)[J].Asian Biomedicine,2010,4(6):835-47.
[2]Flora of China 编委会.Flora of China(《中国植物志》英文修订版)[M].1989-2013,科学出版社和密苏里植物园出版社联合出版.网址:http://www.floraofchina.org.
[3]单人骅,佘孟兰.中国植物志(伞形科)[M].北京:科学出版社,1992,55(3):85-117.
[4]沈冠冕.新疆植物志[M].乌鲁木齐:新疆科学技术出版社,2011(3):575-601.
[5]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:176.
[6]新疆生物土壤沙漠研究所.新疆药用植物志(第一册)[M].乌鲁木齐:新疆人民出版社,1981:106-107.
[7]Lee C L,Chiang L C,Cheng L H,Liaw C C,El-Razek M H A,Chang F R,Wu Y C.Influenza A (H 1 N 1) Antiviral and Cytotoxic Agents fromFerulaassa-foetida[J].Journal of Natural Products,2009,72:1 568-1 572.
[8]Iranshahi M,Sahebkar A,Hosseini S T,Takasaki M,Konoshima T,Tokuda H.Cancer chemopreventive activity of diversin fromFeruladiversivittatain vitro and in vivo[J].Phytomedicine,2010,17:269-273.
[9]Ahmed Saber Abu-Zaiton.Anti-diabetic activity of Ferula assafoetida Extract in Normal and Alloxan-Induced Diabetic Rats[J].Pakistan Journal of Biological Sciences.2010,13(2):97-100.
[10]毛祖美.早春短命植物区系特点[J].干旱区研究,1992,9(1):11-12.
[11]毛祖美,张佃民.新疆北部早春短命植物区系纲要[J].干旱区研究,1994,11(3):1-26.
[12]谢彩香,石明辉,郭宝林,等.濒危野生新疆阿魏低空遥感资源调查[J].世界科学技术—中医药现代化,2014,16(11):2 480-2 486.
[13]杨新美.中国食用菌栽培学[M].北京:农业出版社,1988:546-548.
[14]赵振宇.新疆食用菌志[M].乌鲁木齐:新疆人民卫生出版社,2006:4-5.
[15]冯作山,白羽嘉,黄文书,等.阿魏对阿魏菇子实体抗氧化性能及氨基酸组成的影响[J].中国食品学报,2010,10(2):46-51.
[16]白羽嘉,陶永霞,张莉,等.阿魏对阿魏菇氨基酸及挥发性成分的影响[J].食品科学,2013,34(14):198-204.
[17]胡彩香.阿魏提取物对阿魏菇菌丝生长及生物活性影响的研究[D].乌鲁木齐:新疆农业大学,2009.
[18]Junker R R amp; Tholl D.Volatile Organic Compound Mediated Interactions at the Plant-Microbe Interface[J].Journal of Chemical Ecology,2013,39:810-825.
[19]Wenk P and Renz A.Parasitism and evolution: opposing versus balancing strategies[J].Historical Biology,2013,25(02):251-259.
[20]李钧敏,董鸣.植物寄生对生态系统结构和功能的影响[J].生态学报,2011,31(04):1 174-1 184.
[21]Bright M,Bulgheresi S.A complex journey: transmission of microbial symbionts[J].Nature Reviews.Microbiology,2010,08(3):218-230.
[22]Sachs J L and Wilcox T P.A shift to parasitism in the jellyfish symbiont Symbiodinium microadriaticum[J].Proceedings of the Royal Society of London B-Biological Sciences,2006,273:425-429.
[23]Fukui S.Evolution of symbiosis with resource allocation from fecundity to survival[J].Naturwissenschaften,2014,101(5):437-446.
[24]Pagan I,Montes N,Milgroom M G and Garcia-Arenal F.Vertical Transmission Selects for Reduced Virulence in a Plant Virus and for Increased Resistance in the Host[J].Plos Pathogens,2014,10(7):e 1004293.
[25]Friesen M L,Porter S P,Stark C S,et al.Microbially Mediated Plant Functional Traits[J].The Annual Review of Ecology,Evolution and Systematics,2011,42:23-46.
[26]田聪.新疆阿魏种子萌发与快速繁殖技术初步研究[D].乌鲁木齐:新疆大学,2008.
[27]阿卜杜许库尔·牙合甫,海利力·库尔班.生物碱参与阿魏种子休眠的调控[J].干旱区研究,2013,30(5):882-886.
[28]鲁黎明,安影.不同消毒剂对烟草种子消毒效果及萌发的影响[J].种子,2012,31(4):93-95.
Studies on Interaction Between Seed Germination ofFerulasinkiangensisof Plants in Xinjiang Desert withPleurotusferulaeFungus
BANNa1,2a,WANGHui2b,ZHANGPing3,ZHUJianjun3,HAOXiuying2a,WANGFang1,
(1.College of Agronomy,Xinjiang Agricultural University,Urumqi 830052,China; 2a.Institute of Microbiology; b.Institute of Biomass Energy, Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China; 3.College of Life Sciences,Ludong University,Yantai 264025,China)
Through artificially inoculating five strains mycelia and fermentation liquid ofPleurotusferulaefungus forFerulasinkiangensisseeds in the petri dishes, they are put in the dark place and co-cultured at 4 ℃ for 90 days,which 4 ℃ is the best deposition temperature of seeds.This paper is based on exploring the relationship between ferulae mushroom fungus and assa-foetida seeds germination of desert plants in Xinjiang,and is aimed at revealing the process and its essence nature thatPleurotusferulaefungi are born on the roots and stems ofFerulaspp.The experimental results show that the mycelia growth vigor contacted with seeds is highest among three treat groups,only mycelia (ck) is second,and the mycelia contacted without seeds is lowest.The seeds germination rate of assa-foetida after inoculated by the mycelia is that only seeds (ck) is highest among three treat groups,the seeds contacted without mycelia is second,and the seeds contacted with mycelia is lowest.The seed germination of assa-foetida after inoculated by the fermentation liquid is that only seeds (ck) is highest among five treat groups,half of inactivated fermentation liquid is second,half of fermentation liquid is third,all of inactivated fermentation liquid is fourth,and all of fermentation liquid is lowest.Experiment shows that the existence of thePleurotusferulaefungi is to the disadvantage of seed germination of assafoetida plants.From another side,this reflects the ferulic seed harvested in harsh environments is not colonized byPleurotusferulaefungus.Pleurotus ferulae fungus horizontally transfers,and keeps the advantage of the rapid spread,new hostes are replacemented through death of hosts blossom,which the natural phenomenon is consistent with the field survey and production practice.
FerulasinkiangensisK.M.Shen;PleurotusferulaeLenzi; seed germination; mycelium; fermentation liquid
2016-07-13
国家自然科学基金项目(编号:31260080,31371540);自治区产学研联合培养研究生示范基地项目(编号:xjaucxy-yjs-20131048)。
班 娜(1987—),女,硕士研究生,研究方向:植物抗逆;E-mail:1506509840@qq.com。
郝秀英(1964-),女,研究员,研究方向:新疆特色植物资源的研究;E-mail:haoxy6420@163.com。
10.16590/j.cnki.1001-4705.2016.12.001
S 567.23+9
A
1001-4705(2016)12-0001-07
