抗条锈病小麦-中间偃麦草-华山新麦草杂种后代的分子细胞遗传学鉴定
2016-12-04贵州省旱粮研究所贵阳550006贵州省农业科学院贵阳550006
, , , , (.贵州省旱粮研究所, 贵阳 550006; .贵州省农业科学院, 贵阳 550006)
抗条锈病小麦-中间偃麦草-华山新麦草杂种后代的分子细胞遗传学鉴定
王艳丽1,王伟1,陈天青1,隋建枢1,何庆才2
(1.贵州省旱粮研究所, 贵阳 550006; 2.贵州省农业科学院, 贵阳 550006)
小麦近缘物种中蕴藏着许多优良基因,创制三属杂种是小麦遗传改良的重要途径。对 4个F6代株系采用农艺性状调查、PMC染色体配对观察、GISH和SDS-PAGE等方法分析。结果表明,4个株系的染色体数目均为42条,K-13-649-3、K-13-663-2在细胞遗传学上相对稳定;且均确证为小麦-中间偃麦草易位系;K-13-649-3、 K-13-728-4与亲本中3的特异条带一致,K-13-656-3、K-13-663-2只有3条条带,缺失了亲本中3的1条特异条带,4个株系表现为高抗条锈病。
中间偃麦草; 华山新麦草; 基因组原位杂交; 易位系
小麦近缘属种是小麦遗传改良的重要基因资源,将优良基因引入小麦,对提高小麦的品质、抗性及遗传多样性具有重要意义。华山新麦草(PsathyrostachyshuashanicaKeng ex Guo)和中间偃麦草(Thinopyrumintermedium)均属于小麦的三级基因源,蕴藏着丰富的遗传变异,是改良普通小麦产量、品质、抗病性和抗逆性的重要基因资源[1-2]。通过双二倍体间杂交来创制三属杂种是小麦遗传改良的重要途径[3-4]。
2005年,四川农业大学获得了小麦-华山新麦草双二倍体(2 n=8 x=56,AABBDDNsNs),PHW-SA具有高抗小麦条锈病,细胞遗传稳定等优良特点[3]。PHW-SA与小偃麦中3杂交合成三属杂种,所获F1连续自交至F5,得到大量衍生株系[4-5]。 GISH鉴定表明,F5代存在大量的小麦-中间偃麦草罗伯逊易位和小片段易位染色体[6]。在此基础之上,本研究以F6代4个株系为材料进行分子细胞遗传学鉴定,以期筛选出抗条锈病新材料,为培育抗病、优质、高产小麦新品种奠定基础。

注:a为幼苗期;b为成株期;c为籽粒。图1 K-656-3田间植株及籽粒性状
表1 F6代株系与亲本主要农艺性状比较

品种及亲本株高(cm)旗叶长(cm)旗叶宽(cm)分蘖数(个)穗长(cm)小穗数(个)穗粒数(个)芒长(cm)千粒重(g)K⁃13⁃649⁃3121.02±3.4116.03±1.111.22±0.015.01±0.637.11±1.3121.01±0.5253.70±1.872.91±0.3335.44±2.42K⁃13⁃656⁃3153.34±3.8526.06±1.751.16±0.0911.04±1.6410.63±1.4419.77±0.9853.48±1.755.84±1.2136.31±1.97K⁃13⁃663⁃2106.04±3.1622.05±1.171.23±0.084.07±1.756.20±0.3017.79±1.6035.06±3.08—35.42±1.17K⁃13⁃728⁃4136.36±2.3514.02±1.721.14±0.0511.87±0.9810.13±0.7523.03±0.5558.04±3.40—29.14±1.72PHW⁃SA(a)137.09±11.5027.34±7.951.56±0.357.59±5.5015.12±3.2024.87±5.0031.25±8.253.90±1.1024.05±7.25中3103.84±6.7520.52±5.421.46±0.467.37±4.6212.50±2.8323.0±4.6856.37±5.043.15±0.9629.90±4.78
注:— 表示不存在;(a)表示数据引自康厚扬,2008[13]。
1 材料与方法
1.1 材 料
小麦-华山新麦草双二倍体PHW-SA与部分双二倍体小偃麦中3杂交后连续自交获得的4个F6株系。
1.2 农艺性状调查
调查株高、旗叶长和宽、分蘖数、小穗数、穗粒数、穗长、芒长、千粒重,每个株系3个重复。
1.3 小麦条锈病鉴定
母本PHW-SA、父本小偃麦及其后代衍生系采用混合菌种接种。诱发材料为高感小麦品系SY 95-71,种植于四周。发病程度采用3个指标,即普遍率、严重度和反应型[7-8]。
1.4 花粉母细胞染色体配对观察
取样固定:取不同单株幼穗,室温固定1 d,4 ℃保存。制片:取花药用苯酚品红压片。镜检:记录PMC染色体配对构型。
1.5 高分子量谷蛋白亚基分析
种子高分子量谷蛋白(HMW-GS)的提取参考Marchylo et al.和Sutton的方法[9-10]。SDS-PAGE电泳分析参照Gupta et al.的方法[11]。
1.6 基因组原位杂交
以地高辛标记的中间偃麦草总基因组DNA作为探针,J-11基因组DNA为封阻,对F6代材料进行根尖体细胞有丝分裂中期染色体GISH鉴定。中间偃麦草和J-11叶片DNA提取采用CTAB法[12],基因组原位杂交具体步骤参照文献[6]。
2 结果与分析
2.1 农艺性状调查与条锈病抗性鉴定
2.1.1 农艺性状调查
F6代4个株系及其亲本农艺性状结果见表1。株系K-656-3的幼苗期、成株期及籽粒性状如图1所示。
2.1.2 条锈病抗性鉴定
PHW-SA表现为高抗条锈病,反应型为0-1,严重度为t,普遍率为t,叶片偶尔显示坏死或萎黄色的斑点,但没有孢子形成(图2 g)。中3表现出高感条锈病,产生大量的孢子,反应型为8,严重度为80%~100%,普遍率为100%(图2 b)。4个株系表现为高抗条锈病,反应型为0-1,严重度为t,普遍率为t,叶片偶尔显示坏死或萎黄色的斑点,但没有孢子形成(图2 c-f)。
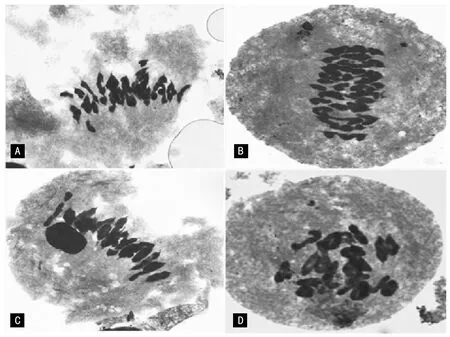
注:A为K-13-649-3;B为K-13-656-3;C为K-13-663-2;D为K-13-728-4。图4 F6代株系减数分裂中期I花粉母细胞染色体配对
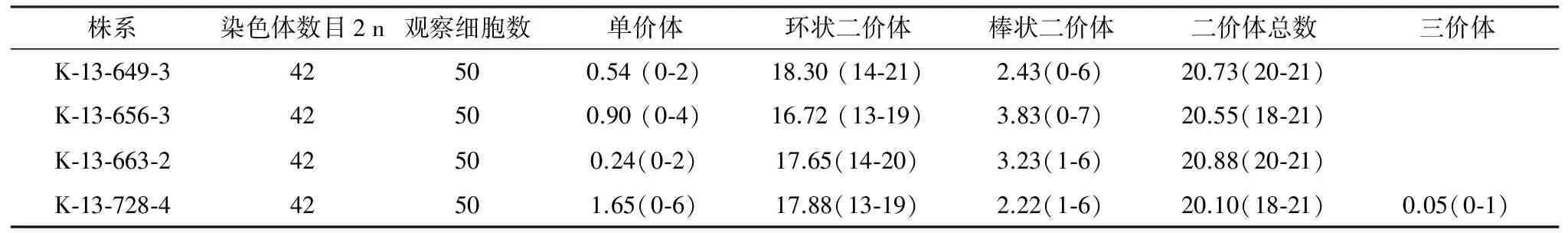
表2 F6代株系花粉母细胞减数分裂中期I染色体配对情况统计
株系染色体数目2n观察细胞数单价体环状二价体棒状二价体二价体总数三价体K⁃13⁃649⁃342500.54(0⁃2)18.30(14⁃21)2.43(0⁃6)20.73(20⁃21)K⁃13⁃656⁃342500.90(0⁃4)16.72(13⁃19)3.83(0⁃7)20.55(18⁃21)K⁃13⁃663⁃242500.24(0⁃2)17.65(14⁃20)3.23(1⁃6)20.88(20⁃21)K⁃13⁃728⁃442501.65(0⁃6)17.88(13⁃19)2.22(1⁃6)20.10(18⁃21)0.05(0⁃1)

注:a为SY 95-71;b为中3;c为K-13-649-3;d为 K-13-656-3;e为K-13-663-2;f为K-13-728-4;g为PHW-SA。图2 F6代株系及亲本抗条锈病鉴定
2.2高分子量谷蛋白亚基分析
4个株系及其亲本的SDS-PAGE结果如图3。K-13-649-3和K-13-728-4具有与中3一致的特异条带(图3,第5泳道和第8泳道)。K-13-656-3与K-13-663-2只有3条条带,缺失了亲本中3的一条特异条带(第6泳道和第7泳道箭头所示)。
2.3花粉母细胞染色体配对分析
花粉母细胞染色体配对情况见图4和表2。 4个株系的染色体数目为42条,配对平均构型为0.83个单价体,20.57个二价体,0.01个三价体,其中K-13-649-3和K-13-663-2平均单价体为0.54和0.24个(表2),染色体配对情况良好,表明在细胞遗传学上相对稳定。而K-13-656-3 和K-13-728-4的平均单价体分别为0.90和1.65个(表2),且K-13-728-4存在三价体,表明在细胞遗传学上不稳定,有待于进一步的自交从而达到稳定。
2.4 基因组原位杂交鉴定
4个株系染色体端部都呈现明显的点状黄绿色杂交信号,染色体其余部分为红色无信号,易位多数发生在染色体端部,证明这4个株系是小麦-中间偃麦草易位系(图5 A-D)。

注:1为中国春;2为PHW-SA;3为中间偃麦草;4为中3;5为K-13-649-3;6为K-13-656-3;7为K-13-663-2;8为K-13-728-4。图3 F6代株系及亲本谷蛋白电泳图谱
3 讨 论
根尖GISH结果表明,三属杂种后代在自交过程中,中间偃麦草比华山新麦草染色体能更好更稳定地传递给后代,和陶珊[6]的研究结论一致。小麦远缘杂交的诸多实践也表明,普通小麦与中间偃麦草的杂交亲和性比华山新麦草好,说明中间偃麦草的染色体与小麦染色体之间关系较近,同源性较强[14]。易位发生在染色体端部,可能是端部易位只需要1次交换或2次断裂和1次重融,并且在染色体端部存在着重组热点区域[15]。易位系的形成有利于将外源有益基因导入到普通小麦中。本研究所确证的4个易位系均为杂合,为创制纯合易位系提供了坚实的理论和物质基础,也为深入研究染色体结构及易位机制提供了理论依据 。研究表明,在PHW-SA中,亲本的条带消失以及产生了一些新的带纹,第1或第6同源群染色体上的相应DNA序列发生了变化,原因可能是某些位点发生突变引起的[16]。SDE-PAGE的结果符合前人的研究,在远缘杂交后代中新的亚基的出现或者原有亚基的丢失现象较为普遍[13,17],这为研究远缘杂交后代中基因冲击或沉默提供了物质基础。

注:A为K-13-649-3;B为K-13-656-3;C为K-13-663-2;D为K-13-728-4。图5 PHW-SA×中3三属杂种F6代根尖染色体GISH检测
[1]Chen Q,Friebe B,Conner RL,et al.Molecular cytogenetic characterization of Thinopyrum intermedium derived wheat germplasm specifying resistance to wheat streak mosaic virus[J].Theoretical and Applied Genetics,1998,96:1-7.
[2]赵继新,陈新宏,王小利,等.普通小麦-华山新麦草异代换系的分子细胞遗传学研究[J].西北植物学报,2004,24:2 277-2 281.
[3]Kang HY,Wang Y,Sun GL,et al.Production and characterization of an amphiploid between common wheat and Psathyrostachys huashanica Keng ex Kuo[J].Plant Breeding,2009,128:36-40.
[4]Kang HY,Zeng J,Xie Q,et al.Molecular cytogenetic characterization and stripe rust response of a trigeneric hybrid involving Triticum,Psathyrostachys, and Thinopyrum[J].Genome,2012,55:383-390.
[5]Kang HY,Zhong MY,Xie Q,et al.Production and cytogenetics of trigeneric hybrid involving Triticum,Psathyrostachys and Secale[J].Genetic Resources and Crop Evolution,2012,59:445-453.
[6]陶珊.普通小麦-华山新麦草-中间偃麦草三属杂种衍生后代分子细胞遗传学鉴定[D].四川农业大学硕士学位论文,温江,2013.
[7]舒焕麟,杨足君,李光蓉.创新诱发材料SY 95-71选育和利用价值研究[J].四川农业大学学报,1999,17:249-253.
[8]Line RF,Qayoum A.Virulence,aggressiveness,evolution and distribution of races of Puccinia striiformis (the cause of stripe rust of wheat) in North America,1968-87[J].Technical Bulletin-Colorado Agricultural Experiment Station,1992,1 788:1-44.
[9]Marchylo BA,Kruger JE,Hatcher DW.Quantitative reversed-phase high-performance liquid chromatographic analysis of wheat storage proteins as a potential quality prediction tool[J].Journal of Cereal Science,1989,9:113-130.
[10]Sutton KH.Qualitative and quantitative variation among high molecular weight subunits of glutenin detected by reversed-phase high-performance liquid chromatography[J].Journal of Cereal Science,1991,14:25-34.
[11]Gupta RB,Macritchie F.Allelic Variation at Glutenin Subunit and Gliadin Loci,Glu-1,Glu-3 and Gli-1 of Common Wheats.II.Biochemical Basis of the Allelic Effects on Dough Properties[J].Journal of Cereal Science,1994,19:19-29.
[12]Doyle J.DNA protocols for plants[J].Molecular techniques in taxonomy,1991,57:283-293.
[13]康厚扬.利用特异小麦资源创制育种新材料及其遗传评价[D].四川农业大学博士学位论文,都江堰,2008.
[14]石丁溧.普通小麦与八倍体小偃麦杂交后代三个特殊中间材料的鉴定及选育[D].四川农业大学硕士学位论文,雅安,2008.
[15]牟金叶,李集临,王献平,等.异源细胞质小麦-中间偃麦草易位系的培育与荧光原位杂交鉴定[J].科学通报,2000(3):33-34.
[16]Kang HY,Chen Q,Wang Y,et al.Molecular cytogenetic characterization of the amphiploid between bread wheat and Psathyrostachys huashanica. Genetic Resources and Crop Evolution,2010,57:111-118.
[17]王益.普通小麦-华山新麦草衍生后代的细胞学鉴定和控制大豆种子低镉积累基因的克隆[D].四川农业大学博士学位论文,温江,2012.
Molecular Cytogenetic Characterization of the Derivatives from Wheat-Thinopyrumintermedium-PsathyrostachyshuashanicaHybrids with Resistance to Stripe Rust
WANGYanli1,WANGWei1,CHENTianqing1,SUIJianshu1,HEQingcai2
(1.Guizhou Research Institute of Arid Crops,Guiyang 550006,China;2.Guizhou Academy of Agricultural Sciences,Guiyang 550006,China)
The relatives of wheat possess a large number of useful genes,Creating trigeneric hybrids is an important way for inherited improvement.In this study,Four F6lines derived from the cross of PHW-SA×Zhong 3 were identified using agronomic traits investigation,cytogenetics,GISH and SDS-PAGE.The results showed that all lines had 42 chromosomes,Lines K-13-649-3 and K-13-663-2 were stable on the cytogenetics.These 4 lines were wheat-Th.intermediumtranslocation lines.K-13-649-3 and K-13-728-4 expressed specific glutenin bands consistent with their parent Zhong 3.K-13-656-3 and K-13-663-2 only expressed three bands,one specific glutenin band was disappeared in these two lines.All lines showed high resistance to stripe rust.
Thinopyrumintermedium;Psathyrostachyshuashanica; genomic in situ hybridization;translocation lines
2016-05-17
国家小麦产业技术体系经费资助(编号:CARS-2-43)。
王艳丽(1987—),女,研究实习员,主要从事小麦遗传育种工作;E-mail:yanliwang1987@163.com。
何庆才(1963—),男,研究员,主要从事作物遗传育种工作;E-mail:gznkykqc@yeah.ne。
10.16590/j.cnki.1001-4705.2016.10.006
S 512.1
A
1001-4705(2016)10-0006-04
