菠萝蜜果皮多酚超声辅助提取工艺及降血糖活性研究
2016-12-03蒋志国李斌
蒋志国,李斌*
(海南大学食品学院,海南海口570228)
菠萝蜜果皮多酚超声辅助提取工艺及降血糖活性研究
蒋志国,李斌*
(海南大学食品学院,海南海口570228)
采用响应面法对菠萝蜜果皮中的多酚提取工艺进行优化,经乙醇溶液萃取得多酚粗提物,用XAD-7HP大孔树脂对多酚粗提物进一步分离纯化,并采用链脲佐菌素诱导的糖尿病小鼠模型,研究了菠萝蜜果皮多酚的降血糖作用及其机制。结果表明,超声波辅助提取最佳工艺为料液比1∶59(g∶mL),乙醇体积分数35%,超声温度55℃,超声时间41 min和超声功率360 W,在该条件下多酚得率为5.89 mg/g。经XAD-7HP大孔树脂纯化后的多酚含量由13.41%提高到63.26%,纯化倍数为4.71。降血糖活性初步研究结果表明,菠萝蜜果皮多酚能显著降低链脲佐菌素(STZ)诱导的糖尿病小鼠血糖浓度,有一定的降血糖活性。
菠萝蜜果皮;多酚;超声辅助提取;降血糖活性
菠萝蜜(Artocarpus heterophyllusLam.)属于桑科木菠萝属,是世界著名的热带水果之一,国内以海南种植最多、最为集中[1]。菠萝蜜果肉爽脆、蜜甜、芳香浓郁,营养成分十分丰富,因此常被加工成果酒[2]、果干[3]、果汁[4]等产品。然而,研究者对占果实总质量约42%的菠萝蜜下脚料果皮中的生物活性物质研究却甚少。近年来研究发现多酚类化合物具有抗病毒和抗氧化[5]、抑制肿瘤细胞生长[6]、降血糖和降血脂[7]等功效,因而激发了人们研究和开发利用多酚类化合物的极大兴趣。
植物多酚类物质的提取通常采用溶剂浸泡、热回流及碱提酸沉等方法,但多酚类物质的提取效率均不理想[8]。超声波能够产生机械振动,并具有强烈的空化效应,能够造成细胞结构的破坏,从而加速了有效成分的溶出,在缩短提取时间的同时避免了高温对功效成分的破坏[12]。近年来,将超声波辅助提取法应用于植物细胞壁的破碎,有效提高了生物活性物质的提取率[9-10]。响应面分析法(response surface methodology,RSM)是一种优化工艺条件的高效方法,可确定各因素及其交互作用在工艺过程中对响应值的影响,准确地反映因素与响应值之间的关系[11]。
本研究在单因素试验基础上,采用响应面法优化了超声波辅助提取菠萝蜜果皮多酚(jackfruit peel polyphenols,JPP)的工艺,大孔吸附树脂对多酚进一步分离纯化,并对其降血糖活性进行了初步研究,旨为实现菠萝蜜的综合利用、提高产品的附加值提供理论依据。
1 材料与方法
1.1材料与试剂
菠萝蜜:海口市万福新村农贸市场;清洁级美国癌症研究所(institute of cancer research,ICR)小鼠(体质量20 g左右):浙江省医学科学院实验动物中心;2,2-二苯基-1-苦基肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基(纯度>99%)、没食子酸(纯度>99%)、链脲佐菌素(streptozotocin,STZ)、二甲双胍(纯度>99%):美国Sigma公司;过硫酸钾、福林酚试剂(均为分析纯):国药集团化学试剂有限公司;XAD-7HP大孔吸附树脂:南开大学化工厂。其他试剂均为国产分析纯。
1.2仪器与设备
KQ-400KDE型数控超声波清洗器:江苏昆山市超声仪器有限公司;FW177型中草药粉碎机:成都一科仪器设备有限公司;AL204型电子天平:梅特勒-托利多仪器(上海)有限公司;T6型紫外可见分光光度计:北京普析通用仪器有限责任公司;RE2000A型旋转蒸发仪:上海亚荣生化仪器厂;JPST-5血糖仪:北京怡成生物电子技术有限公司。
1.3方法
1.3.1原料的预处理
新鲜的菠萝蜜果肉和果皮分离后,取菠萝蜜果皮清洗干净,并于60℃烘干、粉碎、过40目备用。
1.3.2菠萝蜜果皮中多酚含量测定
参照FANG X S等[13]的方法,略有改动。称取0.5 g菠萝蜜果皮粉末,超声辅助萃取得多酚提取液,经抽滤后用蒸馏水定容至100 mL,即为样品溶液。取1.0 mL样品溶液于10 mL比色管中,分别加入3 mL质量分数为7.5%的Na2CO3溶液和1 mL福林-酚试剂,并用蒸馏水定容至10 mL,室温避光静置40min后于波长760nm处测定吸光度值。以没食子酸质量浓度(X,μg/mL)为横坐标,吸光度值(Y)为纵坐标,绘制没食子酸标准曲线,得到标准曲线回归方程Y=14.229 0X+ 0.023 7,相关系数为R2=0.996 3。按照回归方程计算样品中的多酚含量(以没食子酸含量计),多酚提取率及纯度计算公式如下:

式中:Y为多酚提取率,mg/g;C为没食子酸含量,mg/mL;V为提取液体积,mL;M为样品质量,g;P为多酚纯度,%;E为多酚粗提取物的质量,mg。
1.3.3单因素试验
称取0.5 g菠萝蜜果皮粉末,进行单因素试验,分别在料液比为1∶20、1∶30、1∶40、1∶50、1∶60、1∶70、1∶80(g∶mL),乙醇体积分数为20%、30%、40%、50%、60%、70%、80%,超声温度为10℃、20℃、30℃、40℃、50℃、60℃、70℃,超声时间为10 min、20 min、30 min、40 min、50 min、60 min、70 min,超声波功率为160 W、200 W、240 W、280 W、320 W、360 W、400 W条件下,以多酚提取率为评价指标,研究上述各因素对菠萝蜜果皮多酚提取率的影响。
1.3.4响应面试验设计
在单因素试验基础上,选取对菠萝蜜果实多酚提取率影响显著的因素,根据Box-Benhnken中心组合试验设计原理,利用Design-Expert 8.0软件设计4因素3水平试验,共设计29个试验点,中心重复试验为5次,响应面试验因素与水平见表1。
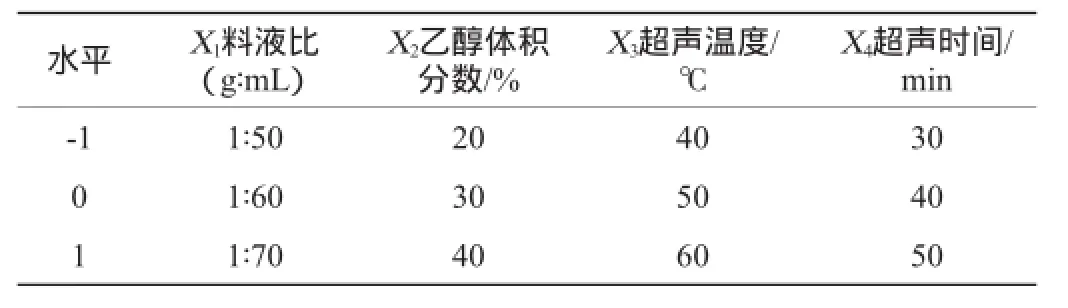
表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiments
1.3.5大孔吸附树脂富集分离菠萝蜜果皮多酚类化合物
称取超声辅助萃取多酚粗物1.0 g,配制成质量浓度为1.0 mg/mL、pH值为5的菠萝蜜果皮多酚提取液,将预处理后的XAD-7HP大孔吸附树脂装填于2.5 cm×60 cm的层析柱中,以1.0 mL/min流速上样,当树脂吸附达到饱和时,即流出液无多酚检出,停止上样,然后依次用蒸馏水、体积分数为30%乙醇、体积分数为60%乙醇及体积分数为90%乙醇溶液分别洗脱,洗脱流速2.0mL/min。收集乙醇洗脱液,旋转蒸发浓缩后冷冻干燥,得到初步纯化的菠萝蜜果皮多酚(JPP)。1.3.6糖尿病小鼠模型的建立
参照JIANGZG等[14]的方法,略有改动。将小鼠随机分成2组,对照组:给予普通饮食喂养;II型糖尿病组:高脂高糖高蛋白饮食喂养3个月,按照150 mg/kg剂量腹腔一次性注射链脲佐菌素(STZ)(粉剂溶于0.1 mol/L pH 4.5柠檬酸-柠檬酸钠缓冲液中),对照组按照上述方法腹腔注射柠檬酸缓冲液。72h后,尾静脉取血测定血糖含量,血糖≥16.7 mmol/L、尿糖持续阳性为造模成功。以血糖>16.7 mmol/L者作为糖尿病小鼠,将小鼠随机分成糖尿病模型组,二甲双胍组(阳性对照)250 mg/(kg·d),以及菠萝蜜果皮多酚(JPP)100 mg/(kg·d)、200 mg/(kg·d)和300 mg/(kg·d)剂量组,每组10只。
1.3.7血糖测定
分别于第7、14、21、28天给药后禁食12 h,从小鼠尾静脉取血,用血糖仪测定空腹血糖水平。
2 结果与分析
2.1单因素试验
2.1.1料液比对菠萝蜜果皮多酚提取率的影响
由图1可知,料液比在1∶20~1∶60(g∶mL)时,随着料液比的变大,增加了目标物与溶剂接触面的浓度差,更有利于多酚的溶出,多酚提取率呈持续增大的趋势。当料液比达到1∶60(g∶mL)时,再增加乙醇用量,多酚提取率增加不明显。因此,从节约试剂的角度考虑,料液比选择1∶60(g∶mL)为宜。

图1 料液比对菠萝蜜果皮多酚提取率的影响Fig.1 Effect of solid-liquid ratio on polyphenols yield of jackfruit peel
2.1.2乙醇体积分数对菠萝蜜果皮多酚提取率的影响
溶剂提取主要是利用被提取物与提取溶剂的相似相溶原理,当提取溶剂的极性与菠萝蜜果皮中多酚类化合物的极性相似时,能够最有效的将多酚类化合物提取出来[15]。由图2可知,当乙醇体积分数为20%~30%时,多酚提取率随乙醇体积分数的增加而增大;当乙醇体积分数为30%时,多酚提取率最大;当乙醇体积分数>30%时,多酚提取率逐渐下降。因此,选择乙醇体积分数30%为宜。
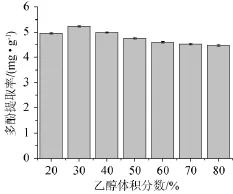
图2 乙醇体积分数对菠萝蜜果皮多酚提取率的影响Fig.2 Effect of ethanol content fraction on polyphenols yield of jackfruit peel
2.1.3超声温度对菠萝蜜果皮多酚提取率的影响
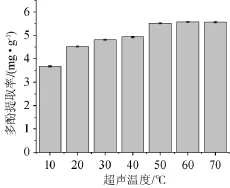
图3 超声温度对菠萝蜜果皮多酚提取率的影响Fig.3 Effect of ultrasonic temperature on polyphenols yield of jackfruit peel
由图3可知,随着超声温度的提高,导致传质的加强和目标物溶解度的提高,多酚提取率呈持续增大的趋势。当超声温度为10~50℃时,多酚提取率随温度增高而增加;当超声温度>50℃之后,多酚提取率增加不明显,而且温度太高容易造成多酚氧化降解。因此,选择超声温度50℃为宜。
2.1.4超声时间对菠萝蜜果皮多酚提取率的影响
由图4可知,超声时间为10~40 min时,多酚提取率随着超声时间的延长呈持续增大的趋势,超声时间>40 min之后,多酚提取率趋于稳定,说明超声时间的延长并不能提高多酚提取率。因此,选择超声时间40 min为宜。

图4 超声时间对菠萝蜜果皮多酚提取率的影响Fig.4 Effect of ultrasonic time on polyphenols yield of jackfruit peel
2.1.5超声功率对菠萝蜜果皮多酚提取率的影响
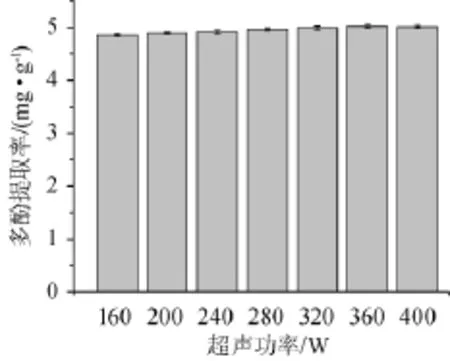
图5 超声功率对菠萝蜜果皮多酚提取率的影响Fig.5 Effect of ultrasonic power on polyphenols yield of jackfruit peel
由图5可知,随着超声功率的增加,多酚提取率不断增加,这是由于功率越大,超声波的空化效应和机械效应越显著,菠萝蜜果皮细胞结构破坏越彻底,有利于多酚类物质的溶出。当超声功率为160~360 W,多酚提取率随超声功率增高而增加;当超声功率达到280 W时,多酚提取率达到最大值;当超声波功率>360 W之后,多酚提取率趋于稳定,这是由于超声功率达到一定值后,产生大量的热,部分多酚发生氧化导致损失。因此,选择超声功率360 W为宜。
2.2响应面试验
2.2.1响应面试验设计与结果
在单因素试验的基础上,固定超声波功率360 W,选取影响显著的4个因素(料液比、乙醇体积分数、超声温度和超声时间),以多酚提取率(Y)为响应值,进行响应面优化试验。根据Box-Benhnken试验设计,利用Design-Expert 8.0软件进行4因素3水平的响应面分析,共设计29个试验点,中心重复试验为5次,用来估计试验误差。Box-Benhnken试验设计及结果见表2,方差分析结果见表3。
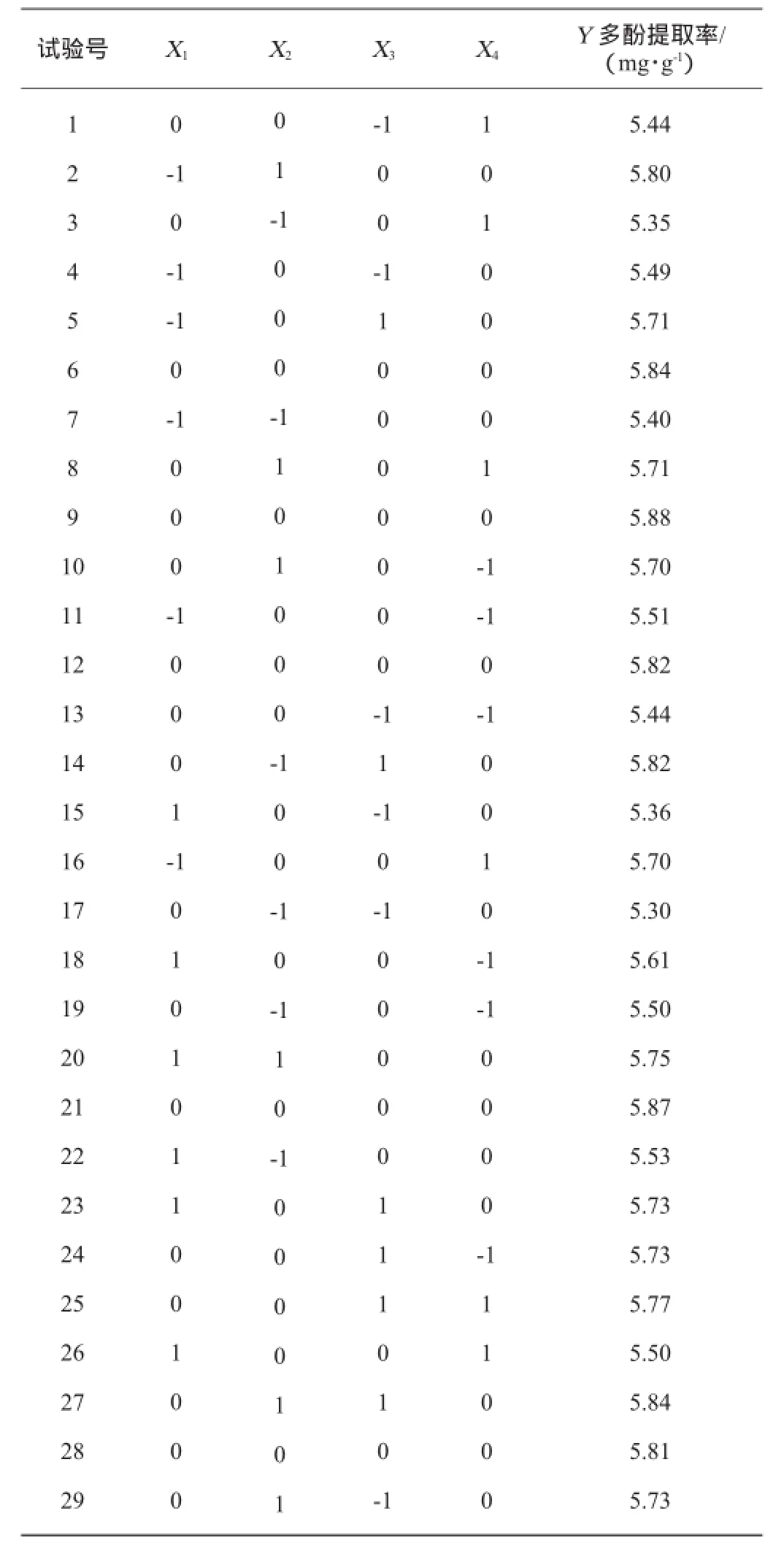
表2 Box-Behnken试验设计与结果Table 2 Design and results of Box-Benhnken experiments

表3 回归模型方差分析Table 3 Variance analysis of regression model
利用Design-Expert 8.0统计软件对表3数据进行多元回归拟合,得到多酚提取率(Y)的二次多项回归模型方程:
Y=5.84-0.011X1+0.14X2+0.15X3-0.001 667X4-0.045X1X2+ 0.038X1X3-0.075X1X4-0.10X2X3+0.040X2X4+0.01X3X4-0.14X12-0.094X22-0.10X32-0.15X42
由表3可知,超声波辅助提取菠萝蜜果皮多酚所建立的回归模型极显著,回归P<0.000 1,表明该模型是极显著的;失拟项P=0.133 3>0.05,表明试验误差较小。并且由统计分析可知,决定系数R2=0.961 7,调整决定系数R2adj= 0.923 4,这说明该回归模型拟合程度较好,应用该回归模型能够对超声波辅助萃取菠萝蜜果皮多酚的结果进行较好的预测和分析。由F值知各因素对多酚产影响的大小顺序为:X3(超声温度)>X2(乙醇体积分数)>X1(料液比)>X4(超声时间)。其中,超声温度、乙醇体积分数的一次项,料液比、乙醇体积分数、超声温度、超声时间的二次项,料液比和超声时间、乙醇体积分数和超声温度的交互项及回归分析对多酚提取率的影响都达到了极显著水平(P<0.01)。
根据回归方程可以绘制各因素对多酚得率影响的响应面图和等高线图,结果见图6。响应面图是回归方程的形象描述,能够直观反映各个因素与响应值之间的关系以及两因素间交互作用的类型。响应面图曲面坡度越陡峭、等高线密集成椭圆形表示两因素交互作用显著,反之坡度平缓、等高线呈圆形则两因素交互作用小[16]。由图6可知,超声时间和料液比、超声温度和乙醇体积分数交互作用的响应面坡度陡峭,等高线均呈现椭圆、扁平状,表示上述因素之间的相互作用显著,与方差分析结果一致。
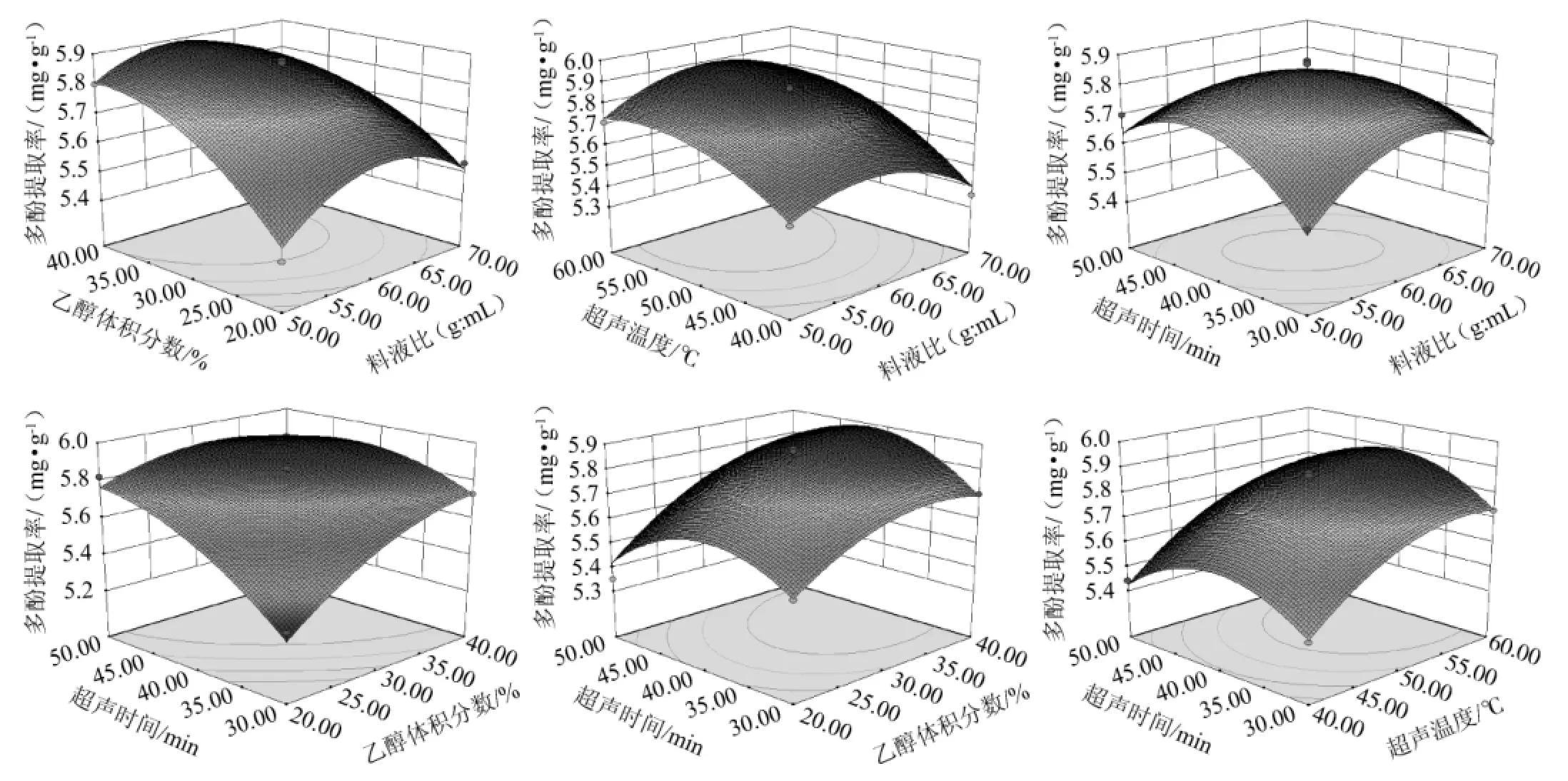
图6 各因素两两交互作用对多酚提取率影响的响应面及等高线Fig.6 Response surface plots and contour lines of effects of interaction between each factors on polyphenols yield
2.2.2验证试验
根据以上的试验结果分析以及模型拟合,利用Design-Expert 8.0软件分析得出菠萝蜜果皮多酚提取的最佳工艺为:料液比1∶59.2(g∶mL),乙醇体积分数34.95%,超声温度54.88℃,超声时间40.95 min,菠萝蜜果皮多酚提取率的预期值约为5.92mg/g。为方便实际操作,将该工艺条件简化为:料液比1∶59(g∶mL)、乙醇体积分数35%、超声温度55℃,超声时间41min。根据最佳工艺条件,进行3次平行试验,所得的菠萝蜜果皮多酚提取率平均值为5.89 mg/g(含量13.41%),与预期值相接近,说明该响应面法得到的回归模型具有一定的可靠性。
2.3大孔吸附树脂富集分离菠萝蜜果皮多酚类化合物
多酚类化合物兼具苯环及羟基结构单元,能通过疏水性和极性相互作用被具有优良物理性质的的极性或弱极性的大孔树脂所亲和吸附。研究表明,极性的非离子型大孔树脂XAD-7HP兼具大比表面积及平均孔径,具有对天然活性小分子化合物的高效吸附与分离能力,特别是多酚类化合物[17]。
由表4可知,对于XAD-7HP树脂柱层析,干物质回收率最高的组分为水洗脱组分,但其多酚含量最低,说明其中杂物质较多。随着洗脱剂乙醇体积分数的提高,洗脱组分中多酚含量先增加后减少,以体积分数30%乙醇洗脱组分中多酚含量最高,达到63.26%。纯化后的多酚含量由13.41%提高至63.26%,纯化倍数为4.71。

表4 XAD-7HP大孔树脂不同体积分数乙醇洗脱组分分析结果Table 4 Analysis results of different ethanol content elution fractions by XAD-7HP macroporous resin
2.4菠萝蜜果皮多酚对糖尿病小鼠血糖的影响
由表5可知,小鼠经链脲佐菌素造模后血糖值明显高于正常小鼠(P<0.01)。模型对照组未经治疗情况下,血糖一直维持在较高水平。给药后,菠萝蜜果皮多酚高、中剂量组从第2周开始,能显著降低糖尿病小鼠血糖水平,与模型对照组比较有显著性差异(P<0.05),且300 mg/(kg·d)高剂量组小鼠的血糖水平跟阳性药物二甲双胍组小鼠的血糖水平在4周后比较接近,与模型对照组比较差异极显著(P<0.01),表明菠萝蜜果皮多酚具有一定的降血糖效果,并且体现为剂量依赖关系,其降血糖机理需进一步研究。
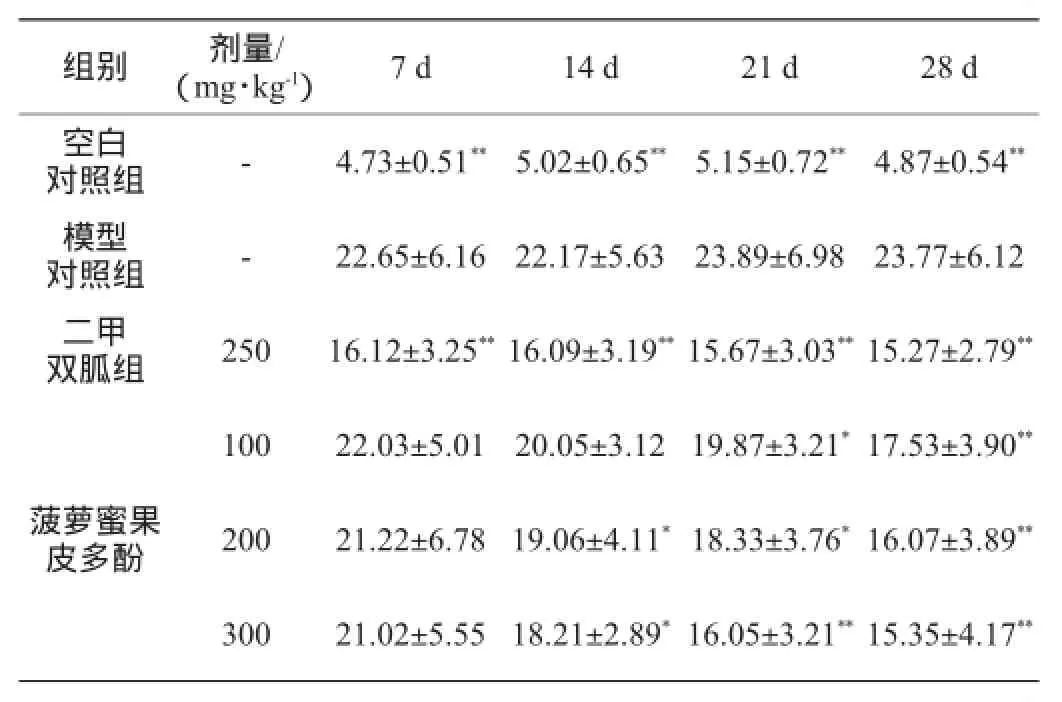
表5 菠萝蜜果皮多酚对糖尿病小鼠血糖的影响Table 5 Effect of jackfruit peel polyphenols on blood glucose of diabetic micemmol/L
3 结论
采用超声波辅助萃取技术,通过响应面试验设计对菠萝蜜果皮中多酚的提取工艺条件进行了优化,其最佳工艺条件为料液比1∶59(g∶mL)、乙醇体积分数35%、超声温度55℃,超声时间41 min和超声功率360 W。在该最佳条件下,多酚提取率为5.89 mg/g。
采用XAD-7HP大孔树脂对超声波辅助提取的菠萝蜜果皮多酚粗提物进行纯化,纯化后的多酚含量由13.41%提高至63.26%,纯化倍数为4.71,表明大孔树脂XAD-7HP对菠萝蜜果皮中的多酚物质具有较好的分离纯化能力。
初步降血糖结果表明,菠萝蜜果皮多酚能显著降低糖尿病小鼠血糖,有一定的抗氧化及降血糖活性,但其降血糖机理尚需要深入研究。
[1]KATEGUNYAR,SANGUANSRIC.Physico-chemicalpropertiesof jackfruit seed starch(Artocarpus heterophyllus)and its application as a thickener and stabilizer in chilli sauce[J].LWT-Food Sci Technol,2011 (4):1309-1313.
[2]张玲,张钟,赖志聪,等.发酵型菠萝蜜果酒加工工艺研究[J].湖北农业科学,2011,50(10):2096-2100.
[3]阳辛凤.食品添加剂处理改善微波膨化菠萝蜜脆片品质的研究[J].食品工业,2008(3):50-52.
[4]陈智理,杨昌鹏,蒲海燕,等.菠萝蜜果汁加工工艺的研究[J].饮料工业,2011,14(6):20-23.
[5]AGOURRAM A,GHIRARDELLO D,RANTSIOU K,et al.Phenolic content,antioxidant potential,and antimicrobial activities of fruit and vegetable by-product extracts[J].Int J Food Prop,2013,16(5):1092-1104.
[6]CHEN A Y,CHEN Y C.A review of the dietary flavonoid,kaempferol on human health and cancer chemoprevention[J].Food Chem,2013, 138(4):2099-2107.
[7]陈亮,孙鹏,王婷,等.天竺桂多酚提取物降血糖活性研究[J].中成药,2014,36(2):229-234.
[8]任虹,薛宏,亮李婷,等.超声波辅助提取花生红衣多酚及其抗氧化活性研究[J].中国粮油学报,2015,30(1):117-123.
[9]XIE J H,SHEN M Y,XIE M Y,et al.Ultrasonic-assisted extraction,antimicrobial and antioxidant activities ofCyclocarya paliurus(Batal.)lljinskaja polysaccharides[J].Carbohyd Polym,2012,89(1):177-184.
[10]CHEN W,WANG W P,ZHANG H S,et al.Optimization of ultrasonicassisted extraction of water-soluble polysaccharides from boletus edulis mycelia using response surface methodology[J].Carbohyd Polym,2012, 87(1):614-619.
[11]吕娜,刘阳,崔艳艳,等.响应面法优化超声波提取山荆子总黄酮工艺[J].中国酿造,2014,33(2):71-74.
[12]范金波,蔡茜彤,冯叙桥,等.超声波辅助提取牛蒡根多酚工艺参数优化[J].食品与发酵工业,2014,40(11):247-252.
[13]FANG X S,WANG J H,WANG Y Z,et al.Optimization of ultrasonic-assisted extraction of wedelolactone and antioxidant polyphenols fromEclipta prostrateL using response surface methodology[J].Sep Purif Technol,2014,138:55-64.
[14]JIANG Z G,DU Q Z.Glucose-lowering activity of novel tetrasaccharide glyceroglycolipids from the fruits ofCucurbita moschata[J].Bioorg Med Chem Lett,2011,21(3):1001-1003.
[15]LIU Y,WEI S L,LIAO M C.Optimization of ultrasonic extraction of phenolic compounds fromEuryale feroxseed shells using response surface methodology[J].Ind Crop Prod,2013,49:837-843.
[16]张振山,刘玉兰,张丽霞,等.超声波辅助提取对亚麻籽油得率和品质的影响[J].中国粮油学报,2014,29(8):90-94.
[17]LIN L Z,ZHAO H F,LI D,et al.Macroporous resin purification behavior of phenolics and rosmarinic acid fromRabdosia serra(MAXIM.) Hara leaf[J].Food Chem,2012,130(2):417-424.
Ultrasonic-assisted extraction technology and hyperglycemic effect of polyphenols from jackfruit peel
JIANG Zhiguo,LI Bin*
(College of Food Science,Hainan University,Haikou 570228,China)
The extraction conditions of polyphenols from jackfruit peel were optimized by response surface methodology.The polyphenols crude extracts were obtained by ethanol solution extraction,and were separated and purified by XAD-7HP macroporous resin.By diabetic mice models induced with streptozotocin,the hyperglycemic effect and its mechanism of polyphenols from jackfruit peel were were researched.The results showed that the optimal process conditions of ultrasonic assisted extraction were solid-liquid ratio 1∶59(g∶ml),ethanol content 35%,extraction temperature 55℃,time 41 min,and ultrasonic power 360 W.Under the conditions,the polyphenols yield was 5.89 mg/g.After XAD 7 HP macroporous resin purification,the polyphenols content increased from 13.41%to 63.26%,purification fold was 4.71.The preliminary results of hyperglycemic effect showed that jackfruit peel polyphenols could significantly reduce blood glucose concentration of diabetic mice models induced with streptozotocin, and had a certain hyperglycemic ability.
jackfruit peel;polyphenols;ultrasonic assisted extraction;hyperglycemic effect
TS209
0254-5071(2016)10-0078-06
10.11882/j.issn.0254-5071.2016.10.017
2016-06-14
海南省自然科学基金(20153157);海南省高等学校科学研究重点项目(Hnky2015ZD-3)
蒋志国(1977-),男,副教授,博士,研究方向为食品化学与营养。
李斌(1966-),男,实验师,本科,研究方向为食品化学与营养。
