羧甲基茯苓多糖对肠癌小鼠生命延长及对环磷酰胺的减毒作用
2016-12-02王灿红霍小位何晓山刘冬羽李立勇
王灿红,霍小位,何晓山,刘冬羽,李立勇,曹 丽,*
(1.中国医学科学院药用植物研究所,北京 100193;2.云南中医学院中药学院,云南 昆明 650500)
羧甲基茯苓多糖对肠癌小鼠生命延长及对环磷酰胺的减毒作用
王灿红1,2,霍小位1,何晓山2,刘冬羽1,李立勇1,曹 丽1,*
(1.中国医学科学院药用植物研究所,北京 100193;2.云南中医学院中药学院,云南 昆明 650500)
目的:研究羧甲基茯苓多糖(carboxymethyl pachymaran,CMP)对结肠癌(CT26)小鼠的生命延长及对环磷酰胺(cyclophosphamide,CTX)的减毒作用。方法:建立小鼠CT26皮下移植瘤模型,减毒增效实验分为:模型组、CTX组、CMP+CTX组;延长生命实验分为:模型组、CMP低、中、高剂量组。检测外周血白细胞(white blood cell,WBC)数、骨髓有核细胞(bone marrow nucleated cell,BMNC)数、肿瘤抑制率、脏器指数以及肿瘤组织中信号调节蛋白-α(signal regulatory protein-α,SIRP-α)和巨噬细胞表面标志物(F4/80)的表达,统计生命延长率和中位生存期。结果:CMP抑制CTX化疗所致的脾脏和胸腺指数的降低及WBC和BMNC数量的减少,拮抗肝脏指数升高,降低SIRP-α和F4/80的表达,并延长小鼠带瘤生存时间。结论:CMP明显减轻CTX的毒副作用,且具有调节肿瘤免疫相关蛋白表达和延长CT26小鼠带瘤生存时间的作用。
羧甲基茯苓多糖;结肠癌;免疫调节;环磷酰胺;减毒作用;生命延长
植物多糖为一类天然生物大分子,其来源丰富、成本低廉、无毒且药理作用广泛,如杏鲍菇多糖、灵芝多糖、茯苓多糖、香菇多糖等,它们在抗肿瘤、抗病毒、抗炎、抗氧化等方面均取得了良好疗效[1-5],其中抗肿瘤和增强免疫作用是其研究的热点,尤其与化疗药物合用的减毒增效作用受到广泛的关注[6-8]。
茯苓为多孔菌科真菌(Poria cocos (Schw.) Wolf)的干燥菌核,根据记载茯苓具有利水渗湿、健脾和胃、宁心安神之功效,为一种药食两用的传统中药材[9]。茯苓多糖是茯苓的主要成分,其含量占茯苓质量的80%以上[10]。未经修饰的茯苓多糖几乎无抗肿瘤活性,经过结构修饰后的茯苓多糖抗肿瘤及免疫增强作用均明显提高[11]。天然茯苓多糖先经氢氧化钠碱化、氯乙酸醚化,再加碱二次醚化,最后乙醇沉淀合成羧甲基茯苓多糖(carboxymethyl pachymaran,CMP)。经过羧甲基化修饰后的茯苓多糖黏度降低、取代度增加、水溶性升高、抗肿瘤及免疫活性也随之增强[12]。
环磷酰胺(cyclophosphamide,CTX)为临床常用的广谱抗肿瘤药物,但其选择性差,在杀伤肿瘤细胞的同时,对生长旺盛的正常组织也产生严重毒副作用,导致机体免疫功能低下,影响患者生活质量[13]。目前,CMP已经被用于临床癌症的辅助治疗,能起到提高机体免疫功能、辅助抗肿瘤等作用,但其如何发挥对化疗药物的减毒增效作用值得深入探讨。因此,本研究通过建立小鼠CT26皮下移植瘤模型,研究CMP对CTX的减毒增效作用及对皮下移植荷瘤小鼠带瘤生存时间的影响,以期为CMP抗肿瘤作用的深入研究及临床应用提供依据。
1 材料与方法
1.1 动物与瘤株
健康SPF级,雄性BALB/c小鼠,52 只,体质量16~18 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。按啮齿类动物饲养方法和条件,饲养于SPF级动物房。小鼠保持在12 h明/暗周期,控制相对湿度50%~70%、温度20~24 ℃,实验前适应性喂养3 d,食物和水可自行使用。
CT26结肠癌瘤株由中国医学科学院药用植物研究所药理毒理中心常规传代保存。
1.2 材料与试剂
CMP 湖南补天药业股份有限公司。
注射用CTX 江苏恒瑞医药股份有限公司;山羊抗鼠抗体信号调节蛋白-α(signal regulatory protein-α,SIRP-α)、巨噬细胞表面标志物F4/80 美国Santa Cruz公司;山羊抗鼠二抗 北京康为世纪生物技术有限公司;冰醋酸、甲醛及其他试剂均为国产分析纯。
1.3 仪器与设备
BCN-1360生物洁净工作台 北京东联哈尔仪器制造有限公司;5410二氧化碳培养箱 美国Napco公司;MQX 200酶标仪 美国Bio-Tek公司;CKX 41荧光倒置显微镜 日本Olympus公司;Labofuge 400R离心机 德国Heraeus公司;TT快速细胞分析仪 德国Casy Innovatis公司。
1.4 方法
1.4.1 小鼠CT26皮下移植瘤模型的建立、分组及给药[14]
CT26移植瘤模型制备:将冻存的CT26瘤株复苏,用无菌生理盐水洗3 次计数并调整浓度为9.0×107个/mL,小鼠腹腔注射0.1 mL/只,连续传2 代。无菌条件下剥离对数生长期的CT26瘤块,无菌匀浆器研磨,200目筛网过筛,细胞分析仪计数活细胞数≥95%。无菌生理盐水调整细胞浓度为6.0×107个/mL,于小鼠右侧腋窝皮下接种,0.1 mL/只,制备CT26皮下移植瘤小鼠模型。
CT26肿瘤模型小鼠分组、给药:接种24 h后,其中24 只CT26小鼠,随机分为模型组、CTX组和CMP+CTX组,每组8 只。模型组小鼠腹腔注射生理盐水;CTX组腹腔注射CTX 20 mg/(kg·2 d)(以小鼠体质量计,腹腔注射体积0.1 mL/10 g,灌胃体积0.2 mL/10 g,下同);CMP+CTX组,灌胃给予CMP 200 mg/(kg·d),腹腔注射CTX 20 mg/(kg·2 d),以上各组均连续给药14 d;用于CMP对CTX减毒增效实验。
另外28 只CT26小鼠,又随机分为模型组、CMP低剂量组、CMP中剂量组、CMP高剂量组,每组7 只。模型组灌胃给予蒸馏水;CMP低、中、高剂量组,分别灌胃给药50、100、200 mg/(kg·d),以上各组均连续给药21 d;用于观察CMP对CT26肿瘤小鼠的生命延长实验。
1.4.2 CMP对CTX减毒增效实验指标检测
1.4.2.1 CT26模型小鼠体质量、肿瘤抑瘤率及脏器指数的测定
末次给药后,称体质量,摘眼球取血并颈椎脱臼处死小鼠,剥离皮下瘤块、胸腺、脾脏、肝脏、肾脏,用电子天平精密称质量,分别按式(1)和(2)计算抑瘤率和脏器指数。

1.4.2.2 CT26模型小鼠外周血白细胞(white blood cell,WBC)数的测定
末次给药1 h后,剪小鼠尾尖,取血10 µL,加入190 µL 3%的稀醋酸,稀释20 倍,轻弹EP管使红细胞充分裂解,采用血细胞计数板法在显微镜下计数。
1.4.2.3 CT26模型小鼠骨髓有核细胞的测定
脱臼处死动物,剥离右侧股骨,用1 mL注射器吸取0.5 mL Hank’s液通过针头反复冲洗骨髓,用3%稀醋酸稀释10 倍后,于血细胞计数板上计数骨髓有核细胞数。
1.4.2.4 免疫组化法检测CT26模型小鼠肿瘤组织中SIRP-α和F4/80表达
剥离肿瘤组织称质量后,剪取部分组织置于10%的甲醛溶液中固定,将固定好的组织进行流水冲洗、梯度酒精脱水,然后浸蜡、包埋,切取6 μm薄片,烤干、脱蜡、苏木素-伊红(hematoxylin eosin,HE)染色,封闭一抗、二抗,中性树脂封片。免疫组化镜检观察,肿瘤组织中SIRP-α和F4/80的表达情况,然后,对于蛋白阳性表达部分用Image Pro-Plus 6.0软件进行量化分析,用平均积分光密度(integral optical density,IOD)值反应表达状况。
1.4.3 CMP对CT26皮下移植瘤小鼠生命延长情况的影响
连续给药21 d期间,观察动物状态、死亡时间,并记录,按照公式(3)~(5)分别计算CMP对CT26结肠癌小鼠的生命延长率、中位生存期(median survival time,MST)及相对生存时间(T/C)。
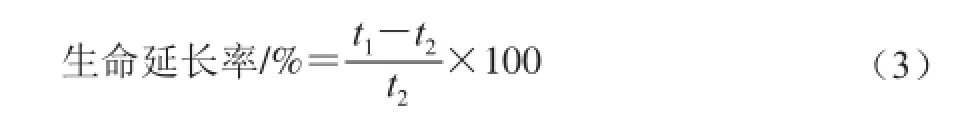
式中:t1为给药组平均存活时间/d;t2为对照组平均存活时间/d。
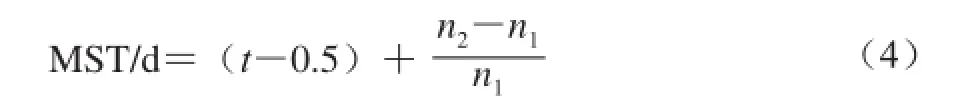
式中:t为中间生存时间/d;n1为中间生存时间死亡的小鼠只数;n2为每组小鼠数的中间数。
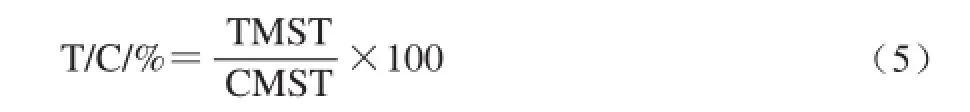
式中:TMST为治疗组中位生存期/d;CMST为对照组中位生存期/d。
1.5 数据统计分析
采用统计学处理软件SPSS 17.0,对实验数据进行正态性分析,Sig.值大于0.05,具有正态性的进行单因素方差分析、t检验,比较组间差异性,P<0.05认为差异有统计学意义;非正态分布的数据采用非参数统计的χ2检验。
2 结果与分析
2.1 CMP对CT26结肠癌小鼠脏器指数的影响
表1 CMP对CT26结肠癌小鼠脏器指数的影响(,n=8)Table 1 Effect of CMP on visceral organ indexes of CT26-bearing mice (n= 8)
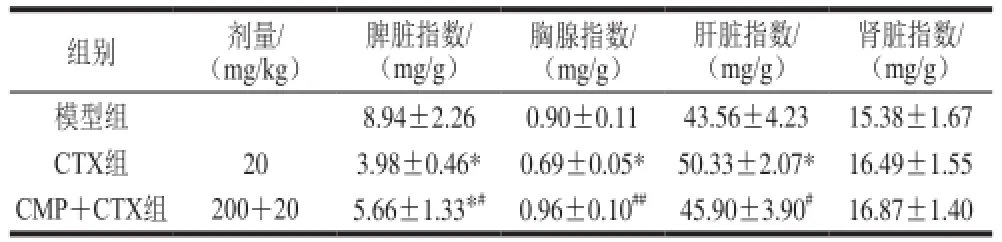
表1 CMP对CT26结肠癌小鼠脏器指数的影响(,n=8)Table 1 Effect of CMP on visceral organ indexes of CT26-bearing mice (n= 8)
注:*. 与模型组相比差异显著(P<0.05);#. 与CTX组相比差异显著(P<0.05);##. 与CTX组相比差异极显著(P<0.01)。
脾脏指数/(mg/g)组别剂量/(mg/kg)胸腺指数/(mg/g)肝脏指数/(mg/g)肾脏指数/(mg/g)模型组8.94±2.260.90±0.1143.56±4.2315.38±1.67 CTX组20 3.98±0.46*0.69±0.05*50.33±2.07*16.49±1.55 CMP+CTX组200+205.66±1.33*#0.96±0.10##45.90±3.90#16.87±1.40
由表1可知,与模型组相比,CTX导致CT26荷瘤小鼠的脏器指数发生明显改变,脾脏和胸腺指数分别下降了55.48%(P<0.05)和23.33%(P<0.05),肝脏指数明显升高了13.45% (P<0.05);而相比CTX组,CMP与CTX合用后,可部分恢复CTX改变的脏器指数,其中脾脏和胸腺指数分别升高42.21%(P<0.05)和39.13%(P<0.01),肝脏指数则显著降低了8.80%(P<0.05)。另外,CTX对CT26模型小鼠的肾脏指数有一定程度的提高,但差异无统计学意义,给予CMP对肾脏指数也无明显影响。
2.2 CMP对CTX抗肿瘤作用的影响
表2 CMP对CTX抗肿瘤作用的影响(,n=8)Table 2 Influence of CMP on the antitumor effect of CTX in CT26-bearing mice (n= 8)
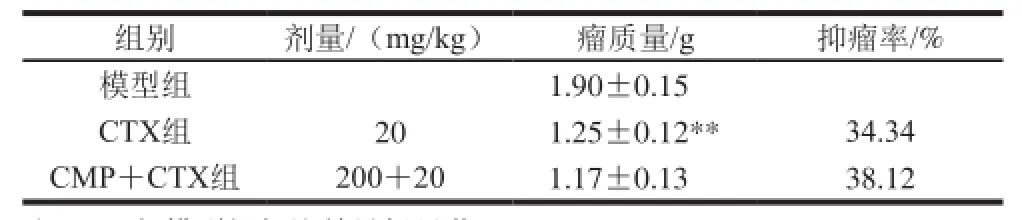
表2 CMP对CTX抗肿瘤作用的影响(,n=8)Table 2 Influence of CMP on the antitumor effect of CTX in CT26-bearing mice (n= 8)
注:**. 与模型组相比差异极显著(P<0.01)。
组别剂量/(mg/kg)瘤质量/g抑瘤率/%模型组1.90±0.15 CTX组20 1.25±0.12**34.34 CMP+CTX组200+201.17±0.1338.12
由表2可知,与模型组相比,CTX和CMP+CTX组瘤质量均明显减轻(P<0.01)。但与CTX组相比,给予CMP后瘤质量无明显减轻;表明CMP无明显增强CTX抗CT26的作用。
2.3 CMP对CT26结肠癌小鼠WBC数和骨髓有核细胞(bone marrow nucleated cell,BMNC)数的影响

表3 CMP对CT26结肠癌小鼠WBC和BMNC数的影响(x±s,n=8)Table 3 Effect of CMP on?peripheral?white blood cells and?bone marrow nucleated cells of CT26 mice (x± s, n= 8)
由表3可知,与模型组相比,CTX显著降低CT26模型小鼠WBC和BMNC水平,分别降低了57.98%(P<0.01)和74.38%(P<0.01)。而相比CTX组,给予CMP后WBC和BMNC水平分别升高26.74%(P<0.05)和141.94%(P<0.05)。
2.4 CMP对CT26结肠癌小鼠肿瘤组织中SIRP-α和F4/80表达的影响
SIRP-α和F4/80参与肿瘤的免疫逃逸、侵袭和转移等,在肿瘤的发生发展中发挥重要作用。免疫组织化学结果见图1、2。SIRP-α和F4/80的阳性表达见图中被染成棕褐色的细胞。与模型组相比,CTX和CMP+CTX组SIRP-α和F4/80的表达均明显减少(P<0.001),并且CMP+CTX组中SIRP-α和F4/80的表达量明显少于CTX组(P<0.05或P<0.01)。
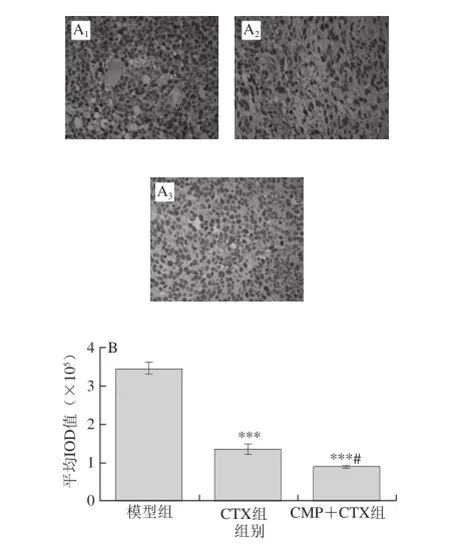
图1 CMP对肿瘤组织中SIRP-α表达的影响(×40)Fig. 1 Effect of CMP on the expression of SIRP-α in tumor tissues of CT26-bearing mice (× 40)
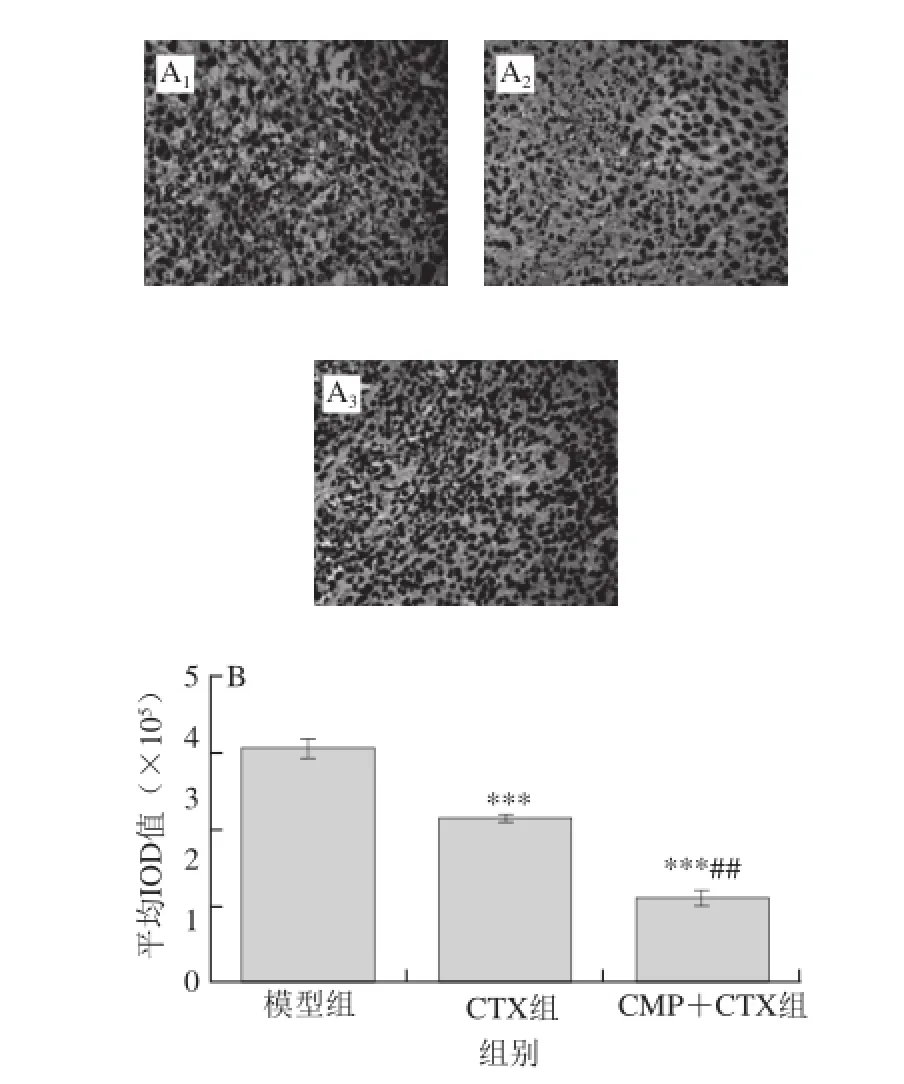
图2 CMP对肿瘤组织中F4/80表达的影响(×40)Fig. 2 Effect of CMP on the expression of F4/80 in tumor tissue of CT26-bearing mice (× 40)
2.5 CMP给药对CT26结肠癌小鼠生命延长的影响
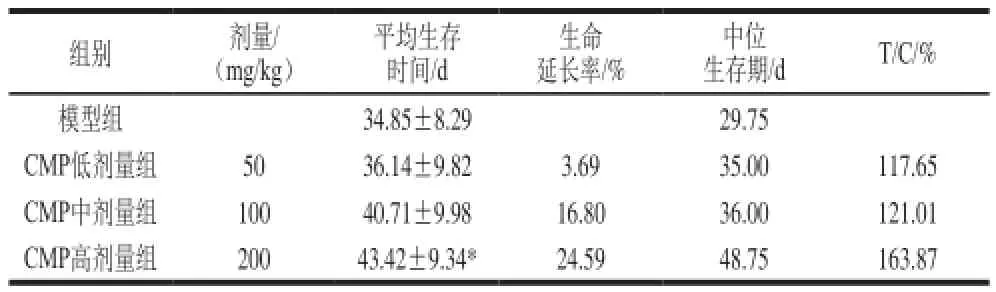
表4 CMP对CT26结肠癌小鼠生存时间的影响(n=7)Table 4 Effect of CMP on the life cycle of CT26 mice (n= 7)
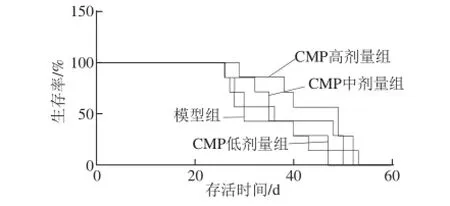
图3 CMP对CT26结肠癌小鼠生存曲线的影响(n=7)Fig. 3 Survival curve of CT26-bearing mice subjected to CMP treatment (n = 7)
由表4和图3可知,与模型组相比,CMP低、中、高剂量组均延长结肠癌小鼠的生存期,其生命延长率分别为3.69%、16.8%和24.59%;中位生存期分别为35.00、36.00 d和48.75 d,明显高于模型组的29.75 d。相对生存时间 (T/C)用来表示实验治疗的效果,T/C>120%认为药物有效,结果显示CMP中和CMP高剂量组T/C值均>120%,表明即使单用CMP对延长CT26肠癌小鼠的生存期就有较显著效果。
3 讨 论
本研究结果显示,CT26荷瘤小鼠给予CTX(20 mg/kg),引起脏器指数异常、WBC和BMNC水平下降等非特异性免疫功能低下,与文献[15-16]报道一致。而CMP则明显拮抗CTX引起的免疫及造血功能异常,显示其对CTX有较好的减毒作用。
但在协同CTX对肠癌CT26的抑瘤作用上CMP增效作用不明显。本课题组前期在体外应用小鼠S180肉瘤、人白血病K562、人宫颈癌HeLa和人胃癌AGS等细胞观察到CMP均未显示体外抗癌活性。同时考察CMP体内对S180、小鼠Lewis肺癌等肿瘤的抑制作用,最高抑瘤率仅为30%,表明其体内抑瘤活性也不显著(本实验未显示结果)。这与文献报道的CMP体内对小鼠S180肉瘤抑制率达35.27%[17]相似。因此,认为CMP在肿瘤治疗中主要起到减低化疗药物毒性、改善肿瘤微环境及增强免疫功能等。
信号调节蛋白SIRP-α和表皮生长因子跨膜家族糖蛋白F4/80,均是肿瘤微环境中巨噬细胞、树突细胞、单核细胞等的表面标志物,主要参与肿瘤的侵袭、转移、免疫逃逸及炎症等过程,在肿瘤组织中高度表达,促进肿瘤生长和炎症发生[18-21]。本研究显示,与模型组相比,CTX和CMP+CTX组SIRP-α和F4/80的表达均明显减少,且CMP+CTX组中SIRP-α和F4/80的表达明显少于单用CTX组,提示CMP可能具有增强巨噬细胞的吞噬作用、改善肿瘤的炎性微环境,阻碍肿瘤相关巨噬细胞的侵袭和转移。
研究报道,CMP(300 mg/kg)使白血病p388小鼠生命延长35.88%,与化疗药物CTX合用后生存期延长到70.05%[22]。本实验结果也显示,单用CMP能明显延长CT26小鼠带瘤生存周期,生命延长率最高可达24.59%,且有量效关系,提示CMP单用能明显改善肠癌荷瘤小鼠的生存质量,延长带瘤生存周期,而与化疗药物合用可能有更好的生命延长效果,这值得进一步探讨。
综上所述,CMP在小鼠肠癌化疗辅助用药中可减轻化疗药物毒副作用,调节免疫功能,改善肿瘤微环境、提高生活质量及延长带瘤生存时间。但其联合化疗药物是否延长生命周期,其减毒、调节肠癌免疫炎症微环境的具体分子机制还有待进一步探究。
[1] 刘海英, 范刘士博. 杏鲍菇多糖对S180荷瘤小鼠的保护作用[J]. 食品科学, 2015, 36(3): 198-201. DOI:10.7506/spkx1002-6630-201503038.
[2] 陈继岩. 羧甲基茯苓多糖抗乙型肝炎病毒的体内与体外研究[J]. 中国生化药物杂志, 2015, 35(2): 66-70.
[3] 乔进, 窦志华, 施忠, 等. 灵芝多糖联合二甲双胍对2型糖尿病模型大鼠氧化应激的影响[J]. 医药导报, 2015, 34(6): 718-721.
DOI:10.3870/yydb.2015.06.004.
[4] 曹露. 鱿鱼墨多糖对环磷酰胺所致小鼠肠道黏膜上皮细胞损伤的保护作用研究[D]. 青岛: 中国海洋大学, 2013: 25-41. DOI:10.7666/ d.D327982.
[5] 岳磊, 汲晨锋. 香菇多糖免疫调节和抗肿瘤活性研究进展[J]. 亚太传统医药, 2015, 11(18): 23-26. DOI:10.11954/ytctyy. 201518012.
[6] QIANG Y, SHAO P N, WANG J Q, et al. Chemoprotective effects of Ganoderma atrum polysaccharide in cyclophosphamide induced mice[J]. International Journal of Biological Macromolecules, 2014, 64: 395-401. DOI:10.1016/j.ijbiomac.2013.12.029.
[7] ZHAO T, MAO G H, ZHANG M, et al. Enhanced antitumor and reduced toxicity effect of Schisanreae polysaccharide in 5-Fu treated Heps-bearing mice[J]. International Journal of Biological Macromolecules, 2014, 63: 114-118. DOI:10.1016/ j.ijbiomac.2013.10.037.
[8] WEI X J, HUA T J, CHEN J R, et al. Inhibitory effect of carboxymethyl pachymaran on cyclophosphamide-induced oxidative stress in mice[J]. International Journal of Biological Macromolecules, 2011, 49(4): 801-805. DOI:10.1016/j.ijbiomac.2011.07.017.
[9] 国家药典委员会. 中华人民共和国药典一部[M]. 北京: 北京化学工业出版社, 2005: 166.
[10] HAMURO J J, MAEDA Y Y, ARAI Y, et al. The significance of the higher structure of the polysaccharides lentinan and pachymaran with regard to their antitumor activity[J]. Chemico-Biological Interactions, 1971, 3(1): 69-71. DOI:10.1016/0009-2797(71)90026-3.
[11] MIZUNO T, YEOHLUI P, KINOSHITA T, et al. Anti-tumor activity and chemical modification of polysaccharides from niohshimeiji mushroom, Tricholoma giganteum[J]. Bioscience Biotechnology Biochemistry, 1996, 60(1): 30-33. DOI:10.1271/bbb.60.30.
[12] 石清东, 蒋先明. 二次碱化法制备羧甲基茯苓多糖[J]. 天然产物研究与开发, 1996(2): 78-81.
[13] 张云波. 环磷酰胺对免疫系统的影响[J]. 安徽农业科学, 2013, 41(30): 12040-12042. DOI:10.13989/j.cnki.0517-6611.2013.30.095.
[14] 魏伟, 吴希美, 李元建. 药理实验方法学 [M]. 4版. 北京: 人民卫生出版社, 2010: 1581-1583.
[15] 姚佳, 彭梅, 肖雄, 等. 仙茅多糖对氟尿嘧啶增效减毒作用[J]. 天然产物研究与开发, 2014, 26: 834-837; 867. DOI:10.16333/j.1001-6880.2014.06.006.
[16] TABATA R, TABATA C. Distinct effect of cyclophosphamide and cyclosporine on pure red cell aplasia associated with T-cell large granular lymphocyte leukemia[J]. International Immunopharmacology, 2014, 23(2): 391-394. DOI:10.1016/j.intimp.2014.10.013.
[17] 吴皓, 林洪生, 裴迎霞, 等. 人参皂甙Rg3对荷瘤及环磷酰胺化疗小鼠黏膜免疫力影响[J]. 中国肿瘤, 2005, 15(6): 369-371.
[18] BARCLAR A N. Signal regulatory protein alpha (SIRPα)/CD47 interaction and function[J]. Current Opinion in Immunology, 2009, 21: 47-52. DOI:10.1016/j.coi.2009.01.008.
[19] RAYMOND M, RUBIO M, FORTIN G, et al. Selective control of SIRP-α-positive airway dendritic cell trafficking through CD47 is critical for the development of TH2-mediated allergic inflammation[J]. Journal of Allergy and Clinical Immunology, 2009, 124(6): 1333-1342. DOI:10.1016/j.jaci.2009.07.021.
[20] VANDENBERG T K, KRAAL G. A function for the macrophage F4/80 molecule in tolerance induction[J]. TRENDS in Immunology, 2005, 26(10): 506-509. DOI:10.1016/j.it.2005.07.008.
[21] HOU T Z, BYSTORM J, SHERLOCK J P, et al. A distinct subset of podoplanin (gp38) expressing F4/80+ macrophages mediate phagocytosis and are induced following zymosan peritonitis[J]. FEBS Letters, 2010, 584: 3955-3961. DOI:10.1016/j.febslet.2010.07.053.
[22] 杨勇, 杨宏新, 闫晓红. 羧甲基茯苓多糖抗小鼠白血病凋亡药理学研究[J]. 肿瘤研究与临床, 2005, 17(2): 83-85. DOI:10.3760/cma. j.issn.1006-9801.2005.02.004.
Effect of Carboxymethyl Pachymaran on Life Extension and Attenuation of Cyclophosphamide-Induced Toxicity in CT26 Tumor-Bearing Mice
WANG Canhong1,2, HUO Xiaowei1, HE Xiaoshan2, LIU Dongyu1, LI Liyong1, CAO Li1,*
(1. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China; 2. Department of Traditional Chinese Medicine, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China)
Objective: To investigate the effect of carboxymethyl pachymaran (CMP) on life extension of colon tumor 26 (CT26)-bearing mice and mitigating the side effects caused by chemotherapy with cyclophosphamide (CTX). Methods: CT26 tumor-bearing mouse models were established by subcutaneous transplantation into mice, and they were randomly divided into model, CTX and CTX + CMP groups for toxicity test. The model, and low-, medium- and high-dose CMP, groups were used for life extension test. Peripheral white blood cells (WBC), bone marrow nucleated cells (BMNC), percentage tumor inhibition, and visceral organ indexes were tested by biochemical assays. The expression of signal regulating protein alpha (SIRP-α) and macrophage surface marker (F4/80) in tumor tissues were detected through immunohistochemistry. Meanwhile, life extension rate and median survival period were observed. Results: CMP could increase the lower spleen index and thymus index, and the decreased levels of WBC and BMNC induced by CTX, antagonize the increase in liver index, and reduce the expression of SIRP-α and F4/80 in tumor tissues. In addition, CMP also could extend the survival time of CT26 tumor-bearing mice. Conclusion: CMP can obviously reduce the side effects of CTX, regulate the expression of tumor immune-related proteins, and prolong the survival time of CT26 tumor -bearing mice.
carboxymethyl pachymaran (CMP); colon cancer; immune regulation; cyclophosphamide (CTX); reducing toxicity; life extending
10.7506/spkx1002-6630-201621039
R285.5
A
1002-6630(2016)21-0229-05
王灿红, 霍小位, 何晓山, 等. 羧甲基茯苓多糖对肠癌小鼠生命延长及对环磷酰胺的减毒作用[J]. 食品科学, 2016, 37(21): 229-233. DOI:10.7506/spkx1002-6630-201621039. http://www.spkx.net.cn
WANG Canhong, HUO Xiaowei, HE Xiaoshan, et al. Effect of carboxymethyl pachymaran on life extension and attenuation of cyclophosphamide-induced toxicity in CT26 tumor-bearing mice[J]. Food Science, 2016, 37(21): 229-233. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621039. http://www.spkx.net.cn
2015-12-22
国家科技部“重大新药创制”科技重大专项(2012ZX09501001-004;2012ZX09301-002-001-026)
王灿红(1986—),女,硕士研究生,研究方向为中药药理与应用。E-mail:xinzhuangjianpo@163.com
*通信作者:曹丽(1966—),女,研究员,博士,研究方向为天然药物抗肿瘤药理学。E-mail:lcao@implad.ac.cn
