纳豆芽孢杆菌NT-6固态发酵罗非鱼下脚料条件优化及产脂肽组分分析
2016-12-02孙力军王雅玲廖建萌徐德峰
张 宁,孙力军,*,王雅玲,*,廖建萌,邓 旗,刘 颖,徐德峰
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东 湛江 524088;2.湛江市食品药品检验所,广东 湛江 524000)
纳豆芽孢杆菌NT-6固态发酵罗非鱼下脚料条件优化及产脂肽组分分析
张 宁1,孙力军1,*,王雅玲1,*,廖建萌2,邓 旗1,刘 颖1,徐德峰1
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东 湛江 524088;2.湛江市食品药品检验所,广东 湛江 524000)
利用纳豆芽孢杆菌(Bacillus natto)NT-6,以罗非鱼下脚料为主要基质,进行固态发酵生产抗菌营养复合型活性肽,以提高抗菌脂肽产量为目的,对培养基和发酵条件进行优化。在对产生的脂肽组分进行分析的基础上,采用高效液相色谱-质谱定量检测法,通过单因素试验和响应面设计优化固态发酵工艺条件。结果表明:利用罗非鱼下脚料为主要基质固态发酵生产的抗菌脂肽组分主要包括表面活性素(m/z分别为995.20、1 008.20、1 058.20)、伊枯草菌素(m/z分别为1 044.30、1 071.20)。优化后的最佳工艺参数为罗非鱼下脚料与麸皮配比3.48∶1(m/m)、初始基质水分含量69.34%(质量分数)、发酵时间61.69 h、发酵温度28.97 ℃、甘蔗渣添加量6%(质量分数)、接种量5 mL/100 g,此条件下抗菌脂肽产量达7.32 g/kg,实际验证结果为7.29 g/kg,相对于优化前提升了7.5 倍,产生的脂肽含有多种脂肽组分。
纳豆芽孢杆菌;罗非鱼下脚料;固态发酵;响应面设计;抗菌脂肽;高效液相色谱-质谱
罗非鱼(Tilapia)又名非洲鲫鱼,是目前在发达和发展中国家最普遍养殖的鱼类物种之一,已得到消费者的普遍认可。中国是迄今为止最大的罗非鱼生产和出口国。在罗非鱼生产加工过程中会产生大量的下脚料,约占总质量的50%[1-2]。在实际生产中,这些下脚料或被丢弃,或以低价卖给了饲料厂作原料,附加值较低[3]。据报道每年有超过50%的鱼类副产品作为不可利用的副产品被丢弃,这样不仅浪费资源,处理不当还会引起环境污染。因此,迫切需要寻找到罗非鱼下脚料的高值化利用途径,达到其被充分利用的目的。
纳豆芽孢杆菌(Bacillus natto)是在中国和日本的传统发酵食品细菌性豆豉和纳豆中被发现并分离出的主要发酵菌株,也可作为益生菌用于动物饲料的微生物添加剂[4],纳豆芽孢杆菌还具有溶血栓、促生长、改变肠道组织和免疫调节等多种保健功能[5-6]。更重要的是,纳豆芽孢杆菌用于发酵时可以产生多种生物活性肽,尤其以抗菌脂肽为主,主要包括表面活性素(surfactin)、伊枯草菌素(iturin)和芬荠素(fengycin)等[7-8]。抗菌脂肽作为一种天然的防腐剂,具有低毒、易降解、抗癌和抗病毒等许多优良特性[9-11],使其在医药、农业、食品、化妆品、生防控制、石油开采和环境治理等领域显示出重要的开发和应用前景,已引起广泛的关注[12-15]。
目前,利用纳豆芽孢杆菌生产抗菌脂肽多为液态发酵,方传记等[16]利用淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)液态发酵产脂肽类抗菌物,Thompson等[17]利用马铃薯废液发酵生产得到抗菌脂肽。但是抗菌脂肽作为一种表面活性剂,在液态发酵情况下极易产生泡沫,造成“跑液”,进而影响抗菌脂肽的产量和产率。近年来,固态发酵因其工艺简单、低成本和高产量等优点,已逐渐在抗菌脂肽的发酵生产中得到重视。如豆粕、稻草[18]和啤酒糟[19]等已被用作生产抗菌脂肽的发酵基质。但是,鲜见利用罗非鱼下脚料作为脂肽生产的主要发酵基质的报道。与其他水产品下脚料相比,罗非鱼下脚料含有较高的蛋白质、氨基酸和各种活性矿物质[3,20],可以作为菌体生长代谢的良好基质,同时微生物代谢过程中所产内源酶可促进下脚料中蛋白质酶解生成小肽。小肽既具有很好的动物促生长能力,又能较大幅度提高动物的防病抗病能力,且能改善产品品质、提高经济效益[21]。若能将抗菌脂肽发酵生产和营养小肽的酶解工艺相结合,不仅可以得到高浓度的抗菌肽产品,还可以解决营养小肽生产中蛋白质酶解所需的生物酶源问题,生产出的产品既具有抗菌肽的功能,又具有营养寡肽的效果,还可以简化生产工艺,显著地降低生产成本,提高产品功效。
本实验拟以罗非鱼下脚料为主要基质,利用研究团队前期分离得到的一株抗菌脂肽高产菌株纳豆芽孢杆菌NT-6[22]进行固态发酵生产抗菌脂肽和营养小肽,在对产生的脂肽组分进行分析的基础上,采用前期研究建立的抗菌脂肽高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)[23]定量检测产物中脂肽的产量,通过单因素试验和响应面设计对抗菌脂肽的发酵基质和发酵条件进行优化,旨在优化抗菌脂肽生产工艺条件,为富含抗菌脂肽和营养小肽的复合功能饲用活性肽生产工艺条件的建立提供参考。
1 材料与方法
1.1 菌株
纳豆芽孢杆菌NT-6,分离于中国传统食品细菌性豆豉,广东海洋大学食品科技学院水产品食源性病原微生物及毒素绿色控制研究室保存。
1.2 材料与试剂
罗非鱼下角料(生产加工罗非鱼片过程中剩下的部分去掉内脏,主要成分为水分、蛋白质和少量脂肪、灰分) 广东省湛江市恒兴科技水产有限公司;麸皮湛江某面粉厂;甘蔗渣 湛江某制糖厂。
Surfactin、Iturin标准品 美国Sigma公司;乙腈(色谱纯)、无水甲醇、超纯水、甲酸、NaOH、HCl(均为分析纯) 齐云生物技术有限公司。
BPY培养基,无机盐溶液(谷氨酸钠5.00 g、KCl 1.00 g、MgSO4·7H2O 1.92 g、葡萄糖10.00 g、K2HPO4·3H2O 1.96 g、MnSO45.00×10-3g、CuSO41.60×10-4g、FeSO41.50×10-4g、蒸馏水1 000 mL)。
1.3 仪器与设备
TSQ Quantum Access HPLC-MS/MS联用仪 美国Thermo公司;立式压力蒸汽灭菌锅 上海云泰仪器仪表有限公司;SPX-250B-Z型生化培养箱、GZX-9240MBE电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂。
1.4 方法
1.4.1 菌株活化及种子液制备
取甘油保藏的纳豆芽孢杆菌NT-6,用接种环挑取一环进行平板划线,37 ℃倒置培养24 h,挑取平板上的单菌落至营养琼脂斜面,静置培养24 h。挑取斜面上的纳豆芽孢杆菌NT-6菌株接种于BPY液体培养基中,37 ℃、150 r/min振荡培养24 h得到种子液。
1.4.2 发酵产物的制备
将发酵基质(罗非鱼下脚料、麸皮和甘蔗渣)混匀,装入250 mL锥形瓶,再加入一定体积配制好的无机盐溶液,121 ℃高压灭菌20 min,冷却至室温。接入一定体积的纳豆芽孢杆菌NT-6种子液,置于生化培养箱中30 ℃发酵,期间每6 h搅拌一次。发酵完成后,将产物于恒温鼓风干燥箱中60 ℃烘干、粉碎。
1.4.3 抗菌脂肽的提取及检测
准确称取一定质量的发酵产物,加入一定体积的无水甲醇(1∶5,m/V)浸提12 h。后将提取液10 000 r/min离心15 min,取上清液,过滤除去不溶物,所得液体即为抗菌脂肽提取液。采用HPLC-MS法[23]检测产物中抗菌脂肽的含量。HPLC条件:色谱柱为氰柱Venusil XBP CN(100 mm×2.1 mm,5 μm);流动相:乙腈(A),5 mmol/L乙酸铵溶液(含0.1%甲酸)(B);洗脱速率:300 μL/min;洗脱过程:0~4 min,40% A和60% B;4~7 min,90% A和10% B;7~12 min,40% A和60% B。质谱条件:在ESI正离子模式下,采用选择性离子扫描SIR模式,喷雾电压4.5 kV;鞘气压力40 arb;辅助气压力15 au;毛细管温度270 ℃,碰撞压0.2 Pa。
1.4.4 单因素试验设计
1.4.4.1 罗非鱼下脚料与麸皮的配比对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量5.0 mL/100 g,初始基质含水量70%,初始pH 7.0,罗非鱼下脚料与麸皮的配比分别设为50∶0、45∶5、40∶10、35∶15、30∶20、25∶25(m/m),总质量50 g(以下单因素试验同),30℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.2 甘蔗渣添加量对抗菌脂肽产量的影响
分别添加甘蔗渣0、1、2、3、4、5 g(分别为下脚料与麸皮总质量的0、2%、4%、6%、8%、10%),接种量5.0 mL/100 g,罗非鱼与下脚料的配比40∶10(m/m),初始基质含水量70%,初始pH 7.0,30℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.3 初始基质水分含量对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量5.0 mL/100 g,初始基质水分含量分别设为55%、60%、65%、70%、75%、80%,初始pH 7.0,罗非鱼与下脚料的配比40∶10,30 ℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.4 初始pH值对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量5.0 mL/100 g,初始基质水分含量为70%,初始pH值分别为5.5、6.0、6.5、7.0、7.5、8.0,罗非鱼与下脚料的配比40∶10,30℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.5 接种量对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量分别为2.5、5.0、7.5、 10.0、12.5、15.0 mL/100 g,初始基质水分含量为70%,初始pH 7.0,罗非鱼与下脚料的配比40∶10,30℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.6 发酵温度对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量5.0 mL/100 g,初始基质水分含量为70%,初始pH 7.0,罗非鱼与下脚料的配比40∶10,分别在27、30、33、36、39 ℃条件下发酵60 h,测定抗菌肽产量。
1.4.4.7 发酵时间对抗菌脂肽产量的影响
添加甘蔗渣6%,接种量5.0 mL/100 g,初始基质水分含量为70%,初始pH 7.0,罗非鱼与下脚料的配比40∶10,30℃条件下发酵12、24、36、48、60、72 h,测定抗菌肽产量。
1.4.5 响应面试验设计
在单因素试验的基础上,利用SPSS 19.0软件对试验结果进行分析,选取对脂肽产量影响显著的因素(罗非鱼与下脚料的配比、发酵时间、初始基质含水量、发酵温度)为考察因素,以抗菌脂肽的产量为考察指标,采用Design-Expert 8.0软件进行四因素三水平的Box-Behnken试验设计,共29 组试验,每组试验3 个平行。
2 结果与分析
2.1 抗菌脂肽组分的鉴定
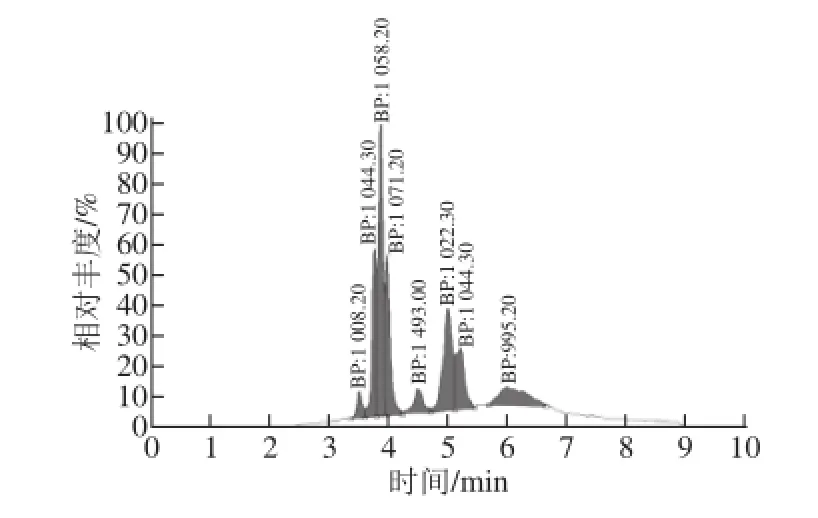
图1 产物抗菌脂肽提取物的阳离子流图Fig. 1 Positive ion current chromatogram of HPLC-MS for antimicrobial lipopeptide extract
由图1可知,在此固态发酵工艺条件下所产的抗菌脂肽产物主要包含7 种物质,其[M+H]+离子峰值分别为995.20、1 008.20、1 058.20、1 044.30、1 071.20、1 493.00。其中1 044.30出现2 个离子峰,推测为2 个同分异构体。对比相关抗菌脂肽的研究报道[24-25]可知,此发酵产物中的抗菌脂肽主要分为Surfactin(m/z 995.20、1 008.20、1 058.20)和Iturin(m/z 1 044.30、1 071.20)两类,另外还有很少量的Fengycin(m/z 1 493.00)。本实验主要研究发酵条件对Surfactin和Iturin总含量的影响。
2.2 单因素试验结果
2.2.1 罗非鱼下脚料与麸皮的配比对抗菌脂肽产量的影响细菌的生长代谢非常容易受到培养基质及外界环境的影响,尤其是发酵基质,其组成决定了其中各营养组分,很大程度上会影响到微生物的生长及代谢产物的生成[26]。由图2可知,随着下脚料与麸皮的配比中下脚料的含量不断减少,麸皮量不断增多,抗菌脂肽的产量呈现先增加后降低的趋势,并在配比为40∶10(m/m)的时候达到最大,产量为3.33 g/kg。罗非鱼下角料富含蛋白质,且湿度和黏度较大,而麸皮呈干燥颗粒状态,二者配比的变化直接影响纳豆芽孢杆菌代谢产物的生成,最终导致抗菌脂肽产量的不同。
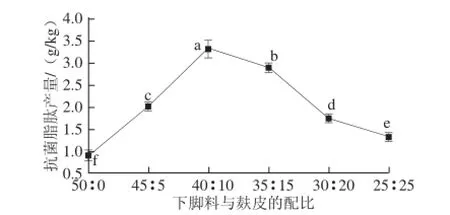
图2 罗非鱼下脚料与麸皮的配比对抗菌脂肽产量的影响Fig. 2 Effect of ratio of tilapia processing byproducts to bran on the yield of antimicrobial lipopeptides
2.2.2 甘蔗渣添加量对抗菌脂肽产量的影响
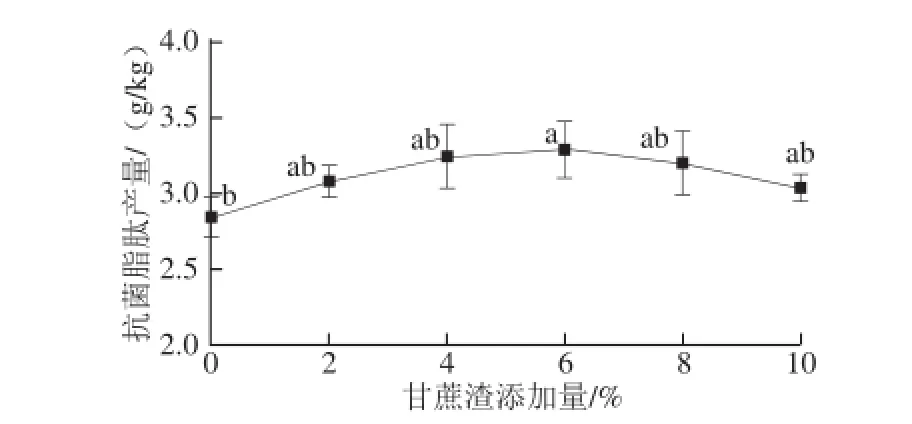
图3 甘蔗渣添加量对抗菌脂肽产量的影响Fig. 3 Effect of the amount of sugarcane bagasse on the yield of antimicrobial lipopeptides
在本实验的固态发酵过程中,甘蔗渣是作为一种通气的基质,有助于菌株的呼吸。由图3可知,随着甘蔗渣添加量的增加,抗菌脂肽的产量呈现先增加后降低的趋势,但是总的来说变化幅度不大,当甘蔗渣添加量为6%时产量达最大,为3.29 g/kg。
2.2.3 初始基质水分含量对抗菌脂肽产量的影响
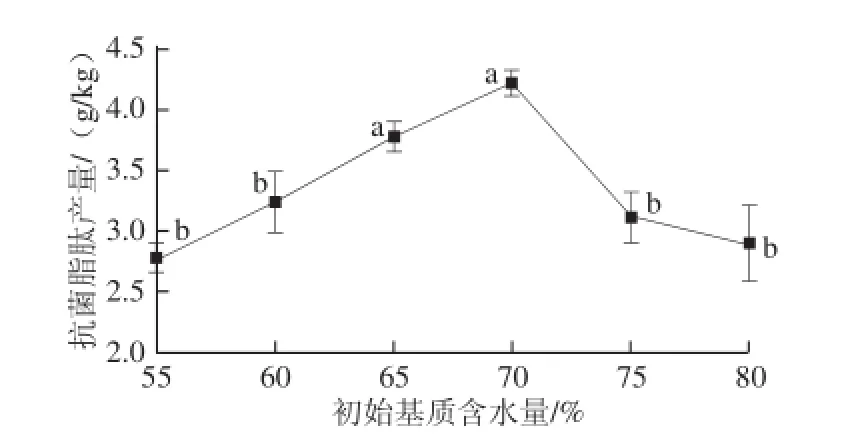
图4 初始基质水分含量对抗菌脂肽产量的影响Fig. 4 Effect of initial substrate moisture content on the yield of antimicrobial lipopeptides
水分是微生物生长的必需条件,微生物的生长代谢很大程度上受到水分含量的影响,因此,非常有必要探究初始基质水分含量对固态发酵产抗菌脂肽的影响。由图4可知,随着初始基质水分含量的升高,抗菌脂肽的产量先增加后降低,在含水量为70%时,抗菌脂肽的产量达到最高,为4.22 g/kg。此后,随着水分含量的增加,抗菌脂肽产量不断下降。固态发酵过程中,水分含量过高,不利于菌株的呼吸生长,进而影响其代谢产物的生成。
2.2.4 发酵时间对抗菌脂肽产量的影响
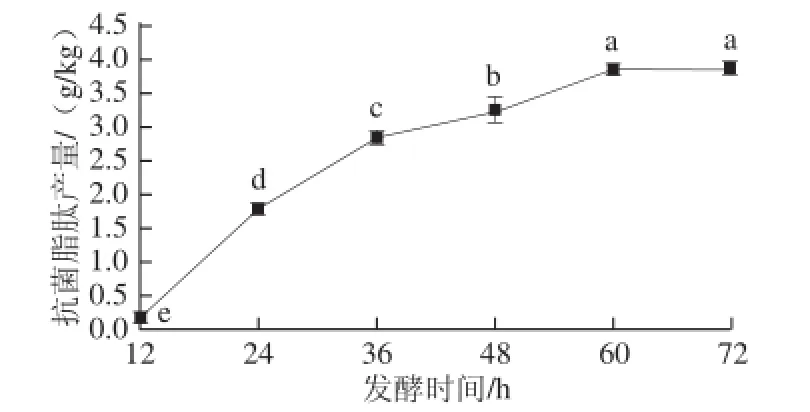
图5发酵时间对抗菌脂肽产量的影响Fig. 5 Effect of fermentation time on the yield of antimicrobial lipopeptides
图5 表明,随着发酵的不断进行,即时间的不断延长,抗菌脂肽的产量不断升高,发酵到60 h时,抗菌脂肽的产量达到3.85 g/kg,之后再延长发酵时间,抗菌脂肽产量差异不显著(P>0.05)。
2.2.5 接种量对抗菌脂肽产量的影响
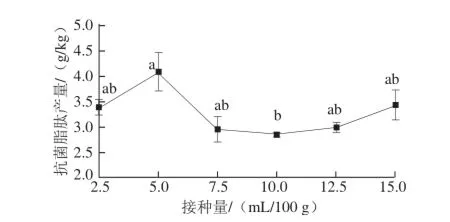
图6 接种量对抗菌脂肽产量的影响Fig. 6 Effect of inoculums volume on the yield of antimicrobial lipopeptides
由图6可以看出,接种量为5 mL/100 g时,抗菌脂肽的产量最高,为4.06 g/kg。之后随着菌种接种量的增加,抗菌脂肽的产量反而下降,即抗菌脂肽的产量与菌种的接种量并不成正比关系。分析原因可能是因为菌种浓度太大,会消耗到营养基质,影响到细菌代谢产物的生成。
2.2.6 发酵温度对抗菌脂肽产量的影响
温度也是影响芽孢杆菌生长代谢产脂肽的重要因素[27],由图7可知,发酵产物中抗菌脂肽的产量在30 ℃时达到最高,为4.23 g/kg。之后随着温度的升高,抗菌脂肽产量呈不断下降的趋势。表明30 ℃条件下,菌株生长代谢旺盛,脂肽产量高,超过此温度范围,菌株的生长代谢能力降低,脂肽产量也随之下降。
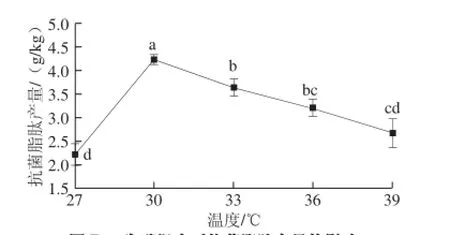
图7 发酵温度对抗菌脂肽产量的影响Fig. 7 Effect of fermentation temperature on the yield of antimicrobial lipopeptides
2.2.7 初始pH值对抗菌脂肽产量的影响
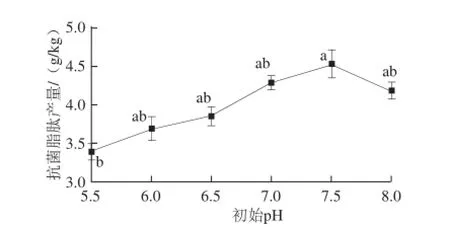
图8 初始pH值对抗菌脂肽产量的影响Fig. 8 Effect of initial pH on the yield of antimicrobial lipopeptides
由图8可知,抗菌脂肽的产量在pH 7.5时达到最大,为4.54 g/kg。在pH 5.5~7.5区间范围内,随pH值的增大,抗菌脂肽的产量不断升高,之后pH值再升高,脂肽产量下降,过高或过低的pH值都不利于脂肽的生成。
2.3 固态发酵产抗菌脂肽工艺参数优化
2.3.1 响应面试验设计及结果
通过Design-Expert软件的Box-Behnken设计试验,利用HPLC-MS法测定各试验组产物中抗菌脂肽的含量。设计的试验组合和测定结果见表1。
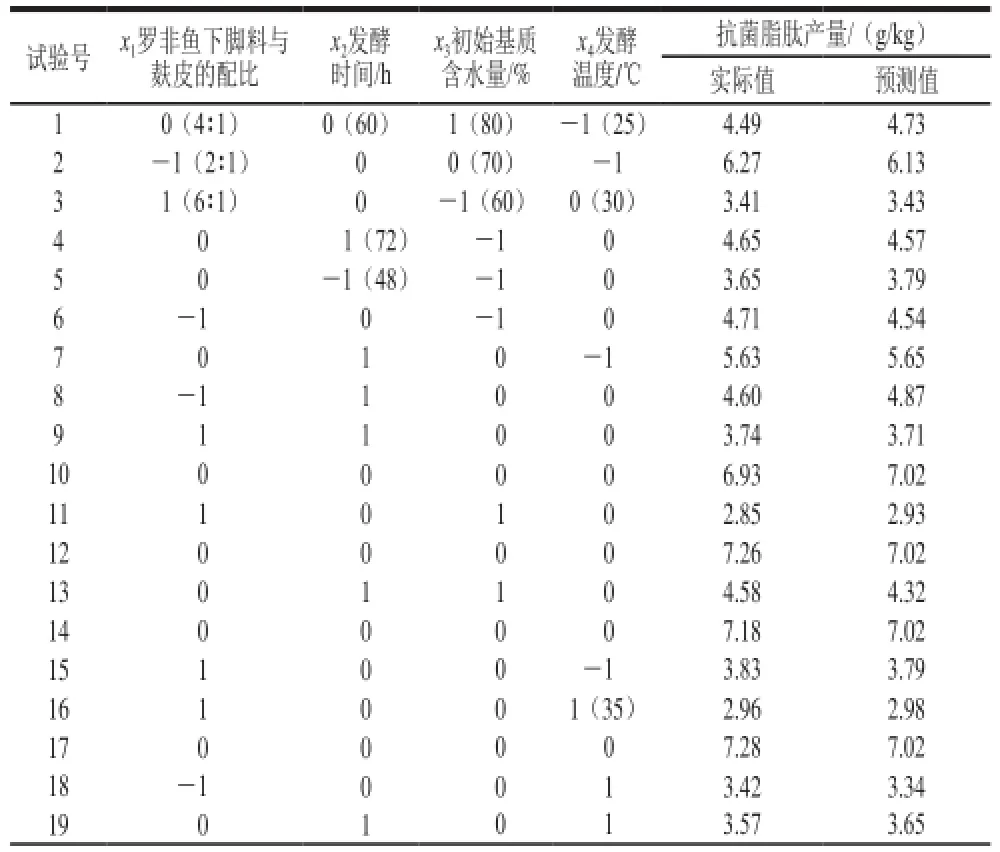
表1 响应面试验设计与结果Table 1 Response surface experimental design with experimental and predictive yield of antimicrobial lipopeptides
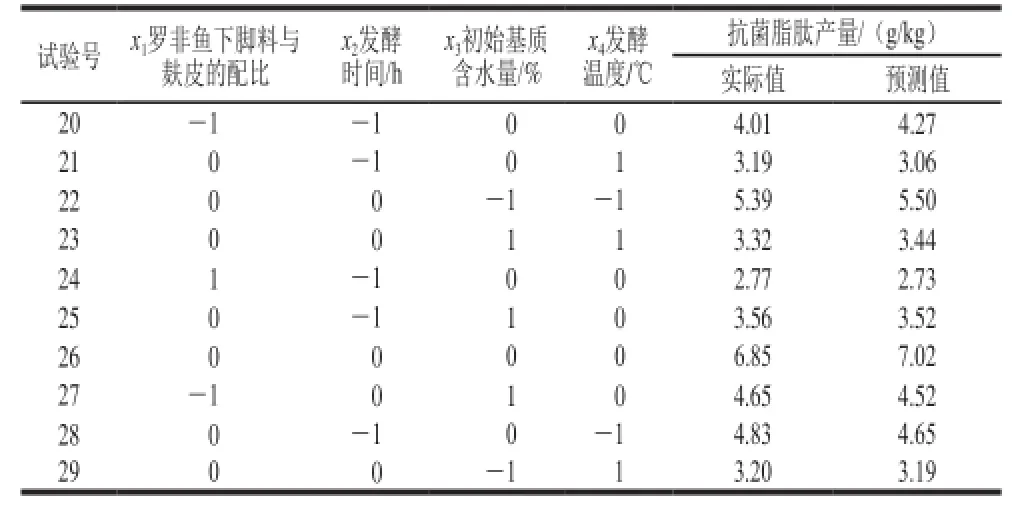
续表1
2.3.2 回归模型的建立和方差分析
对响应面结果用Design-Expert 8.0.5软件的Box-Behnken进行多元回归分析,得到抗菌脂肽产量的预测值(Y)对编码自变量罗非鱼下脚料与麸皮的配比(x1)、发酵时间(x2)、初始基质含水量(x3)、发酵温度(x4)的二次多项回归方程,剔除掉非显著项后模型方程为Y=7.02-0.68x1+0.40x2-0.90x4+0.50x1x4+ 0.25x3x4-1.66x12-1.46x22-1.50x32-1.30x42。对上述二次多项回归方程进行多因素方差分析,结果见表2。
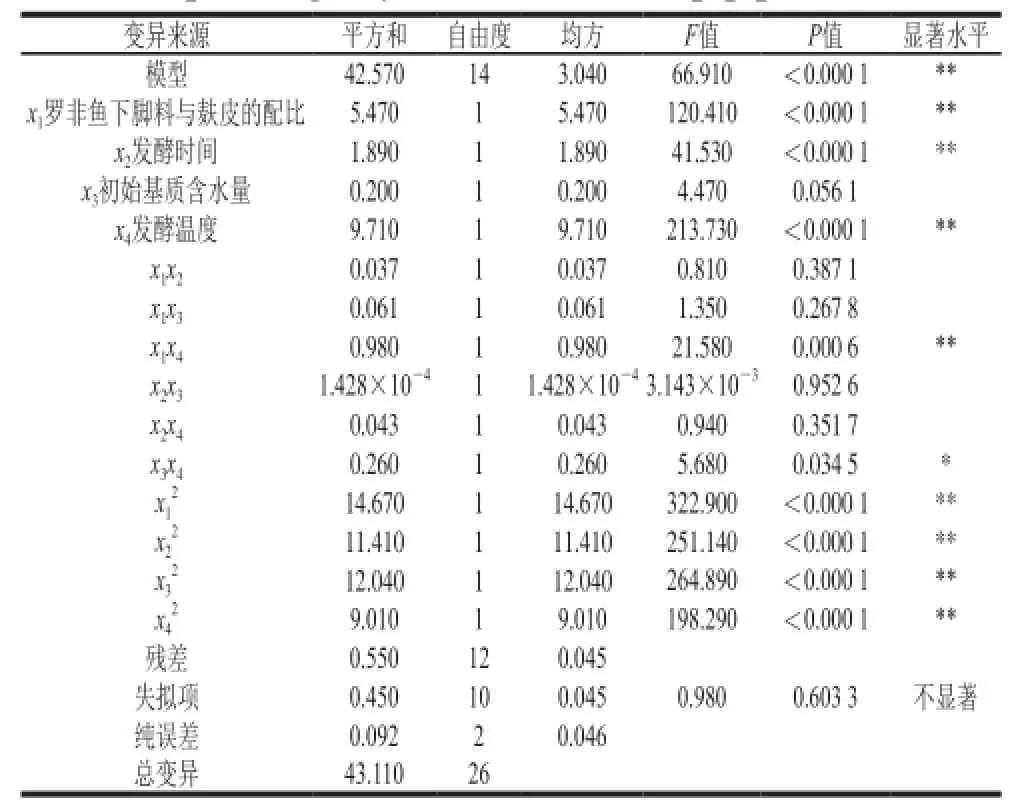
表2 抗菌脂肽产量回归模型方差分析Table 2 Analysis of variance (ANOVA) for regression?equation for predicting the yield of antimicrobial lipopeptides
由模型的方差分析结果(表2)可以看出,回归模型的P<0.000 1,失拟项的P=0.603 3>0.05,此二次多项模型具有极好的显著性,失拟项不显著,说明未知因素对试验结果干扰很小;且模型的相关系数R2=0.987 4,校正系数R2Adj=0.972 6;说明该模型与实际情况拟合良好,能较好反映抗菌脂肽的产量与罗非鱼下脚料与麸皮的配比、发酵时间、初始基质水含量和发酵温度之间的关系,因此该模型可用来分析和预测利用纳豆芽孢杆菌固态发酵产抗菌脂肽的工艺条件。由表2的F值大小可知,4 个因素对抗菌脂肽产量影响的显著性顺序为:发酵温度>罗非鱼下脚料与麸皮的配比>发酵时间>初始基质含水量。
回归方程中的一次项x1、x2和x4的P值均小于0.000 1,影响极显著,x3的P值大于0.05,影响不显著;交互项x1x4极显著,x3x4显著,其他交互项均不显著,二次项x12、x22、x32和x42均处于极显著水平。
2.3.3 两因素交互作用对抗菌脂肽产量的影响
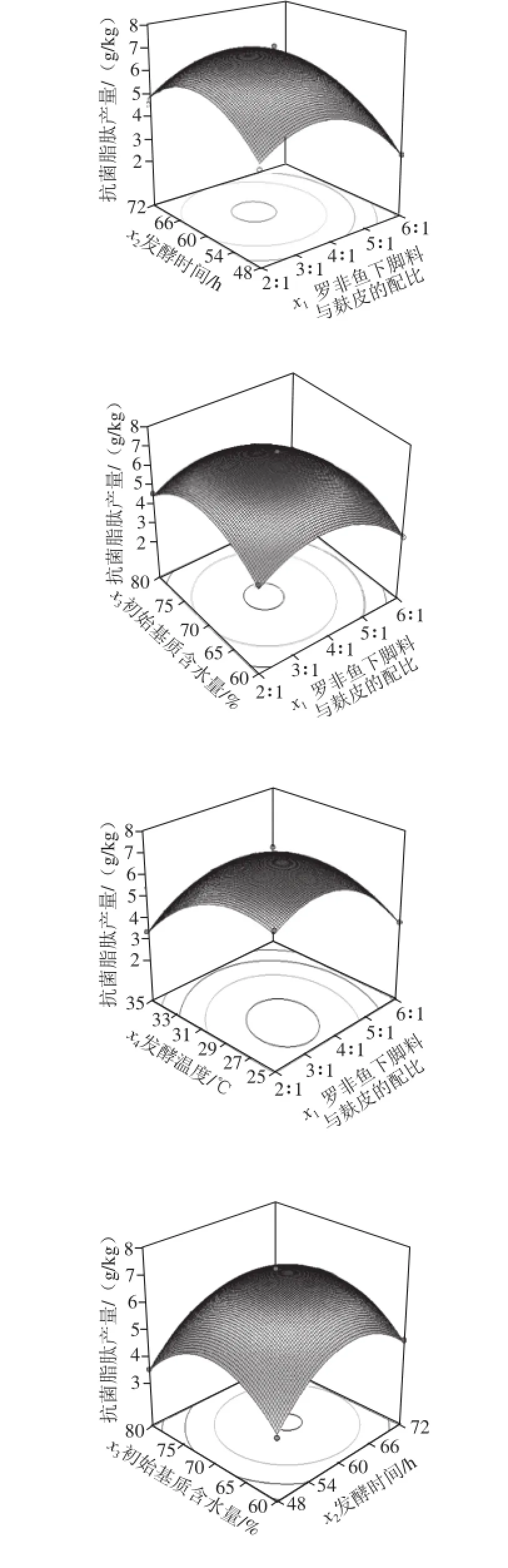
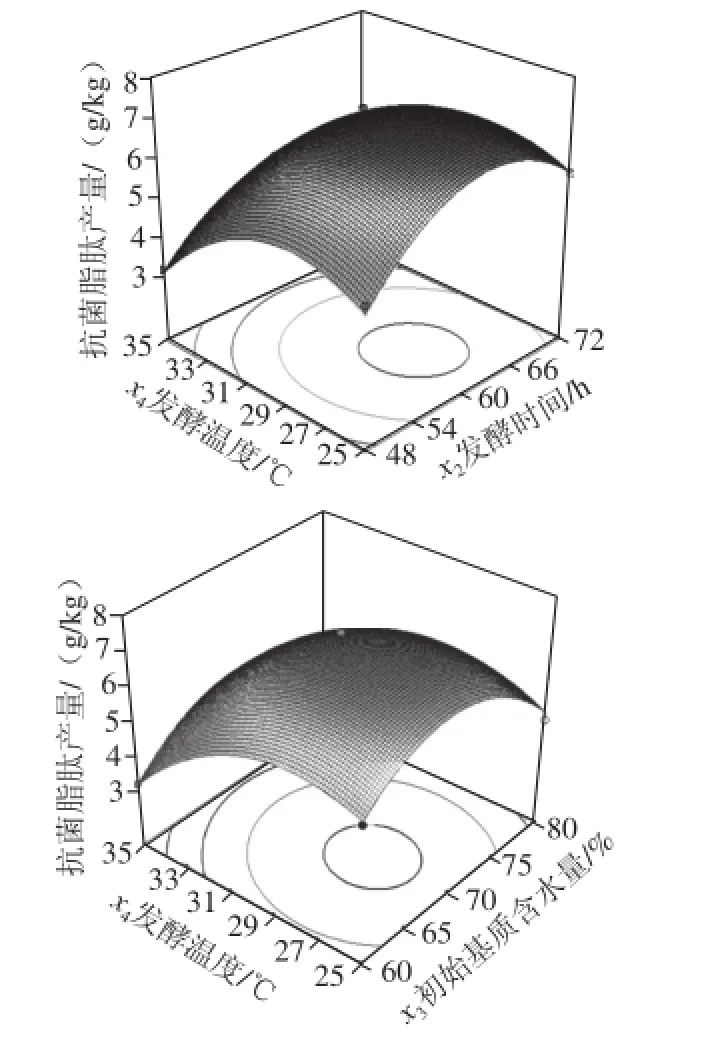
图9 两因素交互作用对抗菌脂肽产量影响的响应面图Fig. 9 Response surface plots for the effect of interaction among four factors on the yield of antimicrobial lipopeptides
响应面图是响应值在各试验因素交互作用下得到的结果构成的一个三维空间曲面图。曲面越陡峭,则表明因素间的交互作用越显著,反之则不显著。由图9可知,罗非鱼下脚料与麸皮配比和发酵温度的交互作用极显著,初始基质含水量和发酵温度交互作用显著,罗非鱼下脚料与麸皮配比和发酵时间、罗非鱼下脚料与麸皮配比和初始基质含水量、发酵时间和初始基质含水量、发酵时间和发酵温度交互作用不显著。
2.3.4 最佳工艺参数的确定及验证实验
由Design-Expert 8.0.5软件计算得到的固态发酵产抗菌脂肽的最佳工艺条件为:罗非鱼下脚料与麸皮配比3.48∶1(m/m)、发酵时间61.69 h、初始基质水分含量69.34%、发酵温度28.97 ℃,抗菌脂肽产量为7.32 g/kg。在实验条件下,为了便于操作,采用下脚料与麸皮配比3.5∶1(m/m)、发酵时间62 h、初始基质含水量70%、发酵温度29 ℃进行验证实验,经检测抗菌脂肽产量为7.29 g/kg,相对于预测值误差为0.37%,差异不显著,说明利用响应面法优化出的发酵工艺参数可靠,可用于实际生产。
3 讨 论
本实验利用罗非鱼下脚料做发酵基质,固态发酵生产抗菌脂肽,此种发酵工艺简单、成本低,不仅有效地拓宽了纳豆芽孢杆菌的应用范围,更重要的是提高了加工副产物罗非鱼下脚料的利用率,实现了原料的“零浪费”。通过优化工艺提高产物中抗菌脂肽的产量,实现抗菌脂肽这一抗生素的良好替代品的产量最大化,为抗菌脂肽的工业化生产提供了很好的参考。另外,由于目前抗菌脂肽的检测方法主要采用传统的称质量法、抑菌圈法、界面张力测定法及HPLC法[23,28],这些检测方法只能对抗菌脂肽进行粗略的初步分析和简单量化,使得脂肽发酵工艺条件优化研究受到了很大限制。本研究采用了前期建立的HPLC-MS定量法检测产物中抗菌脂肽。该方法不仅灵敏度高、检出限低,而且回收率高,重复性好。利用此法对发酵过程的参数进行了优化,取得了较好的优化效果,为利用罗非鱼下脚料生产抗菌脂肽提供了理论参考。
抗菌脂肽一般是由多种脂肽物质组成的混合物,不同的组分各自具有独特的化学性质和生物活性[29],从而造成抗菌脂肽功能活性的不同。即脂肽内各组分含量的不同会很大程度上影响到抗菌脂肽的生物功能。本实验只是研究了抗菌脂肽总量的变化,并没有明确探究在不同的发酵条件下脂肽内各组分及其同系物含量的具体变化。另外,本研究是以抗菌脂肽为目标产物对生产工艺进行的优化,而对发酵过程中微生物所产生的内源酶及下脚料中蛋白质酶解产生营养小肽的情况并未涉及,如何将抗菌脂肽和营养小肽的生产有机结合起来,并使生产效率最大化,仍需要进行深入研究。
4 结 论
利用罗非鱼下脚料为主要基质固态发酵生产的抗菌脂肽组分主要包括Surfactin(m/z 995.20、1 008.20、1 058.20)和Iturin(m/z 1 044.30、1 071.20)。在单因素试验的基础上,利用响应面法对固态发酵产抗菌脂肽的工艺进行了优化,得到最佳的发酵工艺条件是罗非鱼下脚料与麸皮配比3.48∶1(m/m)、发酵时间61.69 h、初始基质水分含量69.34%、发酵温度28.97 ℃。在最佳条件下经过验证实验抗菌脂肽的产量达7.29 g/kg,结果与理论预测值(7.32 g/kg)偏差很小,说明由此响应面设计得到的相关参数有效可用。本研究为利用罗非鱼下脚料生产富含抗菌脂肽和营养小肽的复合功能活性肽生产工艺条件的建立提供了参考。
[1] DUAN Zhenhua, CHENG Changyu, HAI Yang, et al. Determination and identification of chondroitin sulfate from tilapia byproducts[J]. Advanced Materials Research, 2013, 690/693: 1318-1321. DOI:10.4028/www.scientific.net/AMR.690-693.1318.
[2] 李同刚. 罗非鱼下脚料复合酶水解物锌螯合盐的制备[J].包装与食品机械, 2013, 31(3): 13-17. DOI:10.3969/ j.issn.1005-1295.2013.03.003.
[3] ROSLAN J, YUNOS K F M, ABDULLAH N, et al. Characterization of fish protein hydrolysate from tilapia (Oreochromis niloticus) byproduct[J]. Agriculture and Agricultural Science Procedia, 2014, 2: 312-319. DOI:10.1016/j.aaspro.2014.11.044.
[4] 胥振国, 蔡玉华, 范高福, 等. 纳豆芽孢杆菌应用研究进展及开发前景[J]. 基因组学与应用生物学, 2015, 34(11): 2532-2537. DOI:10.13417/j.gab.034.002442.
[5] SAMANYA M, YAMAUCHI K. Histological alterations of intestinal villi in chicken fed dried Bacillus subtilis var. natto[J]. Comparative Biochemistry and Physiology, 2002, 133(1): 95-104. DOI:10.1016/ S1095-6433(02)00121-6.
[6] BARNES A G C, CEROVIC V, HOBSON P S, et al. Bacillus subtilis spores: a novel microparticle adjuvant which can instruct a balanced Th1 and Th2 immune response to specific antigen[J]. European Journal of Immunology, 2007, 37(6): 1538-1547. DOI:10.1002/eji.200636875.
[7] ZHANG Xiaoyun, LI Baoqing, WANG Ye, et al. Lipopeptides, a novel protein, and volatile compounds contribute to the antifungal activity of the biocontrol agent Bacillus atrophaeus CAB-1[J]. Applied Microbiology Biotechnology, 2013, 97(21): 9525-9534. DOI:10.1007/ s00253-013-5198-x.
[8] XU Hongmei, RONG Yanjun, ZHAO Mingxin, et al. Antibacterial activity of the lipopetides produced by Bacillus amyloliquefaciens M1 against multidrug-resistant Vibrio spp. isolated from diseased marine animals[J]. Applied Microbiology Biotechnology, 2014, 98(1): 127-136. DOI:10.1007/s00253-013-5291-1.
[9] THIES T, SANTIAGO-SCHÜBEL B, KOVAČIĆ F, et al. Heterologous production of the lipopeptide biosurfactant serrawettin W1 in Escherichia coli[J]. Journal of Biotechnology, 2014, 181: 27-30. DOI:10.1016/j.jbiotec.2014.03.037.
[10] MNIF I, ELLEUCH M, CHAABOUNI S E, et al. Bacillus subtilis SPB1 biosurfactant: production optimization and insecticidal activity against the carob moth Ectomyelois ceratoniae[J]. Crop Protection, 2013, 50: 66-72. DOI:10.1016/j.cropro.2013.03.005.
[11] 孙力军, 王雅玲, 陈宏. 芽孢杆菌抗菌肽应用于海产品食源性病原菌控制研究展望[J]. 食品与发酵工业, 2010, 36(10): 127-130.
[12] GUDIÑA E J, RANGARAJAN V, SEN R, et al. Potential therapeutic applications of biosurfactants[J]. Trends in Pharmacological Sciences, 2013, 34(12): 667-675. DOI:10.1016/j.tips.2013.10.002.
[13] BEZZA F A, CHIRWA E M N. Production and applications of lipopeptide biosurfactant for bioremediation and oil recovery by Bacillus subtilis CN2[J]. Biochemical Engineering Journal, 2015, 101: 168-178. DOI:10.1016/j.bej.2015.05.007.
[14] NITSCHKE M, COSTA S G V A O. Biosurfactants in food industry[J]. Trends in Food Science & Technology, 2007, 18(5): 252-259. DOI:10.1016/j.tifs.2007.01.002.
[15] MUTHUSAMY K, GOPALAKRISHNAN S, RAVI T K, et al. Biosurfactants: properties, commercial production and application[J]. Current Science, 2008, 94(6): 736-747.
[16] 方传记, 陆兆新, 孙力军, 等. 淀粉液化芽孢杆菌抗菌脂肽发酵培养基及发酵条件的优化[J]. 中国农业科学, 2008, 41(2): 533-539. DOI:10.3864/j.issn.0578-1752.2008.02.029.
[17] THOMPSON D N, FOX S L, BALA G A. Biosurfactants from potato process effluents[J]. Applied Biochemistry Biotechnology, 2000, 84(1): 917-930. DOI:10.1385/ABAB:84-86:1-9:917.
[18] ZHU Zhen, ZHANG Guoyi, LUO Yi, et al. Production of lipopeptides by Bacillus amyloliquefaciens XZ-173 in solid state fermentation using soybean flour and rice straw as the substrate[J]. Bioresource Technology, 2012, 112: 154-260. DOI:10.1016/j.biortech.2012.02.057.
[19] 邹正. 以啤酒糟为基质发酵纳豆芽孢杆菌及其抗氧化肽研究[D]. 长沙: 湖南农业大学, 2012: 24-28.
[20] 赵梅. 罗非鱼下脚料酶解工艺的研究[D]. 福州: 福建农林大学, 2007: 1-2. DOI:10.7666/d.y1175162.
[21] 袁书林, 陈海燕, 王宵燕. 小肽营养研究进展[J]. 粮食与饲料工业, 2002, 9(8): 37-39. DOI:10.3969/j.issn.1004-3314.2003.01.014.
[22] 孙力军, 王雅玲, 刘唤明, 等. 抗菌豆豉发酵菌株的筛选及其脂肽组分鉴定和特性研究[J]. 中国生物工程杂志, 2013, 33(7): 50-56.
[23] 汪文静. 抗菌脂肽LC-MS定量检测方法的建立及产量提增新方法研究[D]. 湛江: 广东海洋大学, 2013: 12-21.
[24] KOUMOUTSI A, CHEN Xiaohua, HENNE A, et al. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42[J]. Journal of Bacteriology, 2004, 186(4): 1084-1096. DOI:10.1128/JB.186.4.1084-1096.2004.
[25] TANG J S, ZHAO F, GAO H, et al. Characterization and online detection of surfactin isomers based on HPLC-MS(n) analyses and their inhibitory effects on the overproduction of nitric oxide and the release of TNF-α and IL-6 in LPS-induced macrophages[J]. Marine Drugs, 2010, 8(10): 2605-2618. DOI:10.3390/md8102605.
[26] SEN R. Response surface optimization of the critical media components for the production of surfactin[J]. Journal of Chemical Technology and Biotechnology, 1997, 68(3): 263-270. DOI:10.1002/(SICI)1097-4660(199703)68:3%3C263::AIDJCTB631%3E3.0.CO;2-8.
[27] OHNO A, ANO T, SHODA M. Effect of temperature on production of lipopeptide antibiotics, iturin a and surfactin by a dual producer, Bacillus subtilis RB14, in solid-state fermentation[J]. Journal of Fermentation and Bioengineering, 1995, 80(5): 517-519. DOI:10.1016/0922-338x(96)80930-5.
[28] DUFOUR S, DELEU M, KATHERINE N, et al. Hemolytic activity of new linear surfactin analogs in relation to their physico-chemical properties[J]. Biochimica et Biophysica Acta, 2005, 1726(1): 87-95. DOI:10.1016/j.bbagen.2005.06.015.
[29] GUO Qinggang, DONG Weixin, LI Shezeng, et al. Fengycin produced by Bacillus subtilis NCD-2 plays a major role in biocontrol of cotton seedling damping-off disease[J]. Microbiological Research, 2014, 169(7/8): 533-540. DOI:10.1016/j.micres.2013.12.001.
Component Analysis of Antimicrobial Lipopeptides from Solid-State Fermentation of Tilapia Processing Byproducts with Bacillus natto NT-6 and Optimization of Fermentation Conditions
ZHANG Ning1, SUN Lijun1,*, WANG Yaling1,*, LIAO Jianmeng2, DENG Qi1, LIU Ying1, XU Defeng1
(1. Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China; 2. Zhanjiang Food and Drug Institute, Zhanjiang 524000, China)
In this study, tilapia processing byproducts were used as the major substrate for solid-state fermentation to produce composite active peptides with antimicrobial and nutritional properties. In order to improve the yield of antimicrobial lipopeptides, the medium and fermentation conditions were optimized. The lipopeptide components generated were analyzed and quantitated by a high performance liquid chromatography-mass spectrometry method. The optimization was performed by applying one-factor-at-a-time method and response surface methodology. The results showed that the main antimicrobial lipopeptides produced were surfactin (m/z 995.20, 1 008.20 and 1 058.20, respectively) and iturin (m/z 1 044.30 and 1 071.20, respectively). Under the optimized conditions: tilapia processing byproducts to wheat bran ratio of 3.48:1 (m/m), initial moisture content of 69.34%, fermentation time of 61.69 h, fermentation temperature of 28.97 ℃, amount of sugarcane bagasse of 6% and inoculum volume of 5 mL/100 g, the yield of antimicrobial lipopeptides reached up to 7.32 g/kg (the actual yield was 7.29 g/kg), which increased 8.5 folds compared with that before optimization. The product obtained was found to consist of a mixture of lipopeptides.
Bacillus natto NT-6; tilapia processing byproducts; solid-state fermentation; response surface methodology; antimicrobial lipopeptides; high performance liquid chromatography-mass spectrometry
10.7506/spkx1002-6630-201621025
TS254.9
A
1002-6630(2016)21-0144-07
张宁, 孙力军, 王雅玲, 等. 纳豆芽孢杆菌NT-6固态发酵罗非鱼下脚料条件优化及产脂肽组分分析[J]. 食品科学, 2016, 37(21): 144-150. DOI:10.7506/spkx1002-6630-201621025. http://www.spkx.net.cn
ZHANG Ning, SUN Lijun, WANG Yaling, et al. Component analysis of antimicrobial lipopeptides from solid-state fermentation of tilapia processing byproducts with Bacillus natto NT-6 and optimization of fermentation conditions[J]. Food Science, 2016, 37(21): 144-150. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621025. http://www.spkx.net.cn
2016-01-10
国家自然科学基金面上项目(31371746;31371777);广东省科技厅公益研究与能力建设专项资金项目(2014B020204005;2014B020205006);广东省高等学校创新强校工程计划项目(GDOU2013050312;GDOU2013050205;GDOU 20014050203)
张宁(1991—),女,硕士研究生,研究方向为水产品质量与安全。E-mail:zhangning_2013@sina.com
*通信作者:孙力军(1965—),男,教授,博士,研究方向为水产品质量与安全。E-mail:suncamt@126.com
王雅玲(1965—),女,教授,博士,研究方向为水产品质量与安全。E-mail:wangylchina@163.com
