谷氨酰胺转氨酶对大豆与小麦混合蛋白凝胶性质的影响
2016-12-02汪亚强罗水忠钟昔阳姜绍通赵妍嫣
汪亚强,罗水忠,2,钟昔阳,2,姜绍通,2,郑 志,2,赵妍嫣,2,*
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
谷氨酰胺转氨酶对大豆与小麦混合蛋白凝胶性质的影响
汪亚强1,罗水忠1,2,钟昔阳1,2,姜绍通1,2,郑 志1,2,赵妍嫣1,2,*
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
研究谷氨酰胺转氨酶(transglutaminase,TG)对大豆和小麦混合蛋白凝胶特性的影响,通过游离巯基含量、表面疏水性、热特性、二级结构和微观结构等测定对混合蛋白凝胶的构象进行了表征。结果显示,当大豆蛋白比例低于45%时,随着大豆蛋白所占比例的增加,凝胶强度显著增强。TG交联混合蛋白凝胶后,其游离巯基减少,热稳定性增强,表面疏水性降低。与TG催化小麦蛋白相比,大豆蛋白添加量为45%的混合蛋白凝胶强度提高了62.74%,β-折叠含量增加了5.701%,游离巯基含量减少了47.48%。
小麦蛋白;大豆蛋白;谷氨酰胺转氨酶;凝胶
小麦蛋白(俗称谷朊粉)是从小麦面粉中提取并烘干而制成的一种粉末状产品[1]。小麦蛋白含有大量的非极性氨基酸残基和极性的不可电离的谷氨酰胺残基,致使其溶解性低、凝胶性差,严重限制了它在食品工业中的应用。改善小麦蛋白的凝胶性能,提高其凝胶稳定性,对推动小麦蛋白在食品领域的应用具有重要意义。
谷氨酰胺转氨酶(transglutaminase,TG)是一种催化蛋白质侧链中谷氨酰胺残基γ-羟胺基团与赖氨酸的ε-氨基之间交联反应的蛋白酶,因此可以改善蛋白质凝胶网络结构,提高凝胶性[2]。近年来,采用TG改善蛋白质凝胶性已成为国内外研究热点。在调理低脂猪肉丸生产中使用TG,可以显著提高肉丸的硬度和弹性,随着TG添加量的增加,肉丸的蒸煮损失率逐渐减小[3];唐传核等[4]研究发现,TG可以催化乳清蛋白的β-乳球蛋白和α-乳清蛋白聚合,形成低聚物或生物聚合物;张佳敏等[5]研究发现,草鱼鱼肉经TG改性后弹性增加了77.79%,蒸煮损失减少了17.21%。在豆类蛋白加工中,TG对豆类蛋白的组织结构、溶解性、乳化性、凝胶强度均有所改善。Schäfer等[6]利用TG处理大豆蛋白、豌豆蛋白、甜鲁冰豆蛋白,发现经TG催化的3 种豆科蛋白均可以制备出具有良好风味与口感的相关产品。TG应用于小麦面团,可以改善面团的吸水性,提高面筋网络结构稳定性。已有研究还发现,TG可以催化不同种类的蛋白质间的相互交联作用,改善混合蛋白的功能特性,提高其应用范围。Sun Xiangdong等[7]研究了TG对豌豆分离蛋白和肌纤维分离蛋白的作用,结果表明TG对混合蛋白的凝胶性有显著提升;洪永祥等[8]研究了TG交联芸豆蛋白及鸡肉蛋白的反应,发现经热处理的芸豆蛋白对TG交联起到促进作用。小麦蛋白富含30%以上的谷氨酰胺[9],但赖氨酸含量较低,是第一限制氨基酸,致使TG催化小麦蛋白凝胶化效率低,产物稳定性较差。
大豆蛋白是一种优质植物蛋白,赖氨酸含量丰富。在小麦蛋白中添加大豆蛋白,不仅可以增加蛋白质含量,更是优化了氨基酸配比[10]。同时,大豆蛋白中赖氨酸的加入可以为TG交联小麦蛋白提供更多的催化位点,可以促进两种蛋白质分子间形成共价交联,提高混合蛋白的凝胶性能。
本研究采用TG催化小麦/大豆混合蛋白,观察其凝胶强度的变化,同时通过表面疏水性、热稳定性、微观结构、巯基及二级结构的变化,了解其变化规律,分析可能的反应机理。研究结果为获得凝胶性能良好的混合蛋白产品,拓宽小麦蛋白在食品工业中的应用提供了参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白购于河南省鲲华生物技术有限公司,基本组成(质量分数,下同)为:水分(6.5±0.05)%、粗蛋白(90.23±0.15)%、粗脂肪(0.29±0.06)%、灰分(0.29±0.06)%;小麦蛋白购于安徽瑞福祥食品有限公司,基本组成为:水分(9.14±0.07)%、粗蛋白(75.36±0.22)%、粗脂肪(1.87±0.15)%、灰分(1.55±0.04)%、淀粉(4.41±0.33)%。
TG(1 000 U/g) 山东一鸣生物制品有限公司;其余试剂为化学纯或分析纯。
1.2 仪器与设备
Nicolet 67型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)仪 美国Thermo Nicolet公司;JSM-6490LV型扫描电子显微镜(scanning electron microscope,SEM) 日本电子公司;FD-1B-50型冷冻干燥机 北京博医康实验仪器有限公司;TA-XT2i型质构仪、Q200-2156型差示扫描量热仪(differential scanning calorimeter,DSC) 美国TA仪器公司; 721G型可见分光光度计 上海精科仪器有限公司。
1.3 方法
1.3.1 混合蛋白凝胶的制备
配制大豆/小麦蛋白混合溶液,大豆蛋白质量分数分别为0%、30%、35%、40%、45%、50%,在室温条件下用磁力搅拌器搅拌均匀。用0.1 mol/L NaOH或HCl溶液调节pH值到7.0,按20 U/g pro的剂量加入TG,设置相同大豆/小麦蛋白比例但未加入TG的混合蛋白样品为对照混合蛋白。混合蛋白在30 ℃水浴反应2 h后,取部分样品冷冻干燥,进行表面疏水性、热稳定性、FT-IR分析以及SEM观察。其余样品在90 ℃加热40 min后,将制得的凝胶放入冰水浴中迅速冷却,并置于4 ℃冰箱中过夜,用于凝胶强度的测定。
1.3.2 大豆/小麦混合蛋白凝胶中加酶量的选择
配制小麦蛋白与大豆蛋白添加量为45%的大豆/小麦混合蛋白溶液,在室温条件下用磁力搅拌器搅拌均匀,用0.1 mol/L NaOH或HCl溶液调节pH值为7.0,按0、10、20、30、40 U/g pro加入TG,设置小麦蛋白样品为对照蛋白,对照蛋白中分别按照相同加酶量加入TG,于30 ℃水浴反应2 h后,90 ℃加热40 min,将制得的凝胶放入冰水浴中迅速冷却,并置于4 ℃冰箱中过夜,用于凝胶强度的测定。
1.3.3 凝胶强度的测定
取1.3.1节制备的不同比例混合蛋白凝胶样品用TA-XT2i质构仪测定其凝胶强度。采用P/0.5探头,设定前进速率5 mm/s,冲压速率5 mm/s,后撤速率5 mm/s,冲压深度10 mm;一次测定过程中探头下压2 次(TPA模式)。每个样品重复3 次测定过程,取平均值为混合蛋白凝胶强度。
1.3.4 表面疏水性的测定
取1.3.1节制备的不同比例混合蛋白凝胶样品,参考文献[11]中的方法,用8-苯胺-1-萘磺酸法测定蛋白质的表面疏水性。
1.3.5 游离巯基含量的测定
参考Ellman[12]的方法并稍作修改。分别取1.3.1节中制备的TG改性混合蛋白及对照样品100 mg,溶于10 mL pH 8.0的磷酸盐缓冲液,8 000 r/min离心10 min。取3 mL上清液加入3 mL上述磷酸盐缓冲液,再加入0.1 mL 4 mg/mL的5-5’二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)溶液,剧烈振荡后于25 ℃的水浴中保温1 h,然后在10 000 r/min条件下离心30 min。以磷酸盐缓冲液为对照组,取上清液于412 nm波长处测定吸光度,游离巯基含量按式(1)计算。
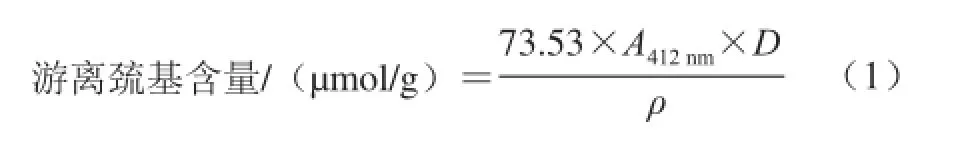
式中:73.53=106/(1.36×104),其中1.36×104为5-5’二硫代双(2-硝基苯甲酸)试剂的摩尔消光系数/(L/mol);A412nm为412 nm波长处的吸光度;D为反应液稀释倍数;ρ为样品的最终质量浓度/(mg/mL)。
1.3.6 热稳定性的测定
分别取TG改性后的小麦蛋白、大豆蛋白添加量为45%的改性混合蛋白样品各10 mg置于铝盒中,以相同比例未改性的蛋白样品作为对照组。设定DSC升温速率为10 ℃/min,升温范围为20~140 ℃,氮气流速80 mL/min,测定混合蛋白的变性温度(Td)和变性焓(ΔH),测量数据由DSC自带软件分析。每个样品做3 组平行实验。
1.3.7 FT-IR检测
分别取TG改性后的小麦蛋白、大豆蛋白添加量为45%的改性混合蛋白样品各2 mg与198 mg溴化钾混合,以相同比例未改性的蛋白样品作为对照组,置于玛瑙研钵中研磨成均匀粉末,干燥、压片,利用FT-IR仪进行全波段(波段范围为400~4 000 cm-1)扫描,背景扫描64 次,样品扫描32 次。
根据文献[13]中蛋白质红外光谱分析方法,取酰胺Ⅰ带(1 700~1 600 cm-1波段)图谱,用Peak Fit v4.12软件分析,进行基线校正,Gaussian去卷积,二阶导数拟合,并进行多次拟合使残差最小。确定各谱峰归属,并根据各谱峰所占面积的百分比确定各类二级结构所占比例。
1.3.8 SEM观察
将1.3.1节中制得的凝胶样品冷冻干燥后取少量样品,用导电胶固定在样品台上,用吸耳球吹去未黏牢的样品颗粒,通过离子溅射在样品上喷金后,将样品转移到SEM台面上,在加速电压20 kV的条件下,观察混合蛋白凝胶的形态结构并拍照。
2 结果与分析
2.1 TG添加量对混合蛋白凝胶强度的影响
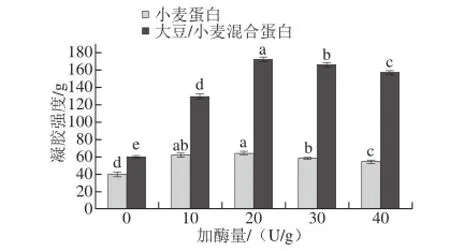
图1 加酶量对混合蛋白凝胶强度的影响Fig. 1 Effect of TGase addition on gel strength of mixed protein gels
由图1可知,随着加酶量的增加,小麦蛋白与大豆/小麦混合蛋白凝胶强度均持续增加。当TG添加量为20 U/g时,凝胶强度达到最大。随着加酶量继续增大,凝胶强度有所下降。
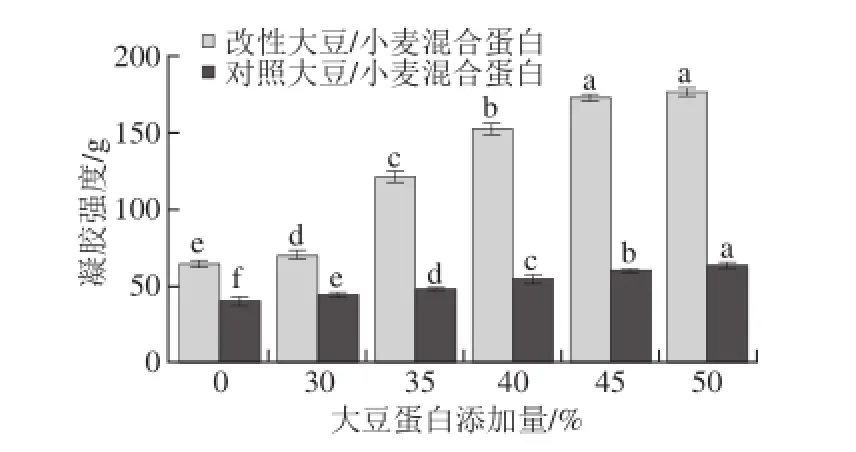
图2 大豆蛋白添加量对混合蛋白凝胶强度的影响Fig. 2 Effect of soybean protein proportion on gel strength of TGase-treated mixed protein gels
2.2 大豆蛋白添加量对混合蛋白凝胶强度的影响受热形成凝胶是小麦蛋白和大豆蛋白的一项重要功能性质。由图2可知,经TG改性的混合蛋白凝胶强度随着大豆蛋白比例的增加显著增大(P<0.05)。当不添加大豆蛋白时,TG改性的小麦蛋白凝胶强度为64.22 g,而当大豆蛋白添加量达45%时,TG改性混合蛋白凝胶强度提高到172.20 g(P<0.05)。混合蛋白经TG改性后凝胶强度增大。随着大豆蛋白在混合蛋白中含量的增加,对照混合蛋白凝胶强度逐渐增大。小麦蛋白中缺乏赖氨酸,不利于和TG发生交联反应。在小麦蛋白悬浮液中添加大豆蛋白,为TG交联作用提供了更多有效的赖氨酸催化位点,提高了蛋白质分子间交联的几率,促进了大豆蛋白中赖氨酸上的ε-氨基和小麦蛋白谷氨酰胺上的γ-酰胺基结合形成ε-(γ-谷氨酰胺)赖氨酸异肽键[14],生成了大分子质量的聚集体。凝胶的形成机制正是蛋白质分子聚集并形成有序蛋白质网络结构的过程,TG催化所形成的空间三维网络状结构使得凝胶性显著提高[15]。
2.3 大豆蛋白添加量对混合蛋白表面疏水性的影响

图3 大豆蛋白添加量对混合蛋白表面疏水性的影响Fig. 3 Effect of soybean protein concentration on surface hydrophobicity of TGase-treated mixed protein gels
表面疏水性能够反映暴露在极性环境中疏水残基的数量,可以用来评价蛋白质构象的变化。由图3可知,添加TG后,大豆蛋白添加量小于40%时,混合蛋白凝胶的表面疏水性随着大豆蛋白添加量的增大显著降低(P<0.05)。而未添加TG的混合蛋白也随着大豆蛋白含量的增加逐渐减小。TG的作用导致蛋白质分子间或分子内形成共价键,这使得蛋白质有了聚集的趋势,疏水性氨基酸被包围到了蛋白质空间结构的内部,亲水性基团外露[16]。同时,由于TG脱酰氨基作用而产生的带负电荷的氨基酸(主要是谷氨酸和天冬氨酸)也会导致整体疏水性下降[17]。随着大豆蛋白的加入,赖氨酸含量增多,蛋白质趋向于通过交联发生聚集,疏水基团不再展露,因而造成疏水性降低。
2.4 大豆蛋白添加量对混合蛋白中游离巯基含量的影响
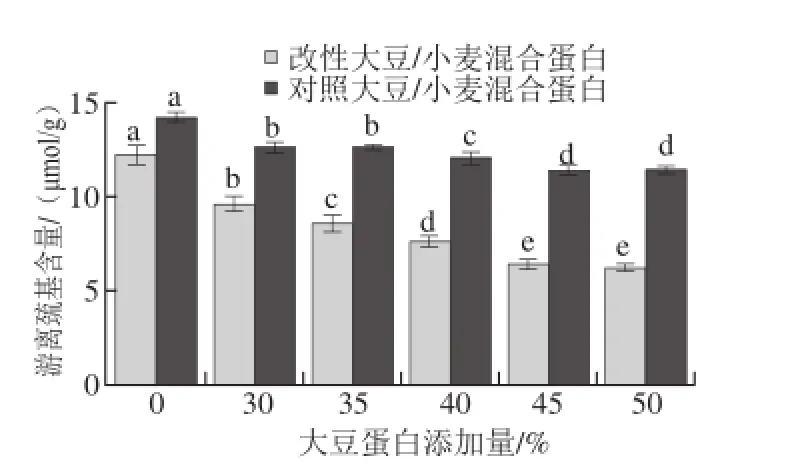
图4 大豆蛋白添加量对混合蛋白游离巯基含量的影响Fig. 4 Effect of soybean protein concentration on free sulfydryl content of TGase-treated mixed protein gels
游离巯基含量是反映蛋白质凝胶网络结构的一个重要指标,混合蛋白经TG改性后游离巯基含量变化如图4所示。当大豆蛋白添加量小于45%时,随着大豆蛋白含量的增加,经TG改性的混合蛋白中游离巯基含量逐渐减小。与相同大豆蛋白含量的对照混合蛋白相比,游离巯基含量明显降低。TG催化混合蛋白形成了大分子质量的聚集体后,暴露在表面的游离巯基被包埋到分子内部[18];另一方面,TG在发挥交联作用时,新形成的交联肽链中含硫氨基酸相互接近,并通过氧化作用形成二硫键,导致游离巯基含量减少[19]。Gujral等[20]在TG作用米粉的研究中指出,米粉中游离巯基的含量随着TG浓度的增加呈显著下降趋势。随着大豆蛋白含量的增加,游离巯基减少量逐渐增大,说明添加大豆蛋白促进了蛋白质分子间的交联反应。
2.5 大豆蛋白的添加对混合蛋白热稳定性的影响
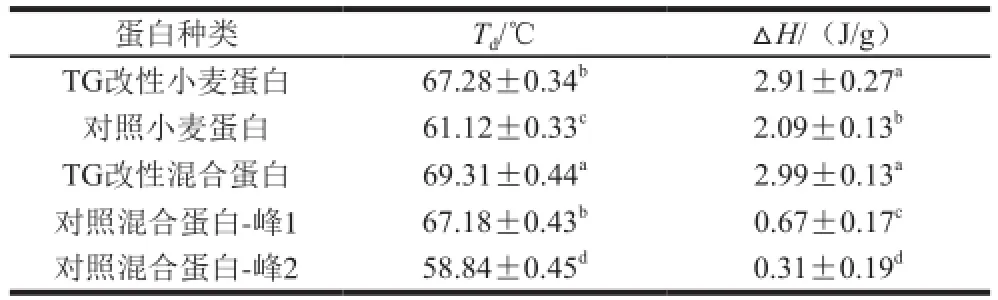
表1 大豆蛋白加入量(45%)对混合蛋白热稳定性的影响Table 1 Effect of soybean protein concentration on thermal properties of TGase-treated mixed protein gels
用DSC记录混合蛋白凝胶热变性过程中的能量变化,其变性温度(Td)和变性焓(△H)可以分别反映蛋白质的热稳定性和聚集程度。由表1可知,对照小麦蛋白的变性温度Td为61.12 ℃,而TG改性小麦蛋白Td为67.28 ℃,说明TG交联能够提高小麦蛋白的热稳定性。当大豆蛋白添加量为45%时,对照混合蛋白凝胶中出现峰1和峰2两个峰,它们分别代表大豆蛋白中的11S球蛋白和小麦蛋白的变性吸热峰。而利用TG聚合的混合蛋白在55~60 ℃范围内只出现了一个变性吸热峰,其最高变性温度较对照小麦蛋白也显著增加。大豆蛋白的加入,使得TG的交联程度增大,蛋白质结构的变化形成的高分子质量蛋白聚合物导致蛋白质分子内部与蛋白质之间相互作用增大,形成的大分子质量聚合物具有更加紧凑而有序的结构,热稳定性因而得到增强[21]。由表1还可知,经TG改性后的混合蛋白凝胶△H略有提高,这与混合蛋白之间形成了聚集体有关。
2.6 大豆蛋白的添加对混合蛋白二级结构的影响
对TG改性前后的混合蛋白进行FT-IR扫描,其酰胺Ⅰ带去卷积再由二阶导数拟合,确定酰胺Ⅰ带各峰的指认标准:1 610~1 640 cm-1对应β-折叠;1 640~1 650 cm-1对应无规卷曲;1 650~1 658 cm-1对应α-螺旋;1 660~1 700 cm-1对应β-转角[22],二级结构的含量和变化如表2所示。
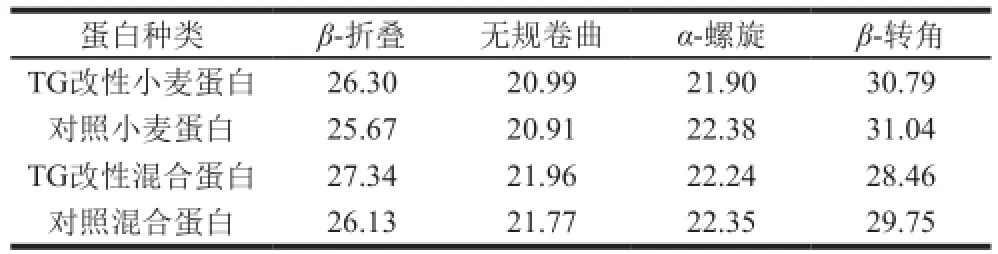
表2 大豆蛋白的加入对混合蛋白二级结构含量的影响Table 2 Effect of soybean protein on secondary structure contents of mixed protein gels %
由表2可知,当大豆蛋白添加量为45%时,混合蛋白经TG改性后比未经改性的混合蛋白β-折叠含量上升。α-螺旋和β-转角含量略微下降。无规卷曲含量变化与TG单独改性小麦蛋白相比差别不大。α-螺旋结构是依靠氢键而稳定的,小麦蛋白经TG催化后,肽链展开,氢键在一定程度上受到破坏,表现在α-螺旋的降低,而暴露的氢键会随着大分子链的聚集重新连接,形成凝胶网络结构,β-折叠含量随之上升。可以推测,未经处理的小麦蛋白在TG改性过程中,蛋白质结构的展开占主导地位,氢键断裂,一部分α-螺旋转变成β-折叠;大豆蛋白的加入,使反应体系中赖氨酸含量上升,为TG的交联作用提供了更多的作用位点,蛋白质趋向于通过交联发生聚集,形成紧密而有序的网状结构,β-折叠含量显著上升。另一方面,TG改性破坏了多肽链反转使蛋白质结构更加紧密,阻止了多肽链的反转,使得β-转角含量降低[23]。
2.7 大豆蛋白加入前后对TG催化小麦蛋白微观结构的影响
由图5可知,经TG改性后,小麦蛋白聚合形成略不规则球形结构,内部呈小的空洞,空洞彼此连接形成网状结构。与之相比,大豆蛋白经TG改性后,表面更加平滑[20]。随着大豆蛋白添加量的增大,样品结构变大,空间分布均匀,分子质量逐渐增高,网状结构更加致密。TG催化2 种蛋白分子间形成共价交联,形成分子内或分子间的网状结构,进而改善蛋白质的结构。
3 结 论
本实验研究了TG对小麦蛋白与大豆蛋白形成的热诱导混合凝胶的凝胶特性的影响。结果表明:大豆蛋白的加入,使得小麦蛋白中赖氨酸含量增加,为TG交联作用提供了更多有效的催化位点,提高了小麦蛋白和大豆蛋白分子间交联的几率,促进了TG催化交联混合蛋白的反应。随着大豆蛋白添加量的增加,混合蛋白的凝胶强度显著增强,游离巯基含量减少,热稳定性增强,表面疏水性降低,β-折叠含量明显增大。当大豆蛋白添加量达45%时,混合蛋白凝胶强度提高了62.74%,β-折叠含量增加了5.701%;相对的,游离巯基含量减少了47.48%。微观结构研究表明,混合蛋白凝胶形成了更为多孔且致密的三维网状结构。本研究为提高小麦蛋白的综合利用提供了参考。
[1] 付博菲, 刘晓, 徐绍建, 等. 谷朊粉的功能特性及改性研究[J]. 中国食物与营养, 2012, 18(9): 35-37. DOI:10.3969/ j.issn.1006-9577.2012.11.010.
[2] NIO N, MOTOKI M, TAKINAMI K. Gelation mechanism of protein solution by transglutaminase[J]. Agricultural and Biological Chemistry, 1986, 50(4): 851-855. DOI:10.1080/00021369.1986.10867499.
[3] 董浩, 陈从贵, 肖凯军. 调理低脂猪肉丸的研制[J]. 现代食品科技, 2011, 27(7): 826-830. DOI:10.13982/j.mfst.1673-9078.2011.07.033.
[4] 唐传核, 杨晓泉. 微生物转谷氨酰胺酶催化乳清蛋白聚合研究[J]. 中国乳品工业, 2002, 30(6): 11-14. DOI:10.3969/ j.issn.1001-2230.2002.06.003.
[5] 张佳敏, 张雯, 卢晓黎. 转谷氨酰胺酶对淡水鱼鱼肉弹性和烹饪损失影响研究[J]. 四川食品与发酵, 2008, 44(2): 50-53. DOI:10.3969/ j.issn.1674-506X.2008.02.016.
[6] SCHÄFER C, NEIDHART S, CARLE R. Application and sensory evaluation of enzymatically texturised vegetable proteins in food models[J]. European Food Research and Technology, 2011, 232(6): 1043-1056. DOI:10.1007/s00217-011-1474-0.
[7] SUN X D, ARNYFIELD S D. Gelation properties of myofibrillar/ pea protein mixtures induced by transglutaminase crosslinking[J]. Food Hydrocolloids, 2012, 27(2): 394-400. DOI:10.1016/ j.foodhyd.2011.11.001.
[8] 洪永祥, 吴妙鸿, 汪少芸. 芸豆蛋白热处理与鸡肉蛋白异源重组及其对功能特性的影响[J]. 中国食品学报, 2015, 15(7): 32-38. DOI:10.16429/j.1009-7848.2015.07.005.
[9] 王延州, 刘丽娅, 钟葵, 等. 不同来源谷朊粉谷氨酰胺肽释放特性的比较分析[J]. 现代食品科技, 2013, 29(8): 1878-1882. DOI:10.13982/ j.mfst.1673-9078.2013.08.037.
[10] 杨春华, 石彦国. 大豆 11S 球蛋白对小麦粉流变学特性及面包品质的影响[J]. 食品科学, 2013, 34(17): 131-135. DOI:10.7506/spkx1002-6630-201317029.
[11] 安志丛. 预处理对小麦面筋蛋白功能性质及酶解特性的影响研究[D].无锡: 江南大学, 2009: 8. DOI:10.7666/d.y1583829.
[12] ELLMAN G D. Tissue sulfhydryl groups[J]. Archives of Biochemistry & Biophysics, 1959, 82(1): 70. DOI:10.1016/0003-9861(59)90090-6.
[13] 刘燕燕, 曾新安, 陈晓东. FT-IR分析脉冲电场和热处理后的大豆分离蛋白结构变化[J]. 光谱学与光谱分析, 2010, 30(9): 2340-2344. DOI:10.3964/j.issn.1000-0593(2010)09-2340-05.
[14] YANG M, LIU F, TANG C H. Properties and microstructure of transglutaminase-set soy protein-tabilized emulsion gels[J]. Food Research International, 2013, 52(1): 409-418. DOI:10.1016/ j.foodres.2011.11.012.
[15] ALUKO R E, YADA R Y. Effect of a microbial calcium-independent transglutaminase on functional properties of a partially purified cowpea (Vigna unguiculata) globulin[J]. Journal of the Science of Food and Agriculture, 1999, 79(2): 286-290. DOI:10.1002/(SICI)1097.
[16] 石彦国, 杨春华, 陶玲玲, 等. 响应曲面法优化转谷氨酰胺酶改性11S球蛋白水解物的研究[J]. 中国食品学报, 2012, 12(7): 120-126. DOI:10.3969/j.issn.1009-7848.2012.07.018.
[17] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81. DOI:10.1016/j.foodhyd.2007.11.012.
[18] 胡晓. 酶法交联与微射流均质改性花生蛋白及其结构与功能特性研究[D]. 广州: 华南理工大学, 2011: 55-56.
[19] AHN H J, KIM J H, NG P K W. Functional and thermal properties of wheat, barley, and soy flours and their blends treated with a microbial transglutaminase[J]. Journal of Food Science, 2005, 70(6): c380-c386. DOI:10.1111/j.1365-2621.2005.tb11433.x.
[20] GUJRAL H S, ROSELL C M. Functionality of rice flour modified with a microbial transglutaminase[J]. Journal of Cereal Science, 2004, 39(2): 225-230. DOI:10.1016/j.jcs.2003.10.004.
[21] AKTAS N, KILIC B. Effect of microbial transglutaminase on thermal and electrophoretic properties of ground beef[J]. LWTFood Science and Technology, 2005, 38(8): 815-819. DOI:10.1016/ j.lwt.2004.10.003.
[22] 戈志成, 张燕萍. 对改性小麦面筋蛋白二级结构的红外光谱研究[J]. 中国粮油学报, 2006, 21(3): 36-39. DOI:10.3321/ j.issn:1003-0174.2006.03.009.
[23] 张淑芬. 亚硫酸钠-碱性蛋白酶复合改性小麦面筋蛋白加工研究[D].合肥: 合肥工业大学, 2013: 30-35.
Effect of Transglutaminase on Gel Properties of Wheat Protein and Soybean Protein Mixtures
WANG Yaqiang1, LUO Shuizhong1,2, ZHONG Xiyang1,2, JIANG Shaotong1,2, ZHENG Zhi1,2, ZHAO Yanyan1,2,*
(1. School of Biology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2. Key Laboratory for Agriculture Products Processing of Anhui Province, Hefei 230009, China)
The effect of transglutaminase (TGase) on gel properties of mixed wheat protein and soybean protein were investigated. In addition, the conformation of mixed protein gels was studied by analyzing surface hydrophobicity, free sulfhydryl content, thermal properties, secondary structure and microstructure. Results showed that, the gel strength significantly increased with increased proportion of soybean protein up to 45%. When TGase crosslinked with mixed protein gels, the thermal stability increased, while the free sulfhydryl content and surface hydrophobicity decreased. Compared with TGase-treated wheat protein, the gel strength and β-sheet content of the mixed protein gel containing 45% soybean protein increased by 62.74% and 5.701%, respectively; however, the free sulfhydryl content decreased by 47.48%.
wheat protein; soybean protein; transglutaminase; gel
10.7506/spkx1002-6630-201621009
TS201.2
A
1002-6630(2016)21-0048-05
汪亚强, 罗水忠, 钟昔阳, 等. 谷氨酰胺转氨酶对大豆与小麦混合蛋白凝胶性质的影响[J]. 食品科学, 2016, 37(21): 48-52.
DOI:10.7506/spkx1002-6630-201621009. http://www.spkx.net.cn
WANG Yaqiang, LUO Shuizhong, ZHONG Xiyang, et al. Effect of transglutaminase on gel properties of wheat protein and soybean protein mixtures[J]. Food Science, 2016, 37(21): 48-52. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621009. http://www.spkx.net.cn
2015-10-25
国家高技术研究发展计划(863计划)项目(2013AA102201);安徽省科技攻关项目(1301031031)
汪亚强(1990—),男,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:820681429@qq.com
*通信作者:赵妍嫣(1972—),女,副教授,博士,研究方向为农产品加工及贮藏工程。E-mail:zhaoyanyan@hfut.edu.cn
