固相萃取-超高效液相色谱法测定黄酒中的有机酸
2016-12-02王琳陈双徐岩
王琳,陈双,徐岩
(江南大学,食品科学与技术国家重点实验室,工业生物技术教育部重点实验室,生物工程学院酿酒微生物与酶技术研究室,江苏 无锡,214122)
固相萃取-超高效液相色谱法测定黄酒中的有机酸
王琳,陈双,徐岩*
(江南大学,食品科学与技术国家重点实验室,工业生物技术教育部重点实验室,生物工程学院酿酒微生物与酶技术研究室,江苏 无锡,214122)
确定了氨基酸/多肽和色素是黄酒有机酸色谱分析的主要干扰因素,筛选了对干扰因素有较强去除能力的固相萃取(SPE)小柱。建立了固相萃取-超高效液相色谱法(SPE-UPLC)快速测定黄酒中7种主要有机酸的方法。黄酒样品采用流动相稀释,经活化后的SCX-SPE小柱净化处理,并使用ACQUITY UPLC HSS T3柱对黄酒中的7种主要有机酸进行分离检测。流动相为20 mmol/L NaH2PO4(pH 2.7),流速为0.25 mL/min,检测波长为210 nm。结果表明,该方法可在5 min内实现7种有机酸的完全分离,各有机酸在0.100~37 456.000 mg/L范围内线性相关性良好,回归方程的线性相关系数均在0.999 3以上,7种有机酸的加标回收率为94.96%~105.08%,相对标准偏差(RSD)为0.43%~1.79%(n=5)。该方法具有净化步骤简单,准确性高的特点。采用该检测方法对传统型黄酒(n=12)和清爽型黄酒(n=6)有机酸含量比较发现,传统型黄酒总酸含量显著(P<0.05)高于清爽型黄酒,且这种差异是由于酒石酸、苹果酸和乳酸含量的显著差异(P<0.05)造成的。
超高效液相;固相萃取;有机酸;传统型黄酒;清爽型黄酒
黄酒是我国民族特色酒精饮料,具有酒度低、营养丰富、风味独特的特点,深受我国人民的喜爱,是国家政策重点扶持的传统产业。黄酒按照酿造工艺不同可以分为传统型、清爽型和特型3种,其中以传统型和清爽型黄酒为主。不同类型黄酒感官特征具有鲜明的差异,传统型黄酒以口味厚重为特色,而清爽型黄酒则具有口味淡雅柔和的特点[1-2],但是构成不同类型黄酒风味差异的物质基础还不清晰。
“无酸不成味”,有机酸是黄酒中含有的一类重要呈味物质,其种类和含量对黄酒的风味品质具有决定性的影响[3]。黄酒中有机酸含量过低容易造成黄酒酒味寡淡、单调、短口,而含量过高则显得味酸、刺舌、粗糙[4-5],同时黄酒中的有机酸在平衡黄酒口味和香气[6]方面也具有重要作用。黄酒中的有机酸主要有乳酸、乙酸、琥珀酸、柠檬酸、苹果酸、酒石酸等,不同有机酸感官特征不同,其含量比例的差异对黄酒风味品质也会造成较大的影响[7]。但目前关于传统型和清爽型黄酒中有机酸含量特征的研究还缺乏相关报道。
黄酒中有机酸的分析方法主要有红外光谱法[8]、分光光度法[9]、CE[10]、GC/GC-MS[11-12]、RP-HPLC[13]、离子排斥色谱技术[14]等。其中,RP-HPLC法因灵敏度较高、重复性好、操作简便而被广泛使用。但是基于HPLC法进行有机酸分析遇到的最常见的问题就是样品中其他杂质的干扰[15]。黄酒作为一种发酵酒,其化学成分十分复杂,除水、乙醇外,还含有大量的氨基酸/多肽[16-17]、色素[18]及糖类等组分,均可能对有机酸的色谱分离产生影响。任一平等人首先尝试采用C18小柱对黄酒样品进行净化处理实现了乳酸、乙酸和琥珀酸的准确定量[19];毕丽君等人采用C18小柱对色酒进行色素去除处理,进而实现了7种有机酸的准确定量[20]。但目前对影响黄酒有机酸色谱分离的主要干扰因素还缺乏系统研究,这也限制了黄酒净化处理方法的开发。
本文首先分析了黄酒检测中影响有机酸色谱分离分析的主要干扰因素,进而通过不同类型固相萃取柱净化效果的比较选择最佳的净化处理方法,最后建立了一种基于固相萃取一步净化与UPLC技术相结合的快速检测黄酒中有机酸含量的方法。进一步采用该方法比较分析了传统型黄酒和清爽型黄酒有机酸含量特征及差异。
1 材料与方法
1.1 材料与试剂
草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸标准品(美国sigma公司);氨基酸混合物[参照黄酒中主要氨基酸的大致比例天冬氨酸∶谷氨酸∶丝氨酸∶甘氨酸∶精氨酸∶丙氨酸∶缬氨酸∶苯丙氨酸∶异亮氨酸∶亮氨酸∶脯氨酸=2.5∶6∶1∶1∶2∶2∶2∶1∶1∶1.5∶2,(美国sigma公司)];多肽混合物[TRYPTONE,(英国OXOID公司)];焦糖色素(古越龙山有限公司提供);NaH2PO4(美国sigma公司);甲醇(美国sigma公司);葡萄糖(国药集团化学试剂有限公司)。SPE小柱型号及规格:PRS(丙磺酸;500 mg,3 mL)、SCX(强阳离子;500 mg,3 mL)、MCX(混合型阳离子;500 mg,3 mL)、WCX(弱阳离子;500 mg,3 mL)、C8-SCX(500 mg,3 mL)、Si(硅胶;500 mg,3 mL)、HC-C18(500 mg,3 mL)、Coconut(椰子壳活性炭;500 mg,3 mL)、Celite545(硅藻土;4 g,10 mL)、Alumina-B(碱性氧化铝;500 mg,3 mL)(上海安谱科学仪器有限公司)。不同品牌传统型与清爽型黄酒样品信息,见表1。
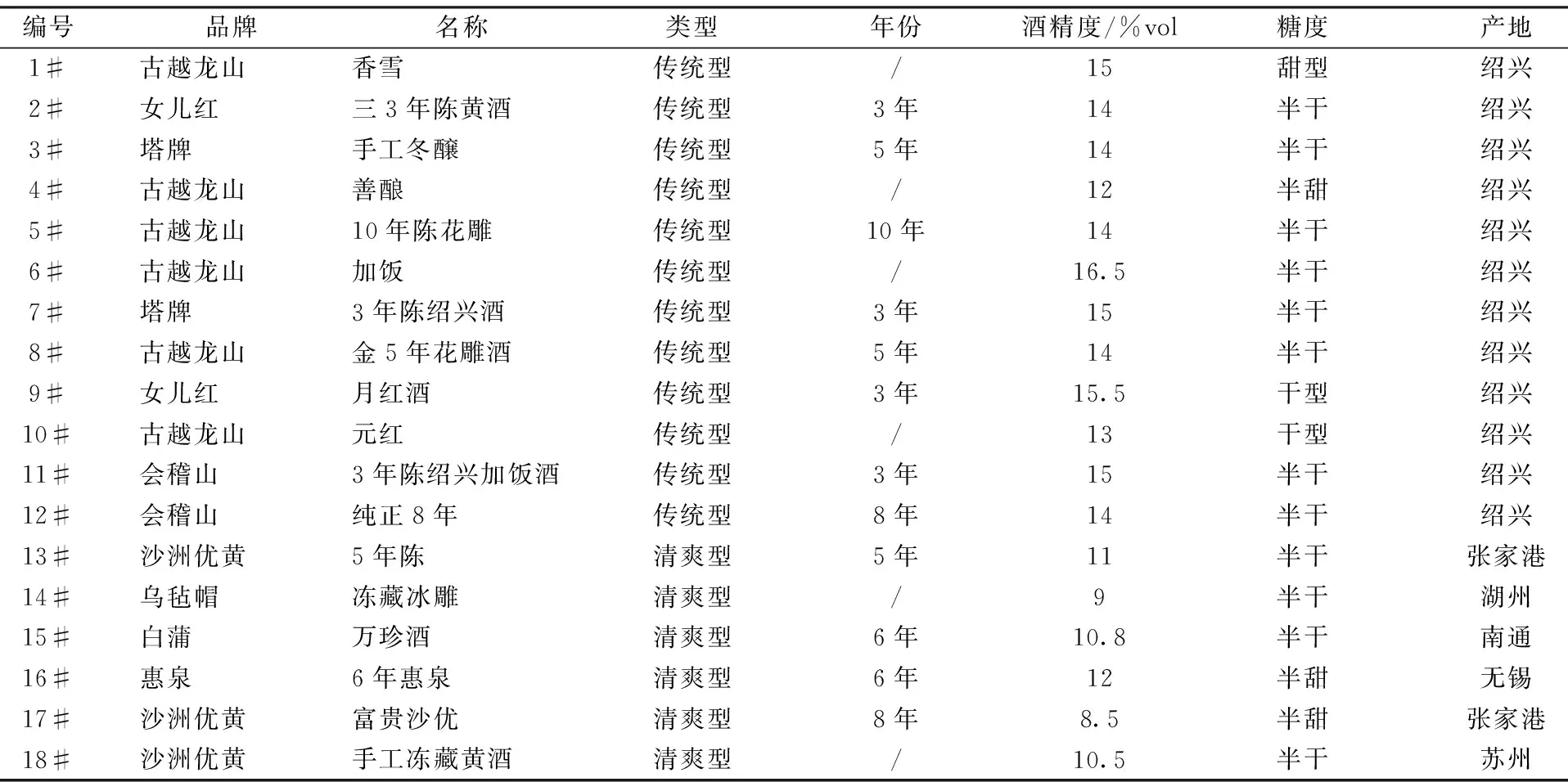
表1 传统型与清爽型黄酒样品信息
1.2 主要仪器与设备
Acquity型超高效液相色谱仪及2966型光电二级管阵列检测器(美国Waters公司);Milli-Q超纯水系列(美国密理博公司);Visipreep DL型固相萃取装置(美国Supelco公司)。
1.3 色谱条件
参照文献[21]通过优化确定色谱条件。色谱柱:ACQUITY UPLC HSS T3(i.d 2.1 mm×100 mm,1.8 μm);流动相:20 mmol/L NaH2PO4溶液(pH 2.7);检测波长:210 nm,柱温:30 ℃,流速:0.25 mL/min,进样1 μL。
以此色谱条件将有机酸标准品和样品色谱图进行对照,根据保留时间确定样品中各组分的色谱峰[22]。
1.4 实验方法
1.4.1 黄酒中有机酸检测干扰因素分析
本研究通过分析不同类型杂质添加对有机酸标准溶液回收率影响确定黄酒中干扰有机酸分离检测的主要杂质类型,设计实验方案如下:
方案1:直接分析不经处理黄酒中有机酸的加标回收率情况。向成品黄酒(13#半干型黄酒,以下涉及成品黄酒有机酸回收率所用黄酒样品均为13#)中添加有机酸标准品(各有机酸添加浓度,g/L:草酸0.198、酒石酸0.123、苹果酸0.069、乳酸0.207、乙酸1.236、柠檬酸0.6、琥珀酸1.068)测定回收率。成品黄酒中有机酸本底含量是以优化后方法的测定值。
方案2:考察氨基酸/多肽混合物对有机酸测定的影响。向有机酸混合标准溶液(以流动相为溶剂,以13#酒样有机酸含量为参照,各有机酸添加浓度,g/L:草酸0.408、酒石酸0.171、苹果酸0.405、乳酸3.370、乙酸1.016、柠檬酸0.444、琥珀酸0.949,下同)添加氨基酸/多肽类杂质(加入量参照黄酒中的大致比例,氨基酸与多肽质量比约为1∶3)总量为6.0 g/L[23-24],测定回收率。
方案3:考察焦糖色素对有机酸测定的影响。向有机酸混合标准溶液添加焦糖色素(黄酒中的主要色素)测定回收率,焦糖色素添加浓度1.0 g/L[18]。
方案4:考察糖分对黄酒有机酸测定影响。向有机酸混合标准溶液添加葡萄糖测定回收率,葡萄糖添加浓度100.017 g/L(模拟甜型黄酒总糖(以葡萄糖计)>100 g/L)。
以上设计方案样品检测前均经0.22 μm微孔滤膜过滤。
1.4.2 样品预处理
待测黄酒样品进样前需经过以下步骤:首先采用移液管准确量取黄酒样品5 mL,流动相10 mL充分混匀,其次经SPE小柱进行净化处理,净化处理流程如下:依次用1倍柱体积的纯甲醇和水活化小柱,将待净化的稀释后黄酒样品通过SPE小柱进行净化处理,舍去前面1倍柱体积净化液,剩余净化液经0.22 μm微孔滤膜过滤,备用。
1.4.3 标准曲线绘制
分别精确称取草酸(0.409 g)、酒石酸(0.171 g)、苹果酸(0.405 g)、乳酸(3.746 g)、乙酸(1.106 g)、柠檬酸(0.444 g)和琥珀酸(0.949 g),以流动相为溶剂溶解定容至100 mL配制成有机酸混合标准溶液母液,使用时,采用流动相逐级稀释,进行标准曲线的绘制,标准品母液现配现用。
1.4.4 样品测定
根据建立的黄酒有机酸准确定量方法对传统型和清爽型黄酒样品进行测定,每个样品平行测定3次,结果取平均值。
2 结果与讨论
2.1 黄酒中有机酸检测干扰因素分析
本研究分析比较了黄酒中含量较高的组分(氨基酸/多肽、色素、糖分)对有机酸分离检测的影响,黄酒本底有机酸含量的测定采用了SCX-SPE小柱净化处理。首先对未经净化处理的黄酒样品直接进行UPLC色谱分析及回收率的测定,结果显示各有机酸分离度较差,且大部分有机酸回收率不满足要求(见图1,表2),由此可知黄酒中存在的杂质严重干扰了有机酸的准确定量。有机酸标准溶液中添加干扰杂质进行回收率分析发现,氨基酸/多肽类杂质对有机酸检测影响最大,其中苹果酸和草酸的回收率分别达到了164.54%和159.75%;其次为色素类杂质,酒石酸和苹果酸的回收率分别达到了146.34%和143.68%;而糖类杂质添加后,各有机酸的回收率均在95%~110%,未对有机酸准确定量造成影响(表2)。由此可知黄酒中存在的氨基酸/多肽类以及色素类杂质对有机酸准确定量的具有较大的影响。
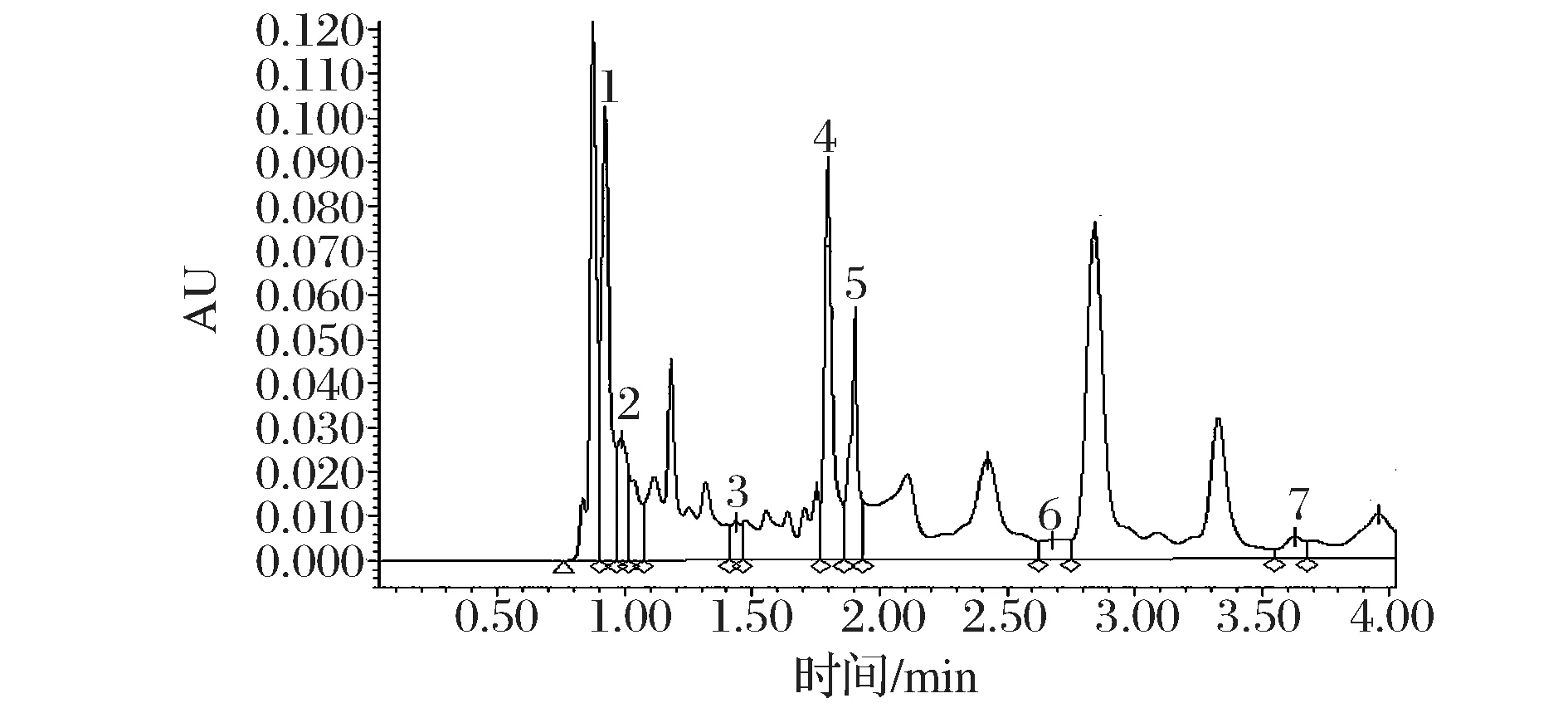
1-草酸;2-酒石酸;3-苹果酸;4-乳酸;5-乙酸;6-柠檬酸;7-琥珀酸图1 未经SPE小柱净化处理黄酒样品有机酸超高效液相色谱图Fig.1 UPLC chromatogram of organic acids in Chinese rice wine without SPE purify
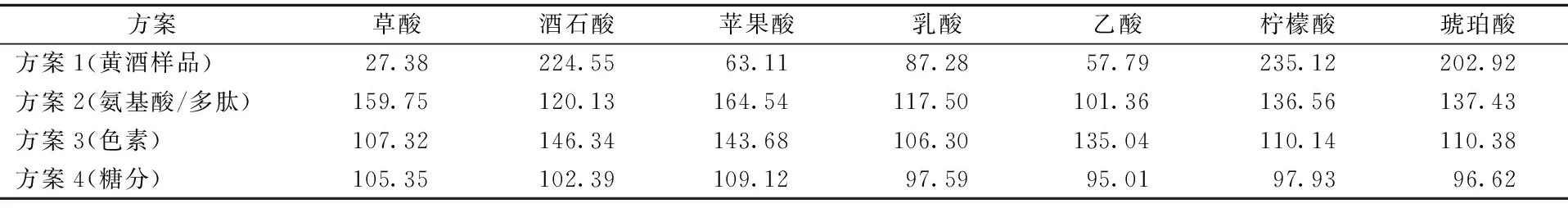
方案草酸酒石酸苹果酸乳酸乙酸柠檬酸琥珀酸方案1(黄酒样品)27.38224.5563.1187.2857.79235.12202.92方案2(氨基酸/多肽)159.75120.13164.54117.50101.36136.56137.43方案3(色素)107.32146.34143.68106.30135.04110.14110.38方案4(糖分)105.35102.39109.1297.5995.0197.9396.62
2.2 基于SPE小柱净化方法优化
为了降低样品中杂质对有机酸检测的干扰,SPE技术经常用于样品的净化处理[25-27]。传统处理方法一般要经过活化、上样、淋洗、洗脱等繁琐步骤。为了简化样品净化处理的流程,本研究提出直接通过SPE过滤吸附除杂对黄酒样品进行净化处理的方案。考虑到有机酸在黄酒中主要以分子或阴离子状态存在,因此在SPE小柱的选择时,采用阴离子以外的SPE柱对净化效果进行比较。本研究优化比较的SPE小柱型号见1.1,样品处理流程参照1.4。
2.2.1 不同SPE小柱氨基酸/多肽及色素类杂质去除能力比较
针对氨基酸/多肽和色素两类杂质对有机酸出峰有较大影响的问题 ,选取不同型号的SPE小柱对,2种杂质的去除能力进行比较。

表3 SPE小柱净化黄酒样品杂质去除能力
注:空白为未经固相萃取小柱处理。
[28, 29]中的方法分别对黄酒样品中水解氨基酸浓度和610 nm波长下的光密度值进行测定,以比较不同SPE小柱的氨基酸/多肽和色素去除能力。从表3中可以看出,不同型号SPE小柱均在一定程度上具有氨基酸/多肽及色素吸附的能力,但吸附效果差异较大。其中SCX和MCX对氨基酸/多肽及色素具有较强的吸附能力,氨基酸/多肽去除率分别为95.28%和82.84%,色素去除率分别为47.57%和51.46%。而其他小柱的氨基酸/多肽和色素去除能力均较低。
2.2.2 黄酒样品净化处理后有机酸回收率测定
为了进一步考察氨基酸/多肽和色素对黄酒样品有机酸测定的影响及不同SPE小柱的净化效果,通过不同SPE小柱净化处理加标和未加标黄酒样品(13#),对有机酸回收率测定结果见表4。从表4可以看出,SCX-SPE小柱净化效果最好,各有机酸回收率均在91%~114%。而经MCX-SPE小柱净化处理,各有机酸回收率也有了明显提升,但较SCX效果略差。而经其他SPE小柱净化处理后,有机酸回收率的测定结果不理想,无法实现有机酸的准确定量。比较表2,表3结果可知,对氨基酸/多肽和色素去除效果较好的SPE小柱一般能够获得较好的有机酸测定回收率,这也进一步表明氨基酸/多肽和色素可能是影响黄酒有机酸测定的主要干扰因素。
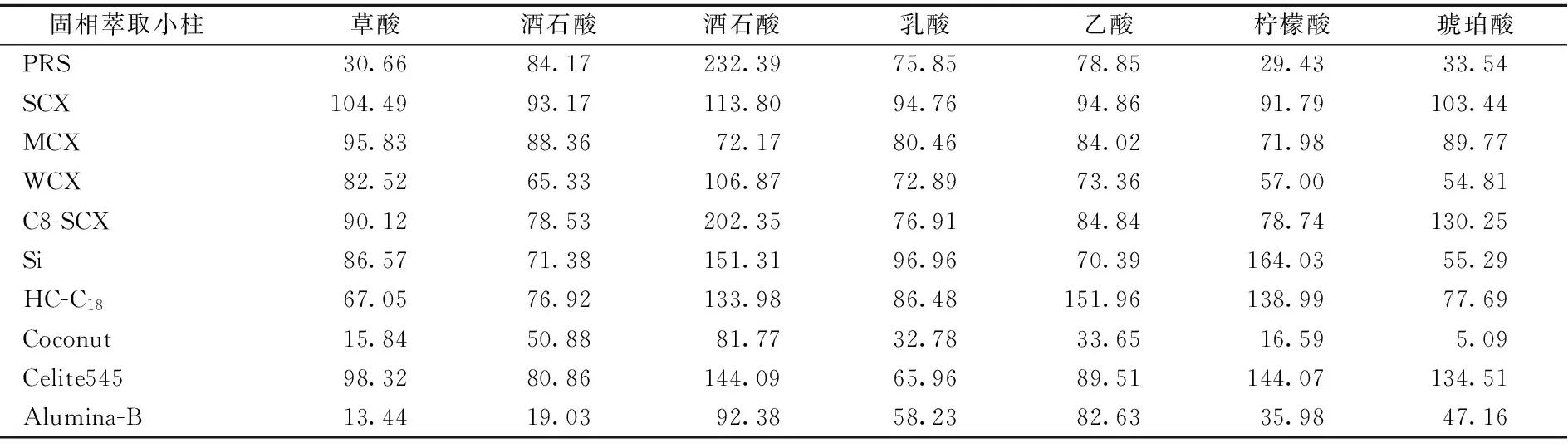
表4 SPE小柱净化处理黄酒样品7种有机酸回收率(%)
2.3 方法学考察
2.3.1 标准曲线、最低检测限和线性范围
对7种有机酸混合标准品母液采用流动相逐级稀释,依照1.3所示色谱条件进行检测,结果显示7种有机酸均有较好的分离度,峰形对称性好,基线噪音小,标准曲线、检测限和线性范围见表5。各有机酸的相关系数均在0.999 3~1.000 0,说明在此液相条件下各有机酸组分的峰面积和质量浓度线性相关性很好,可以满足有机酸准确定量的要求。
2.3.2 回收率及精密度
取流动相稀释处理的加标和未加标黄酒样品(13#)各5份,SPE小柱型号为SCX(500 mg,3 mL),净化处理流程参照1.4,色谱条件参照1.3。UPLC色谱图见图2,各有机酸的回收率及精密度测定结果(n=5)见表6。从图2可以看出,经SCX-SPE小柱处理后,7种目标有机酸的峰形均有了较大改善,基本可以实现基线分离。各有机酸的回收率均在94.96%~105.08%之间,RSD为0.43%~1.79%,符合有机酸准确定量的要求。

表5 7种有机酸的线性范围、线性回归方程、相关系数和检出限
注:y,峰面积;X,浓度,g/L。
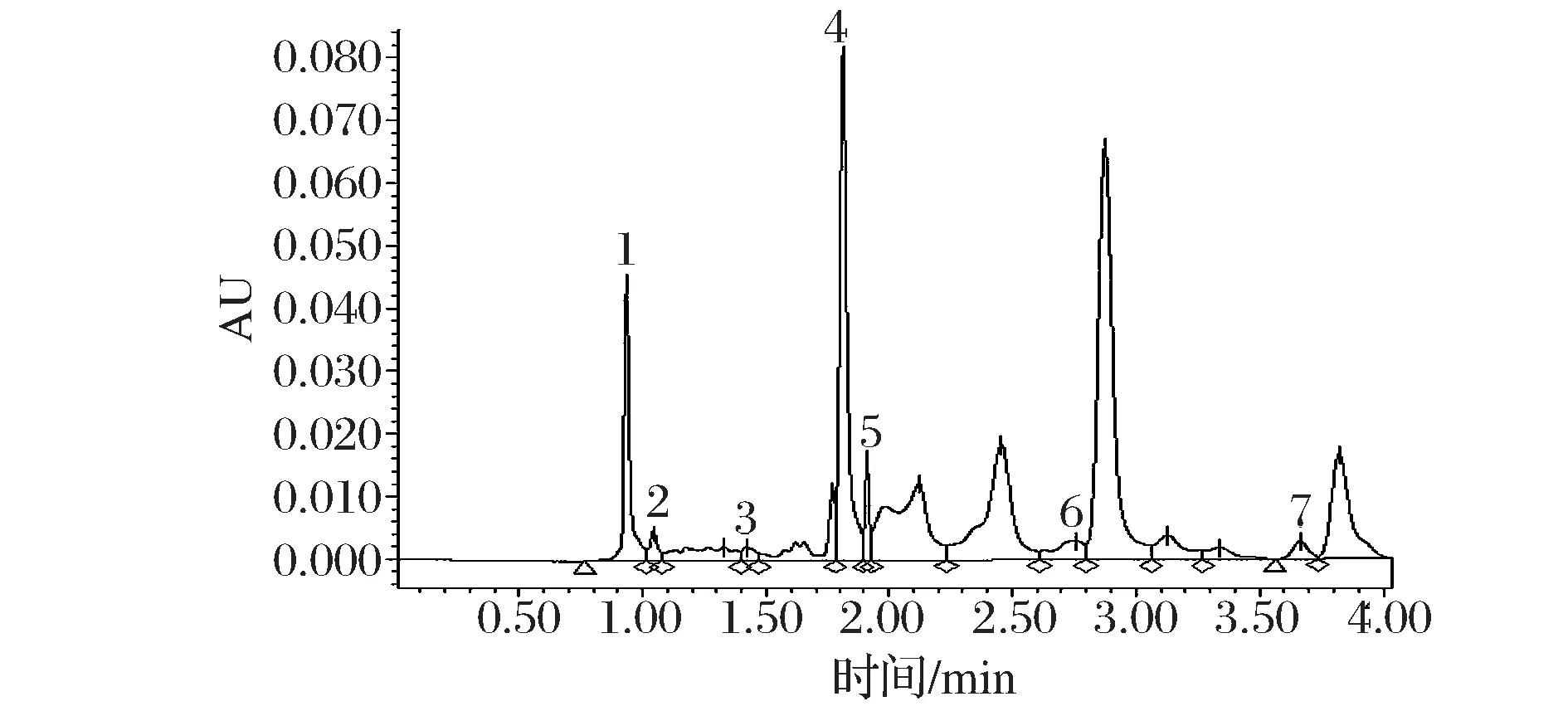
1-草酸;2-酒石酸;3-苹果酸;4-乳酸;5-乙酸;6-柠檬酸;7-琥珀酸图2 经SCX-SPE小柱净化处理的黄酒有机酸超高效液相色谱图Fig.2 UPLC chromatogram of organic acids in Chinese rice wine with SCX-SPE purifying

有机酸酒样浓度/(g·L-1)加标浓度/(g·L-1)加标检测浓度/(g·L-1)回收率/%RSD/%草酸0.1110.1980.32196.260.43酒石酸0.0630.1230.177105.081.31苹果酸0.1890.2070.41794.961.79乳酸3.3063.846.987102.280.80乙酸1.1611.2362.337102.571.03柠檬酸0.6330.61.185104.051.17琥珀酸0.9511.0682.04698.680.87
2.4 不同类型黄酒中有机酸含量分析
采用本研究建立的方法对不同来源的传统型黄酒样品(1#~12#)和清爽型黄酒样品(13#~18#)中有机酸含量进行了测定,结果见表7。
从表7可以看出,黄酒中含量最高的有机酸为乳酸(2.290~5.959 g/L),其次为琥珀酸(1.776~3.228 g/L)及乙酸(0.511~1.306 g/L)。虽然传统型黄酒中有机酸总含量显著高于清爽型黄酒(P<0.05),但两种类型黄酒中乙酸、琥珀酸、柠檬酸和草酸的含量接近,并没有显著差异。两种类型黄酒中有机酸含量的差异主要集中于乳酸、苹果酸和酒石酸。传统型黄酒中酒石酸、苹果酸和乳酸的含量显著高于清爽型黄酒(P<0.05),分别是后者的2.78、1.71和1.60倍。这3种有机酸可能是造成两种类型黄酒口感差异的重要因素之一,因此可作为区分传统型黄酒和清爽型黄酒的特征性组分。乳酸作为黄酒中最主要的有机酸,其口感柔和,能够增加酒体醇厚感。乳酸在黄酒酿造过程中主要由搭窝过程中霉菌和浸米发酵过程中乳酸菌代谢生成[30],传统型黄酒较长浸米时间和发酵时间可能是造成其高乳酸含量的主要原因。苹果酸酸味清新爽快,呈味持久缓慢且呈味阈值较低(0.087 g/L),其主要由三羧酸循环途径代谢生成,微生物种类及代谢特征的差异均能影响苹果酸的生成[31]。酒石酸作为两种类型黄酒中含量差异最大的有机酸,其在黄酒中的形成途径还未见相关报道,值得进一步的研究。
3 结论
本研究系统考察了黄酒中主要杂质组分对有机酸测定的影响,明确了氨基酸/多肽和色素这两类组分是影响有机酸的准确定量的主要因素。
本研究提出了基于SPE一步净化除杂的策略,建立了一种基于固相萃取一步净化与UPLC技术相结合的快速检测黄酒中主要有机酸的方法。采用SCX-SPE小柱可以有效去除对有机酸测定影响较大的氨基酸/多肽和色素类杂质,结合UPLC能够在5 min内实现黄酒中有机酸的分离检测。该方法具有快速、便捷、准确性高等优点,适合于黄酒样品有机酸的准确测定。
采用本研究建立的方法对不同来源传统型黄酒和清爽型黄酒样品中有机酸含量特征进行分析发现,传统型黄酒中有机酸总含量显著高于清爽型黄酒。这种差异主要由酒石酸、苹果酸和乳酸的含量差异造成。2种类型黄酒中琥珀酸、乙酸、柠檬酸和草酸含量并没有显著差异。

表7 传统型与清爽型黄酒样品有机酸含量
注:* 每个样品测定3个平行,平行间相对标准偏差(RSD)均小于5%。
参考文献
[1] 罗涛.清爽型黄酒香气特征及麦曲对其香气的影响[D].无锡:江南大学,2008.
[2] 汪建国.对清爽型黄酒风味的认识和探讨[J].中国酿造,2007,26(11):48-50.
[3] 叶芙蓉,陈细丹,倪夏红.高效液相色谱法测定黄酒中有机酸[J].酿酒,2013,40(2):80-85.
[4] 冯爱军,赵文红,白卫东,等.不同黄酒中有机酸的测定[J].中国酿造,2010,29(8):144.
[5] 郭金英,杨慧.黄酒中主要有机酸的分析[J].酿酒科技,2014(10):94.
[6] 徐岳正,周建弟,丁关海.浅谈绍兴酒中的有机酸[J].酿酒科技,2004(6):77.
[7] 汪建国.浅谈黄酒中有机酸的特征和功能[J].中国酿造,2008,27(14):81-83.
[8] 樊双喜,钟其顶,李国辉,等.近红外光谱法快速检测黄酒的酒精度,总糖和总酸[J].中国酿造,2015,34(2):135.
[9] 魏晓霞,张小伟,马东平,等.黄酒中酒石酸含量的测定[J].陇东学院学报,2015,26(5):89.
[10] 陈乃东,胡平,罗志强,等.黄酒及其酸败组分的高效毛细管电泳检测方法的研究[J].食品工业科技,2014,(5):69.
[11] 刘峰.黄酒中不挥发酸组分的分析研究[J].食品与发酵工业,1989,15(3):16.
[12] 宣栋梁,翟武.气质联用分析黄酒中有机酸[J].现代预防医学,2001,28(2):257.
[13] ARUP J D,PRERNA K,TATSURO M,et al.HPLC and GC-MS analyses of organic acids carbohydrates,amino acids and volatile aromatic compounds in some varieties of rice beer from northeast India [J].Institute of Brewing & Disstilling,2014,120(3):244.
[14] 林晓捷,魏巍,何志刚,等.离子排斥色谱法测定黄酒中的13种有机酸色谱[J].色谱,2014,32(3):304-308.
[15] 丁明玉,陈培榕,罗国安.食品中有机酸的高效液相色谱分析法[J].色谱,1997,15(3):34.
[16] SHEN Fei,NIU Xiao-ying,YANG Dan-ting,et al.Determination of amino acids in chinese rice wine by fourier transform near-infrared spectroscopy[J].Journal of Agricultural and Food Chemistry,2010,58(17):9 809.
[17] HAN Fu-liang,XU Yan.Identification of low molecular weight peptides in Chinese rice wine (Huang Jiu) by UPLC-ESI-MS/MS[J]. Journal of the Institute of Brewing,2011,117(2):238.
[18] 经斌,王栋,徐岩,等.中国黄酒中若干重要风味物质嗅觉阈值的研究[J].食品工业科技,2012,33(6):135.
[19] 任一平,高宗裕,黄百芬.高效液相色谱法测定黄酒中的有机酸[J].食品与发酵工业,1991,17(41.
[20] 毕丽君,顾振宇.固相萃取-反相HPLC分析色酒中有机酸[J].理化检验:化学分册,2000,36(4):163-164.
[21] 唐柯,王蓓,马玥,等.不同酵母与温度发酵的威代尔冰葡萄酒有机酸分析[J].食品与发酵工业,2015,80(1):154.
[22] 马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2011,30(1):62.
[23] 余有贵,金城,刘屏亚,等.两种工艺酿造的干型黄酒主要质量指标比较[J].邵阳学院学报,2013,10(3):55.
[24] 诸葛庆,李博斌,刘兴全,等.采用离子色谱法分析研究黄酒中的氨基酸[J].酿酒科技,2008(4)110.
[25] 朱晓玲,叶飞,杨洁,等.固相萃取-高效液相色谱法测定蜂蜜中的有机酸[J].色谱,2010,28(10):945-949.
[26] 霍艳敏,王艳丽,王骏,等.高效液相色谱法测定婴幼儿乳粉中烟酰胺的不确定度评定[J].食品科学,2011,32(16):330-333.
[27] 云环,刘鑫,何悦,等.固相萃取-超高效液相色谱法同时测定乳制品中6种有机酸[J].分析试验室,2014,33(5):609.
[28] MAJIDANO S,KHUHAWAR M,ZOUNR R,et al.Determination of amino acids in jams,fruits and pharmaceutical preparations by gas chromatography using trifluoroacetylacetone and ethylchloroformate as derivatizing reagents[J].Analytical Methods,2015,7(7):3 148-3 156.
[29] 崔云,卢红梅,张义明,等.食醋色率变化的研究[J].中国调味品,2009,34(4):61.
[30] 汪建国.嘉兴喂饭酒有机酸的种类,含量,来源及作用[J].江苏调味副食品,2010(4):28-31.
[31] 董霞,李崎,顾国贤.啤酒有机酸类物质研究进展[J].酿酒,2004,31(6):63-66.
Determination of organic acids in Chinese rice wine by solid phase extraction-ultra performance liquid chromatography
WANG Lin,CHEN Shuang,XU Yan*
(State Key Laboratory of Food Science & Technology, Key Laboratory of Industrial Biotechnology, Ministry of Education; Centre for Brewing Science and Enzyme Biotechnology, School of Biotechnology Jiangnan University, Wuxi 214122, China)
The influence of major components in Chinese rice wine on the chromatographic analysis of organic acids was investigated. Amino acids, polypeptides and pigments were the major impurities which observably interfere with chromatographic separation of organic acids in Chinese rice wine. A method for the simultaneous determination of 7 organic acids in Chinese rice wine was developed by solid-phase extraction and ultra performance liquid chromatography (SPE-UPLC). The sample was purified by the SCX-SPE cartridge after pretreatment, and then separated by ACQUITY UPLC HSS T3 column. 20 mmol/L NaH2PO4(pH 2.7) was used as the mobile phase at a flow rate of 0.25 mL/min. The detection was performed by a diode array detector at 210 nm. The results showed that 7 organic acids were completely separated and determined in 5 min. the linear correlation coefficients were above 0.999 3 in the range of 0.100-37 456.000 mg/L. Under these conditions, the recoveries of 7 organic acids in rice wine were in the range of 94.96%-105.08% with the relative standard deviations (RSDs,n=5) of 0.43%-1.79%. Compared with traditional organic acid SPE’s adsorption and elution operation, this method is feasible, accurate and applicable for the quantitative analysis of organic acids in Chinese rice wine. With this method, we analyzed the differences of the organic acids concentrations between Traditional and Qingshuang Chinese rice wine. The results showed that the total acids in Traditional Chinese rice wine was significantly higher (P<0.05) than those in Qingshuang Chinese rice wine, while the difference was mainly caused by the remarkable difference (P<0.05) in the concentrations of tartaric acid, malic acid and lactic acid.
ultra performance liquid chromatography(UPLC); solid phase extraction(SPE); organic acid; Traditional Chinese rice wine; Qingshuang Chinese rice wine
10.13995/j.cnki.11-1802/ts.201610024
硕士研究生(徐岩教授为通讯作者,E-mail:yxu@jiangnan.edu.cn)。
国家自然科学基金(31530055、21506074);国家高技术研究发展计划(863计划)(2013AA102108);江苏省自然科学基金(BK20140153)
2016-02-24,改回日期:2016-03-30
