紫花苜蓿小孢子发育时期与花器形态的相关性研究
2016-12-02金西子张博陈爱萍李陈建
金西子,张博,陈爱萍,李陈建
(新疆草地资源与生态实验室/新疆农业大学草业与环境科学学院,乌鲁木齐 830052)
紫花苜蓿小孢子发育时期与花器形态的相关性研究
金西子,张博,陈爱萍,李陈建
(新疆草地资源与生态实验室/新疆农业大学草业与环境科学学院,乌鲁木齐 830052)
【目的】研究紫花苜蓿小孢子各发育时期细胞学特征与花器形态之间相关性,依据花器形态来判断小孢子发育时期,为小孢子培养诱导单倍体的提供依据。【方法】以5个品种紫花苜蓿为供试材料,观察小孢子不同发育时期细胞学特征及花蕾形态、花药大小、颜色及形态。【结果】紫花苜蓿小孢子的发育的四个时期(四分体时期、单核早中期、单核靠边期和双核期)细胞学特征明显;紫花苜蓿小孢子发育时期与花蕾形态特征密切相关,花蕾纵径、横径和花瓣长增长显著,同一品种四个时期存在极显著差异;亮牧1号花蕾纵径长度在小孢子发育的四个时期大于其它4个品种的相应时期;同一时期参试品种间花器形态差异不显著;品种内四个时期花药大小变化不显著,花药颜色变化明显,由绿色逐渐变为黄色。【结论】花蕾纵径、横径和花瓣长适合作为小孢子发育时期的判断指标;紫花苜蓿小孢子处于单核靠边期时,纵径长在5.40~6.10 mm,横径长在1.61~1.85 mm,花瓣长在3.98~5.55 mm,此时花瓣露出萼片,花瓣呈紫色,花药为淡黄色。
紫花苜蓿;小孢子;发育时期;花器形态
0 引 言
【研究意义】紫花苜蓿(MedicagosativaL.)是世界上重要的豆科牧草,由于蛋白质含量高(约占干物质的20%),尤其是它持续高产、适应性强、草质优、适口性好[1]、易栽培等特点,使其在畜牧业生产中被人们冠之以“牧草之王”的美誉[2]。苜蓿是遗传型复杂的异花授粉植物,常规育种方法会导致其后代性状分离,不易获得稳定性状的品系。要想快速获得稳定的纯合品系,利用单倍体育种技术不失为一条有效的捷径[3]。【前人研究进展】人工诱导植物产生单倍体途径较多,主要有:花药或小孢子培养、未授粉子房(胚珠)培养、远缘杂交、体细胞染色体消失(又称球茎大麦技术)等。其中花药或小孢子培养应用最为广泛[4]。小孢子的发育时期是影响小孢子培养效果的重要因素,选择适宜的小孢子发育时期进行培养能够有效提高诱导率[5]。小孢子发育阶段主要包括单核早期、单核中期、单核晚期(即单核靠边期)、双核期等。对于大多数植物来说,单核中晚期到双核早期是最适合的小孢子发育阶段,单核晚期成胚率最大[6-10]。许多研究表明,不同发育时期的小孢子与其花蕾的外部形态,如花蕾大小、萼片和花瓣的相对长短等有相关性,例如白芦笋小孢子[11]的发育时期与花蕾的纵径、横径密切相关,不同时期的小孢子其花蕾纵径和横径差异显著;新疆芜菁小孢子[12]花蕾横径、花蕾纵横比、花瓣长、瓣药比均适合作为不同材料花蕾取样的参考指标。【本研究切入点】前人的研究主要集中在十字花科植物[13-15]、禾谷类植物[16-18]等,以苜蓿[19,20]为主体,研究小孢子发育时期与花器形态相关性的报道虽有,但并不全面。研究通过观测小孢子发育各时期的细胞学特征及小孢子发育各时期花蕾和花药形态,以研究小孢子发育时期与花器形态相关性。【拟解决的关键问题】试验以5个品种紫花苜蓿为材料,探究小孢子发育时期与花器形态的相关性,从而为紫花苜蓿小孢子培养材料的选择提供依据,为紫花苜蓿单倍体育种奠定基础。
1 材料与方法
1.1 材 料
2015年5月,5个品种紫花苜蓿由新疆草地资源与生态实验室苜蓿种植资源圃提供,分别是:亮牧1号、公农1号、敖汉苜蓿、陇东苜蓿和三得利苜蓿,这5个品种紫花苜蓿具有花期时间长,花器形态易于观测等特点,材料采自于乌鲁木齐市新疆农业大学实验基地三坪农场。
1.2 方 法
1.2.1 小孢子发育各个时期的细胞学观察
于现蕾期开始(5月10日),晴天早上08:30~09:30,采摘带枝叶的苜蓿顶端花序装入自封袋后放入冰盒带回实验室。根据外观特征,分别将不同大小的花蕾放入卡诺氏固定液FAA(无水乙醇与冰醋酸体积比为3∶1)中于室温下固定24 h后,转到70%酒精中,置4℃冰箱保存备用。用镊子取出花药放在载玻片上,用酸洋红染液进行染色,盖上盖玻片,轻轻敲击后制成临时压片后在显微镜下观测。将制好的压片置于Olympus CX41显微镜下观察小孢子所处发育时期,每个时期取10个花蕾进行观测,重复3次,每个花药观察10个不同的视野,并拍摄小孢子不同发育时期的照片。
1.2.2 小孢子发育各个时期花蕾及花药形态观测
根据不同发育时期,采摘相应大小的花蕾,用数显游标卡尺测量花蕾纵径、横径,计算其纵横比,将花瓣、花萼完整剥离,测量其花瓣长、花萼长,并计算瓣萼比。每个时期取花蕾30个,重复3次。最后用解剖针剥取完整的花药,用Profound UM1000软件对花药长和宽进行测量,计算长宽比。采用DPS 数据处理系统进行差异显著性分析,寻找其相关性。
2 结果与分析
2.1 紫花苜蓿小孢子各发育阶段细胞学特征
2.1.1 四分体时期
紫花苜蓿花粉母细胞经减数分裂形成小孢子,它们被一层厚的胼胝质包围成四分体,细胞的体积相对较小,细胞质中无明显液泡。由于小孢子在细胞内呈立体排列,因此在显微镜下常观察到3个小孢子,偶可看到4个小孢子,其外围有一层薄而透明的细胞壁。图1A
2.1.2 单核早中期
包裹在四分孢子周围的胼胝质壁逐渐溶解,形成四个单核花粉粒,小孢子体积逐渐增加,细胞整体变圆,细胞核增大且多位于细胞中央,有时能观测到此时花粉细胞壁较薄,不明显。图1B
2.1.3 单核靠边期
细胞体积继续增大,液泡开始形成并发育为大液泡,将核从细胞中央位置挤压到靠近细胞壁的位置,细胞质相对不透明,此时花粉细胞壁较厚,且萌发孔结构明显。图1C
2.1.4 双核期
花粉细胞进行第1次有丝分裂后,形成1个营养细胞和1 个生殖细胞。靠近细胞壁的是生殖核,远离细胞壁的为营养核。图1D
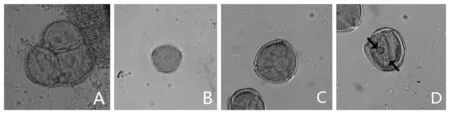
A.四分体时期;B.单核早中期;C.单核靠边期;D.双核期
2.2 紫花苜蓿小孢子发育时期与花蕾形态特征的相关性
研究表明,紫花苜蓿小孢子发育时期与花蕾形态特征密切相关。紫花苜蓿小孢子从四分体时期到双核期的发育过程中,花蕾纵径、横径、花瓣长、萼片长均呈现增长趋势。同一品种紫花苜蓿小孢子在发育的四个时期,纵径、横径、花瓣长和瓣萼比大都存在显著差异,其中纵径、横径和花瓣长差异最为明显;亮牧1号在单核早中期向单核靠边期的发育过程中纵径差异不显著,可能由于两个时期发生时间间隔太短;同一品种紫花苜蓿纵横径比和萼片长之间有差异,但差异不显著;瓣萼比除敖汉苜蓿和陇东苜蓿在单核靠边期到双核期差异不明显外,其它几个品种在发育的各个时期均存在显著或极显著差异;不同品种苜蓿,除亮牧1号的花蕾纵径长在小孢子发育的四个时期大于其它4个品种的相应时期外,品种间参试品种同一时期花器形态差异不显著。紫花苜蓿小孢子处于单核早中期时,纵径长在5.01~6.00 mm,横径长在1.51~1.74 mm,花瓣长的范围在3.18~4.68 mm,小孢子处于单核靠边期时,纵径长在5.40~6.10 mm,横径长在1.61~1.85 mm,花瓣长在3.98~5.55 mm。表1
观察小孢子发育各个阶段的花蕾外观形态发现,花蕾逐渐增大,萼片颜色逐渐变浅,由深绿色变为浅绿色,四分体时期萼片完全闭合,花瓣被完全包被,单核早中期时萼片稍张,花瓣稍稍露出,单核靠边期时萼片张开,花瓣露出萼片,双核期时花瓣露出的部分与萼片接近等长或明显长于萼片。图2,表2
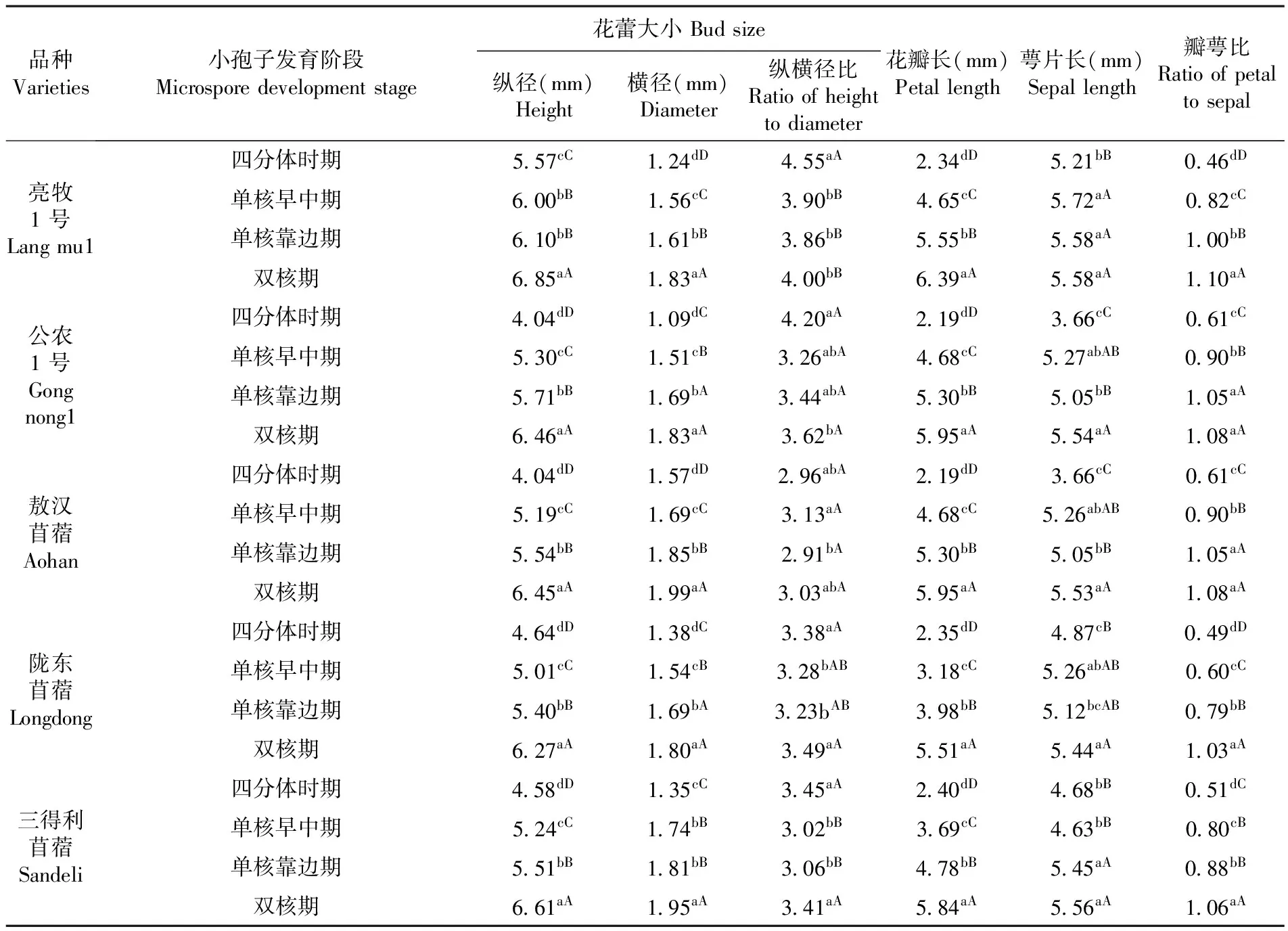
表1 5个品种紫花苜蓿小孢子各发育时期花蕾形态特征
注:不同小写字母表示在0.05 水平下差异显著,不同大写字母表示在0.01 水平下差异显著,下同
Note:Different lowercase letters expressed significant difference at the 0.05 level, different capital letters expressed significant difference at the 0.01 level, the same as below

A.亮牧1号;B.公农1号;C.敖汉苜蓿;D.陇东苜蓿;E.三得利苜蓿
2.3 紫花苜蓿小孢子发育时期与花药发育特征的相关性
研究表明,紫花苜蓿小孢子在发育的过程中,花药大小除三得利苜蓿在小孢子发育的四个时期呈增长趋势外,其它几个品种在前三个发育时期呈现增长趋势,在双核期呈现减小趋势,各个时期花药长和花药宽虽有差异,但差异不显著;花药长宽比差异亦不显著。表3
观察紫花苜蓿小孢子发育不同时期的花药形态发现,由四分体向双核期的发育过程中,花药颜色变化较为明显。花药为绿色时,小孢子发育处于四分体时期所占比例最多,为91.4%~96.1%,少数小孢子的发育状态处于单核早中期,所占比例为3.9%~9.6%,处于单核靠边期和双核期的比例均为0;花药为黄绿色时,小孢子处于四分体时期所占比例有所减少,为15.2%~22.5%,处于单核早中期所占比例逐渐增加,为77.5%~84.8%,处于单核靠边期和双核期所占比例均为0;花药为淡黄色时,小孢子处于四分体时期所占比例为0,处于单核早中期所占比例减少为5.6%~21.5%,大多数小孢子发育至单核靠边期阶段,所占比例为66.0%~82.5%,少数发育至双核期,所占比例为9.8%~18.9%;花药为黄色时,小孢子发育逐渐成熟,处于四分体时期和单核早中期所占比例均为0,处于单核靠边期所占比例为21.8%~35.5%,处于双核期的小孢子所占比例最多,为64.5%~78.2%。随着花药的不断发育,其颜色的变化规律依次为绿色-黄绿色-浅黄色-黄色。表4
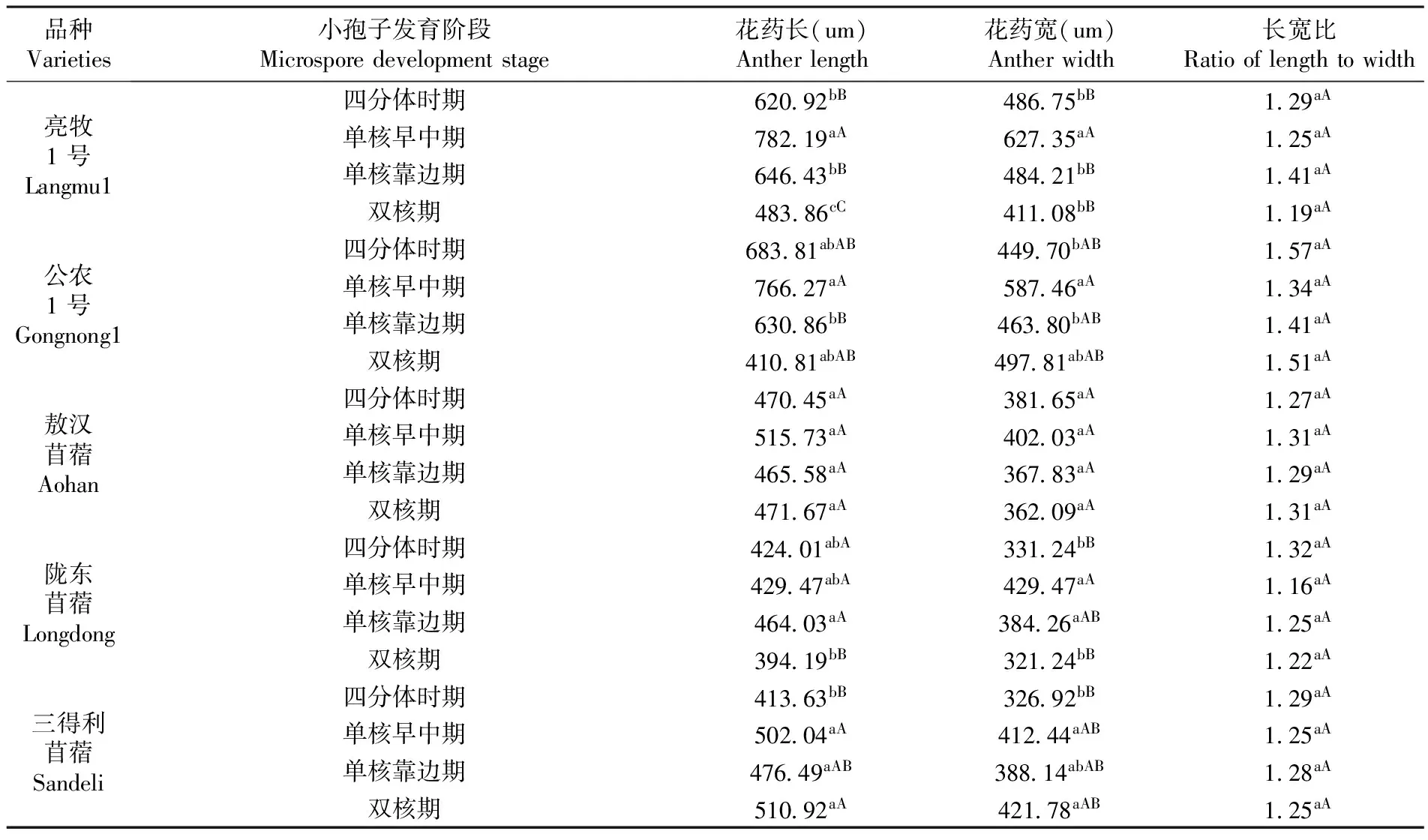
表3 5个品种紫花苜蓿小孢子各发育时期花药大小特征
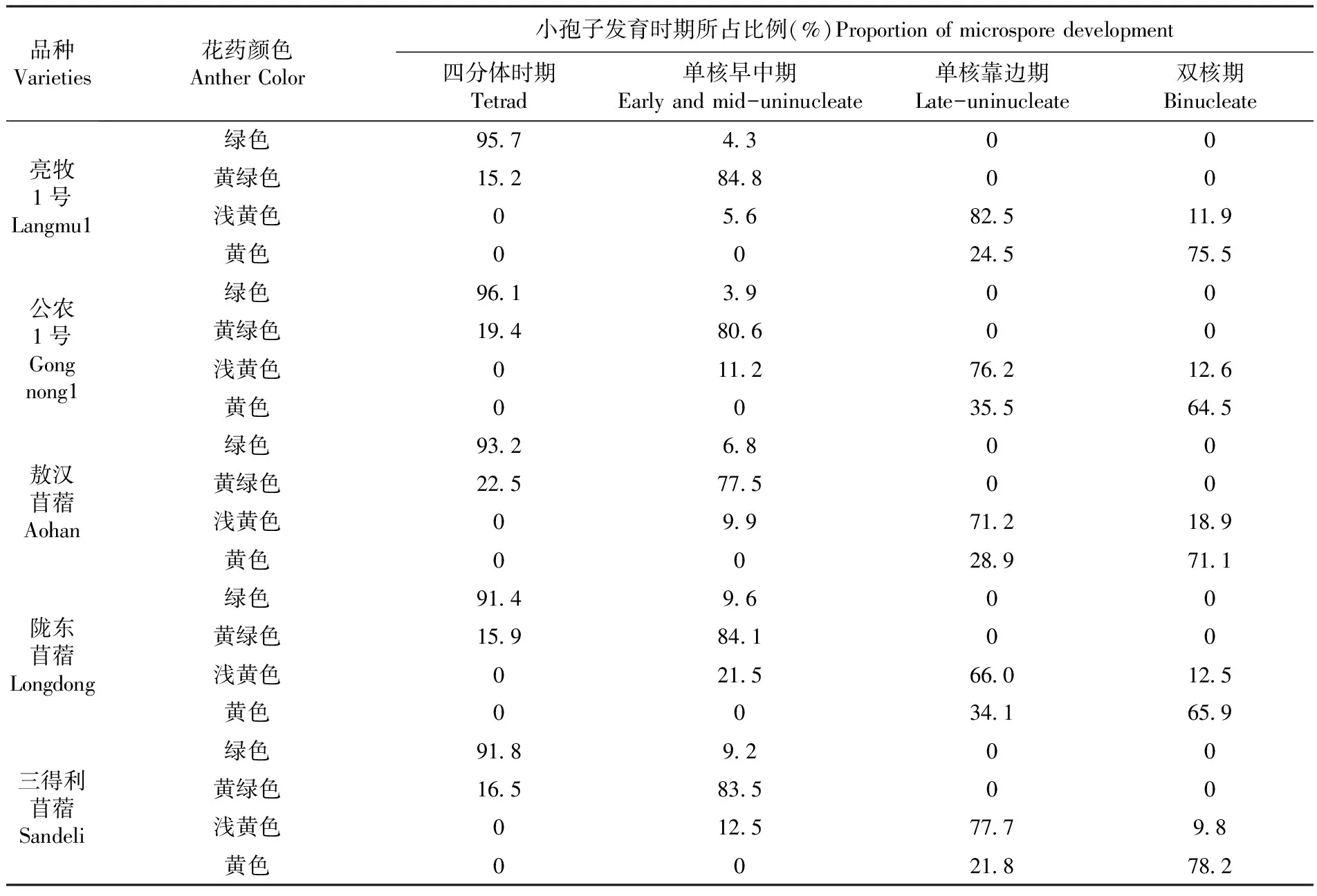
表4 5个品种紫花苜蓿小孢子各发育时期花药颜色特征
3 讨 论
3.1 紫花苜蓿小孢子各发育阶段细胞学特征
花粉在花药中的发育过程一般可形成2种成熟的花粉粒,即二核细胞花粉和三核细胞花粉[21]。大多数植物的花粉在散粉时为二核细胞状态,此时含有1个营养细胞,1个生殖细胞,生殖细胞在花粉管中进行有丝分裂后形成2个精子,甜瓜[22]、辣椒[23]、黄花苜蓿[24]等皆属于此种发育途径;少数植物的花粉生殖细胞有丝分裂发生在散粉前,形成1个营养细胞和2个生殖细胞,此时小孢子为三核细胞状态,如白芷[25]、玉米[26]等植物。试验通过显微观察,发现紫花苜蓿小孢子的发育分为四个时期,即为四分体时期、单核早中期、单核靠边期和双核期,花粉粒发育成熟时属于二核细胞花粉粒,各时期特征可以通过细胞核的大小,位置,数量,细胞壁的厚度等特征进行判断。小孢子处于四分体时期时,小孢子呈立体结构排列,一般可看到3个;单核早中期时细胞核增大并位于细胞中央,出现萌发孔;单核靠边期时,出现较大液泡,将细胞核从挤压到靠近细胞壁的位置;双核期形成两个细胞核,靠近细胞壁的是生殖核,远离细胞壁的为营养核。这与张晶[19]、马菊兰[27,28]等研究的苜蓿小孢子发育细胞学特征的试验结果一致。
3.2 紫花苜蓿小孢子发育时期与花蕾形态特征的相关性
紫花苜蓿小孢子从四分体时期到双核期的发育过程中,花蕾不断增大,花瓣颜色加深,萼片颜色变浅,花蕾纵径、横径、花瓣长均呈增长趋势。同一品种紫花苜蓿小孢子发育的四个时期花部形态指标存在显著或极显著差异,尤其是纵径、横径和花瓣长,说明纵径和花瓣长可以作为判定小孢子发育时期的选择指标。
在小孢子培养和花药培养的研究中表明,小孢子处于单核靠边期时,愈伤组织诱导率最高;[29]蒺藜苜蓿[30]小孢子处于单核靠边期时,愈伤组织诱导率可达37.21%;也有植物将单核早中期作为小孢子培养的最佳时期,如芸薹属植物[31]。试验中紫花苜蓿小孢子处于单核早中期和单核靠边期时,纵径长的范围在5.01~6.00 mm和5.40~6.10 mm,而花瓣长的范围在3.18~4.68 mm和3.98~5.55 mm,这与张鑫[11]的研究结果有差异,其研究结果表示,紫花苜蓿处于单核末期时,花萼比花瓣稍长,瓣萼比为14/25,即0.56,研究的5个品种的紫花苜蓿瓣萼比的范围在0.88~1.05 mm,比张晶的研究结果稍大,这可能是由于不同品种之间存在差异;马菊兰[28,29]的研究表明,小孢子发育处于单核中期到单核靠边期时,花冠伸出花萼1~2 mm,由于紫花苜蓿处于单核靠边期时,花瓣露出花萼部分较短,不易测量,试验未选择测量花瓣长和萼片长。
3.3 紫花苜蓿小孢子发育时期与花药发育特征的相关性
研究表明[32],随着小孢子的发育,花药长度、宽度、长宽比存在显著差异,花药颜色变化明显。通过对5个品种紫花苜蓿小孢子的花药观测发现,花药长度和宽度差异并不显著,说明花药长宽不适合作为判断小孢子发育时期的指标。花药颜色存在明显差异,随着小孢子的发育,花药颜色变化规律依次为绿色-黄绿色-浅黄色-黄色。
4 结 论
在进行紫花苜蓿花药培养或游离小孢子培养时,可以根据花蕾形态判断小孢子的发育时期,并进而确定适合小孢子培养的最佳选材标准。试验中紫花苜蓿小孢子处于单核早中期和单核靠边期时,纵径长的范围在5.01~6.00 mm和5.40~6.10 mm,横径长的范围在1.51~1.74 mm和1.61~1.85 mm,而花瓣长的范围在3.18~4.68 mm和3.98~5.55 mm。紫花苜蓿小孢子单核靠边期时花蕾外观和花药的形态特征是:花蕾已明显膨大,花瓣露出萼片,萼片淡绿色,花瓣呈紫色;花药体积较大,花药淡黄色,较易剥离。因此,在进行紫花苜蓿单倍体育种时,可以根据此时期的特点,通过测量紫花苜蓿花蕾纵径和花瓣长,判断小孢子的发育时期,从而为紫花苜蓿花药离体培养接种外植体的选择提供科学依据。
References)
[1]闵继淳,肖凤.新疆当家草种紫花苜蓿生产有关问题[J].新疆畜牧业,1986,(S1):53-56.
MIN Ji-chun,XIAO Feng.(1986).The problems of Xinjiang grass alfalfa production [J].JournalofAnimalHusbandryinXinjiang,(S1):53-56. (in Chinese)
[2] GENG Hua-Zhu.Chinese Alfalfa. Beijing China Agricultural Science and Technology Press. 1995.
[3] Maluszynski, M. (2003). Doubled haploid production in crop plants - a manual.DodrechtKluwerAcademicPublishers:309-335.
[4]张正.农作物单倍体育种研究概况与思考[J].山东农业科学,2007,(5):122-125.
ZHANG Zheng. (2007). Research progress and advice on crop haploid breeding [J].ShandongAgriculturalSciences,(5):122-125. (in Chinese)
[5]王玉英,孙敬三,王敬驹,等. 小黑麦(Triticale)和辣椒(Capsicumannuum)花粉植株的诱导[J].中国科学,1973,(1):104-107.
WANG Yu-ying,SUN Jing-san,WANG Jing-ju,et al. (1973).Induction of pollen plants ofTriticaleandCapsicumannuum[J].JournalofChinaScience,(1):104-107. (in Chinese)
[6]任飞,王羽梅.我国十字花科蔬菜游离小孢子培养研究进展[J].韶关学院学报,2010,31(3):77-83.
REN Fei,WANG Yu-mei.(2010). Progress of study on isolated microspore culture of cruciferae vegetables [J].JournalofShaoguanUniversity(NaturalScience),31(3):77-83. (in Chinese)
[7]闵子扬,童龙,李玲,等.葫芦科蔬菜游离小孢子培养研究进展[J].长江蔬菜,2013,(12):6-9.
MIN Zi-yang,TONG Long,LI Ling,et al. (2013).Research Progress on Isolated Microspore Culture of Cucurbitaceous Vegetables [J].JournalofChangjiangVegetables,(12):6-9. (in Chinese)
[8]郭金英,申书兴,陈雪平,等.十字花科蔬菜游离小孢子培养研究进展[J].河北农业大学学报,2002,25(5):122-124.
GUO Jin-ying,SHEN Shu-xing,CHEN Xue-ping,et al. (2002).Progress of isolated microspore cultures of cruciferae vegetabale crops[J].JournalofAgriculturalUniversityofHebei, 25(5):122-124. (in Chinese)
[9]汤青林,宋明,张钟灵.甘蓝类蔬菜游离小孢子培养研究进展[J].西南农业学报,2000,13(3):98-103.
TANG Qing-lin,SONG Ming,ZHANG Zhong-ling.(2000). The advances of studies on isolated microspore culture in cole crops [J].SouthwestChinaJournalofAgriculturalScience,13(3):98-103. (in Chinese)
[10]谢淼,秦丽颖,潘俊松.黄瓜花器形态发生、小孢子发育与花药培养[J].西北植物学报,2005,25(6):1 096-1 100.
XIE Miao,QIN Li-ying,PAN Jun-song.(2005).Flower Morphogenesis andMicrospore Development Versus Anther Culture of Cucumber[J].ActaBotanicaBoreali-OccidentaliaSinica,25(6):1,096-1,100. (in Chinese)
[11]张鑫,杜红斌,轩正英.新疆芜菁小孢子不同发育时期的细胞学和花器官形态特征观察[J].北方园艺,2015,(21):1-5.
ZHANG Xin,DU Hong-bing,XUAN Zheng-ying.(2015). Morphological Characteristics of Flower Organ and Cytological Observation of Microspore in Different Development Stage in Xinjiang Turnips [J].NorthernHorticulture,(21):1-5. (in Chinese)
[12]林宗铿,张天翔,杨俊杰,等.白芦笋小孢子发育时期与花器形态相关性研究[J].中国农学通报,2011,27(28):200-204.
LIN Zong-qiang,ZHANG Tian-xiang,YANG Jun-jie,et al. (2011).Correlation of Microspore Development Period and the Flower Organ Morphology of White Asparagus [J].ChineseAgriculturalScienceBulletin,27(28):200-204. (in Chinese)
[13]蒋根水,肖辉,沈建勋.十字花科蔬菜游离小孢子培养中若干影响因素分析[J].杭州农业科技,2008,(4):20-22.
JIANG Gen-shui,XIAO Hui,SHEN Jian-xun.(2008). Analysis of Cruciferous Vegetable Microspore Culture in Some Influencing Factors [J].HangzhouAgriculturalScienceandTechnology,(4):20-22. (in Chinese)
[14]佟智慧.青花菜(BrassicaoleraceaL.)游离小孢子培养技术研究[D].福州:福建农林大学硕士论文,2009.
TONG Zhi-hui.(2009).StudyonTheTechniquesofisolatedMicrosporeCultureinBroccoli(BrassicaoleraceaL.)[D]. Master Dissertation. Fujian Agriculture and Forestry University,Fuzhou. (in Chinese)
[15]付文婷.大白菜游离小孢子胚诱导及植株再生技术研究[D].杨凌:西北农林科技大学硕士论文,2010.
FU Wen-ting. (2010).StudyonisolatedMicrosporeCultureandPlantletFormationHeadingChineseCabbage[D]. Master Dissertation. North West Agriculture and Forestry University,Yangling. (in Chinese)
[16]陆瑞菊.大麦游离小孢子培养技术的优化及单倍体耐盐、耐低氮胁迫筛选体系的建立[D].南京:南京农业大学博士论文,2012.
LU Rui-ju.(2012).SystemOptimizationofisolatedmicrosporeCultureandScreeningofStressTolerancestoSaltandLowNitrogeninHaploidBarley[D].PhD Dissertation. Nanjing Agriculture University,Nanjing. (in Chinese)
[17]王亦菲,陆瑞菊,黄剑华.花药和小孢子培养技术应用于大麦育种的回顾与展望[J].植物生理学报,2014,50(12):1 753-1 758.
WANG Yi-fei, LU Rui-ju, HUANG Jian-hua. (2014).Review and Perspective on the Application of Anther and Microspore Culture in Barley Breeding [J].PlantPhysiologyJournal,50(12):1,753-1,758. (in Chinese)
[18]刘成洪,陆瑞菊,郭桂梅,等.诱变结合小孢子培养创制大麦黄花叶病不同抗性突变体[J].核农学报,2015,29(11):2 065-2 070.
LIU Cheng-hong,LU Rui-ju,GUO Gui-mei,et al. (2015). Mutants Resistant to Barley Yellow Mosaic Virus ( BaYMV)Created by Mutagenesis Combined With Microspore Culture [J].JournalofNuclearAgriculturalSciences,29(11):2,065-2,070. (in Chinese)
[19]张晶.影响苜蓿游离小孢子的培养因素的研究[D].乌鲁木齐:新疆农业大学硕士论文,2012.
ZHANG Jing.(2012).EffectsofFactorsonMicrosporeCultureofAlfalfaAnther[D]. Master Dissertation. Xinjiang Agriculture University,Urumqi. (in Chinese)
[20]陈爱萍,王玉祥,张晶,等.不同处理对苜蓿小孢子离体培养存活率的影响[J].新疆农业科学,2013,50(6):1 150-1 156.
CHEN Ai-ping,WANG Yu-xiang,ZHANG Jing,et al. (2013).Effect of Survival Rate of Alfalfa Microspore Culture by Different Treatments [J].XinjiangAgriculturalSciences,50(6):1,150-1,156. (in Chinese)
[21]吕世友,李彦舫,陈祖铿,等.花粉发育的研究进展[J].植物学通报,2001,18(3): 340-346.
LV Shi-you,LI Yan-fang,CHEN Zu-qiang,et al. (2001). Review on Pollen Development [J].ChineseBulletinofBotany,18(3):340-346. (in Chinese)
[22]王薇薇,羊杏平,范淑英,等.甜瓜小孢子发育时期与花器形态的关系[J].西北农林科技大学学报(自然科学版),2015,43(4):108-112.
WANG Wei-wei, YANG Xing-ping, FAN Shu-ying,et al. (2015). Correlation between Microspore Development Period and Floral Organ Morphology ofCucumisMeloL.[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.),43(4):108-112. (in Chinese)
[23]张芳,李海涛,张馨宇.不同基因型辣椒相同花器外部形态小孢子发育时期的差异[J].中国蔬菜,2009,(10):23-27.
ZHANG Fang,LI Hai-tao,ZHANG Xin-yu. (2009). Differences in Cytological Development Period of Capsicum's Microspore with Same Flower Organ Morphology of Different Genotypes [J].ChinaVegetables,(10):23-27. (in Chinese)
[24]杨静,张博,陈爱萍, 等.黄花苜蓿小孢子发育时期与花器形态的相关性研究[J].草地学报,2014,22(5):1 063-1 068.
YANG Jing,ZHANG Bo,CHEN Ai-ping,et al. (2014).Correlation between Microspore Development Period and Floral Organ Morphology ofMedicagofalcataL.[J].ActaAgrestiaSinaca,22(5):1,063-1,068. (in Chinese)
[25]李静夜,吴卫,郭耀杰,等.白芷小孢子发育时期与花器形态相关性分析[J].中国农学通报,2013,29(36):151-154.
LI Jing-ye,WU Wei,GUO Yao-jie,et al. (2013).Correlation of Cytological Development Period and Morphological Characteristics of Flower Organ ofAngelicadahurica[J].ChineseAgriculturalScienceBulletin,29(36):151-154. (in Chinese)
[26]齐延芳,宋建成,姜丽君,等.玉米小孢子胚胎发生的细胞形态学观察[J].核农学报,1999,13(1):1-10.
QI Yan-fang,SONG Jian-cheng,JIANG Li-jun,et al. (1999). Cyto-Morphological Observations of Maize Microsporic Embry ogenesis [J].ActaAgriculturalNucleataeSinica,13(1):1-10. (in Chinese)
[27]马菊兰,张博.低温预处理和低温预培养对苜蓿新品系花药愈伤组织诱导的影响[J].中国草地学报,2007,29(6):59-63.
MA Ju-lan,ZHANG Bo.(2007). Effects of Cold Pretreatment and Low Temperature Pre-culture on the Callus Induction Rate on Anther Culture of Alfalfa [J].ChineseJournalofGrassland, 29(6):59-63. (in Chinese)
[28]马菊兰.苜蓿花药培养预处理方法和培养基的研究[D].乌鲁木齐:新疆农业大学,2007.
MA Ju-lan. (2007).StudyonPretreatmentMethodandMediumofAlfalfaAntherCulture[D].Master Dissertation. Xinjiang Agriculture University, Urumqi. (in Chinese)
[29]李允菲,王仁涛,袁存权,等.红花槐花药培养最适取材时期及选蕾标准[J].西北农林科技大学学报(自然科学版),2013,41(8):65-71.
LI Yun-fei,WANG Ren-tao,YUAN Cun-quan,et al. (2013).Optimal Anther Culture Period and Flower Bud Selecting for Robinia pseudoacacia var.decaisneana(Carr.)Voss [J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.),41(8):65-71. (in Chinese)
[30]谷文英,祈新梅,庞巧遇,等.蒺藜苜蓿小孢子不同发育时期花蕾形态与花药脱分化能力的研究[J].中国农学通报,2011,27(20):29-33.
GU Wen-ying,QI Xin-mei,PANG Qiao-yu,et al. (2011). Studys on Bud Morphology of Cytological Development Period of Microspore and Dedifferentiation Capacity of Anthers of Medicago Truncatula [J].ChineseAgriculturalScienceBulletin, 27(20):29-33. (in Chinese)
[31]史庆馨.芸薹属作物小孢子技术的发展与应用[J].北方园艺,2005,(4):14-15.
SHI Qing-xin.(2005).The Development and Application of Technique of Microspore of Brassica Crops [J].NorthernHorticulture,(4):14-15. (in Chinese)
[32]张菊平,巩振辉,刘珂珂,等.辣椒小孢子发育时期与花器形态的相关性[J]. 西北农林科技大学学报(自然科学版),2007,35(3):153-158.
ZHANG Ju-ping,GONG Zhen-hui,LIU Ke-ke,et al. (2007). Interrelation of cytological development period of pepper's microspore and the morphology of flower organ [J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.),35(3):153-158.(in Chinese)
Fund project:Supported by National Natural Science Foundation (31340068) and Key Laboratory of Grassland Resources and Ecological of Xinjiang program(XJDX0209-2012-06)
Study on Correlation between Microspore Development Period and Floral Organ Morphology ofMedicagosativaL.
JIN Xi-zi, ZHANG Bo, CHEN Ai-ping, LI Chen-jian
(College of Pratacultural and Environmental Sciences / Xinjiang Key Laboratory of Grassland Resources andEcology,XinjiangAgriculturalUniversity,Urumqi830052,China)
【Objective】 The paper focuses on the correlation between the cytological characteristics and floral characteristics ofMedicagosativaL. in different developmental stages of microspore in the hope of determining the developmental stage of microspore by floral characteristics and providing the basis for inducing haploid of microspore culture.【Method】5 varieties ofMedicagosativaL. were used as the test materials to observe their cytological characteristics in different developmental stages of microspore, floral characteristics, anther size, color and shape.【Result】Four stages of microspore inMedicagosativaL. including that the tetrad, the early and the mid-uninucleate, the late-uninucleate, the binucleate had obvious cytological characteristics; microspore development had correlation to the floral characteristics, bud height, diameter and petal length increased significantly, there were significant differences in the four periods of the same variety. The length of the longitudinal diameter of the Liangmu I was greater than that of the other 4 varieties during the period of the development of the pollen. The tested varieties had no significant difference in other floral characteristics. The anther size showed no significant difference in different stages of microspore development, but the color changed significantly, from green to yellow.【Conclusion】The longitudinal diameter, transverse diameter and the length of the petal are suitable to be used as indicators for the development of the pollen.. Alfalfa microspores at the uninucleate stage, longitudinal diameter length was between the 5.40 mm-6.10 mm, transverse diameter length was between the 1.61 mm-1.85 mm petals length was between 3.98 mm and 5.55 mm. At this stage, sepals were exposed from petals with purple color and anther showed canary yellow hue.
MedicagosativaL.; microspore; development period; floral organ morphology
10.6048/j.issn.1001-4330.2016.07.022
2016-03-29
国家自然科学基金项目(31340068);新疆草地资源与生态实验室项目(XJDX0209-2012-06)资助;
金西子(1991-),女,辽宁鞍山人,硕士研究生,研究方向为牧草遗传育种,(E-mail)328925362@qq.com
张博(1963-),男,甘肃人,教授,硕士生导师,研究方向为牧草遗传育种,(E-mail)xjauzb@sina.com
S551+.7
A
1001-4330(2016)07-1337-09
