疏水上转换纳米晶的均相体系聚合物包覆及在发光检测中的应用
2016-12-02张庆彬孔祥贵
张庆彬, 孔祥贵, 程 成
(1. 浙江工业大学理学院应用物理系, 杭州 310023;2. 中国科学院长春光学精密机械与物理研究所激发态重点实验室, 长春 130033)
疏水上转换纳米晶的均相体系聚合物包覆及在发光检测中的应用
张庆彬1, 孔祥贵2, 程 成1
(1. 浙江工业大学理学院应用物理系, 杭州 310023;2. 中国科学院长春光学精密机械与物理研究所激发态重点实验室, 长春 130033)
选用水解的十八碳烯-马来酸酐共聚物(PMAO)为表面修饰分子, 发展了一种以疏水纳米粒子吸附表面活性剂十二烷基磺酸钠(NaYF4-SDS)为中间体的均一液相聚合物包覆纳米粒子方法. 该方法解决了油溶性纳米晶与弱极性聚合物分子难以在单一体系下均匀分散的问题, 实现了在均一液相体系下对疏水纳米晶的单分散包覆以及表面羧酸官能团修饰. 红外光谱与表面Zeta电位测试结果表明纳米晶已被聚合物包覆, 粒子表面为强电负性的羧酸基团. 电镜结果表明聚合物包覆的上转换纳米晶粒径无明显的变化, 具有良好的单分散性. 发射光谱表明聚合物包覆前后粒子的发射谱带无显著变化, 保持了原油相粒子的发光性能. 进一步的特异性识别荧光显微成像实验证实聚合物包覆后的粒子(NaYF4-PMAO)可用于生物学检测.
纳米粒子; 上转换发光; 聚合物表面包覆; 生物应用
近年来, 以NaYF4∶Yb3+, Er3+等为代表的上转换发光(980 nm激发)纳米粒子作为一类新的荧光探针在生物医学领域中的应用引起了人们广泛的兴趣[1~7], 其独特优势在于近红外光源激发下低的生物背景荧光能够极大地提高光学检测的灵敏度[8,9]. 相对于水相体系合成, 高温有机相体系合成的纳米晶展现出结晶性高、 粒径均一、 发光强等优良性能[10~12]. 然而, 高温有机相体系合成的纳米晶表面为油酸、 油胺等疏水有机配体, 不具有水溶性, 且不含有可用于偶联生物分子的官能团, 限制了其在生物医学检测中的实际应用.
对高温有机体系合成的高性能纳米晶进行表面功能化修饰是获得适合生物应用发光纳米探针的必要途径. 目前对油溶性纳米晶进行表面修饰的主要方法可概括为两类: 一类是利用双官能团分子替代粒子表面疏水配体的配体交换法修饰; 另一类是选用双亲性聚合物或SiO2等直接对疏水纳米晶进行表面包覆[1,8,13~23]. 表面配体交换的优点在于取代剂一般为小分子, 实验过程简单, 但配体交换过程需经历原有配体的解离与新配体的再配位过程, 难免会对纳米晶的性能造成影响[19,20]. 与配体交换法相比, 表面包覆法具有明显的优点: 首先, 修饰过程直接在疏水粒子外附加包覆层, 不改变纳米粒子的原表面状态, 从而降低了对功能性质的影响; 其次, 包覆层的存在使粒子具有更高的水溶稳定性[13,15,16]. 然而, 表面包覆法也存在一些明显不足, 如SiO2包覆纳米粒子的操作过于复杂且包覆层厚度难于控制, 聚合物的长碳链容易造成纳米粒子的团聚等[15,17]. 因此, 选择适合的表面包覆剂, 并发展有效的表面包覆技术仍然是发光纳米晶应用于生物医学检测需解决的重要问题.
本文选用水解处理的十八碳烯-马来酸酐共聚物(PMAO)为包覆剂, 发展了一种借助疏水纳米晶与表面活性剂吸附中间体(NaYF4-SDS)过程的表面包覆技术, 克服了双亲性聚合物与疏水纳米粒子的界面问题, 在均一液相体系下实现了对纳米粒子的有效包覆. 获得的粒子为水溶性并具有丰富的表面羧酸官能团. 修饰后的粒子表现出良好的单分散性, 包覆前后纳米晶的发光性能无明显变化. 进一步的特异性识别荧光显微成像实验证实该粒子适合用于生物学检测.
1 实验部分
1.1 试剂与仪器
Y2O3(纯度99.99%)、 Yb2O3(纯度99.99%)和Er2O3(纯度99.99%)购于北京稀土创新技术有限公司; 油酸(OA)、 NH4F(98%)、 N-羟基硫代琥珀酰亚胺(Sulfo-NHS)、 2-(N-吗啉代)乙磺酸(MES)、 牛血清白蛋白(BSA)和十二烷基磺酸钠(SDS)等购于国药集团化学试剂有限公司; 马来酸酐与十八碳烯的交替共聚物(PMAO, Mn=30000~50000)购于Aldrich公司; 十八碳烯(纯度90%)购于Alfa aesar公司; 实验用水为自制去离子水.
8100IV型透射电子显微镜(日本Hitachi公司), 加速电压200 kV; F4500荧光光谱仪(日本Hitachi公司), 激发光源为外接的980 nm激光器(功率1 mW); Colloidal Dynamics Zeta电位分析仪(美国Colloidal Dynamics公司); Motic AE30 倒置生物显微镜以外接980 nm激光器为激发光源.
1.2 NaYF4∶Yb3+,Er3+纳米晶的制备
NaYF4∶Yb3+, Er3+发光纳米晶的制备参照文献[24]方法. 将盐酸与稀土氧化物反应获得的YCl3(0.78 mmol), YbCl3(0.2 mmol), ErCl3(0.02 mmol)按计量比放入50 mL三颈瓶中, 向体系中加入12 mL十八碳烯和9 mL油酸, 加热至160 ℃使稀土盐充分溶解, 冷却至室温. 将溶有氟源(4 mmol NH4F)和钠源(2.5 mmol NaOH)的甲醇溶液加入反应器中, 缓慢搅拌使之充分混合. 然后, 在氩气流保护下缓慢加热蒸出低沸点的甲醇溶剂, 升温至330 ℃回流反应1 h后停止反应, 冷却至常温, 离心收集样品, 用乙醇-水混合液和乙醇-氯仿混合液分别清洗2次, 获得的纳米晶分散于环己烷中备用.
1.3 NaYF4-PMAO纳米晶的制备
聚合物PMAO的酸酐水解处理: 称取40 mg聚合物溶解于20 mL丙酮中, 加入2~4 mL水, 于65 ℃缓慢搅拌回流12 h, 使聚合物中的酸酐水解为羧基. 高速离心收集产物, 移除体系中的丙酮和水, 水解聚合物分散于乙醇中备用.
将1 mL含有5 mg NaYF4∶Yb3+, Er3+纳米晶的环己烷溶液与10 mL溶解了20 mg SDS的水溶液混合, 在200 r/min转速下磁力搅拌乳化30 min, 之后在搅拌下缓慢加热到70 ℃蒸发掉体系内的环己烷, 高速离心沉化, 将获得的纳米粒子与表面活性剂吸附中间体NaYF4-SDS分散于2 mL无水乙醇中. 然后缓慢滴加到10 mL含有20 mg水解的PMAO的乙醇体系中, 高速搅拌超过12 h, 离心收集样品, 用乙醇清洗3次移除过量的游离聚合物, 最后将NaYF4-PMAO样品分散在去离子水中用于进一步分析.
1.4 NaYF4-PMAO纳米粒子的亲核素修饰
取约2.0 mg NaYF4-PMAO分散于1.0 mL MES(0.02 mol/L)缓冲溶液(pH=6.0)中, 加入5 mg EDAC 与 15 mg sulfo-NHS, 室温搅拌反应4 h后离心纯化, 再分散于MES中, 加入1 mg 亲核素, 在4 ℃ 下搅拌反应48 h. 最后, 将亲核素化的NaYF4-PMAO粒子离心纯化后分散于5 mmol/L 的硼酸盐缓冲液(pH=8.5)中备用.
取2片表面醛基化的硅片与0.1 mg/mL的人血清蛋白在37 ℃下反应2 h, 使人血清蛋白固定于硅片表面, 清洗3次后加入2%的 BSA溶液, 反应1 h用于表面封闭. 之后, 将2个硅片分别放入0.1 mg/mL羊抗人蛋白(对照细)与生物素化的羊抗人蛋白溶液中, 在37 ℃下反应2 h, 清洗备用. 获得的两组硅片分别与亲核素功能化的NaYF4-PMAO纳米粒子进行特异性识别反应, 用于荧光显微检测. 检测系统为Motic AE30 倒置荧光显微镜, 外加980 nm激光器为激发光源.
2 结果与讨论
2.1 PMAO聚合物均一液相体系包覆NaYF4∶Yb3+,Er3+上转换纳米晶
PMAO同时含有亲水性基团与亲油性碳链, 是常见的油水双亲性聚合物. 聚合物本身含有丰富的酸酐, 经水解反应为羧酸化PMAO后极性明显增强, 可溶解于弱极性溶剂无水乙醇中. 高温有机相合成得到的NaYF4∶Yb3+,Er3+上转换纳米晶由于表面存在疏水配体, 仅能分散于氯仿和环己烷等溶剂中. 羧酸化PMAO分子与NaYF4∶Yb3+,Er3+纳米晶表面的极性差异导致两者难以在同一溶剂中形成均一反应体系, 从而无法有效接触实现聚合物对纳米晶的有效包覆. 因此, 我们设计了借助疏水纳米晶与表面活性剂吸附中间体NaYF4-SDS来完成聚合物对纳米晶的包覆. 利用SDS分子亲、 疏水基团在纳米晶表面的取向吸附作用, 经过水包油微乳液过程, 在纳米晶表面吸附一层SDS分子(NaYF4-SDS, 见Scheme 1), 表面磺酸基团使得纳米晶能够短时间内在乙醇溶剂中保持分散. 当将NaYF4-SDS加入到PMAO的乙醇溶液中时, 在高速搅拌下不稳定的NaYF4-SDS吸附结构被打开, SDS从纳米晶表面脱落, 长碳链的PMAO分子逐渐缠绕包覆于纳米晶表面, 实现了在均一乙醇溶剂体系中聚合物对疏水纳米晶的表面包覆(NaYF4-PMAO), 具体过程见Scheme 1.

Fig.1 TEM images of NaYF4∶Yb3+, Er3+ nanocrystals before(A) and after(B) surface coating process
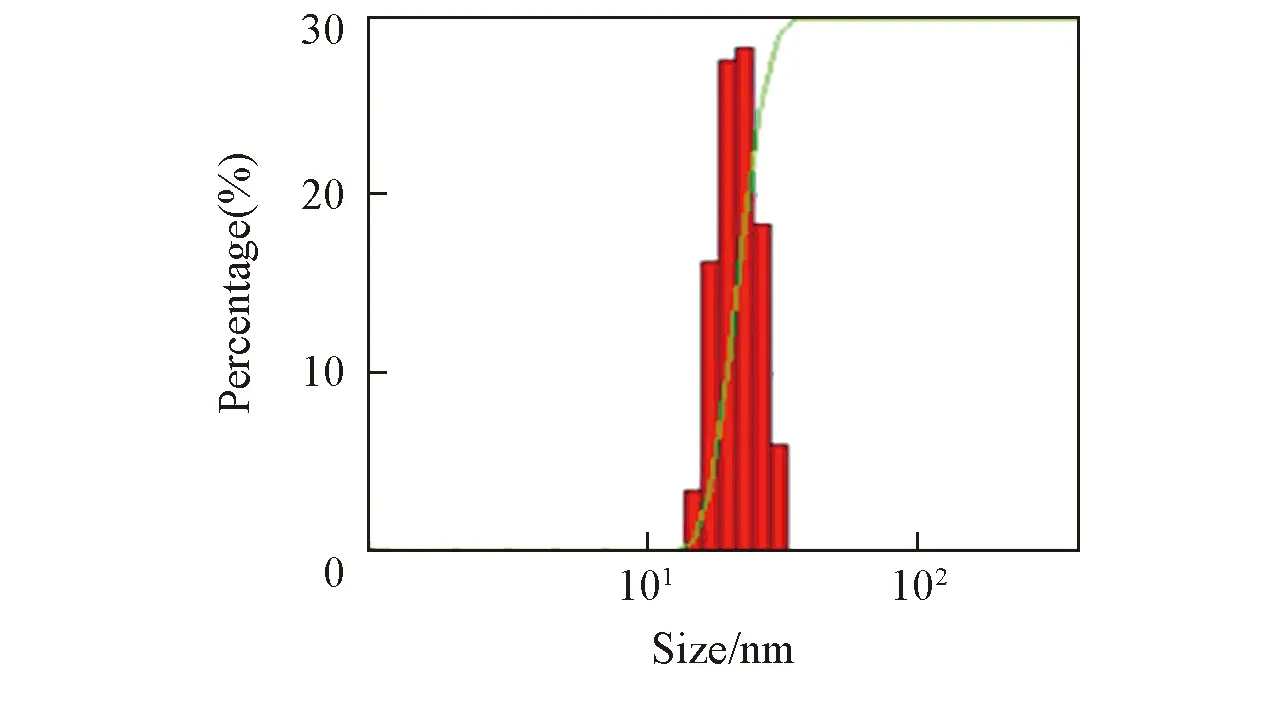
Fig.2 Hydrodynamic diameter distribution of the polymer coated NaYF4∶Yb3+, Er3+ in water
图1为聚合物包覆前后NaYF4∶Yb3+, Er3+纳米晶的TEM照片. 可见, 表面包覆前油酸稳定的纳米晶平均尺寸为(12±1.99) nm[图1(A)], 具有良好的分散性. 包覆后水溶性纳米晶的形貌与尺寸未发生明显的变化, 尺寸为(12±1.76) nm[图1(B)]. NaYF4-PMAO纳米粒子表面含有丰富的羧酸基团, 能够稳定分散于去离子水中. 在生物学中常用的磷酸盐(PBS, pH=7.4)、 硼酸盐(50 mmol/L, pH=8.3)和MES(20 mmol/L, pH=6.1) 等缓冲溶液中也可以保持稳定分散, 未发生可见的聚集与沉淀. 通过激光粒度分析(DLS)测试了NaYF4-PMAO粒子在水溶液中的伸展尺寸, 结果如图2所示.
2.2 NaYF4-PMAO纳米粒子的表面分子分析

Fig.3 FTIR spectra of NaYF4-SDS(A) and NaYF4-PMAO(B)

采用本文方法制备的NaYF4-PMAO纳米粒子表面含有大量的羧酸基团, 这些羧基不仅使NaYF4-PMAO纳米粒子具有良好的水溶性, 同时也可以作为反应基团为后续的生物医学应用偶联功能分子. 为了进一步确定粒子的表面性质, 对NaYF4-PMAO进行了表面Zeta电位测试, 结果表明粒子表面电位为-38.3 mV(图4). 强的电负性进一步证实NaYF4∶Yb3+, Er纳米粒子的表面被PMAO分子所包覆.

Fig.4 Zeta potential at the surface of NaYF4-PMAO nanoparticles

Fig.5 Luminescence spectra of NaYF4∶Yb3+, Er3+ nanoparticles in cyclohexane(a) and NaYF4-PMAO nanoparticles in water(b)λex=980 nm.
2.3 聚合物修饰前后的光谱性质
图5为NaYF4∶Yb3+, Er3+粒子包覆前后的上转换发射光谱. 发射谱中位于521, 540和654 nm的发射峰分别归属于Er3+离子2H11/2,4S3/2和4F9/2能级到4I15/2能级的跃迁. 经过表面聚合物包覆后, 纳米粒子的发光性质受到了较小的影响, 谱带中2个主发光峰的相对强度比(I540/I654)由油溶纳米晶的5.65降低为4.79. 这种谱带相对强度的变化归因于纳米粒子表面分子与分散环境的改变. 表面分子基团的变化会造成不同的非辐射跃迁[25,26], 同时, 聚合物亲水表面的吸附水也会对发射谱带产生一定的影响[27,28].
2.4 NaYF4-PMAO纳米粒子检测蛋白的荧光显微成像
对亲核素功能化的NaYF4-PMAO纳米粒子的特异性识别能力进行了研究. 图6(A)中的荧光来自于NaYF4-PMAO纳米粒子的上转换发光, 表明亲核素化的纳米粒子已经与在硅片表面固定的生物素化羊抗人血清蛋白特异性结合; 而在未进行生物素处理的硅片上只观测到很少的荧光[图6(B)], 这些光点归因于纳米粒子与固定于硅片表面的蛋白少量的非特异性吸附. 实验结果表明所制备NaYF4-PMAO纳米粒子适合用于生物学检测.

Fig.6 Fluorescence image of avidin-coated NaYF4-PMAO and biotinylated IgG bioconjugates(A) and the result of control experiment(B)
3 结 论
本文以十八碳烯-马来酸酐共聚物(PMAO)为表面包覆分子, 发展了一种以纳米粒子吸附表面活性剂作为中间体的均一液相聚合物包覆纳米粒子方法. 借助于表面活性剂两端的亲、 疏水特性, 使得疏水纳米粒子能够与油、 水双亲性聚合物分子均匀分散于乙醇溶剂中, 实现了双亲性聚合物对油溶性纳米粒子的表面包覆修饰. 获得的NaYF4-PMAO纳米粒子展示了良好的水溶性与单分散性, 保持了较好的上转换发光性能. 通过荧光显微成像技术对聚合物包覆的纳米粒子进行了特异性生物识别检测研究, 表明获得的NaYF4-PMAO纳米粒子适合用于生物学检测.
[1] Deng M., Tu N., Bai F., Wang L., Chem. Mater., 2012, 24, 2592—2597
[2] Zhang Q. B., Wang X., Zhu Y. M., J. Mater. Chem., 2011, 21, 12132—12138
[3] Yang Y., Zhao Q., Feng W., Li F., Chem. Rev., 2013, 113, 192—270
[4] Jothirmayanantham P., John C. B., Kerry R. D., van Veggd F. C. J. M., J. Phys. Chem. C, 2011, 115, 19054—19064
[5] Tang Y., Di W., Zhai X., Yang R., Qin W., ACS Catal., 2013, 3, 405—412
[6] Xie L. G., Qin Y., Chen H. Y., Anal. Chem., 2013, 85, 2617—2622
[7] Ju Q., Tu D. T., Liu Y. S., Li R. F., Zhu H. M., Chen J. C., Chen Z., Huang M. D., Chen X. Y., J. Am. Chem. Soc., 2012, 134, 1323—1330
[8] Jiang S., Zhang Y., Langmuir, 2010, 26(9), 6689—6694
[9] Li L. L., Wu P., Hwang K., Lu Y., J. Am. Chem. Soc., 2013, 135, 2411—2414
[10] Wang F., Liu X., J. Am. Chem. Soc., 2008, 130, 5642—5643
[11] Li Z., Zhang Y., Jiang S., Adv. Mater., 2008, 20, 1—5
[12] Wang G., Peng Q., Li Y., J. Am. Chem. Soc., 2009, 131, 14200—14201
[13] Pellegrino T., Manna L., Kudera S., Nano Lett., 2004, 4, 703—707
[14] Gao X., Cui Y., Levenson R. M., Nat. Biotechnol., 2004, 22, 969—976
[15] Yu W. W., Chang E., Falkner J. C., J. Am. Chem. Soc., 2007, 129, 2871—2879
[16] Wang L., Li Y., Chem. Mater., 2007, 19, 727—734
[17] Selvan S. T., Tan T. T., Ying J. Y., Adv. Mater., 2005, 17, 1620—1625
[18] Zhelev Z., Ohba H., Bakalova R., J. Am. Chem. Soc., 2006, 128, 6324—6525
[19] Liu W., Choi H. S., Zimmer J. P., J. Am. Chem. Soc., 2007, 129, 14530—14531
[20] Zhang Q. B., Kong X. G., Wang X., Cheng C., Chem. J. Chinese Universities, 2014, 35(2), 224—229(张庆彬, 孔祥贵, 王新, 程成. 高等学校化学学报, 2014, 35(2), 224—229)
[21] Mattoussi H., Mauro J. M., Goldman E. R., J. Am. Chem. Soc., 2000, 122, 12142—12150
[22] Jiang W., Mardyani S., Fischer H., Chem. Mater., 2006, 18, 872—878
[23] Dong W., Cheng Y., Luo L., RSC Adv., 2014, 4, 45939—45945
[24] Qian H., Zhang Y., Langmuir, 2008, 24, 12123—12125
[25] Sun Y., Chen Y., Tian L., Nanotechnology, 2007, 18, 275609
[26] Zhao J., Sun Y., Kong X., J. Phys. Chem. B, 2008, 112, 15666—15672
[27] Bai X., Song H., Pan G., J. Phys. Chem. C, 2007, 111, 13611—13617
[28] Zhang F., Wan Y., Shi Y., Tu B., Chem. Mater., 2008, 20, 3778—3784
(Ed.: F, K, M)
† Supported by the National Natural Science Foundation of China(No.21305126) and the Natural Science Foundation of Zhejiang University of Technology, China(No.2102X2003).
Surface Coating of Hydrophobic Up-converting Nanoparticles in Homogenous Liquid Phase System and Application in Optical Detection†
ZHANG Qingbin1*, KONG Xianggui2, CHENG Cheng1
(1. Department of Applied Physics, College of Science, Zhejiang University of Technology, Hangzhou 310023, China 2. Key Laboratory of Excited State Process, Changchun Institute of Optics, Fine Mechanics and Physics Chinese Academy of Sciences, Changchun 130033, China)
NaYF4∶Yb3+,Er3+nanoparticles were successfully surface-coated via a hydrophobic nanoparticles adsorption surfactant intermediate(NaYF4-SDS)process with hydrolysed poly(maleic anhydride-alt-1-octadecene) molecules(PMAO). This method overcomes the defect that oil-soluble nanocrystals and weak polar polymer molecules could hardly well-disperse in a single system and the surface-coating was realized in homo-genous solution system. The surface-coating process was confirmed by Fourier transform infrared spectra(FTIR) and surface Zeta potential. Investigations by transmission electron microscopy(TEM) and photoluminescence(PL) spectroscopy showed no obvious variations in the morphologies and luminescent properties of the nanoparticles during the surface-coating process. The specific molecular recognition capacity of PMAO-coated nanoparticles confirms that hydrophilic NaYF4-PMAO are suitable for potential biological labeling.
Nanoparticles; Up-conversion luminescence; Polymers surface coating; Biological application
10.7503/cjcu20150944
2015-12-10.
日期: 2016-02-03.
国家自然科学基金(批准号: 21305126)和浙江工业大学自然科学基金(批准号: 2012XZ003)资助.
O614
A
联系人简介: 张庆彬, 男, 博士, 副教授, 主要从事纳米光电材料制备与光学检测研究. E-mail: qbzhang@zjut.edu.cn
