超声辅助结合离子液体双水相提取-高效液相色谱法测定三七中5种稀有人参皂苷的含量
2016-12-02李兰杰李绪文王晓中金永日
李兰杰, 李绪文, 丁 健, 刘 迎, 吴 谦, 王晓中, 李 敏, 金永日
(1. 吉林大学化学学院, 长春 130012; 2. 吉林大学第四医院, 长春 130013)
超声辅助结合离子液体双水相提取-高效液相色谱法测定三七中5种稀有人参皂苷的含量
李兰杰1, 李绪文1, 丁 健2, 刘 迎1, 吴 谦1, 王晓中1, 李 敏1, 金永日1
(1. 吉林大学化学学院, 长春 130012; 2. 吉林大学第四医院, 长春 130013)
建立了超声辅助结合离子液体双水相提取-高效液相色谱法测定三七中5种稀有人参皂苷20(S)-Rg2, 20(S)-Rh1, Rk3, 20(S)-Rg3及Rk1含量的方法. 考察了影响提取率的多种因素并确立了最佳提取条件, 在该条件下, 5种稀有人参皂苷加样回收率均在92.07%~110.55%之间, RSD值均<5.43%. 实验结果表明, 该方法具有快速、 高效、 准确且环保等优点, 为中药材及其制剂中微量化学成分的提取、 富集与分析提供了参考.
离子液体; 超声辅助提取; 三七; 稀有人参皂苷
三七为五加科植物三七[Panax notoginseng (Burk.) F. H. Chen] 的干燥根和根茎, 具有散瘀止血、 消肿定痛等功效, 可用于治疗咯血、 吐血、 衄血、 便血、 崩漏、 外伤出血和跌扑肿痛等症[1]. 皂苷类化学成分是三七药材中的主要有效成分. 迄今, 研究人员已从三七的不同部位分离并鉴定了 60余种皂苷类成分[2]. 这些皂苷类成分大多数为达玛烷型人参皂苷, 主要有20(S)-原人参二醇型和20(S)-原人参三醇型. 此外, 三七中还含有与人参皂苷不同的独特成分, 如三七皂苷R1, R2, R3, R4, R6, Fa, Fc和Fe等. 其中人参皂苷Rb1, Rb2, Rb3, Rc, Rd, Re和Rg1等在人参属植物中含量较高, 因此称为常见人参皂苷; 而一些人参皂苷如Rg2, Rh1, Rg3, Rg6, F4, Rk3, Rg5和Rk1等在人参属植物中含量很低, 因此称为稀有人参皂苷.
三七中皂苷类成分具有多种生物活性[3,4], 因此如何有效地从三七中提取、 检测皂苷类化学成分对三七药材的质量控制及其新的医药应用具有重要意义. 日前, 关于三七中常见人参皂苷和三七皂苷的提取和检测的报道较多[5,6]. 因为稀有人参皂苷含量微少且高温易导致其结构变化, 迄今尚未见三七药材中稀有人参皂苷含量测定的报道. 研究表明, 稀有人参皂苷比常见人参皂苷具有更强的清除自由基[7~10]、 抗氧化以及抗癌活性[11~13].
本实验前期考察了传统的提取分离方法, 如回流法、 溶剂浸提法及渗滤法等提取与富集三七中稀有人参皂苷的效果, 发现这些方法存在目标提取物回收率小、 富集倍数低和成本高的问题, 且易导致稀有人参皂苷化学结构发生改变. 因此, 有必要寻找提取率和富集倍数高并能防止在提取过程中稀有人参皂苷化学结构发生变化的新提取方法. 近年来, 已有采用离子液体双水相提取技术提取天然产物中含量较高活性成分的报道[14~17], 结果证明其具有再现性好、 操作简单、 溶剂量少、 提取条件温和和耗能低等优点.
本文采用超声辅助结合离子液体双水相提取技术作为样品处理手段, 并采用高效液相色谱法测定了三七药材中5种稀有人参皂苷20(S)-Rg2, 20(S)-Rh1, Rk3, 20(S)-Rg3及Rk1的含量, 通过考察影响提取率的主要因素, 确立了最佳提取条件, 为三七乃至其它中药材中微量活性成分的分析提供了新思路.
1 实验部分
1.1 试剂与仪器
5种稀有人参皂苷20(S)-Rg2, 20(S)-Rh1, Rk3, 20(S)-Rg3和Rk1为本实验室自制, 利用1H NMR与13C NMR确认其化学结构, 经高效液相色谱法检测其纯度均高于98%, 结构见图1. 实验用3份三七样品购自河北安国药材市场, 经吉林大学药学院张静敏教授鉴定其中2份为三七干燥根茎, 1份为三七筋条, 分别标记为GJ-1, GJ-2和JT-1; 溴化1-丁基-3-甲基离子液体([Bmim]Br, 上海成捷化学有限公司); 磷酸氢二钾(分析纯, 西陇化工股份有限公司); 磷酸(分析纯, 北京化工厂); 吐温-20(天津市光复精细化工研究所); 乙腈(色谱纯, Sigma-Aldrich 公司); 实验用水为超纯水.
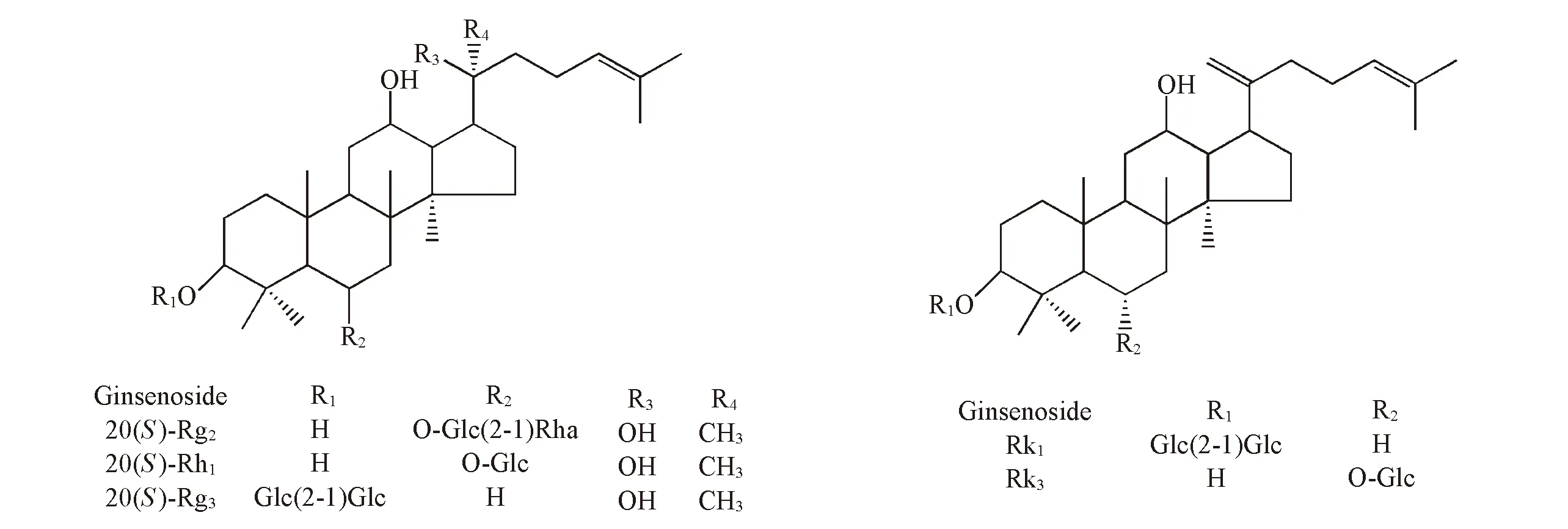
Fig.1 Chemical structures of rare ginsenosides 20(S)-Rg2, 20(S)-Rh1, 20(S)-Rg3, Rk1 and Rk3
昆山KQ-250型超声波清洗器(昆山市超声仪器有限公司); 飞鸽TDL80-2B和TGL-16G型台式离心机(上海安亭科学仪器厂); HYQ-2121A型涡旋混匀器(上海睿玥实验器材有限公司); Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm, 5μm)和Aglient 1200型高效液相色谱仪(HPLC), 配有DAD紫外检测器(美国安捷伦公司).
1.2 实验方法
称取0.6 g三七粉末于10 mL离心管中, 加入5.0 mL水、 1.0 mL [Bmim]Br离子液体(准确称取11.92 g用水定容至25.00 mL)和0.1 mL吐温-20, 涡旋混匀, 室温下超声20 min, 抽滤至10 mL离心管中, 加入7.0 g K2HPO4, 涡旋震荡溶解, 在4000 r/min 转速下离心5 min, 用微量注射器取20 μL上层离子液体, 注入高效液相色谱仪进行测定, 平行测定3次.
高效液相色谱条件: 流动相为乙腈(A)和0.1%磷酸水溶液(B); 梯度条件: 0~10 min, 29% A, 10~25 min, 29%~40% A, 25~50 min, 40%~60% A, 50~60 min, 60%~75% A; 柱温30 ℃, 流速0.8 mL/min, 检测波长203 nm. 样品及标准品的色谱图见图2.
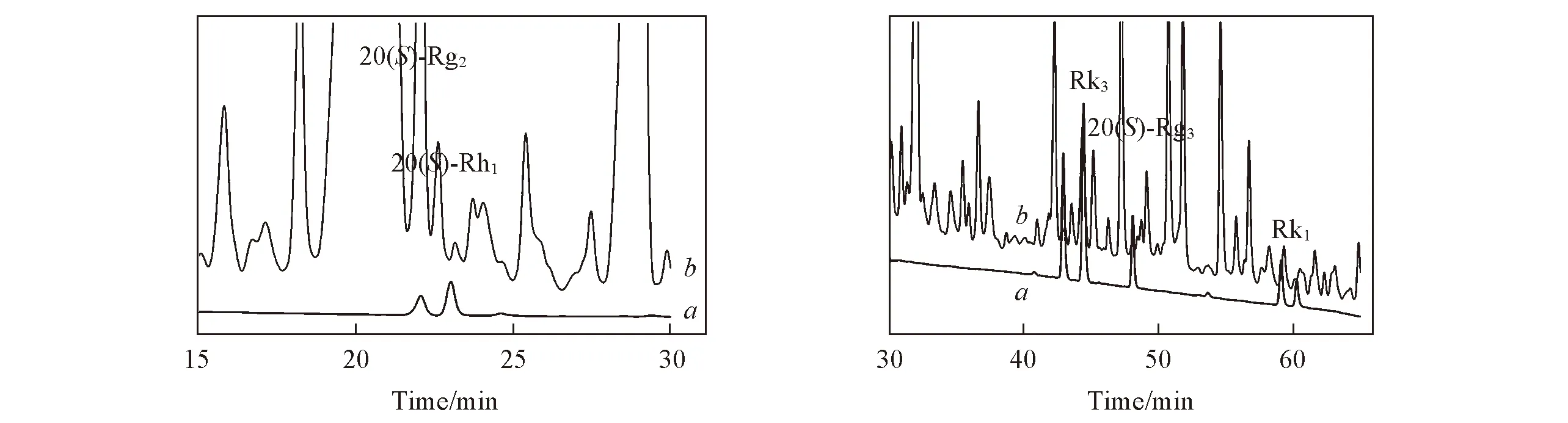
Fig.2 Chromatograms of standards(a) and rhizome of Sanqi(GJ-1)(b)
2 结果与讨论
2.1 双水相体系的选择
首先考察了多种离子液体([Bmim]BF4, [Hmim]BF4, [Omim]BF4, [Bmim]Br和[Hmim]Br)及无机盐[K2HPO4, Na2HPO4, K3PO4, KCl, (NH4)2SO4和NaCl]的双水相提取组合. 结果表明, [Bmim]BF4-(NH4)2SO4, [Bmim]Br-K2HPO4和[Hmim]Br-K2HPO4等体系可以形成双水相, 但是[Hmim]Br-K2HPO4体系的离子液体相中无稀有人参皂苷, 而[Bmim]BF4-(NH4)2SO4体系由于(NH4)2SO4加入量过大造成pH值过低, 导致稀有皂苷结构发生变化, 故实验选择[Bmim]Br-K2HPO4离子液体双水相体系.
2.2 影响因素的考察
实验考察了脱脂溶剂、 K2HPO4加入量、 料液比、 吐温-20加入量、 超声提取时间、 提取温度及离心时间等因素对提取效率的影响.
2.2.1 脱脂溶剂的影响 三七药材中脂类成分的存在会影响离子液体提取效率并容易造成色谱柱污染, 因此在离子液体提取前应对三七粉末进行脱脂处理. 实验以20(S)-Rg2和20(S)-Rh1提取率的高低作为依据, 考察了氯仿、 石油醚、 正己烷和环己烷4种脱脂溶剂的效果, 结果如图 3所示. 可见, 使用氯仿作为脱脂溶剂时可明显降低20(S)-Rh1的提取率; 使用正己烷和环己烷作为脱脂溶剂时2种目标物提取率均略有下降; 使用石油醚作为脱脂溶剂时2种目标物提取率均达最高, 故选择石油醚作为脱脂溶剂.

Fig.3 Effects of different degreasants on the extraction efficiencyConditions: 1.00 mL ionic liquid, 5.0 mL water, 7.00 g K2HPO4, 0.60 g Sanqi, ultrasonic time was 20 min. Error bars represent SDs.

Fig.4 Effects of different amounts of K2HPO4 on the extraction efficiencyConditions: 1.00 mL ionic liquid, 5.0 mL water. Error bars represent SDs.
2.2.2 K2HPO4加入量的影响 在提取体系中加入K2HPO4直接影响离子液体双水相比例, 其加入量对萃取效率影响很大. 实验固定离子液体体积为1.0 mL, 水相体积为5.0 mL, 考察K2HPO4加入量为1.0~7.5 g时上层离子液体相的体积, 结果见图4. 可见, K2HPO4加入量低于2.0 g时, 未形成双水相体系; 当K2HPO4加入量在2.0~6.5 g范围内时, 双水相体系形成且上层离子液体相的体积逐渐增加; 当K2HPO4加入量大于6.5 g时, 上层离子液体相的体积基本保持不变, 故选择K2HPO4加入量为7.0 g.
2.2.3 料液比的影响 料液比(m/V, g/mL)是指三七粉末的质量与离子液体的体积之比. 料液比的大小影响提取效率和富集倍数, 料液比过大, 目标皂苷提取不完全; 料液比过小, 富集倍数降低. 实验固定离子液体体积为1.0 mL, 考察了三七粉末质量为0.1~1.0 g时人参皂苷20(S)-Rg2和20(S)-Rh1的提取效率, 结果见图 5. 可见, 当三七粉末质量为0.1~0.6 g时, 人参皂苷20(S)-Rg2和20(S)-Rh1的峰面积呈线性增长, 此时目标皂苷提取完全; 当三七粉末质量为0.6~0.8 g时, 人参皂苷20(S)-Rg2和20(S)-Rh1峰面积的增长趋势减缓; 当三七粉末质量大于0.8 g时, 人参皂苷20(S)-Rg2和20(S)-Rh1的峰面积反而呈明显下降趋势, 表明料液比过大时, 目标皂苷提取不完全; 当料液比为0.6/1.0时富集倍数最高, 故选择0.6/1.0作为最佳料液比.

Fig.5 Effects of different amounts of Sanqi on the extraction efficiencies of 20(S)-Rg2(a) and 20(S)-Rh1(b)The degreasant was petroleum ether. Conditions: 1.00 mL ionic liquid, 5.0 mL water, 7.00 g K2HPO4, ultrasonic time was 20 min. Each data point represents two analytes.
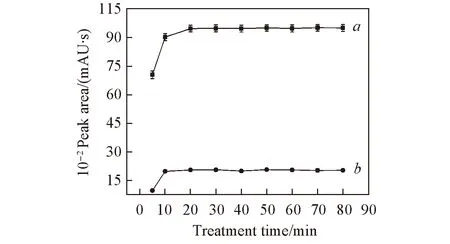
Fig.6 Effects of the ultrasonic treatment time on the extraction efficiencies of 20(S)-Rg2(a) and 20(S)-Rh1(b)The degreasant was petroleum ether. Conditions: 1.00 mL ionic liquid. 5.0 mL water, 7.00 g K2HPO4, 0.60 g Sanqi. Each data point represents two analytes. Error bars represent SDs.
2.2.4 吐温-20加入量的影响 吐温-20是一种非离子表面活性剂, 它的加入能够消除离子液体双水相形成过程中出现的乳化现象. 实验在0.01~0.2 mL范围内对吐温-20的加入量进行了考察. 结果表明, 当吐温-20加入量为0.1 mL时, 双水相体系界面乳化层消失并保持清晰稳定. 故选择0.1 mL作为吐温-20的最佳加入量.
2.2.5 超声提取时间的影响 超声提取时间能影响提取目标物在细胞内外的动态平衡, 时间过短会降低提取效率. 实验考察了80 min内超声提取时间对人参皂苷20(S)-Rg2和20(S)-Rh1提取率的影响, 结果见图 6. 可见, 在20 min内超声辅助可提高稀有人参皂苷20(S)-Rg2和20(S)-Rh1的提取率, 之后无明显影响. 这是由于在20 min内随着提取时间的延长, 细胞内的人参皂苷在超声作用下大量溶出和扩散, 所以提取率显著提高; 当提取时间大于20 min 时, 由于细胞内外有效成分含量已达到动态平衡, 浓度差推动力几乎为0, 所以提取率趋于平缓. 故选择20 min作为最佳超声提取时间.
2.2.6 提取温度的影响 由于高温下稀有人参皂苷20(S)-Rg2, 20(S)-Rh1, Rk3, 20(S)-Rg3和Rk1等化学结构容易发生改变[18], 会影响实验结果的准确性, 所以提取温度选择为室温25 ℃.
2.2.7 离心时间的影响 为获得一个清晰的双水相体系界面, 在2~10 min范围内对离心时间进行了考察. 结果表明, 离心时间超过5 min时可形成清晰稳定的双水相体系界面. 故选择5 min作为最佳离心时间.
2.3 方法学考察
考察了该方法的线性关系、 日内精密度、 日间精密度、 检出限(S/N=3)和定量限(S/N=10), 实验结果见表 1.
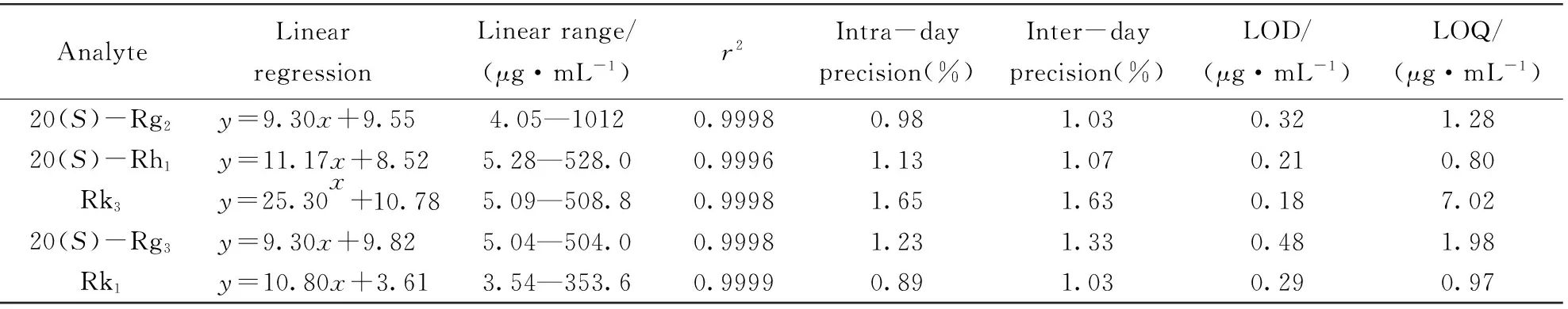
Table 1 Regression equations, LODs, LOQs, intra-day and inter-day precision
2.4 加标回收率
准确称取0.6 g三七粉末于10 mL离心管中, 加入5.0 mL水、 1.0 mL [Bmim]Br离子液体(准确称取11.92 g用水定容至25.00 mL)和0.1 mL吐温-20, 涡旋混匀, 在混合液中加入一定浓度的混合标准溶液, 按照实验方法处理后注入高效液相色谱仪测定, 平行测定6次, 考察方法的加标回收率, 结果列于表2. 结果表明, 5种稀有人参皂苷的加标回收率在92.07%~110.55%之间, RSD值均小于5.43%, 表明本方法的回收率良好, 测定结果准确.

Table 2 Recoveries of the analytes(N=6)
2.5 三七药材中5种稀有人参皂苷含量的测定
测定了3份市售三七药材中5种稀有人参皂苷的含量, 实验结果列于表3. 结果表明, 3份三七药材中5种稀有人参皂苷的含量差别不大.
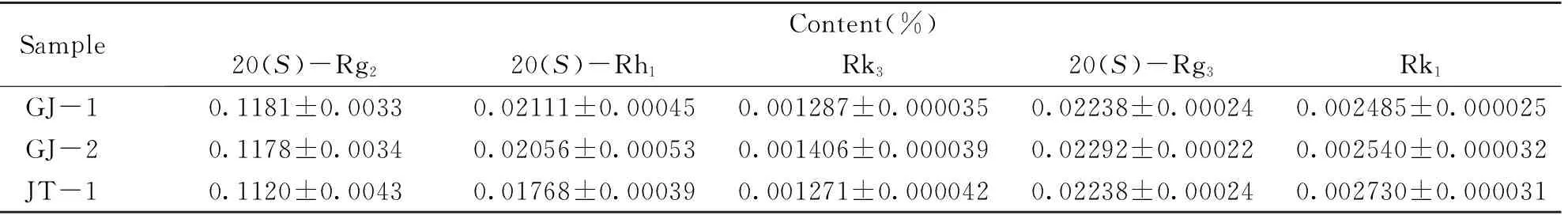
Table 3 Contents(%) of the rare ginsenosides in Sanqi(N=6)
3 结 论
采用超声辅助结合离子液体双水相提取-高效液相色谱法测定了三七中5种稀有人参皂苷含量, 该方法具有快速、 高效、 准确且环保等优点, 为三七药材质量控制提供了新方法, 也为超声辅助结合离子液体双水相提取应用于其它药材中微量化学成分的分析提供了新思路.
[1] National Pharmacopoeia Committee., Pharmacopoeia of the People’s Republic of China, Part 2, 2010, 11—12(国家药典委员会. 中华人民共和国药典, 二部, 中国医药科技出版社, 2010, 11—12)
[2] Bao J. C., Liu G., Cong D. L., Zhang C. X., Chin. Trad. Pat. Med., 2006, 28(2), 246—253(鲍建才, 刘刚, 丛登立, 张崇禧. 中成药, 2006, 28(2), 246—253)
[3] Liu H. Z., Pang J., Wang Z. L., Acta Pharm. Sin., 1982, 17(11), 801(刘贺之, 庞健, 王增龄. 药学学报, 1982, 17(11), 801)
[4] Shi L., Fan P. S., Wu L., Acta Pharm. Sin., 1990, 11(1), 29(石琳, 范盘生, 吴玲. 中国药理学报, 1990, 11(1), 29)
[5] Zhang H. J., Cheng Y. Y., J. Pharmaceut. Biomed., 2006, 40(2), 429—432
[6] Guan J., Lai C. M., Li S. P., J. Pharmaceut. Biomed., 2007, 44(4), 996—1000
[7] Kang K. S., Kim H. Y., Yamabe N., Yokozawa T., Bioorg. Med. Chem. Lett., 2006, 16(19), 5028—5031
[8] Wang Y., Jiang Y., Wang B. X., Qiu Q. Y., Acta Pharm. Sin., 2002, 37(12), 927—929(王毅, 蒋艳, 王本祥, 邱全瑛. 药学学报, 2002, 37(12), 927—929)
[9] Kang S. K., Yokozawa T., Yamabe N., Kim Y. H., Park Y. H., Biol. Pharm. Bull., 2007, 30(5), 917—921
[10] HwangI. G., Kim H. Y., Joung E. M., Woo K. S., Jeong J. H., Yu K. W., Lee J., Jeong H. S., Food. Sci. Biotechnol., 2010, 19(4), 941—949
[11] Tian J. W., Fu F. H., Geng M. Y., Neurosci. Lett., 2005, 374(2), 92—97
[12] Kim H. S., Lee E. H., Ko S. R., Arch. Pharm. Res., 2004, 27(4), 429—435
[13] Kim Y. J., Kwon H. C., Ko H., Biol. Pharm. Bull., 2008, 31(5), 826—830
[14] Wang Y., Song H., Jia C. M., The 2012 Congress of Chinese Medicine, 2012(汪雁, 宋航, 贾春梅. 2012年中国药学大会暨第十二届中国药师周论文集, 2012)
[15] Feng X. D., Liang F. H., Su R., Wu L. J., Li X. Y., Wang X. H., Zhang H. Q., Yu A. M., Chem. Res. Chinese Universities, 2013, 29(4), 647—652
[16] Wu K. K., Zhang Q. L., Liu Q., Tang F., Long Y. M., J. Sep. Sci., 2009, 32(24), 4220—4226
[17] Cao X. J., Ye X. M., Lu Y. B., Yu Y., Mo W. M., Anal. Chim. Acta, 2009, 640(1/2), 47—51
[18] Yao H., Jin Y. R., Yang J., Li L. J., Sun T., Shi X. L., Li X. W., Chem. J. Chinese Universities, 2014, 35(11), 2317—2323(姚华, 金永日, 杨洁, 李兰杰, 孙婷, 时晓磊, 李绪文. 高等学校化学学报, 2014, 35(11), 2317—2323)
(Ed.: N, K)
† Supported by the Jilin Provincial Scientific and Technological Development Program, China(No.20140203005YY).
Ionic Liquid Surfactant-mediated Ultrasonic-assisted Extraction Coupled with HPLC for the Determination of Five Rare Ginsenosides in Panax notoginseng (Burk.) F. H. Chen†
LI Lanjie1, LI Xuwen1, DING Jian2, LIU Ying1, WU Qian1, WANG Xiaozhong1,LI Min1, JIN Yongri1*
(1. College of Chemistry, Jilin University, Changchun 130012, China; 2.The Fourth Hospital of Jilin University, Changchun 130013, China)
A method of ultrasonic-assisted ionic liquid-salt aqueous two-phase extraction coupled with high-performance liquid chromatography(HPLC) was developed for the determination of the contents of five rare ginsenosides[20(S)-Rg2, 20(S)-Rh1, Rk3, 20(S)-Rg3and Rk1] in Panax notoginseng(Burk.) F.H.Chen(Sanqi). The factors influencing the ultrasonic-assisted extraction were investigated in detail. Under the optimized conditions, satisfactory extraction efficiency was achieved with the recoveries ranging from 92.07% to 110.55%, and the RSDs were lower than 5.43%. The results showed that the method had the advantages of fast, efficient, accurate and environmental protection. It provided a strong basis for the extraction, enrichment and analysis of the trace bio-active chemical composition of the traditional Chinese medicine and its preparations.
Ionic liquid; Ultrasonic-assisted extraction; Panax notoginseng(Burk.) F.H.Chen; Rare ginsenoside
10.7503/cjcu20150703
2015-09-09.
日期: 2016-01-24.
吉林省科技发展计划项目(批准号: 20140203005YY)资助.
O657.7
A
联系人简介: 金永日, 男, 博士, 教授, 博士生导师, 主要从事药物分析研究. E-mail: jinyr@jlu.edu.cn
