PLK1抑制剂对骨肉瘤细胞增殖的影响及其机制研究
2016-12-02黄崇新吕波王跃庞健郝鹏刘萍
黄崇新 吕波 王跃 庞健 郝鹏 刘萍
·实验研究论著·
PLK1抑制剂对骨肉瘤细胞增殖的影响及其机制研究
黄崇新 吕波 王跃 庞健 郝鹏 刘萍
目的 探讨Polo样激酶1(polo⁃like kinase 1,PLK1)的小分子抑制剂NMS⁃P937对骨肉瘤细胞增殖的影响及其作用机制,并分析PLK1蛋白水平与临床骨肉瘤患者预后的关系。方法 本研究采用HOS、Saos⁃2骨肉瘤细胞系以及人成骨细胞系HOB⁃C作为实验细胞,通过Western Blot和荧光定量PCR检测PLK1在不同细胞系中蛋白和mRNA的表达水平;分别用不同浓度(0.01、0.05、0.1、0.2、0.5μmol/L)的NMS⁃P937干预骨肉瘤细胞,采用MTT比色法检测细胞增殖情况,流式细胞术检测不同浓度NMS⁃P937对骨肉瘤细胞系细胞周期的调控作用;免疫共沉淀技术检测PLK1蛋白与p53蛋白的相互作用情况;通过对骨肉瘤患者的组织芯片分析及随访,分析PLK1蛋白表达水平与临床预后的关系。结果 研究结果表明与人成骨细胞系HOB⁃C细胞相比,HOS、Saos⁃2骨肉瘤细胞系中PLK1蛋白和mRNA表达水平更高;NMS⁃P937可有效抑制骨肉瘤细胞的增殖,且经过NMS⁃P937处理后,S、G2/M期的骨肉瘤细胞Saos⁃2显著升高,G0/G1期细胞显著降低;细胞免疫共沉淀结果表明PLK1与p53蛋白存在相互作用;生存分析显示PLK1的表达水平与患者生存率呈负相关。结论 PLK1抑制剂可抑制骨肉瘤细胞的增殖,这可能与PLK1通过调节p53蛋白参与细胞周期转换过程有关,此外,PLK1蛋白水平的高度表达与患者不良预后密切相关,提示PLK1蛋白可作为临床潜在治疗骨肉瘤患者的有效靶点。
骨肉瘤;Polo样激酶1;蛋白激酶抑制剂;p53;生存分析
骨肉瘤是一种好发于儿童和青少年的原发性恶性骨肿瘤,恶性程度高且进展迅速。传统治疗方法包括外科手术切除及辅助化疗,但易复发。目前人们在治疗骨肉瘤、改善患者生存率方面尚未取得长足的进歩。因此,探寻新的骨肉瘤治疗靶标显得尤为迫切与重要。
Polo样激酶1(polo⁃like kinase 1,PLK1)是定位于人类染色体16p12上的一种丝氨酸/苏氨酸蛋白激酶,是Polo样激酶家族的重要成员之一,于1994年由Golsteyn等[1]最先报道。PLK1参与细胞周期各检测点的活动,可以在M期促进细胞的增殖[2]。目前研究发现,PLK1在包括肉瘤在内的许多恶性肿瘤中表达增高[3,4],与多种恶性肿瘤的发生、发展预后关系密切[5];同时,针对PLK1的shRNA或siRNA可抑制肿瘤细胞生长并诱导细胞凋亡[6,7],这也在Horning等[8]对横纹肌肉瘤的研究中得到了验证。
本研究中,我们分析了PLK1蛋白在骨肉瘤细胞中的表达,通过应用小分子抑制剂NMS⁃P937抑制PLK1的表达,探讨了以下内容:①NMS⁃P937对骨肉瘤细胞增殖的影响;②NMS⁃P937对骨肉瘤细胞周期的调控;③NMS⁃P937调控骨肉瘤细胞周期的分子机制;④PLK1蛋白水平与临床骨肉瘤患者预后的关系。以期为临床使用NMS⁃P937等肿瘤抑制剂治疗癌症提供理论依据,阐明NMS⁃P937调控骨肉瘤细胞周期的分子机制,为骨肉瘤患者的预后情况提供潜在的临床指标。
材料与方法
一、临床样本的收集
36例受试骨肉瘤患者(发生于四肢的原发、低分化骨肉瘤,患者年龄<40岁)均得到病理诊断确诊,均签署知情同意书,该研究经四川省人民医院伦理委员会批准执行。
二、试剂及仪器
人骨肉瘤细胞系HOS、Saos⁃2及人成骨细胞系HOB⁃C(ATCC,美国),IMDM成骨细胞专用培养基(PromoCell,德国),胎牛血清、青霉素-链霉素溶液、胰蛋白酶-EDTA溶液、L-谷氨酰胺、PBS(Gibco,美国),PLK1小分子抑制剂NMS⁃P937(Selleck,美国),兔抗人单克隆PLK1抗体、鼠抗人GAPDH抗体(Cell Siganling Technologies,美国),总RNA提取试剂盒(Omega Bio⁃Tek,美国),逆转录试剂盒、荧光定量PCR试剂SYBR®(TaKaRa,日本),MTT细胞增殖检测试剂盒、支原体染色检测试剂盒(碧云天,中国),羊抗鼠和羊抗兔辣根过氧化物酶二抗,正常兔或鼠IgG抗体(Bio⁃Rad,美国);SuperSignalWestPico化学荧光底物(Pierce,美国),FuGENE转染试剂(Pro⁃mega,美国),PVDF膜、蛋白G琼脂糖(Sigma,美国)。
实时荧光定量PCR系统(ABI公司,美国),电泳仪、电转仪、PCR仪(Bio⁃rad公司,美国),流式细胞仪(BD公司,美国),倒置显微镜(Olympus公司,日本);二氧化碳培养箱、冷冻离心机、酶标仪、Nano⁃Drop分光光度计(Thermo公司,美国)。
三、细胞培养及分组
(一)细胞培养
骨肉瘤细胞株HOS、Saos⁃2培养于含10%胎牛血清的1640培养基中,成骨细胞HOB⁃C培养于含10%胎牛血清的IMDM培养基中。置于37℃,5% CO2以及适宜湿度的培养箱中培养。细胞贴壁生长,在细胞状态良好且长满80%~90%时根据需要按照1∶3~1∶5的比例传代。细胞系经检测确认无支原体污染。
(二)细胞分组
细胞分组主要根据NMS⁃P937的浓度,各组中NMS⁃P937的浓度分别为0.01、0.05、0.1、0.2、0.5 μmol/L。
四、三种细胞中PLK1的表达水平
培养上述细胞至生长对数期后,收集细胞提取总RNA和蛋白。
各取1μg RNA逆转录合成cDNA,每个处理采取三重复原则,进行实时荧光定量PCR反应,记录数据。
收集各组细胞后,4度裂解细胞30min,进行蛋白定量,余下蛋白液中加入loading buffer,于95℃水浴中10min。根据蛋白定量的结果上样,80 V电泳30min,120 V电泳至指示剂到分离胶底层,转为恒压100 V转膜90min。转膜结束后,5%的脱脂牛奶封闭1 h。根据蛋白marker的位置孵育一抗,4℃过夜。次日用PBST溶液洗PVDF膜3次,每次5min;孵育相应二抗,室温1 h,PBST洗PVDF膜3次,每次7min。混合发光液,与PVDF膜充分反应,压片适当时间后进行曝光。
五、NMS⁃P937对骨肉瘤细胞的作用
(一)对PLK1的抑制作用
收集不同浓度NMS⁃P937处理过的Saos⁃2细胞至EP管中,采用Western Blot分析PLK1的蛋白表达水平变化,方法同步骤四。依据曝光的片子进行蛋白灰度处理分析,并比较蛋白水平的差异。
(二)对骨肉瘤细胞增殖情况的影响
取生长状态良好且处于对数生长期的HOS和Saos⁃2细胞,用含10%胎牛血清的完全培养基将细胞制备成每毫升含2×104个细胞的悬液,每孔200 μl,接种于96孔细胞培养板内,培养24 h后,依次加入含不同浓度NMS⁃P937的培养基,用完全培养基作为空白对照。进一步培养24 h后,每孔加入MTT溶液(5mg/ml)20μl,继续孵育4 h后终止培养。弃掉孔内培养液上清,每孔加入150μl DMSO,振荡10min,使结晶物充分融解。在酶联免疫监测仪上570 nm测定吸光度A值,绘制不同浓度抑制剂处理后的细胞增殖曲线。
(三)对细胞周期的影响
取对数生长期的Saos⁃2细胞,按每毫升1×106个细胞的浓度分别接种于6孔细胞培养板中,实验组分别加入不同浓度的NMS⁃P937(终浓度分别为0.01、0.05、0.1、0.2、0.5μmol/L),对照组加入与NMS⁃P937等量的培养液。24 h后收集细胞,并用75%冰乙醇于-20℃固定,然后在含溴化乙啶(50mg/L)和RNase(10mg/L)的PBS缓冲液中室温避光孵育30min,用流式细胞仪检测细胞周期。用ModFit LT软件(Verity Software House,美国)分析G0/G1、S、G2/ M各期细胞所占百分比,重复实验3次。
六、PLK1与p53的免疫共沉淀分析
(一)质粒构建及转染
以pcDNA3为载体,来源于原代肝母细胞瘤的cDNA为模板,通过PCR扩增带FLAG标签的人pcD⁃NA3⁃FLAG⁃PLK1载体。上游引物序列为5'⁃CC⁃ GCTCGAGAGTGCTGCAGTGACTGCAGGGAAG⁃3',下游引物序列为5'⁃CTAGTCTAGATTAGGAG⁃GCCTTGAGACGGTTGCT⁃3'。构建成功的载体经测序验证无误后通过FuGENE转染试剂转染Saos⁃2细胞,收集用于后续的免疫共沉淀实验。
(二)免疫共沉淀
上述收集的Saos⁃2细胞用细胞裂解液进行充分裂解,4℃下以最大转速离心10min,留取适量蛋白液作为阳性对照,余下蛋白液依据细胞体积分为两等份,一部分加入抗体原液(p53或FLAG),另一部分加入正常兔或鼠IgG抗体,4℃摇床过夜孵育;次日,两部分中各加入蛋白G琼脂糖30μl,4℃摇床孵育2 h;离心收集琼脂糖珠,适量裂解缓冲液,4℃摇床洗3次,每次5min;在沉淀中加入30μl的loading buffer,95℃煮10min。而后进行Western Blot的实验,孵育一抗为待测稀释抗体(PLK1或p53)。
七、PLK1的表达水平与骨肉瘤患者临床预后的关系
采集临床骨肉瘤患者的骨肉瘤组织芯片信息,依据PLK1的表达水平,患者被分为高、中、低三组,分析PLK1表达水平与患者预后的关系。
八、统计学分析
采用SPSS 19.0统计学软件(SPSS公司,美国)分析,数据用均数±标准差(±s)表示,蛋白水平的两两比较采用独立样本t检验,细胞周期的比较采用单因素方差分析,其中的两两比较采用q检验。Kapla⁃Meier方法绘制生存曲线,PLK1高表达组和低表达组之间的比较采用log⁃rank检验。检验水准α值取双侧0.05。
结果
一、PLK1在骨肉瘤细胞系中高表达
无论是在mRNA水平还是蛋白水平,与正常人成骨细胞系(HOB⁃C)相比,PLK1在HOS、Saos⁃2细
胞中呈高表达状态(图1 a、b)。

图1 PLK1在骨肉瘤细胞系HOS和Saos⁃2中高表达
二、NMS⁃P937对PLK1的抑制作用
Western Blot结果显示PLK1的表达水平随着NMS⁃P937浓度升高逐渐降低(图2 a);蛋白灰度分析表明,除0.01μmol/L时,其余浓度的NMS⁃P937均可显著降低Saos⁃2细胞中PLK1的表达水平,且该抑制作用呈剂量依赖性(图2 b)。

图2 NMS⁃P937对PLK1的抑制作用(与NMS⁃P937浓度为0时相比,*P<0.05)
三、NMS⁃P937抑制骨肉瘤细胞的增殖
随着NMS⁃P937浓度的提升,HOS和Saos⁃2细胞的增殖受到抑制,抑制效果呈现剂量依赖性。NMS⁃P937抑制HOS和Saos⁃2细胞增殖的最低有效浓度均为0.1μmol/L;以最高浓度的NMS⁃P937处理72 h后,抑制效果消失,故其最长有效抑制时间为72 h(图3)。

图3 不同浓度NMS⁃P937对骨肉瘤细胞HOS与Saos⁃2增殖的影响
四、NMS⁃P937对骨肉瘤细胞周期的影响
流式细胞仪分析结果显示,NMS⁃P937作用Saos⁃2细胞后,G0/G1期细胞含量降低,S期与G2/M期细胞比例则明显增加,且随着处理浓度的增加,其G2/M期细胞含量逐渐增加。除0.01μmol/L组外,其余各组与对照组相比,差异均有统计学意义(均P<0.05,表1)。其中NMS⁃P937的最低有效浓度为0.05μmol/L。
五、p53蛋白和PLK1蛋白的相互作用
免疫共沉淀实验结果表明,PLK1与p53之间存在相互作用(图4)。当以p53抗体进行免疫沉淀实验,FLAG蛋白抗体为孵育一抗时,Western Blot结果显示,p53蛋白可与FLAG⁃PLK1蛋白相互作用(图4a);当以FLAG抗体进行免疫沉淀,孵育一抗为p53蛋白抗体时,Western Blot结果显示FLAG⁃PLK1蛋白与p53蛋白存在相互作用(图4 b)。
六、PLK1表达水平与骨肉瘤患者临床预后相关
通过骨肉瘤组织芯片信息分析PLK1蛋白表达水平与骨肉瘤患者临床预后之间的关系;依据PLK1的表达水平将36例患者分为低、中、高三组。在这36例患者的组织芯片中,其中14例(38.9%)的PLK1表达水平为低,10例(27.8%)的PLK1表达水平为中,12例(33.3%)的PLK1表达水平为高。Kaplan⁃Meier分析表明PLKl表达水平低的患者生存率明显高于较PLK1表达水平高的患者(P=0.03,图5)。
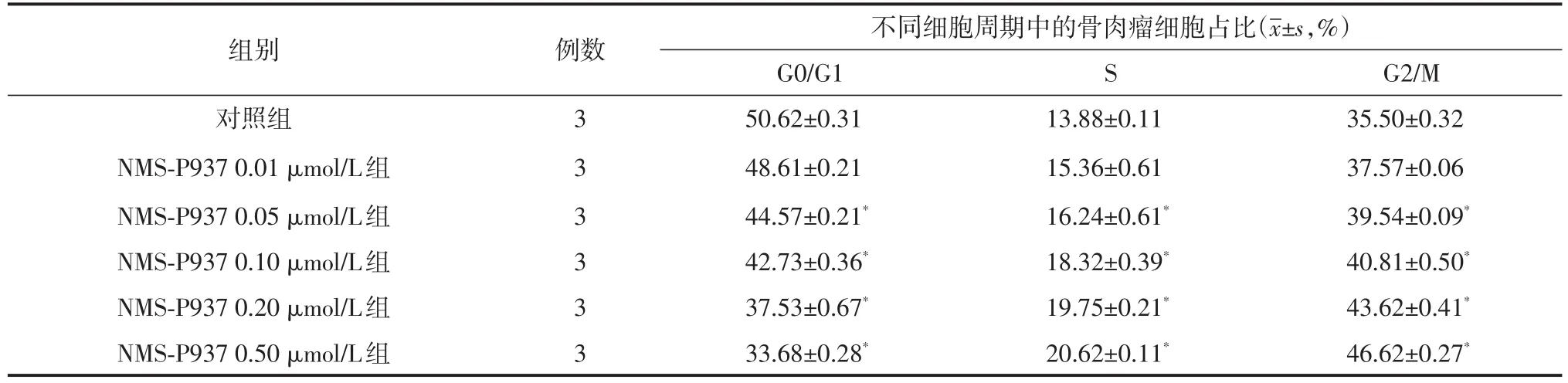
表1 不同浓度NMS⁃P937干预Saos⁃2细胞24 h后对细胞周期的影响

图4 PLK1与p53在细胞内的相互作用

图5 PLK1表达高低与骨肉瘤患者临床生存率相关性
讨论
人类激酶组由至少600种不同的蛋白激酶组成,其中许多激酶如PI3K、AKT和mTOR等在不同肉瘤组织中持续高表达,且蛋白水平随着肿瘤的进展而升高[9⁃11]。蛋白激酶通过磷酸化激活蛋白,抑制这些蛋白激酶表达则可以抑制肿瘤细胞的生长和增殖[12],将上述蛋白激酶作为治疗靶点可能开辟治疗各种肉瘤的新方法。
PLK1是蛋白激酶家族中的一员,结构上高度保守,N末端含有一个激酶结构域,C末端具有保守的Polo⁃box domain,PLK1蛋白在肿瘤组织中高度表达,表达水平与肿瘤进展、预后等密切相关[13],现如今针对PLK1蛋白的蛋白酶抑制剂广泛应用于肿瘤治疗或基础实验[14]。NMS⁃P937是一种新型的PLK1蛋白抑制剂,它具有药效良好、服用简易等优势,已在多个临床前实验模型中证实其对肿瘤的抑制作用[15]。
在本研究中,我们使用了两种骨肉瘤细胞系(HOS与Saos⁃2),无论在蛋白还是mRNA水平上,其中PLK1的表达均高于人成骨细胞系(HOB⁃C)。这一结果提示PLK1蛋白水平的高表达可能与肿瘤细胞的生长或侵袭等相关;在对骨肉瘤细胞应用NMS⁃P937抑制剂后,通过Western Blot和荧光定量PCR实验,我们发现PLK1蛋白和基因水平均出现了降低,抑制效果良好,提示NMS⁃P937可能通过抑制PLK1基因的表达水平进而抑制蛋白的表达。
同时我们发现NMS⁃P937对骨肉瘤细胞的细胞增殖及周期也有一定的影响。实验结果显示,经过不同浓度抑制剂处理后,骨肉瘤细胞的增殖受到了抑制,细胞周期停滞在G2/M期,提示我们骨肉瘤细胞的增殖抑制可能是由于PLK1蛋白调控骨肉瘤细胞周期,进而抑制细胞增殖。Sero等[16]的研究报道证实,PLK1与中心体复制、纺锤体形成、染色体分离以及细胞质分裂等一系列细胞有丝分裂事件联系密切,猜测PLK1蛋白参与细胞周期调控,而我们的研究结果在骨肉瘤细胞中与之相对应。
p53作为一种重要的肿瘤抑制基因,在绝大多数肿瘤中高度表达,人类肿瘤中有50%以上都是由p53基因的缺失造成的[17,18],而相关文献报道PLK1可抑制p53的活性[19],在PLK1与p53的相互作用中,两者各以一段特殊的DNA序列作为结合区。因此,笔者进行了免疫共沉淀实验,验证二者之间的相互作用关系,免疫共沉淀结果显示,PLK1蛋白和p53蛋白存在相互作用,提示p53可能是PLK1的一个直接作用靶点,笔者猜测PLK1可能通过磷酸化p53抑制其一部分的生物活性,进而抑制p53发挥检验点蛋白和诱导细胞凋亡的功能,从而导致肿瘤细
胞的异常增殖和癌症发生,然而,其中的具体机制有待进一步的探索。
最后,通过绘制不同PLK1蛋白表达水平的临床骨肉瘤患者生存曲线,笔者发现PLKl蛋白表达水平与患者5年生存率呈负相关(P=0.03,图4),进一步提示PLK1蛋白水平的高表达可能与骨肉瘤的发生发展有着密切的关系,这与已报道的PLK1在小细胞肺癌患者中的表型是一致的[20],然而,PLK1蛋白水平的高度表达是否是骨肉瘤或肺癌细胞中所特有的特征还有待确定。
然而,此次研究中仍有不足。PLK1蛋白与p53蛋白相互作用验证一部分为FLAG⁃PLK1外源性蛋白水平上的验证,二者在内源性蛋白的相互作用未曾探讨,此外,二者作用的方式是直接还是间接的模式也未有验证;其次,在PLK1蛋白水平表达发生变化后,未对p53磷酸化和总的蛋白水平进行验证,尚不能阐明PLK1蛋白对p53蛋白的调控具体机制;最后,笔者收集的进行临床样本数目不足,仅探讨了骨肉瘤患者生存率与PLK1蛋白水平的表达,未对肿瘤分型或者PLK1蛋白在不同肿瘤患者中分析等进行探索,临床数据不够充分。
综上所述,我们的研究结果表明PLK1蛋白可能通过抑制p53蛋白的活性,从而调控骨肉瘤细胞的周期,进而抑制瘤细胞的增殖,而研究所用的NMS⁃P937小分子抑制剂显著抑制了PLK1蛋白水平的表达和骨肉瘤细胞的增殖,提示PLK1蛋白可作为骨肉瘤治疗的潜在靶标进行开发,而其小分子抑制剂将来亦可在人类肿瘤尤其是骨肉瘤临床试验性治疗中的得到检验;此外,临床骨肉瘤患者预后良好可能与PLK1蛋白水平的低表达相关,也未临床预测骨肉瘤患者预后提供一个潜在的方向。
[1]Golsteyn RM,Schultz SJ,Bartek J,et al.Cell cycle analysis and chromosomal localization of human Plk1,a putative homologue of themitotic kinases Drosophila polo and Saccharomyces cerevisiae Cdc5[J].JCellSci,1994,107(Pt6):1509⁃1517.
[2]Craig SN,WyattMD,Mclnnes C.Current assessmentof polo⁃like kinases as anti⁃tumor drug targets[J].Expert Opin Drug Discov, 2014,9(7):773⁃789.
[3]Gjertsen BT,Schöffski P.Discovery and development of the Polo⁃like kinase inhibitor volasertib in cancer therapy[J].Leukemia, 2015,29(1):11⁃19.
[4]Holland AJ,Cleveland DW.Polo⁃like kinase 4 inhibition:a strategy for cancer therapy?[J].Cancer Cell,2014,26(2):151⁃153.
[5]Zhang XG,Lu XF,Jiao XM,etal.PLK1 gene suppresses cell inva⁃ sion of undifferentiated thyroid carcinoma through the inhibition of CD44v6,MMP⁃2 and MMP⁃9[J].Exp TherMed,2012,4(6):1005⁃1009.
[6]Zhao CL,Ju JY,GaoW,et al.Downregulation of PLK1 by RNAi attenuates the tumorigenicity of esophageal squamous cell carci⁃noma cells via promoting apoptosis and inhibiting angiogenesis[J].Neoplasma,2015,62(5):748⁃755.
[7]McCarroll JA,Dwarte T,Baigude H,etal.Therapeutic targeting of polo⁃like kinase 1 using RNA⁃interfering nanoparticles(iNOPs)for the treatmentofnon⁃small cell lung cancer[J].Oncotarget,2015,6 (14):12020⁃12034.
[8]Horning JL,Sahoo SK,Vijayaraghavalu S,et al.3⁃D tumormodel for in vitro evaluation of anticancer drugs[J].Mol Pharm,2008,5 (5):849⁃862.
[9]Bittinger S,Alexiadis M,Fuller PJ.Expression status and muta⁃tional analysis of the PTEN and P13K subunit genes in ovarian granulosa cell tumors[J].Int JGynecol Cancer,2009,19(3):339⁃342.
[10]Tsutsui S,Matsuyama A,Yamamoto M,et al.The Akt expression correlates with the VEGF⁃A and⁃C expression as well as the microvessel and lymphatic vessel density in breast cancer[J]. OncolRep,2010,23(3):621⁃630.
[11]Chuang WY,Chang YS,Chao YK,et al.Phosphorylated mTOR expression correlates with podoplanin expression and high tumor grade in esophageal squamous cell carcinoma[J].Int JClin Exp⁃Pathol,2015,8(10):12757⁃12765.
[12]Kim JH,Choi SY,Kang BH,et al.AMP⁃activated protein kinase phosphorylates CtBP1 and down⁃regulates its activity[J].Biochem BiophysRes Commun,2013,431(1):8⁃13.
[13]张瑞涛,史惠蓉,任芳,等.PLK1和P53蛋白在卵巢上皮性癌中的表达及其意义[J].中国临床医师杂志(电子版),2014,8(8): 1432⁃1436.
[14]Gutteridge RE,Ndiaye MA,Liu X,et al.Plk1 inhibitors in cancer therapy:from laboratory to clinics[J].Mol Cancer Ther,2016,15 (7):1427⁃1435.
[15]Valsasina B,Beria I,AlliC,etal.NMS⁃P937,an orally available, specific small⁃molecule polo⁃like kinase 1 inhibitorwith antitumor activity in solid and hematologic malignancies[J].Mol Cancer Ther,2012,11(4):1006⁃1016.
[16]Sero V,Tavanti E,Vella S,et al.Targeting polo⁃like kinase 1 by NMS⁃P937 in osteosarcoma cell lines inhibits tumor cell growth and partially overcomes drug resistance[J].Invest New Drugs, 2014,32(6):1167⁃1180.
[17]柴成国,张建军,李宁,等.P53、C⁃MYC和BCL⁃6基因异常在弥漫性大B细胞淋巴瘤中的临床意义[J].中国实验血液学杂志, 2016,24(1):89⁃93.
[18]尹肖云,乔丽雅,王红英,等.PTEN基因和P53基因在子宫内膜癌中的表达及意义[J].现代生物医学进展,2014,14(14):2628⁃2631.
[19]Ando K,Ozaki T,Yamamoto H,etal.Polo⁃like kinase 1(Plk1)in⁃hibits p53 function by physical interaction and phosphorylation[J].JBiolChem,2004,279(24):25549⁃25561.
[20]Yoon HE,Kim SA,ChoiHS,etal.Inhibition of Plk1 and Pin1 by 5'⁃nitro⁃indirubinoxime suppresses human lung cancer cells[J]. Cancer Lett,2012,316(1):97⁃104.
Effect of PLK 1 inhibitor on proliferation of osteosarcoma cells and itsmechanism.
HUANGChongxin*, LYU Bo,WANGYue,PANG Jian,HAOPeng,LIU Ping.*DepartmentofOrthopaedics,Sichuan Academy ofMedi⁃cal Sciences&Sichuan ProvincialPeople’sHospital,Chengdu 610072,China
LYU Bo,E⁃mail:lnter_1@163.com
Objective To investigate the effect and mechanism of NMS⁃P937,a smallmolecule inhibitor of PLK1 on the proliferation of human osteosarcoma cells,and the relationship between the level of PLK1 and the prognosis of patientswith osteosarcoma.M ethods In this study,HOS,Saos⁃2 osteosarcoma cell lines and human osteoblastic cell line HOB⁃C were used as experimental samples.The protein and mRNA levelsof PLK1 in various cell lineswere detected byWestern blottingand q⁃PCR respectively.Differentconcen⁃trations(0.01,0.05,0.1,0.2,0.5mol/L)of NMS⁃P937 were used to interfere osteosarcoma cells respectively. The inhibitory effects of NMS⁃P937 on proliferation were estimated by virtue of MTT assay,and regulation of cell cycle by NMS⁃P937 was verified applying flow cytometry.Association between PLK1 and p53 protein was tested by co⁃immunoprecipitation technology.Relationship between clinical prognosis and PLK1 protein expression levelwas analyzed through tissue array information by Kaplan⁃Meier.Results Our results indi⁃cated thatPLK1 protein andmRNA expression levelswere higher in HOSand Saos⁃2 cells than in HOB⁃c cells. The NMS⁃P937 inhibitor could effectively suppress the PLK1 expression level.Through treatmentwith NMS⁃P937 inhibitor,the number of Saos⁃2 cells in Sand G2/M phaseswas elevated significantly and that in G0/G1 phase decreased evidently.Co⁃immunoprecipitation indicated association between PLK1 and p53 protein.Sur⁃vival analysis showed a negative correlation between PLK1 protein expression leveland patients’survival rate. Conclusion The application of PLK1 inhibitor can inhibit the proliferation of osteosarcoma cells,whichmay be associated with the negative role of PLK1 in regulating p53 involved in cell cycle transformation.Besides, high PLK1 protein expression level affects patients’prognosis,indicating PLK1 protein may exert potential
Osteosarcoma;Polo⁃like kinase1;Protein kinase inhibitors;p53;Survivalanalysis
2016⁃02⁃19)
10.3969/j.issn.1674⁃8573.2016.05.014
国家自然科学青年基金(81300964)
610072 成都,四川省医学科学院·四川省人民医院骨科(黄崇新、吕波、王跃、庞健、郝鹏);山东大学医学院(刘萍)
吕波,E⁃mail:lnter_1@163.com
target role in treating clinicalosteosarcoma patients.
