免疫磁珠富集与荧光定量PCR技术联合检测丙型肝炎病毒
2016-12-02曹姗姗张文玲王瑾周鲁林刘留吴燕肖利力
曹姗姗 张文玲 王瑾 周鲁林 刘留 吴燕 肖利力*
(1.北京国际旅行卫生保健中心 北京 100088;2.重庆大学)
免疫磁珠富集与荧光定量PCR技术联合检测丙型肝炎病毒
曹姗姗1张文玲1王瑾1周鲁林1刘留2吴燕2肖利力1*
(1.北京国际旅行卫生保健中心北京100088;2.重庆大学)
建立一种免疫磁珠与荧光定量PCR技术联合检测丙型肝炎病毒的方法。将丙型肝炎病毒抗体与羧基修饰磁珠偶联,制备出特异性丙型肝炎病毒免疫磁珠,并检测活化磁珠富集病毒的效率。结果表明1 mg免疫磁珠与75 μg丙型肝炎病毒单克隆抗体偶联时,具有最高抗体偶联量,该偶联后的磁珠富集丙型肝炎病毒的效率是94.50%;同时检测出丙型肝炎病毒高拷贝和低拷贝样品的重复性良好。本研究探索的免疫磁珠与荧光定量PCR技术的结合具有灵敏性高、特异性强、简便快捷以及可信度高的优点,为丙型肝炎病毒检验与评价提供了有利的技术支持。
丙型肝炎病毒;免疫磁珠;荧光定量
1 前言
丙型肝炎是由丙型肝炎病毒(Hepatitis C virus,HCV)感染而引起的严重威胁人类健康的传染性疾病[1]。HCV能在肝细胞中寄生并进行无限制复制,这将引起人体肝细胞结构和功能发生改变,而慢性感染会进一步发展为慢性进行性肝病,包括肝硬化、肝细胞癌等[2],因此尽早检测出病毒显得非常重要。HCV感染者血清中丙肝抗原(HCAg)是病毒复制的一个标志物,感染一周后出现并可被检测出来。但由于抗原在血清中含量较低,目前的免疫检测技术(如荧光定量、胶体金、酶和化学发光等)[3]灵敏度不高,因此限制了临床上HCV抗原的检出率。
免疫磁珠技术是近几年发展起来的一种新的免疫学技术,其将免疫学反应的高度特异性和磁珠特有的磁响应性相结合,具有特异性强、分离速度快和操作简单等优点[4],应用于医学检测中有着突出的优势。通过表面修饰等方法可以赋予磁珠表面存在特殊功能基团,这些基团可以与特异性免疫配基相结合,如抗原、抗体、受体等[5]。目前在食品检验系统中利用磁珠检测食品金黄色葡萄球菌和鼠伤寒沙门菌,其检测效果快速、灵敏[6,7]。本研究将带有羧基基团的磁珠进行活化后偶联HCV单克隆抗体,通过对磁珠偶联抗体量的优化,探索最佳富集病毒方案,同时对临床血清样本进行特异性检测。
2 材料与方法
2.1材料
2.1.1试剂
羧基修饰磁珠:购于无锡百运纳米科技有限公司;HCV及单克隆抗体:北京出入境检验检疫局技术中心提供;BCA蛋白浓度测定试剂盒:Sigma公司;碳二亚胺(EDC):上海共价化学科技有限公司,纯度大于98%;N-羟基琥珀酰亚胺(NHS):成都贝斯特试剂有限公司,纯度大于99%;2-(4-吗啉)乙磺酸(MES):东阳市百航化工有限公司,纯度99%-99.8%;PBS缓冲液和BSA封闭液:北京索莱宝生物有限公司;Trizol:Invitrogen;氯仿、乙醇和异丙醇:成都化夏化学试剂有限公司;DNA提取试剂盒:TAKARA。
2.1.2仪器设备
多功能磁分离器:Biocanal,BCN2001-2;酶标仪:Thermo,Multiskan Spectrum;隔水式电热恒温培养箱:苏州江东精密仪器有限公司,GHP-9050;静音混合器:郑州南北仪器设备有限公司,WH-986;冷冻离心机:Eppendorf,5424R;涡旋混合仪:北京大龙,MX-F;RT-PCR仪:ABI公司,7500 fast。
2.1.3引物
Primer 1:5'-CGlACAAACAAIGAGACACC-3';Primer 2:5'-AGGCTCTAAGATGTTGTCAGC-3';由上海生工生物工程股份有限公司合成。
2.2方法
2.2.1免疫磁珠的制备
2.2.1.1活化
取2 mg(25 mg/mL)充分摇匀的羧基磁珠置于2 mL离心管中,加1 mL浓度为0.01 mol/L的MES(pH 5.0,0.05%Tweeb-20)活化缓冲液洗涤磁珠3遍;用磁分离器分离后,分别加入300 μL浓度为5 mg/mL的活化试剂EDC和NHS(均使用0.01 mol/L pH 5.0的MES缓冲液配制)溶液,经涡旋混合仪混匀,固定在静音混合器上,37℃活化45 min;用磁分离器分离磁珠,弃去上清液,加500 μL pH 7.4的PBS缓冲液洗涤3次,每次洗涤需在混合器上充分混合洗涤,再加入200 μL PBS缓冲液,悬浮磁珠。
2.2.1.2偶联
取1 mg(100 μL)活化磁珠至2 mL离心管中,加入适量HCV单克隆抗体,用PBS缓冲液补齐至500 μL,用涡旋混合仪混匀,固定在静音混合器上,37℃偶联2 h;用磁分离器分离磁珠,弃去上清液,加入500 μL PBS缓冲液洗涤3次,每次洗涤需在混合器上充分混合洗涤,去除未结合的抗体。
2.2.1.3封闭
在上述装有磁珠的离心管中,加入500 μL 1%的BSA封闭液,经涡旋混合仪混匀,固定在静音混合器上,37℃封闭1 h(或4℃封闭过夜);用磁分离器分离磁珠,弃去上清液,加入500 μL PBS缓冲液洗涤3次,再加入300 μL PBS缓冲液,悬浮磁珠,置于4℃备用。
2.2.2检测偶联最佳抗体量的活化磁珠富集病毒的效率
取6支2 mL离心管各加入1 mg活化磁珠,再分别加入HCV单克隆抗体(1 mg/mL)10、25、50、75、100、250 μg,用PBS缓冲液补齐至500 μL,用旋涡混合仪混匀,固定在静音混合器上,37℃偶联2 h;用磁分离器分离磁珠,收集各管上清液。用BCA试剂盒检测上述各管上清液中剩余抗体量,用酶标仪测定其A562 nm值,可得1 mg磁珠偶联抗体的量,计算偶联效率。
此6份1 mg免疫磁珠封闭后各加300 μL浓度为8×105的HCV(试剂中未曾列出),用涡旋仪混匀,室温固定在混合器上孵育2 h;用磁分离器分离磁珠,弃上清液后加入PBS缓冲液500 μL洗涤3次(每次洗涤需要在混合器中充分洗涤,以除去吸附病毒);提取免疫磁珠吸附病毒的核酸,检测吸附不同抗体量免疫磁珠吸附HCV的效率。
2.2.3检测免疫磁珠捕获病毒能力
浓度1.52×106拷贝/μL的HCV,按1∶10、1∶100、1∶1000的比例稀释,取4份1 mg免疫磁珠(偶联75 μg丙肝病毒单克隆抗体)分别与原浓度及3个稀释比例的病毒吸附,室温孵育2 h,检测并计算富集效率。
2.2.4免疫磁珠捕获病毒提取核酸(Trizol提取病毒RNA)
在已吸附病毒的免疫磁珠中加入600 μL Trizol,室温静置5 min,使其溶解;加入氯仿200 μL,震荡混匀10-15 s,室温放置2-3 min;4℃、12000 rpm离心15 min,小心吸取上清透明液体移入一新离心管;加入等体积的异丙醇(约500 μL),上下颠倒混匀,室温放置10 min,使RNA析出沉淀;4℃、12000 rpm离心10 min,可见白色块状RNA沉于管底;小心弃去上清,加入1 mL预冷的75%乙醇洗涤沉淀,温和震荡,沉淀悬浮即可;4℃、8000 rpm离心5 min,小心弃去上清;室温晾干5 min,待乙醇蒸发即可,RNA不要过于干燥;根据沉淀量多少,取100 μL DEPC水(用焦碳酸二乙酯处理并经高温、高压灭菌的MiliQ纯水),用枪头吹打,55℃水浴5 min以溶解沉淀(RNA可放入-80℃长期保存),测量浓度及OD值。按表1的组成配制反转录反应液体系及反应条件。

表1 反转录反应体系
2.2.5荧光定量PCR检测
用含有HCV基因组中编码VP1-VP3衣壳蛋白区域片段的标准品质粒(试剂中未曾列出)制作荧光定量PCR标准曲线,取浓度范围9.27×101-9.27×107拷贝/μL的7个点。
实时荧光定量PCR采用7500 fast Realtime-PCR仪对上述获得的cDNA进行检测,反应体系见表2;同时优化PCR反应条件,在60℃3 s-72℃11 s-80℃3 s进行44个循环,见表3。

表2 普通RT-PCR反应体系

表3 普通RT-PCR反应条
2.2.6HCV富集效率的计算

3 结果与分析
3.1蛋白浓度标准曲线
1 mg磁珠分别偶联10、25、50、75、100、250 μg HCV单克隆抗体后,用酶标仪检测上清液中剩余抗体的量。处理酶标仪所检测的数据,选用五参数的曲线比单纯的直线拟合更加精确。图1为标准蛋白量与吸光值点对点的标准曲线,检测样本的加样量在0-10 μg之间,可以根据标准曲线的吸光度计算每个样本所加的抗体量。根据加样体积和上清液总体积换算出上清液中剩余的抗体量及免疫磁珠与HCV抗体的偶联效率。

图1 蛋白浓度标准曲线
3.2活化磁珠偶联抗体效率
1 mg磁珠分别与10、25、50、75、100、250 μg HCV单克隆抗体偶联的结果见表4。

表4 活化磁珠偶联抗体的效率
表4显示,抗体量过高或过低,其富集效率均降低。当1 mg活化的磁珠与25 μg HCV单克隆抗体偶联时,偶联效率最高,为55.2%;但是当1 mg活化磁珠与75 μg HCV单克隆抗体偶联时,有最大偶联量,为17.6 μg。因此后续实验的单位活化磁珠均选择75 μg HCV单克隆抗体偶联。
3.3活化磁珠偶联不同量的抗体富集效率
将偶联HCV单克隆抗体的免疫磁珠吸附300 μL浓度为8×105拷贝/μL病毒,其富集效率见表5。

表5 不同抗体量偶联磁珠对富集效率的影响
表5显示,抗体量过高或过低,其富集病毒的效率均下降。1 mg的活化磁珠与75 μg HCV抗体偶联时,免疫磁珠对丙肝病毒的富集效率最高,达到94.50%。
3.4单位质量免疫磁珠富集病毒能力
4份1 mg免疫磁珠(偶联上述最佳效率抗体量)分别与原浓度(1.48×106拷贝/μL)、1∶10、1∶100、1∶1000稀释的300 μL病毒吸附,结果见表6。

表6 免疫磁珠吸附不同HCV的富集效率
表6显示,随着稀释倍数的增加,富集效率降低。
3.5免疫磁珠与荧光定量检测HCV的方法重复性检测
分别取高拷贝(105拷贝/μL)和低拷贝(103拷贝/μL)的HCV血清样品1份,平行做8管,用免疫磁珠法提取病毒RNA,取5 μL进行荧光定量PCR,结果见表7、表8。
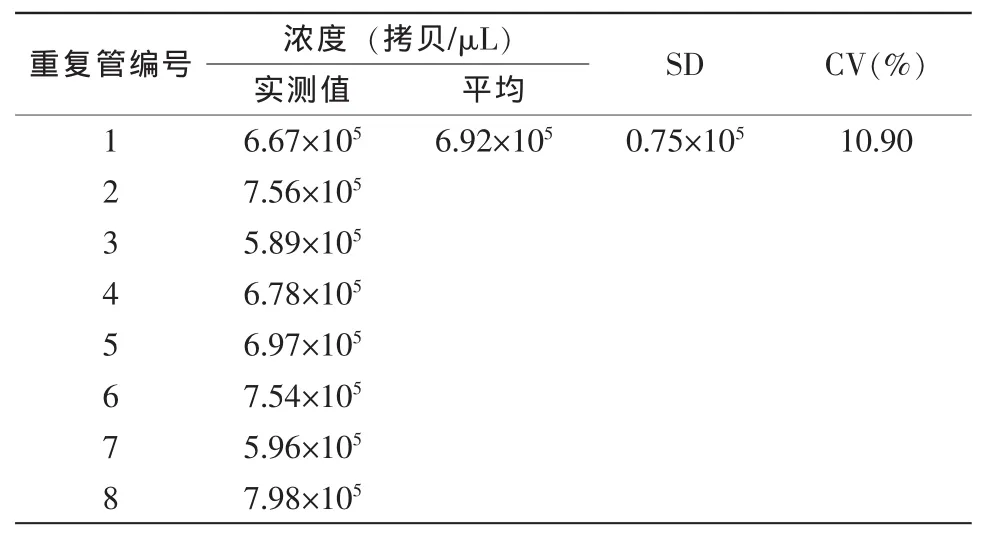
表7 HCV高拷贝样品重复性检测

表8 HCV低拷贝样品重复性检测
表7显示,高拷贝样品定量的最大值为7.98× 105,最小值为5.89×105,SD为0.75×105,CV为10.90%;表8显示,低拷贝样品定量的最大值为1.67×103,最小值为0.96×103,SD为0.23×103,CV为17.56%,结果说明无论高拷贝样品还是低拷贝样品,其检测重复性良好。
3.6样品之间重复性检测
取HCV血清样品10份,用免疫磁珠法提取病毒RNA,取5 μL进行荧光定量PCR,每天各测一次,连续测定4 d,结果显示该检测方法有较高的重复性(见表9)。

表9 HCV样品间重复性检测结果与分析
3.7特异性检测
为了了解该方法的特异性,取12份健康人血清,用免疫磁珠法提取核酸,取5 μL进行荧光定量PCR。另外用全血基因组DNA提取试剂盒提取健康人的基因组DNA,取1 μL作为模板用HCV引物进行荧光定量PCR。结果显示,除阳性对照管外一律为阴性。
4 讨论
免疫磁珠技术利用抗原-抗体结合原理和物理磁性吸附,从而高效、特异性地捕获病毒微生物,有效剔除样本中的杂质和非目标微生物[4,8,9]。目前免疫磁珠检测技术已得到广泛应用,例如牛乳中沙门菌的检测[10],免疫磁珠捕获甲肝病毒以及轮状病毒也有所报道[11,12],但临床上对于HCV检测的灵敏度、特异性以及重复性等诸方面都有很高的要求。本研究利用基于荧光定量PCR和基于纳米磁珠捕获血清病毒核酸提取方法建立了HCV共同检测体系,不仅有效去除PCR反应的抑制物,而且可以吸附完整抗原性的病毒,这弥补了单独使用PCR技术检测不能表征病毒感染性的不足。另外,使用此方法既可大大提高检测效率,也降低了检测难度,可避免假阳性结果的出现。
本研究选用羧基磁珠,制备了富集HCV的免疫磁珠材料,建立了基于免疫磁珠富集HCV的方法。用单位质量羧基磁珠经EDC、NHS活化后,与75 μg HCV单克隆抗体偶联时,具有最大抗体偶联量;同时在实验过程中,选用Trizol法提取HCV RNA,虽然与Reynolds等[13]研究中提取甲肝病毒核酸方法不同,但却得到良好的富集效果,单位质量免疫磁珠可使病毒浓度为1.48×106拷贝/μL的300 μL丙肝病毒样本富集效率达92.57%,其HCV高拷贝与低拷贝样品重复性好,特异性强,保证了富集结果的准确性。本研究利用高效、灵敏的荧光定量PCR检测免疫磁珠富集丙肝病毒的结果,相比普通PCR法的检测,该方法具有特异性强、灵敏度高、重复性好、简便快捷的特点,对丙肝病毒检测与评价提供了一种有利的技术支持。
5 结论
本研究利用免疫磁珠富集与荧光定量PCR技术联合检测丙型肝炎病毒,相比普通PCR法的检测,该方法具有特异性强、灵敏度高、重复性好、简便快捷的特点,对HCV检测与评价提供了一种有利的技术支持。
[1]Mohamed A A,Elbedewy T A,El-Serafy M,et al.Hepatitis C virus:A global view[J].World journal of hepatology,2015,7:2676-2680.
[2]Wurcel A G,Chen D D,Fitzpatrick R E,et al.Hepatitis C ScreeninginPeopleWithHumanImmunodeficiencyVirus:LessonsLearnedFromSyphilisScreening[J].Openforum infectious diseases,2016:3(1):215.
[3]Gravitz I.Introduction:a smouldering public health crisis[J]. Nature,2011,474(7350):S2-S4.
[4]Shire N J,Sherman K E.Epidemiology of Hepatitis C Virus:A Battle on New Frontiers[J].Gastroenterology clinics of North America,2015,44:699-716.
[5]Yang S,Shang Y,Wang D,et al.Diagnosis of porcine circovirus type 2 infection with a combination of immunomagnetic beads,single-domain antibody,and fluorescent quantum dot probes. Archives of virology,2015,160:2325-2334.
[6]陈旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,21(8):148-155.
[7]周莉,王永,王法云,等.免疫磁珠检测食品中金黄色葡萄球菌的研究[J].河南科学,2015,7:1119-1123.
[8]朱海华,王永,王法云,等.免疫磁珠富集鼠伤寒沙门氏菌条件的研究[J].食品科技,2015,8:314-317.
[9]JayamohanH,GaleBK,MinsonB,etal.Highlysensitive bacteriaquantificationusingimmunomagneticseparationand electrochemical detection of guanine-labeled secondary beads[J]. Sensors,2015,15:12034-12052.
[10]Song F,Zhou Y,Li Y S,et al.A rapid immunomagnetic beadsbased immunoassay for the detection of beta-casein in bovine milk[J].Food chemistry,2014,158:445-448.
[11]Casas N,Sunen E.Detection of enteroviruses,hepatitis A virus and rotaviruses in sewage by means of an immunomagnetic capture reverse transcription-PCR assay[J].Microbiological research,2002,157(3):169-175.
[12]Chigor V N,Okoh A I.Quantitative RT-PCR detection of hepatitis A virus,rotaviruses and enteroviruses in the Buffalo River and source water dams in the Eastern Cape Province of South Africa[J].International journal of environmental research and public health,2012,9(11):4017-4032.
[13]ReynoldsKA,GerbaCP,AbbaszadeganM,etal.ICC/PCR detection of enteroviruses and hepatitis A virus in environmental samples[J].Canadian journal of microbiology,2001,47(2):153-157.
Detection of Hepatitis C Virus by Immunomagnetic Beads-based Concentration Combined with RT-PCR
CAO Shanshan1,ZHANG Wenling1,WANG Jin1,ZHOU Lulin1,LIU Liu2,WU Yan2,XIAO Lili1*
(1.Beijing International Travel Healthcare Center,Beijing,100088;2.Chongqing University)
The aim of the experiment to build up a detection method of Hepatitis C Virus(HCV)by immunomagnetic combined with RT-PCR.A HCV antibody was coupled with carboxyl groups conjugated to magnetic beads prepared as specific HCV immunomagnetic beads,and detect the activated magnetic beads virus efficiency.The results showed that 1mg immunomagnetic beads and 75 μg hepatitis C virus monoclonalantibodyconjugate,thehighestantibodycouplingandthecouplingofmagneticbeads enrichment efficiency of hepatitis C virus(HCV)is 94.50%.At the same time,the detection of HCV high copy and low copy sample is good repetitions.The results showed that the combination of immunomagnetic beads and fluorescence quantitative PCR has high sensitivity,strong specificity,simple and fast and high reliability advantages and favorable technical support is provided for the test and evaluation of hepatitis C virus(HCV).
Hepatitis C Virus;Hepatitis C Virus;Real-Time PCR
Q789
E-mail:caoshsh@bjciq.gov.cn;*通讯作者E-mail:xiaoll@bjciq.gov.cn
国家质检总局科技计划项目(2015IK342)
2016-03-01
