利用谷氨酸棒杆菌转化法合成4-羟基异亮氨酸
2016-12-01张成林陈鹏杰谢希贤徐庆阳
温 冰,张成林,麻 杰,陈鹏杰,谢希贤,徐庆阳,陈 宁
(代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学生物工程学院,天津 300457)
利用谷氨酸棒杆菌转化法合成4-羟基异亮氨酸
温 冰,张成林,麻 杰,陈鹏杰,谢希贤,徐庆阳,陈 宁
(代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学生物工程学院,天津 300457)
4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)具有葡萄糖依赖的促进胰岛素分泌的活性,在 L-异亮氨酸(L-isoleucine,L-Ile)生产菌株谷氨酸棒状杆菌(Corynebacterium glutamicum)YILW 中过表达来源于苏云金芽胞杆菌(Bacillus thuringiensis)TCCC11826的L-异亮氨酸羟化酶(L-isoleucine dioxygenase,IDO)编码基因ido,以期利用微生物转化法合成 4-HIL,并研究α-酮戊二酸(α-ketoglutarate,α-KG)和 Fe2+添加量对菌株合成 4-HIL的影响.结果表明:构建的C. glutamicum YILW-IDO菌株能够表达出有活性的IDO,并能够利用菌体自身合成的L-Ile以及培养基中的α-酮戊二酸合成4-HIL.此外,α-酮戊二酸和Fe2+均能影响4-HIL的合成,在其添加量分别为40,mmol/L和4,mmol/L条件下,培养50,h,4-HIL产量达(35.7±1.0)mmol/L.本研究可为4-HIL及氨基酸衍生物的生物制造提供理论依据.
4-羟基异亮氨酸;L-异亮氨酸羟化酶;谷氨酸棒状杆菌;微生物转化
4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)是一种自然界存在的非蛋白质氨基酸,主要存在于胡芦巴属植物种子中[1].研究表明4-HIL具有葡萄糖依赖的促进胰岛素分泌的活性,当葡萄糖浓度高于8.3,mmol/L时4-HIL能够明显促进胰岛素分泌,且该活性随血糖浓度的升高而增强,但当葡萄糖浓度低于该值时,4-HIL无此活性.此外,4-HIL还具有加速脂肪代谢、降血脂和保护肝功能的作用[2-6],可见4-HIL具有广泛的应用前景和市场需求.
4-HIL的合成方法包括提取法、化学合成法和酶法,目前主要采用提取法工业化生产 4-HIL.此方法获得的4-HIL构型较多,但仅(2S,3R,4S)-4-HIL具有上述生物学活性,从而使得该方法存在提取率低(仅为 0.091%~0.60%,)、分离纯化困难、原材料需求量大、成本高等不足[3,7].因此利用 L-异亮氨酸羟化酶(L-isoleucine hydroxylase,IDO)特异性合成(2S,3R,4S)-4-HIL是较为理想的方法.
Haefelé等[8]在胡芦巴种子中发现可将L-异亮氨酸(L-isoleucine,L-Ile)转化为(2S,3R,4S)-4-HIL的活性成分,但未见将其分离纯化的报道.Ogawa等[1]在苏云金芽胞杆菌(Bacillus thuringiensis)中发现了能特异性地催化 L-Ile生成(2S,3R,4S)-4-HIL的IDO,为4-HIL的生物法合成奠定了基础[9].
在前期研究中,本研究室从苏云金芽胞杆菌(B.thuringiensis)TCCC11826基因组克隆了 IDO编码基因ido,其表达产物能够特异性地催化L-Ile生成(2S,3R,4S)-4-HIL,最适反应温度和 pH分别为35,℃和 7.0,可见该酶反应条件温合,比较适合用于生物法合成 4-HIL[9].序列分析结果表明,该 IDO含有His1-X-Asp-Xn-His2基序,属于Fe2+和α-KG依赖型羟化酶家族.因此前期在酶催化以及利用大肠杆菌(Escherichia coli)W3110进行微生物转化合成 4-HIL时需加入底物L-Ile和α-KG以及FeSO4[9].
本文在前期研究基础上以L-Ile生产菌株谷氨酸棒状杆菌(Corynebacterium glutamicum)YILW 为出发菌株,过表达 ido基因,构建 4-HIL生产菌株YILW-IDO,以期利用 YILW-IDO自身合成的 L-Ile及外源添加α-KG和 Fe2+实现生物转化法合成 4-HIL.在此基础上研究α-KG和 Fe2+添加量对重组菌株合成4-HIL的影响.
1 材料与方法
1.1材料
1.1.1菌株和质粒
大肠杆菌(E.coli)DH5α、L-Ile生产菌株谷氨酸棒状杆菌(C. glutamicum)YILW(LeuL+AHVr+SGr+ Leu-MEr)以及质粒 pXMJ19(Cmr)和 pMD-ido为模板(ido基因经过密码子优化)均由本实验室保藏.
1.1.2培养基
LB培养基(g/L):蛋白胨10.0,酵母提取物5.0, NaCl 10.0,pH 7.0~7.2,121,℃高压蒸汽灭菌20,min.
LBG培养基(g/L):蛋白胨 10.0,酵母提取物5.0,NaCl 10.0,葡萄糖5.0,pH 7.0~7.2,115,℃高压蒸汽灭菌15,min.
BHIS培养基(g/L):脑心浸提物 37.0,山梨醇9.1,葡萄糖 0.5,pH 7.0~7.2,115,℃高压蒸汽灭菌15,min.
发酵培养基[10](g/L):葡萄糖80.0,(NH4)2SO45.0,MgSO4·7H2O 0.5,MnSO4·H2O 0.015,KH2PO4·3H2O 1.5,维生素 B10.015.玉米浆 35.0 mL/L,pH 7.0~7.2,115,℃高压蒸汽灭菌15,min.
1.1.3主要试剂
限制性内切酶、T4,DNA 连接酶、Ex Taq DNA聚合酶,宝生物工程(大连)有限公司;PCR产物回收及质粒提取试剂盒,北京博大泰克生物基因技术有限责任公司;(2S,3R,4S)-4-HIL,美国 Sigma公司;其他试剂均为国产分析纯.
1.2方法
1.2.1质粒pXMJ-ido的构建
以质粒 pMD-ido为模板,利用引物 HIL-F(5′-GCGAAGCTT AGAAAGGTGTGTTTCACCC-3′)和HIL-R(5′-GCGGGATCCTTACTTGGTCTCCTTGTA GG-3′)以及 Ex Taq PCR试剂盒扩增其 ido基因.PCR条件:94,℃ 5,min,1个循环;94,℃ 30,s、56,℃ 30,s、72,℃ 1,min,30个循环;72,℃ 10,min,1个循环,反应体系为50,µL.PCR产物经1.5%,琼脂糖凝胶电泳并切胶回收.
目的产物回收后经 Hind,Ⅲ和 BamHⅠ酶切、电泳、切胶回收后连接至经相同酶切的表达载体pXMJ19上并转化至E. coli DH5α 感受态细胞中.经LB液体培养基活化后涂布于含氯霉素(30,µg/mL)的LB固体培养基.过夜培养后挑取单菌落,利用引物HIL-F和HIL-R进行PCR验证,阳性菌株接入含氯霉素(30,µg/mL)的 LB液体培养基.经 37,℃、220,r/min振荡培养24,h后提取质粒,利用引物HILF和HIL-R进行PCR验证,并分别利用Hind,Ⅲ单酶切以及Hind,Ⅲ和BamHⅠ双酶切,酶切产物经1.5%,琼脂糖凝胶电泳验证.将验证正确的重组质粒命名为pXMJ-ido.
1.2.2YILW-IDO的构建
取5,ng重组质粒pXMJ-ido电转化至YILW感受态细胞(2.5,kV,25,µF,200,Ω,2,mm电击杯),经BHIS培养基37,℃活化1,h后,取200,µL涂布于含氯霉素(10,µg/mL)的 BHIS固体培养基上,于 32,℃倒置培养36,h.挑取单菌落接种至装有5,mL含氯霉素(10,µg/mL)BHIS液体培养基的摇管中,于 37,℃220,r/min振荡培养 48,h.离心收集菌株提取其质粒并利用Hind,Ⅲ单酶切及Hind,Ⅲ和BamHⅠ双酶切,酶切产物经 1.5%,琼脂糖凝胶电泳验证.将验证正确的重组菌株命名为YILW-IDO.
1.2.3实时荧光定量PCR(Real-time PCR)
将YILW-IDO种子培养物以10%,的接种量接种至 LB液体培养基中,32,℃、200,r/min振荡培养至A600=0.6~0.8时,加入终浓度为 0.2,mmol/L 异丙基-β-D-硫代吡喃半乳糖苷(IPTG)继续培养 4,h.根据ido及C.glutamicum ATCC13032 16S rDNA(内参)基因序列利用Primer 5.0软件设计用于Real-time PCR 引物IDO-1(5′-GGTAAAGTTAGACAGTTC CATAGCA-3′)和 IDO-2(5′-CAAATAGGTGAACTA AAAGATGGTC-3′)以及16S-F(5′-AGAACCACCGC CTGCTCACC-3′)和 16S-R(5′-CCGTCGTCGTAGTT GTACTCCTTG-3′)分别采用 Trizol和 Prime Script TMRT试剂盒提取总RNA并反转录成cDNA.然后采用SYBR®Premix Ex Taq™Ⅱ荧光定量PCR 试剂盒及Real-time PCR 仪进行扩增和检测.PCR反应程序:95,℃预变性30,s,1 个循环;95,℃变性5,s,60,℃退火和延伸共34,s,40 个循环.采用2-ΔΔCT相对定量法[11]分析 ido的转录水平,以未经 IPTG诱导的YILW-IDO为对照.
1.2.4IDO活性检测
收集经IPTG诱导的菌体用PBS缓冲液重悬浮,经超声破碎仪超声破碎(功率 350,W,工作时间 5,s,间隔时间 10,s,5 个循环,于冰上操作)后 5,000,g离心5,min.取上清液20,µL至PBS缓冲液(含终浓度为 30,mmol/L α-KG、30,mmol/L L-Ile、1,mmol/L FeSO4、1,mmol/L 维生素 C)中,反应体系为 1,mL,于30,℃反应1,h后加入10,µL乙酸终止反应[12].采用高效液相色谱测定4-HIL含量,酶活性以每毫克总蛋白每分钟内催化生成 4-HIL的量计算,单位为nmol/(min·mg).
1.2.5YILW-IDO摇瓶发酵
分别将含质粒pXMJ19的 C. glutamicum YILW(YILW-pXMJ19,对照组)及重组菌株YILW-IDO(实验组)经斜面培养基活化后接种至 LB液体培养基中,于32,℃、200,r/min振荡培养15,h,使A600=1.2~1.6.将种子培养物以 10%,的接种量接种至含有30,mL 发酵培养基的 500,mL挡板瓶中,于 32,℃、200,r/min振荡培养至 A600=0.6~0.8时,加入IPTG(终浓度为 0.2,mmol/L),同时加入α-KG 和FeSO4(终浓度分别为 30,mmol/L和 2,mmol/L)继续发酵至50,h,检测发酵液中4-HIL的浓度.发酵过程中补加10%,的尿素,维持发酵液pH 6.7~7.0.
在 FeSO4终浓度为 2,mmol/L条件下,考察 0、30、35、40、45、50,mmol/L α-KG 对4-HIL产量的影响.在α-KG 终浓度为 30,mmol/L条件下,考察 0、1、2、3、4、5、6,mmol/L Fe2+对4-HIL产量的影响.在α-KG 终浓度分别为0、30、35、40、45、50,mmol/L条件下,考察1、2、3、4、5、6,mmol/L Fe2+对4-HIL产量的影响,以研究α-KG与Fe2+的交互作用.
1.2.64-HIL的检测
将IDO反应液或发酵液于8,000,g离心5,min后取上清液,经体积分数为0.8%,的2,4-二硝基氟苯衍生后采用高效液相色谱测定 4-HIL含量,检测条件为:Agilent C18(150,mm×4.6,mm,5,µm),采用乙腈/醋酸钠二元梯度洗脱,柱温 33,℃,检测波长360,nm[13].
1.3数据分析
每组实验均设3个平行并重复3次,利用SPSS 19.0统计软件对实验数据进行分析和处理.采用SPSS 19.0统计软件分析α-KG与Fe2+的交互作用.
2 结果与分析
2.1重组质粒pXMJ-ido的构建
经筛选挑取阳性菌落活化后提取质粒进行酶切验证,结果如图 1所示.经 Hind,Ⅲ单酶切获得约7,000,bp的片段,经 Hind,Ⅲ和 BamHⅠ双酶切获得约6,600,bp及750,bp的片段,与重组质粒、pXMJ19以及ido分子质量接近(分别为7,300,bp、6,574,bp和723,bp),证明 ido基因已成功连接到表达载体上.将重组质粒命名为pXMJ-ido.
2.2YILW-IDO菌株的构建
提取重组质粒 pXMJ-ido并电转化至 C. glutamicum YILW 感受态细胞中,经筛选、活化后提取质粒进行酶切验证,结果如图 2所示.经 Hind,Ⅲ单酶切获得约7,000,bp的片段,经Hind,Ⅲ和BamHⅠ双酶切获得约 6,600,bp及 750,bp的片段与重组质粒、pXMJ19以及ido接近,表明重组菌株构建成功,将其命名为YILW-IDO.
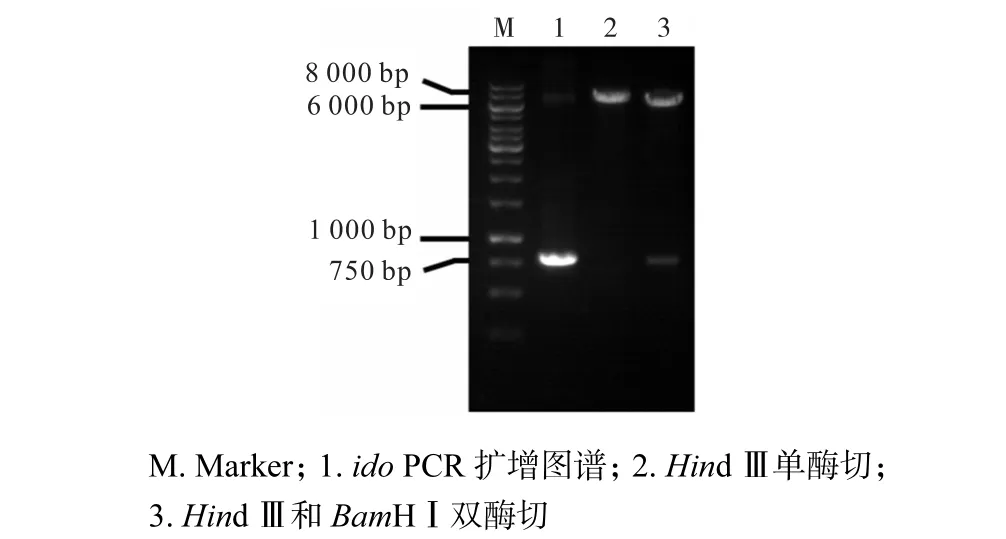
图1 ido PCR扩增及 E.,coli DH5α中质粒 pXMJ-ido酶切验证Fig.1 ido PCR products and identification of recombined pXMJ-ido plasmids in E.,coli DH5α digested by restricted endonuclease
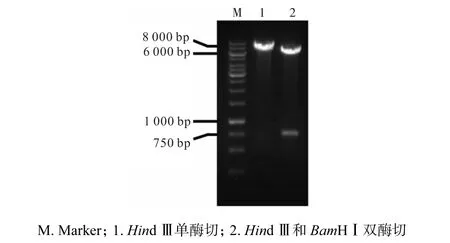
图2 菌株YILW-IDO中质粒pXMJ-ido酶切验证Fig.2 Identification of recombined pXMJ-ido plasmids in YILW-IDO strain digested by restricted endonuclease
2.3重组菌株 YILW-IDO中 ido转录水平及 IDO活性测定
分别提取未经IPTG诱导(对照组)及经IPTG诱导的 YILW-IDO(实验组)总 RNA并测定其转录水平.结果表明,经诱导后YILW-IDO中ido的相对转录量为(31.6±0.5),表明该基因能够于谷氨酸棒杆菌C.glutamicum YILW中成功转录.收集经IPTG诱导的YILW-IDO细胞,超声破碎并离心后取上清液,测定 IDO活性,以含质粒 pXMJ19的 C.glutamicum YILW为对照.结果显示,YILW-IDO破碎液IDO比活力达(1.1±0.3)nmol/(min·mg),表明该 ido基因可在YILW-IDO中表达出具有活性的酶.
2.4利用重组菌株YILW-IDO转化法合成4-HIL
分别将 YILW-pXMJ19(对照组)及重组菌株YILW-IDO(实验组)于含有 30,mL 发酵培养基的500,mL挡板瓶中发酵培养 50,h,测定其 L-Ile和 4-HIL浓度,结果如图 3所示.YILW-IDO可积累 4-HIL达(13.7±0.4)mmol/L,同时生成 L-Ile(26.5± 0.5)mmol/L;而对照组仅积累L-Ile(39.1±1.2)mmol/L,未检测到4-HIL.
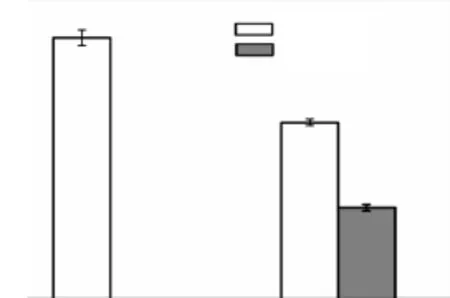
图3 YILW-IDO 4-HIL产量Fig.3 Production of 4-HIL with YILW-IDO
2.4.1α-KG的添加量对4-HIL合成的影响
IDO在催化过程中需底物α-KG.YILW-IDO在发酵结束时,培养基中仍含(26.5±0.5)mmol/L L-Ile,但 4-HIL产量仅(13.7±0.4)mmol/L,而 YILW-pXMJ19,L-Ile产量(39.1±1.2)mmol/L,推测可能因培养基中底物α-KG不足使得YILW-IDO合成的LIle未反应完全而积累.
因此,研究了不同α-KG的添加量对4-HIL产量的影响,结果如图 4所示.当α-KG浓度为40,mmol/L时,4-HIL产量最高,但仍有少量L-Ile积累.随着α-KG添加量的增加,尽管无L-Ile积累但4-HIL产量逐渐降低.前期研究表明,α-KG浓度为40~60,mmol/L时,重组IDO活性并未受到抑制.本实验发现,α-KG添加量为45,mmol/L和50,mmol/L时 YILW-IDO生物量较α-KG添加量为 40,mmol/L时低 9.6%,和 14.2%,(结果未显示),这可能是该条件下4-HIL合成量低的原因.
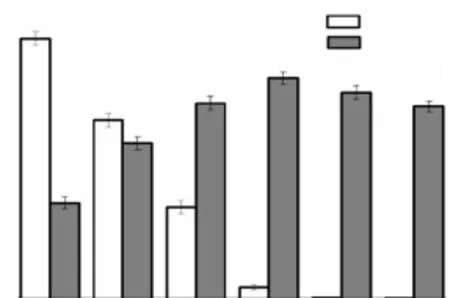
图4 α-KG浓度对4-HIL产量的影响Fig.4 Effects of different concentration of α-KG on 4-HIL production
2.4.2FeSO4的添加量对4-HIL合成的影响
IDO属于 Fe2+及α-KG依赖的羟化酶家族,因此,研究了不同Fe2+添加量对4-HIL产量的影响,结果如图 5所示.随着 Fe2+添加量的增加 4-HIL产量逐渐升高,Fe2+浓度为4,mmol/L时,4-HIL产量达到最高,随后逐渐降低.前期研究表明,当 Fe2+高于4,mmol/L时,重组 IDO活性降低,因此 Fe2+添加量为5,mmol/L和6,mmol/L时,可能因IDO活性受到抑制而使得4-HIL产量降低.
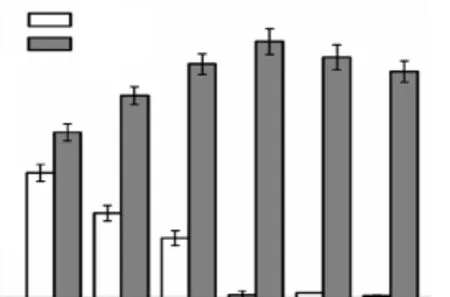
图5 Fe2+浓度对4-HIL产量的影响Fig.5 Effects of different concentration of Fe2+on 4-HIL production
2.4.3α-KG和FeSO4添加量对4-HIL合成的影响
α-KG和FeSO4添加量对4-HIL合成量的影响及其交互作用实验结果见表1和表2.结果表明:α-KG和 FeSO4均能显著影响 4-HIL的合成(P<0.05),当α-KG添加量一定时,FeSO4添加量为4,mmol/L条件下 4-HIL合成量最高;当 FeSO4添加量一定时,α-KG添加量为40,mmol/L条件下4-HIL合成量最高;α-KG和FeSO4添加量分别为40,mmol/L和4,mmol/L时4-HIL达到最高值,为(35.7±1.0),mmol/L.由表2可知,α-KG和 Fe2+对4-HIL合成的影响不具有交互作用(P>0.05).
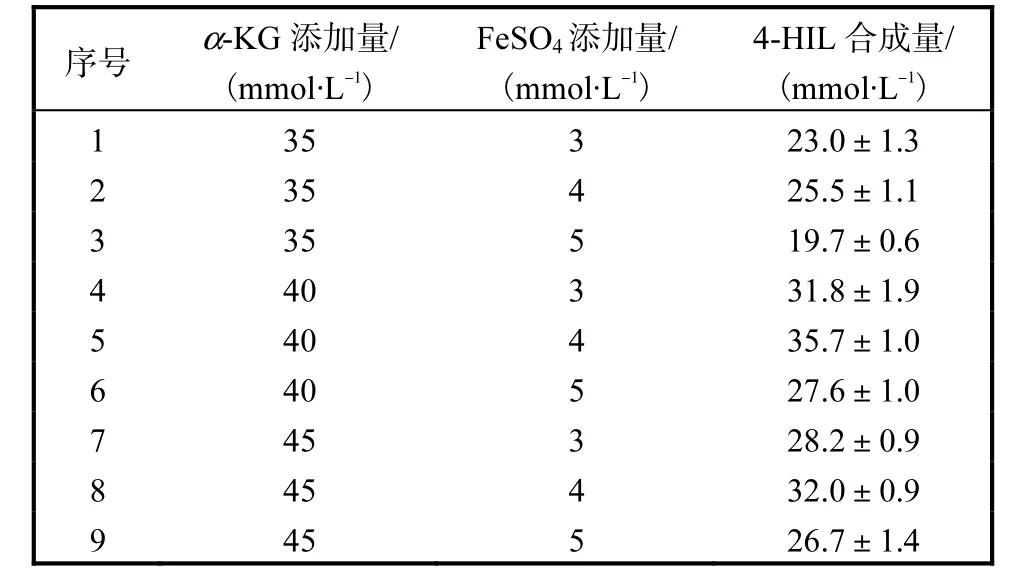
表1 α-KG和FeSO4添加量对4-HIL合成的影响Tab.1 Effects of different concentration of FeSO4and α-KG on 4-HIL production
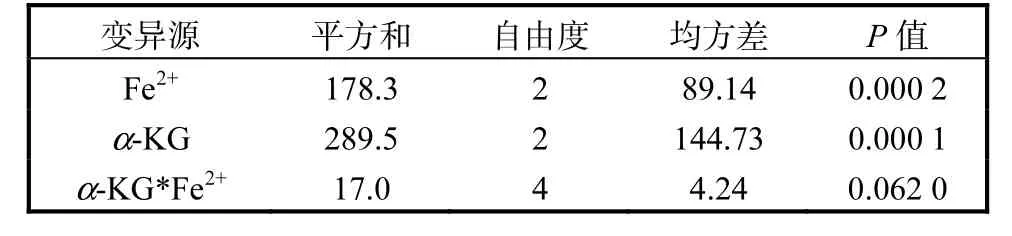
表2 实验结果方差分析Tab.2 Variance analysis of the results
3 讨 论
目前工业化生产 4-HIL所采用的胡芦巴种子提取法具有收率低、成本高等不足.IDO的发现使得具有生物学活性的(2S,3R,4S)-4-HIL高效合成成为可能[1].
本文在前期研究[9]的基础上,以 L-Ile生产菌株C.,glutamicum YILW 为出发菌株通过过表达 ido基因能够成功合成 4-HIL.Smirnov等[13]以 E.coli MG1655为出发菌株,通过敲除α-酮戊二酸脱氢酶编码基因以及异柠檬酸裂解酶编码基因以增加α-KG的积累量,在此基础上过表达ido并在发酵过程中添加L-Ile,在优化条件下其转化率为 0.82,mol/mol.本文利用C.glutamicum YILW-IDO自身合成的L-Ile并向培养基中添加α-KG,在初步优化条件下其转化率为0.86,mol/mol.
IDO属于α-KG和 Fe2+依赖型羟化酶家族.由IDO的酶反应式可知,1,mol α-KG和L-Ile可生成等物质的量的 4-HIL.摇瓶实验结果表明,含质粒pXMJ19的 YILW 可生成 L-Ile(39.1±1.2)mmol/L,因此在发酵过程中添加 40,mmol/L的α-KG使得 4-HIL产量达到最高值.值得注意的是,尽管发酵过程中不添加α-KG,仍可积累4-HIL(14.3±0.9)mmol/L(图4),其原因可能是菌体可利用自身合成的α-KG与L-Ile反应生成4-HIL.Yi等[14]在研究利用脯氨酸羟化酶(属于α-KG和Fe2+依赖型羟化酶家族)合成羟脯氨酸时,发现菌体可利用自身生成的α-KG合成羟脯氨酸.
α-KG 和 Fe2+依赖型羟化酶家族含 His1,XAsp/Glu-Xn-His2基序,该基序中的 His、Asp/Glu及His络合Fe2+后形成活性中心.本文所利用的IDO亦含 His1,X-Asp-Xn-His2基序,实验结果表明适量增加Fe2+添加量可有效提高4-HIL产量.
研究[4]表明维生素 C对 IDO活性亦有一定影响,但通过研究发现添加不同量的维生素 C并未对4-HIL产量产生影响.
本文结果表明,来源于 B.,thuringiensis TCCC 11826的 ido能够在 L-Ile生产菌株 C.,glutamicum YILW中成功表达出有活性的IDO并利用其生成的L-Ile催化生成 4-HIL,实现 4-HIL的生物合成.α-KG和Fe2+添加量均影响 4-HIL的合成,在α-KG和Fe2+添加量分别为40,mmol/L和4,mmol/L条件下,4-HIL产量达(35.7±1.0)mmol/L.本研究可为 4-HIL及其他氨基酸衍生物的生物制造提供理论依据.
[1] Ogawa J,Kodera T,Smirnov S V,et al. A novel L-isoleucine metabolism in Bacillus thuringiensis generating(2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J]. Appllied Microbiology and Biotechnology,2011,89(6):1929-1938.
[2] 高峰,蔡琴,蔡伦,等. 4-羟基异亮氨酸的研究现状[J].医药导报,2014,33(10):1261-1264.
[3] Narender T,Puri A S,Khaliq T,et al. 4-hydroxyisoleucine:An unusual amino acid as antidyslipidemic and antihyperglycemic agent[J]. Bioorganic & Medicinal Chemistry Letters,2006,37(16):293-296.
[4] Kodera T,Smirnov S V,Samsonova N N,et al. A noval L-isoleucine hydroxylating enzyme,L-isoleucine dioxygenase from Bacillus thuringiensis,produces(2S,3R,4S)-4-hydroxyisoleucine[J]. Biochemical and Biophysical Research Communications,2009,390(3):506-510.
[5] Haeri M R,Izaddoost M,Ardekani M R,et al. The effect of fenugreek 4-hydroxyisoleucine on liver function biomarkers and glucose in diabetic and fructose-fed rats[J]. Phytotherapy Research,2009,23(1):61-64.
[6] Haeri M R,Limaki H K,White C J,et al. Noninsulin dependent anti-diabetic activity of(2S,3R,4S)-4-hydroxyisoleucine of fenugreek (Trigonella foenumgraecum)in streptozotocin-induced type I diabetic rats[J]. Phytomedicine,2012,19(7):571-574.
[7] Fowden L,Pratt H M,Smith A. 4-Hydroxyisoleucine from seed of Trigonella foenumgraecum[J]. Phytochemistry,1973,12(7):1707-1711.
[8] Haefelé C,Bonfils C,Sauvaire Y. Characterization of a dioxygenase from Trigonella foenumgraecum involved in 4-hydroxyisoleucine biosynthesis[J]. Phytochemistry,1997,44(4):563-566.
[9] 张成林,刘远,薛宁,等. 苏云金芽胞杆菌重组 L-异亮氨酸羟化酶的酶学性质及其在 4-羟基异亮氨酸合成中的应用[J]. 微生物学报,2014,54(8):889-896.
[10] 张成林,龙辉,温冰,等. 双底物指数流加和双阶段溶氧控制对谷氨酸棒状杆菌生产 L-异亮氨酸的影响[J].食品与发酵工业,2014,40(4):1-6.
[11] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[12] Hibi M,Kawashima T,Kodera T,et al. Characterization of Bacillus thuringiensis L-isoleucine dioxygenase for production of useful amino acids[J]. Applied Environmental Microbiology,2011,77(19):6926-6930.
[13] Smirnov S V,Kodera T,Samsonova N N,et al. Metabolic engineering of Escherichia coli to produce(2S,3R,4S)-4-hydroxyisoleucine[J]. Appllied Microbiology and Biotechnology,2010,88:719-726.
[14] Yi Y L,Sheng H K,Li Z M,et al. Biosynthesis of trans-4-hydroxyproline by recombinant strains of Corynebacterium glutamicum and Escherichia coli[J]. BMC Biotechnology,2014,14(44):1-8.
责任编辑:郎婧
Synthesis of 4-hydroxyisoleucine with Corynebacterium glutamicum via Biotransformation
WEN Bing,ZHANG Chenglin,MA Jie,CHEN Pengjie,XIE Xixian,XU Qingyang,CHEN Ning
(National and Local United Engineering Laboratory of Metabolic Control Fermentation Technology,Tianjin Engineering Laboratory of Efficient and Green Amino Acid Manufacture,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
4-hydroxyisoleucine(4-HIL)possesses glucose-dependent insulinotropic activities.L-isoleucine dioxygenase encoded gene ido from Bacillus thuringiensis TCCC11826 was cloned and expressed in L-isoleucine produced strain Corynebacterium glutamicum YILW to synthesize 4-hydroxyisoleucine via biotransformation.The effect of α-ketoglutarate(α-KG)and Fe2+on 4-HIL synthesis was also studied.C.glutamicum YILW-IDO expressed active IDO was constructed,which could directly convert its endogenous L-isoleucine and α-ketoglutarate in the medium into 4-HIL.Moreover,4-HIL synthesis could be affected by α-KG and Fe2+.After 50,h fermentation,(35.7±1.0)mmol/L 4-HIL was produced by adding 40,mmol/L α-KG and 4,mmol/L Fe2+.This research can lay a theoretical foundation for the microbial manufacture technology of 4-HIL and amino acid derivatives.
4-hydroxyisoleucine;L-isoleucine dioxygenase;Corynebacterium glutamicum;biotransformation
Q815
A
1672-6510(2016)04-0009-06
10.13364/j.issn.1672-6510.20150182
2015-10-27;
2016-02-26
国家自然科学基金资助项目(31300069);天津市大学生创新创业训练计划资助项目(201510057063)
温 冰(1977—),女,天津人,博士研究生,副研究员;通信作者:陈 宁,教授,ningch@tust.edu.cn.
数字出版日期:2016-05-19;数字出版网址:http://www.cnki.net/kcms/detail/12.1355.N.20160519.1030.006.html.
