热活化过硫酸钠耦合甲酸技术研究——处理水溶液中四氯化碳与六价铬污染
2016-12-01磊顾小钢2吕树光李晴宜杨雪瑞王贝宁卢泽海华东理工大学国家环境保护化工过程环境风险评价与控制重点试验室上海市功能性材料化学重点试验室上海200237华东理工大学化学工程联合国家重点试验室上海200237
高 磊顾小钢2*吕树光李晴宜杨雪瑞王贝宁卢泽海(.华东理工大学国家环境保护化工过程环境风险评价与控制重点试验室上海市功能性材料化学重点试验室上海 200237;2.华东理工大学化学工程联合国家重点试验室上海 200237)
热活化过硫酸钠耦合甲酸技术研究——处理水溶液中四氯化碳与六价铬污染
高 磊1,顾小钢1,2*,吕树光1,李晴宜1,杨雪瑞1,王贝宁1,卢泽海1(1.华东理工大学,国家环境保护化工过程环境风险评价与控制重点试验室,上海市功能性材料化学重点试验室,上海 200237;2.华东理工大学,化学工程联合国家重点试验室,上海 200237)
以甲酸为活化剂,耦合热活化过硫酸钠技术产生还原性二氧化碳阴离子自由基(CO2·-),从而还原去除水溶液中四氯化碳(CT)和Cr(VI),考察过硫酸钠和甲酸初始浓度的影响以及复合污染处理效果.结果表明:当过硫酸钠与甲酸浓度均为100mmol/L时,单独CT或Cr(VI)分别在120min、60min内基本完全去除(50℃ ) ,且污染物去除效率随过硫酸钠及甲酸浓度升高而增强.在CT和Cr(VI)复合污染体系中,Cr(VI)的存在能够抑制CT降解,且抑制程度随Cr(VI)初始浓度升高而提高,但Cr(VI)去除率随CT初始浓度增大而升高.加入C O2·-猝灭剂(甲基紫精)能够抑制CT降解,但促进Cr(VI)去除,表明有机物的存在能够增强Cr(VI)去除效率.
四氯化碳;六价铬;热活化过硫酸钠;二氧化碳阴离子自由基
随着我国城市化进程加速和产业结构调整,各大中城市大力实施污染企业关闭或搬迁,从而遗留和遗弃大量污染场地,往往涉及土壤和地下水污染.工业污染场地污染物类型复杂多样,有机污染物与重金属经常被同时检出[1].广泛应用于化工制药、电子、印染等行业的氯代烃和Cr(VI),分别是地下水中常见的有机及重金属污染物[2-3].
过硫酸盐(常用形式为过硫酸钠)是一种新型原位氧化剂,在光、热、过渡金属离子、碱、过氧化氢等条件下,能够活化产生以硫酸根自由基(SO4·-,E0=2.6V)、羟基自由基(OH·,E0=2.7V)为主的活性氧自由基,从而有效降解有机污染物
[4-7].热活化过硫酸钠技术简单易行,已被成功应用于降解地下水中的有机污染物[8-10],但该技术处理难氧化有机物(如四氯化碳)的效率仍不高
[11].因此,有必要改进热活化过硫酸钠工艺以提高污染物去除效率.
热活化过硫酸钠耦合甲酸技术是利用甲酸与热活化过硫酸钠产生SO4·-、·OH的反应,生成还原性二氧化碳阴离子自由基(CO2·-,E0= -2.0V),见反应式(1)和式(2),该技术能够将过硫酸钠氧化体系转化为还原体系[12-13].研究证实,热活化过硫酸钠体系中加入甲酸能够显著提高三氯乙酸、四氯化碳(CT)去除效率[14-15].Berkovic等[16]发现,光活化过硫酸钠/甲酸技术能够产生 CO2·-,从而将氯化汞还原为毒性较低的氯化亚汞.本研究采用热活化过硫酸钠/甲酸工艺还原去除水溶液中CT与Cr(VI)污染,研究该工艺处理CT与Cr(VI)单独存在及复合污染的效果,考察过硫酸钠、甲酸投加量以及CO2·-猝灭剂的影响.
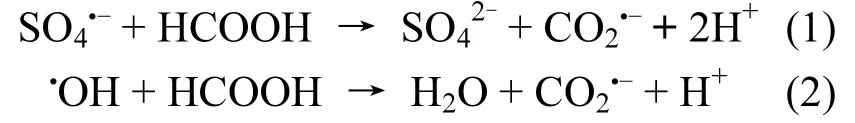
1 材料与方法
1.1 试剂及仪器
试剂:四氯化碳、过硫酸钠、甲酸、重铬酸钾、磷酸、甲基紫精、正己烷,以上试剂均为分析纯,购自上海晶纯有限公司.
仪器:气相色谱仪(Agilent 7890A)、分光光度计(HACH D6000)、恒温振荡水浴锅(华利达实验设备有限公司 HZ-9810SB)、pH计(Mettler-Toledo DELTA320)、超纯水仪(ELGA Classic DI).
1.2 试验方法
采用通用标准螺纹口样品瓶为反应瓶(有效容积 24mL,瓶盖内衬聚四氟乙烯/硅胶隔垫),试验条件下能够有效控制四氯化碳挥发(<3%).由于室温下过硫酸钠与甲酸反应较慢,因此先将一定浓度的Cr(VI)、四氯化碳、过硫酸钠、甲酸混合均匀,随后迅速依次装满反应瓶,置于水浴振荡器中(150r/min),既定时间取样分析.试验均不调节溶液pH值,所有溶液均采用超纯水配制,反应温度控制为50℃.
1.3 分析方法
溶液中四氯化碳采用正己烷萃取富集法测定:取1mL正己烷置于萃取瓶中,立即加入1mL待测溶液,室温震荡3min,静置5min后取上层有机相经气相色谱仪进行测定.气相色谱条件:Agilent 7693自动进样器,DB-VRX色谱柱(长60m、内径 250μm、膜厚 1.4μm),ECD检测器,进样器温度分别为240、260℃,柱温75℃,进样量1μL,分流比 20:1.溶液中 Cr(VI)含量采用分光光度法测定.
2 结果与讨论
2.1 CT与Cr(VI)单独处理效果
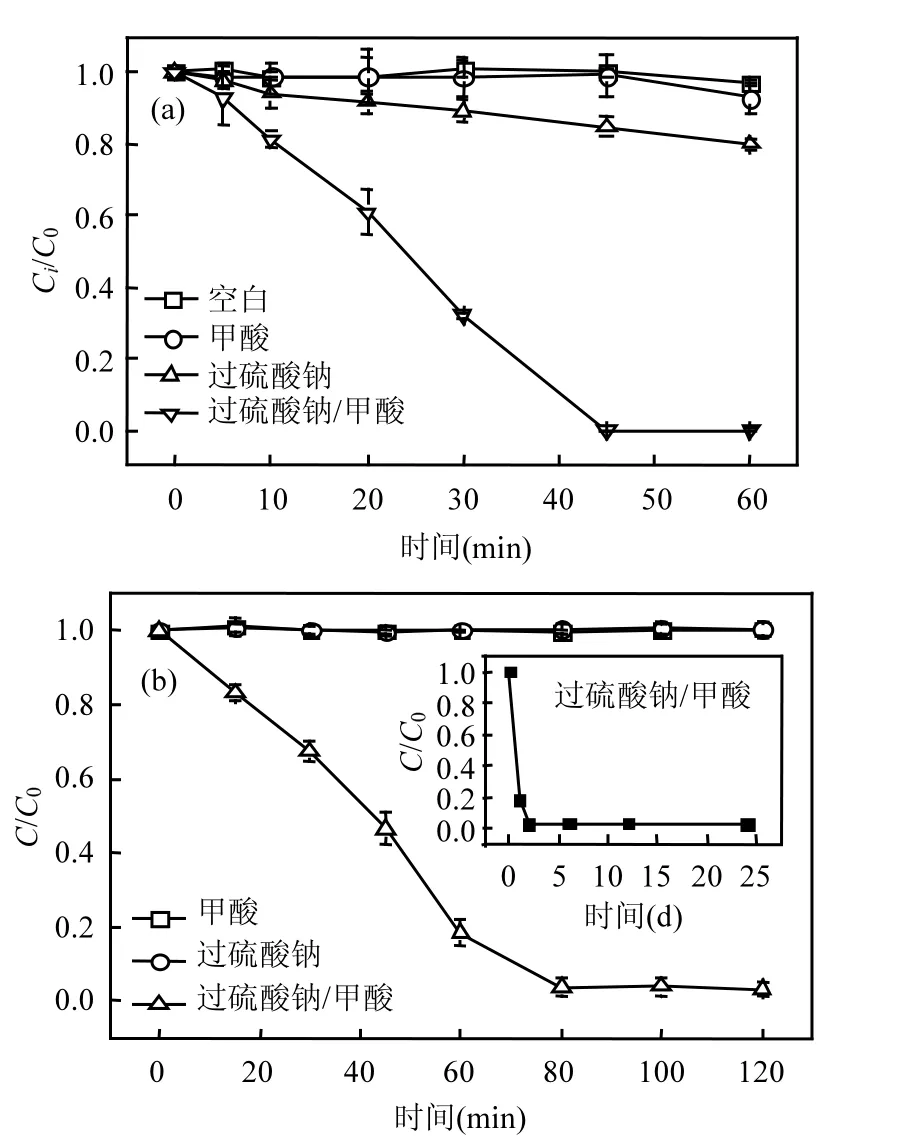
图1 热活化过硫酸钠/甲酸处理CT或Cr(VI)Fig.1 The removal of CT or Cr(VI) in the thermallyactivated persulfate/formic system
图1显示了热活化过硫酸钠/甲酸技术单独处理水溶液中CT及Cr(VI)的效果.结果表明,单独甲酸存在时,60min内CT基本不降解;单独过硫酸钠作用时,CT去除率为20.1%(图1(a)).虽然CT很难与氧化性自由基(如·OH、SO4·-)反应[11],但 Xu等[17]研究证实,热活化过硫酸钠体系中产生还原性超氧自由基(O2·-,E0= -2.4V)能够还原CT.然而,O2·-在水溶液中活性较低[18],因此,单独热活化过硫酸钠体系中 CT降解速率较低.加入甲酸后,CT去除效率明显增强,60min内基本完全降解.由于酸性条件下过硫酸钠加热分解主要产生SO4·-,因此本试验中热活化过硫酸钠首先分解产生SO4·-,SO4·-与甲酸反应生成CO2·-,从而还原水溶液中的CT.
此外,由图1(b)可以看出,单独过硫酸钠或甲酸存在时(50℃),120min内Cr(VI)基本无去除.热活化过硫酸钠/甲酸体系中,120min内Cr(VI)基本完全去除. 图1(b)内图为24d内Cr(VI)浓度变化,表明 Cr(VI)被还原为 Cr(III)后并未被再氧化生成Cr(VI).
2.2 过硫酸钠与甲酸浓度的影响
图2为过硫酸钠与甲酸浓度对CT降解效果的影响.由图 2(a)可知,过硫酸钠投加量由20mmol/L提高至100mmol/L时,60min内CT去除率由37.1%逐渐升高为100%.提高过硫酸钠浓度,能够加强 SO4·-产率,进而促进 CO2·-生成(式(1)),最终强化污染物去除效率.此外,CT去除率也受甲酸浓度影响,甲酸投加量为 20mmol/L时,45min内CT去除率仅为63.1%;当甲酸浓度提高至100mmol/L,CT完全去除.因此,热活化过硫酸钠/甲酸体系中,CT去除效率随过硫酸钠及甲酸投加量升高而增强.
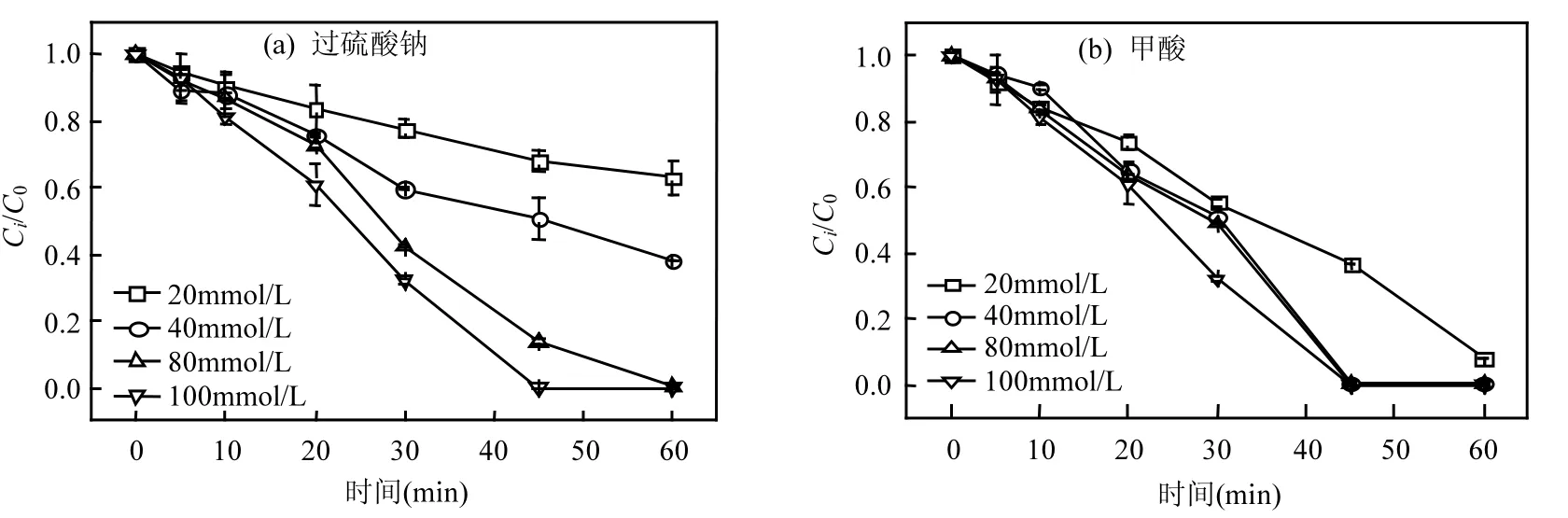
图2 过硫酸钠和甲酸浓度对CT降解的影响Fig.2 Effects of persulfate and formic acid dosage on CT degradation
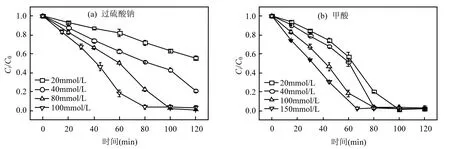
图3 过硫酸钠(a)和甲酸(b)浓度对Cr(VI)去除的影响Fig.3 Effects of persulfate and formic acid dosage on Cr(VI) removal
由于过硫酸钠和甲酸分别为SO4·-、CO2·-的直接来源,因此,提高过硫酸钠或甲酸浓度同样能够增强 Cr(VI)还原效率(图(3)).Mora[14]与 Xu等
[15]研究中也发现类似的结果.
2.3 CT与Cr(VI)合污染处理效果
考察热活化过硫酸钠/甲酸工艺对水溶液中CT与Cr(VI)共存时的去除效果.图4(a)为Cr(VI)投加浓度(0~1mmol/L)对CT的影响.由图4(a)可以看出,无Cr(VI)存在时,30min内CT去除率为99.6%;当Cr(VI)初始浓度由0.02mmol/L增加到1mmol/L时,CT去除率由49.6%递减至21.0%.由此得出,溶液中 Cr(VI)的存在将抑制热活化过硫酸钠/甲酸工艺降解 CT,抑制程度随 Cr(VI)浓度升高而增强,推断是由于Cr(VI)与CT竞争CO2·-.
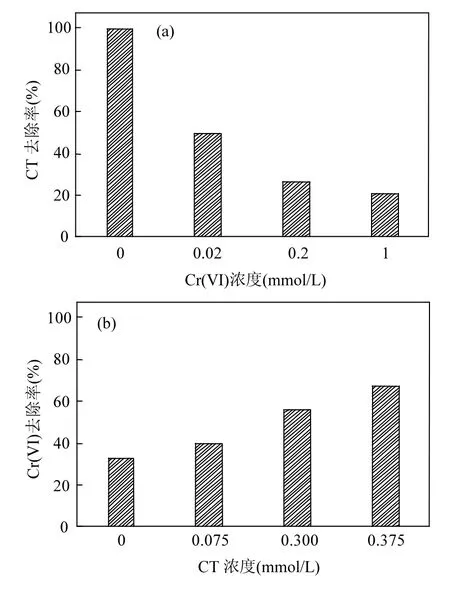
图4 CT和Cr(VI)浓度对复合污染处理效果的影响Fig.4 Effects of Cr(VI) and CT concentrations on the reduction performance in the combined pollutants system
图4(b)为CT初始浓度对Cr(VI)去除率的影响.当CT初始浓度由0增加至0.375mmol/L时,30min内Cr(VI)去除率由32.7%升高至67.3%,呈递增趋势,表明热活化过硫酸钠/甲酸体系中CT的存在能够促进 Cr(VI)还原.Cr(VI)的促进作用可能由两种原因所致:①CT与CO2·-反应生成·CCl3[19],文献报道其可以将MnO4-还原为 MnO42-,推断也能够促进 Cr(VI)还原;②Cr(VI)还原为 Cr(III)会经过Cr(II)、Cr(IV)、Cr(V)等价态,这些中间价态的Cr能够与有机基团反应形成多种配合物,从而增强Cr(VI)还原效率[20-21].Buerge等[21]在研究有机配体对二价铁还原Cr(VI)的影响时发现,羧酸和酚等能够与Cr(III)形成稳定复合物,使Cr(III)不会重新被氧化成高价态 Cr,从而加快 Cr(VI)还原效率.Puzon[22]等研究发现细胞有机物存在时,Cr(VI)还原形成的可溶性 Cr(III)-有机配合物同样能够增强Cr(VI)还原效率,并且,该Cr(III)-有机配合物能够长期稳定存在.复合污染的研究结果表明,水相中Cr(VI)与CT存在相互作用,Cr(VI)抑制CT的降解,而CT促进Cr(VI)的还原.
2.4 甲基紫精的影响

图5 甲基紫精对去除CT和Cr(VI)的影响Fig.5 Effect of MV on CT and Cr(VI) removal
根据文献报道,甲基紫精(MV)能够作为CO2·-的淬灭剂[23](式(3)).Berkovic等[16]研究证实,MV可以竞争消耗CO2·-从而抑制HgCl2还原效率.因此,试验分别考察甲基紫精对热活化过硫酸钠/甲酸工艺去除CT和Cr(VI)的影响,结果如图 5所示.加入甲基紫精后,CT降解受到明显抑制,60min内CT去除率由99.9%下降至44.3%,表明CO2·-为CT降解的主导自由基.然而,Cr(VI)还原过程中加入甲基紫精却起促进作用.由式(3)可知,甲基紫精和 CO2·-反应能够产生 MV·+等有机基团,与CT对Cr(VI)作用类似,有机物质存在时能够促进 Cr(VI)去除效果.因此,我们推断,有机物质能够强化CO2·-还原Cr(VI)的效率.
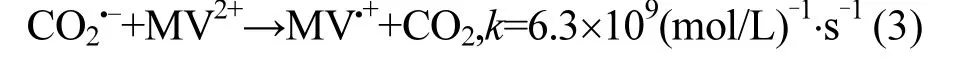
3 结论
3.1 热活化过硫酸钠/甲酸技术能够有效还原水溶液中CT和Cr(VI).50℃,过硫酸盐与甲酸浓度均为 100mmol/L时,CT或 Cr(VI)分别在60min、120min内基本完全去除.
3.2 试验条件下,增大过硫酸钠或甲酸初始浓度能够提高CT或Cr(VI)去除效率.
3.3 复合污染体系中,Cr(VI)的存在抑制 CT降解,而CT对还原Cr(VI)起促进作用.
3.4 加入甲基紫精后 CT降解受到抑制,表明CO2·-是起还原作用的主导自由基;Cr(VI)处理过程中加入甲基紫精呈促进作用,表明有机物质能够促进热活化过硫酸钠/甲酸工艺还原Cr(VI).
[1] 廖晓勇,崇忠义,阎秀兰,等.城市工业污染场地:中国环境修复领域的新课题 [J]. 环境科学, 2011,32(3):784-794.
[2] Kaur K, Crimi M. Release of chromium from soils with persulfate chemical oxidation [J]. Groundwater, 2014,52(5):748-755.
[3] Arjoon A, Olaniran A O, Pillay B. Co-contamination of water with chlorinated hydrocarbons and heavy metals: challenges and current bioremediation strategies [J]. International Journal of Environmental Science and Technology, 2013,10(2):395-412.
[4] 杨世迎,陈友媛,胥慧真,等.过硫酸盐活化高级氧化新技术 [J].化学进展, 2008,20(9):1433-1438.
[5] Tsitonaki A, Petri B, Crimi M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate: a review [J]. Critical Reviews in Environmental Science and Technology,2010,40(1):55-91.
[6] Siegrist R L, Crimi M, Petri B G, et al. In situ chemical oxidation for groundwater remediation [J]. Serdp & Estcp Remediation Technology Monograph, 2011,6(10):19.
[7] 刘佳露,卢 伟,张凤君,等.活化过硫酸盐氧化地下水中苯酚的动力学研究 [J]. 中国环境科学, 2015,35(9):2677-2681.
[8] Liang C J, Bruell C J, Marley M C, et al. Thermally activated persulfate oxidation of trichloroethylene (TCE) and 1, 1,1-trichloroethane (TCA) in aqueous systems and soil slurries [J]. Soil and Sediment Contamination: An International Journal,2003,12(2):207-228.
[9] Yang S, Wang P, Yang X, et al. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: persulfate, peroxymonosulfate and hydrogen peroxide [J]. Journal of Hazardous Materials, 2010,179(1):552-558.
[10] Tan C, Gao N, Deng Y, et al. Degradation of antipyrine by heat activated persulfate [J]. Separation and Purification Technology,2013,109:122-128.
[11] Huang K C, Zhao Z, Hoag G E, et al. Degradation of volatile organic compounds with thermally activated persulfate oxidation[J]. Chemosphere, 2005,61(4):551-560.
[12] Rosso J A, Bertolotti S G, Braun A M, et al. Reactions of carbon dioxide radical anion with substituted benzenes [J]. Journal of Physical Organic Chemistry, 2001,14(5):300-309.
[13] Koppenol W H, Rush J D. Reduction potential of the carbon dioxide/carbon dioxide radical anion: a comparison with other C1radicals [J]. Journal of Physical Chemistry, 1987,91(16):4429-4430.
[14] Mora V C, Rosso J A, Le Roux G C, et al. Thermally activated peroxydisulfate in the presence of additives: a clean method for the degradation of pollutants [J]. Chemosphere, 2009,75(10):1405-1409.[15] Xu M, Gu X, Lu S, et al. Degradation of carbon tetrachloride in thermally activated persulfate system in the presence of formic acid [J]. Frontiers of Environmental Science and Engineering, 2015:1-9.
[16] Berkovic A M, Gonzalez M C, Russo N, et al. Reduction of mercury (II) by the carbon dioxide radical anion: A theoretical and experimental investigation [J]. The Journal of Physical Chemistry A, 2010,114(49):12845-12850.
[17] Xu M, Gu X, Lu S, et al. Degradation of carbon tetrachloride in aqueous solution in the thermally activated persulfate system [J]. Journal of Hazardous Materials, 2015,286:7-14.
[18] Smith B A, Teel A L, Watts R J. Identification of the reactive oxygen species responsible for carbon tetrachloride degradation in modified Fenton's systems [J]. Environmental Science and Technology, 2004,38(20):5465-5469.
[19] Koster R, Asmus K D. Reduction of carbon tetrachloride by hydrated electrons, H-atoms, and reducing radicals [J]. Zeitschrift Fur Naturforschung part B-Chemie Biochemie Biophysik Uad Verwandten Gebiete, 1971(11):1104-1108.
[20] Perez-Benito J F, Arias C. A kinetic study on the reactivity of chromium (IV) [J]. Canadian Journal of Chemistry, 1993,71(5):649-655.
[21] Buerge I J, Hug S J. Influence of organic ligands on chromium(VI) reduction by iron (II) [J]. Environmental Science and Technology, 1998,32(14):2092-2099.
[22] Puzon G J, Roberts A G, Kramer D M, et al. Formation of soluble organo-chromium (III) complexes after chromate reduction in the presence of cellular organics [J]. Environmental Science and Technology, 2005,39(8):2811-2817.
[23] Das T N, Ghanty T K, Pal H. Reactions of methyl viologen dication (MV2+) with H atoms in aqueous solution: mechanism derived from pulse radiolysis measurements and ab initio MO calculations [J]. The Journal of Physical Chemistry A, 2003,107(31):5998-6006.
The removal performance of carbon tetrachloride and Cr(VI) in aqueous solution by thermally-activated persulfate/formic acid process.
GAO Lei1, GU Xiao-gang1,2*, LÜ Shu-guang1, LI Qing-yi1, YANG Xue-rui1,WANG Bei-ning1, LU Ze-hai1(1.State Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process, Shanghai Key Laboratory of Functional Materials Chemistry, East China University of Science and Technology, Shanghai 200237, China;2.State Key Laboratory of Chemical Engineering,East China University of Science and Technology, Shanghai 200237, China). China Environmental Science,2016,36(9):2645~2649
Carbon tetrachloride (CT) and hexavalent chromium removal performances were investigated by the thermal activation of persulfate, in the presence of formic acid to turn the oxidizing capacity of the reaction mixture into a reductive one by the generation of carbon dioxide anion radicals (CO2·-). The Effects of initial concentrations of persulfate and formic acid on CT and Cr(VI) removal were evaluated respectively. For single pollutant system, when the initial persulfate and formic acid concentrations were both 100mmol/L, CT and Cr (VI) could be almost completely removed in 120min and 60min at 50℃, respectively. In addition, the removal efficiencies of CT and Cr (VI) increased with increasing persulfate and formic dosage. For the combined pollutants system, CT degradation efficiency was found to decrease with increasing Cr (VI) concentrations. However, Cr (VI) removal was increased with an increase in CT concentrations. CT degradation was inhibited with the addition of methyl viologen as CO2·-scavenger, while an enhanced Cr (VI) reduction was observed, indicating that the addition of organic substances may shift to favor Cr (VI) removal in thermally-activated persulfate/formic process.
carbon tetrachloride;Cr(VI);thermally-activated persulfate;carbon dioxide anion radicals
X523
A
1000-6923(2016)09-2645-05
2016-01-26
国家自然科学基金(41373094);中国博士后科学基金(2015M570341);中央高校基本科研业务费专项资金(222201514339)
* 责任作者, 讲师, xggu@ecust.edu.cn
高 磊(1992-),男,湖北鄂州人,华东理工大学硕士研究生,主要从事污染场地修复治理研究.
