布鲁氏菌分离株MLVA分子分型鉴定
2016-12-01马晓菁易新萍谷文喜吐尔洪努尔马俊杰
马晓菁,叶 锋,姚 刚,易新萍,刘 帅,谷文喜,吐尔洪·努尔,马俊杰,钟 旗
布鲁氏菌分离株MLVA分子分型鉴定
马晓菁1,叶 锋1,姚 刚2,易新萍1,刘 帅2,谷文喜1,吐尔洪·努尔1,马俊杰1,钟 旗1
目的 对牛奶、羊奶以及羊流产胎儿中分离布鲁氏菌进行分型鉴定。方法 采集新疆4个地区牛奶20份,羊奶20份,羊流产胎儿10份,分离培养后,运用VirB8-PCR和布鲁氏菌分子分型PCR(AMOS-PCR)方法对分离株进行布鲁氏菌属、种的鉴定,同时采用MLVA方法对分离株进一步鉴定,并将测定结果与http://mlva.u-psud.fr/数据库提供的布鲁氏菌数据进行比较,结合软件BioNumerics 6.6进行聚类分析。结果 6株分离株均为羊种3型布鲁氏菌,与辽宁省分离羊种3型布鲁氏菌在聚类分析中关系较近。结论 MLVA作为布鲁氏菌基因分型鉴定的一种快速、可靠的方法,为今后布鲁氏菌传染源的追溯及防控措施的制定提供依据。
MLVA; 牛乳; 布鲁氏菌; 鉴定
布鲁氏菌病是由布鲁氏菌引起的世界范围内严重危害畜牧业和人类健康的人畜共患病。布鲁氏菌属分为9个种[1],其中牛种和羊种布鲁氏菌传染性较强,也是我国主要流行的布鲁氏菌菌种。新疆地区早在20世纪50~80年代初就是我国主要的布病疫区,90年代初新疆布病疫情得到了有效的控制,但此后布病疫情不断回升[2]。人类可通过直接接触患病动物感染布鲁氏菌病, 患病动物的皮、毛、乳、肉以及内脏也是该病重要的传染源[3-6]。新疆人间布病监测结果显示2013年乳肉加工人员、畜产品销售加工人员布病疫情上升较明显[7]。畜间布病疫情回升不仅严重影响畜牧业的发展,同时危害人民健康。
布鲁氏菌传统的细菌学鉴定方法,虽可以对病畜做出确切的诊断,但鉴定时间长,且对实验室操作人员具有较高的感染风险[8]。多位点可变数目串联重复序列分析(Multiplelocus variable-number tandem-repeat analysis,MLVA)是近年发展起来的以PCR为基础,根据被检菌株散在基因组中不同位点的、变数量串联重复序列(variable number randem repeat,VNTR)的重复单元拷贝数的差异来进行分子分型的技术。该方法具有操作简单,重复性好,可比性强等优点[9]。本研究利用MLVA方法对牛奶、羊奶以及羊流产胎儿中分离布鲁氏菌进行生物型的分析,为追溯传染源,确定当地布鲁氏菌流行趋势制定相应的防控措施提供依据。
1 材料与方法
1.1 对象 分别从新疆不同地区采集牛奶20份、羊奶20份、羊流产胎儿10份,送实验室-20 ℃保存。
1.2 主要试剂 布鲁氏菌琼脂培养基(BBLTMBrucella Agar)和布鲁氏菌液体培养基均购自Becton and Dickinson company公司,布鲁氏菌培养添加剂(OXO ID Ltd)、PCRmix、细菌基因组DNA提取试剂盒均购自北京庄盟生物有限公司,引物由上海基康生物技术有限公司合成,PCR产物送北京鼎国生物有限公司测序。牛种布鲁氏菌疫苗株A19,羊种布鲁氏菌标准菌株16M均由新疆畜牧科学院兽医研究所布病室保存。
1.3 方法
1.3.1 细菌培养 将乳样混匀取300 μL接种布鲁氏菌琼脂培养基,无菌取流产胎儿脾脏研磨后接种布鲁氏菌琼脂培养基,置于37 ℃,含5% CO2培养48 h~72 h,观察细菌生长情况。
1.3.2 布鲁氏菌属、种PCR鉴定 取布鲁氏菌琼脂培养基生长疑似菌落,接种布鲁氏菌肉汤培养基中,增菌培养。按照细菌基因组DNA提取试剂盒方法提取DNA作为模板,参照钟旗[10]等建立的VirB8-PCR方法,扩增布鲁氏菌VirB8基因,对分离株进行布鲁氏菌属的鉴定。根据参考文献[11-12]采用AMOS-PCR方法对布鲁氏菌分离株进行种型的鉴定。反应条件如下:94 ℃ 5 min;94 ℃ 60 s、60 ℃ 90 s、72 ℃ 60 s,40个循环;72 ℃延伸10 min。
1.3.3 MLVA鉴定 合成引物16对Panel 1(Bruce06、Bruce08、Bruce11、Bruce12、Bruce42、Bruce43、Bruce45、Bruce55),Panel 2(Bruce18、Bruce19、Bruce21、Bruce04、Bruce07、Bruce09、Bruce16、Bruce30 )见文献[13-14],反应体系:PCRmix 12.5 μL,上、下游引物(10 pmol/μL)各1 μL、分离菌DNA 1 μL双蒸水补足25 μL,反应条件:96 ℃,3 min;96 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,35个循环;72 ℃延伸5 min。Panel 1引物扩增PCR产物1%琼脂糖凝胶电泳,Panel 2引物扩增产物毛细管电泳,并送公司测序。计算获得各位点的重复单元数,整理成Excel表格,将结果输入http://mlva.u-psud.fr/,与数据库进行比较,以确定分型,通过软件BioNumerics 6.6聚类分析,聚类方式采用平均连锁聚类法(UPGMA)。
2 结 果
2.1 细菌分离培养 40份奶样、10份羊流产胎儿脾脏接种布鲁氏菌琼脂培养基培养3~4 d,观察菌落生长情况,其中1份牛奶样,3份羊奶样,2份流产胎儿脾脏接种的培养基上可见圆形、无色透明、表面凸起的菌落生长。
2.2 布鲁氏菌属VirB8-PCR鉴定 挑取6个培养基上的疑似菌落,增菌,提取基因组DNA作为模板,采用VirB8-PCR方法对疑似布鲁氏菌PCR鉴定。分别以牛种布鲁氏菌疫苗株A19和大肠杆菌DH5α作为阳性对照和阴性对照。PCR鉴定结果可见6株分离株均扩增出750 bp左右的条带,与阳性对照一致,而阴性对照DH5α未扩增出相应条带,见图1。

M:DNA DL2000 Marker;1:E.coli DH5α;2:牛种布鲁氏菌标准菌A19;3-8:奶样、流产胎儿中布鲁氏菌分离株M:DNA DL2000 Marker;1:E.coli DH5α;2:Standard strain of B.abortus;3-8:Brucella isolated in milk and aborted fetuses图1 布鲁氏菌分离株VirB8-PCR鉴定Fig.1 Identification of Brucella by VirB8-PCR
2.3 布鲁氏菌种型AMOS-PCR鉴定 VirB8-PCR鉴定阳性分离株采用AMOS-PCR方法进一步种型的鉴定,牛种A19(1、2、3a、4型)、羊种16M和大肠杆菌DH5α作为阳性对照和阴性对照。鉴定结果显示6株布鲁氏菌分离株均扩增出731 bp条带,与羊种布鲁氏菌(1、2、3型)扩增结果一致,见图2。表明6株分离株为羊种布鲁氏菌。
2.4 MLVA分型 分别对6株羊种布鲁氏菌分离株16个位点重复单元PCR扩增,获得相应片段,见图3。
整理测序结果计算重复单元数,将结果输入到http://mlva.u-psud.fr/,与数据库进行比较,结果见表1。
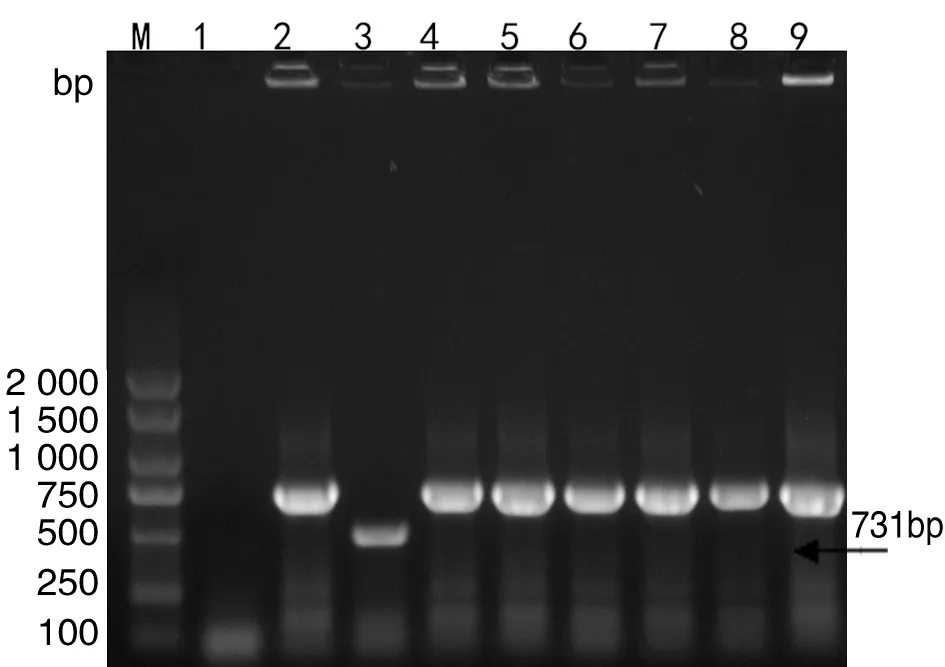
M:DNA DL2000 Marker;1:E.coli DH5α;2:羊种标准布鲁氏菌16M;3:牛种标准布鲁氏菌A19;4-9:奶样及流产胎儿中布鲁氏菌分离株M:DNA DL2000 Marker;1:E.coli DH5α;2:Standard strain of B.melitensis;3:Standard strain of B.abortus;4-9:Brucella isolated in milk and aborted fetuses图2 布鲁氏菌分离株AMOS-PCR鉴定Fig.2 Identification of Brucella biotypes by AMOS-PCR

M:DNA DL2000 Marker;1:Bruce 11位点;2:Bruce 06位点;3:Bruce 12位点;4:Bruce 45位点;5:Bruce 08位点;6:Bruce 42位点;7:Bruce 55位点;8:Bruce 43位点M:DNA DL2000 Marker;1:Bruce 11;2:Bruce 06;3:Bruce 12;4:Bruce 45;5:Bruce 08;6:Bruce 42;7:Bruce 55;8:Bruce 43.图3 布鲁氏菌分离株MLVA位点PCR扩增Fig.3 Brucella isolates PCR amplification of MLVA
表1 6株布鲁氏菌分离株MLVA分型结果Tab.1 Result of 6 Brucella strain by MLVA
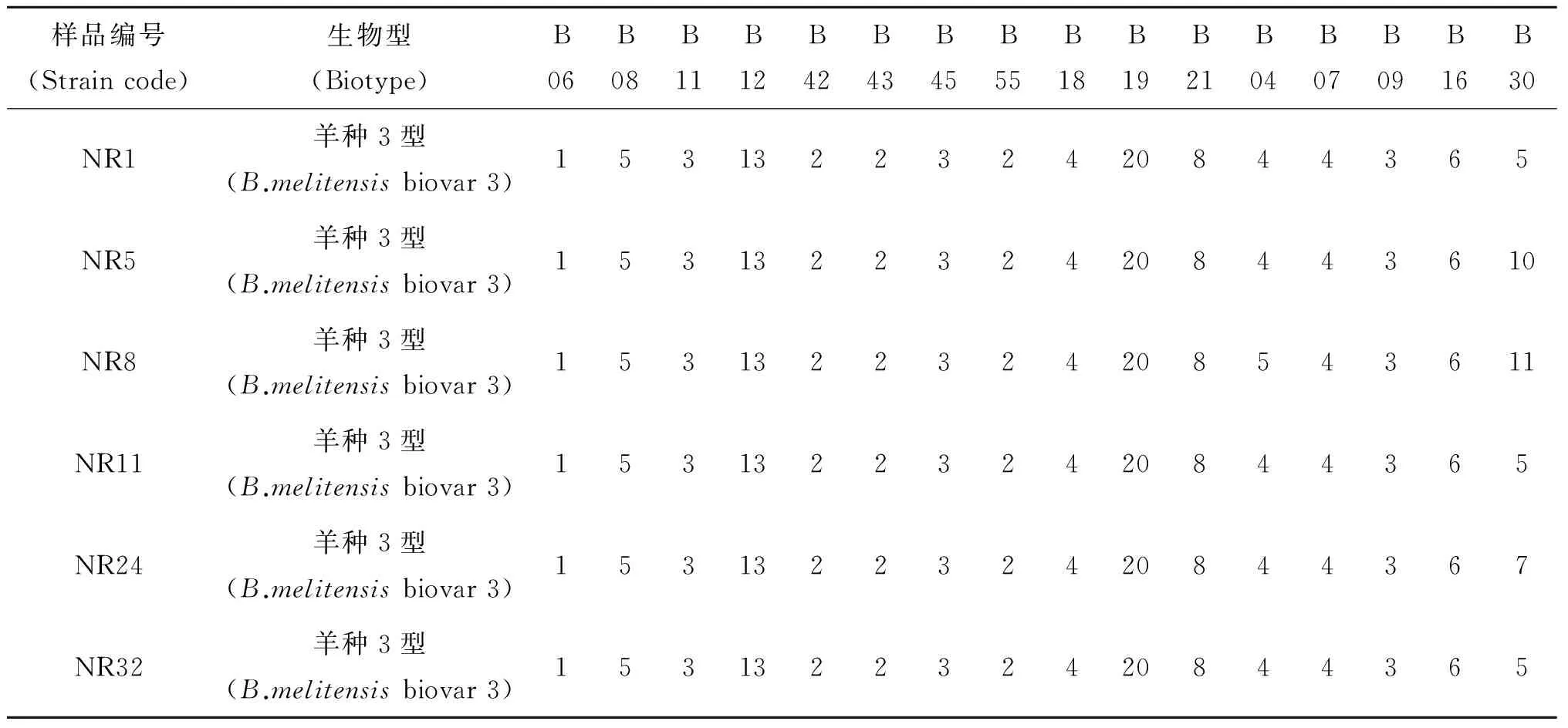
样品编号(Straincode)生物型(Biotype)B06B08B11B12B42B43B45B55B18B19B21B04B07B09B16B30NR1羊种3型(B.melitensisbiovar3)153132232420844365NR5羊种3型(B.melitensisbiovar3)1531322324208443610NR8羊种3型(B.melitensisbiovar3)1531322324208543611NR11羊种3型(B.melitensisbiovar3)153132232420844365NR24羊种3型(B.melitensisbiovar3)153132232420844367NR32羊种3型(B.melitensisbiovar3)153132232420844365
VirB8-PCR、AMOS-PCR及MLVA方法对分离株鉴定,结果表明6株分离株均为羊种3型布鲁氏菌,见表2。
2.5 聚类分析 将扩增产物VNTR重复次数,经BioNumerics 6.6进行聚类分析,结果可见牛奶、羊奶以及羊流产胎儿中分离6株羊种布鲁氏菌与辽宁省分离羊种3型布鲁氏菌在聚类分析中关系较近,见图4。
表2 6株布鲁氏菌分离株鉴定结果
Tab.2 ientification result of 6 Brucella strain
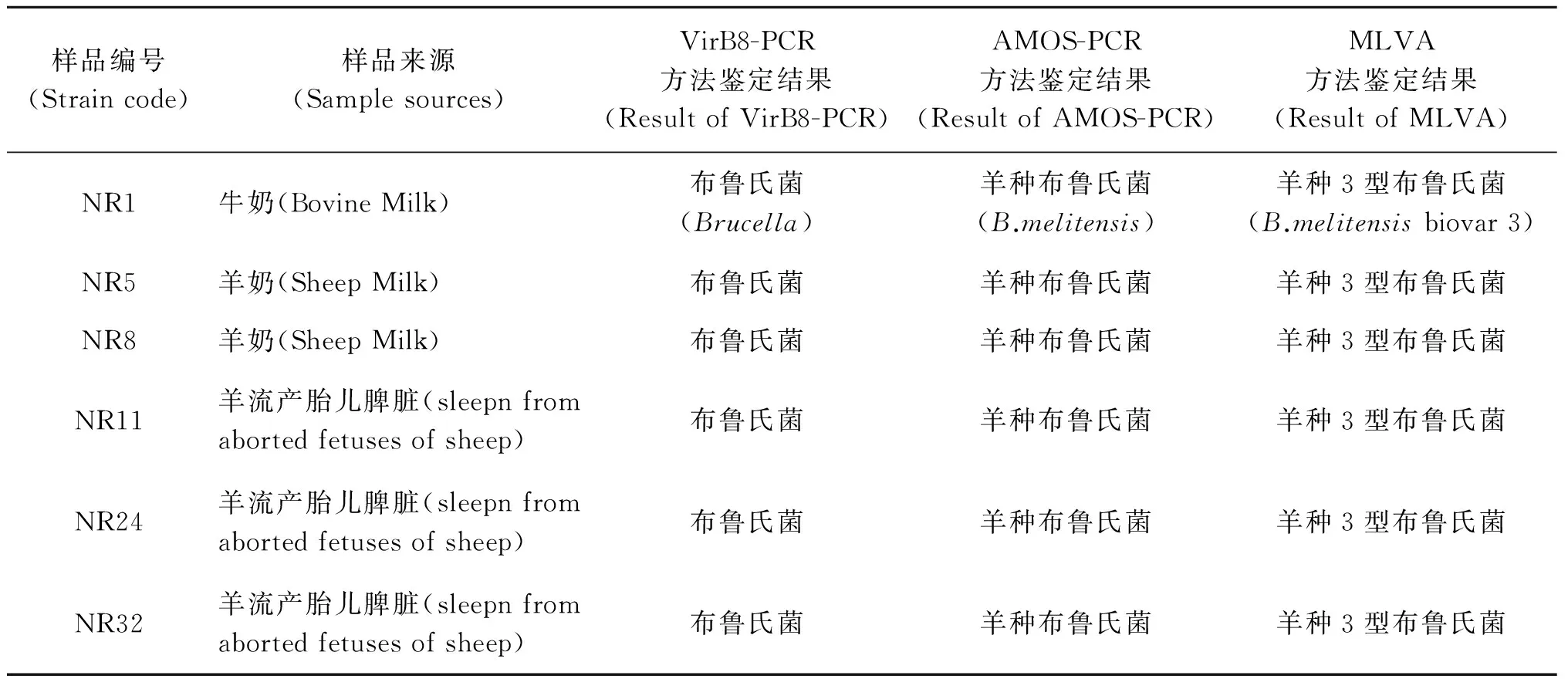
样品编号(Straincode)样品来源(Samplesources)VirB8-PCR方法鉴定结果(ResultofVirB8-PCR)AMOS-PCR方法鉴定结果(ResultofAMOS-PCR)MLVA方法鉴定结果(ResultofMLVA)NR1牛奶(BovineMilk)布鲁氏菌(Brucella)羊种布鲁氏菌(B.melitensis)羊种3型布鲁氏菌(B.melitensisbiovar3)NR5羊奶(SheepMilk)布鲁氏菌羊种布鲁氏菌羊种3型布鲁氏菌NR8羊奶(SheepMilk)布鲁氏菌羊种布鲁氏菌羊种3型布鲁氏菌NR11羊流产胎儿脾脏(sleepnfromabortedfetusesofsheep)布鲁氏菌羊种布鲁氏菌羊种3型布鲁氏菌NR24羊流产胎儿脾脏(sleepnfromabortedfetusesofsheep)布鲁氏菌羊种布鲁氏菌羊种3型布鲁氏菌NR32羊流产胎儿脾脏(sleepnfromabortedfetusesofsheep)布鲁氏菌羊种布鲁氏菌羊种3型布鲁氏菌

图4 6株布鲁氏菌分离株MLVA聚类分析Fig.4 Dendrogram based on the MLVA genotyping assay of the 6 strains of Brucella
3 讨 论
布病疫情的回升不仅与疫情程度、流行范围有关,更重要的是对布病控制所采取有效的防治策略与措施相关[14],针对不同地区布病流行情况因地制宜采取相应的措施能够有效控制布病疫情。本研究通过分子生物学方法替代传统方法完成分离株型的鉴定,与传统的生物学鉴定方法相比操作过程简单、快速,并降低操作人员感染布鲁氏菌病的风险。多位点数目可重复序列分析(MLVA)通过分析VNTR分布进行基因分型研究。Le Flèche P和Al DahouK S[15-16]建立并完善的布鲁氏菌MLVA-16位点,将16个位点分为3组,Panel 1包括8个位点,用于布鲁氏菌种的比较。Panel 2A包括3个位点,Panel 2B包括5个位点,用于布鲁氏菌进一步分型以及菌株间基因型的比较。杨杰[9]等初步建立了我国常见布鲁氏菌MLVA分型参考标准操作方法,用于布鲁氏菌鉴定、基因分型以及传染源的追溯、布鲁氏菌暴发和流行的分析。姜海[17]等通过MLVA方法结合多重PCR对24株犬种布鲁氏菌遗传关系研究,结果表明该方法可以用于布鲁氏菌种(生物型)的鉴定,成为传统表型鉴定方法的补充。毛玲玲[18]等采用MLVA方法对辽宁地区人间分离布鲁氏菌33株分型分析,结果表明辽宁省布鲁氏菌存在丰富的多态性,为布鲁氏菌病的防治提供有力的分子生物学依据。本研究采用MLVA方法对分离布鲁氏菌进行种型的鉴定,结果可见6株分离株均为羊种布鲁氏菌生物3型,与辽宁省分离羊种3型布鲁氏菌在聚类分析中关系较近。
新疆是我国五大牧区之一,也是布病的老疫区。我区布鲁氏菌病的防治工作从1954年起开展,上世纪80~90年代畜间布病疫情大幅度下降,1993年对新疆分离布鲁氏菌进行系统鉴定结果发现新疆流行的布鲁氏菌有5个种8个生物型,分别为羊种布鲁氏菌生物1、2、3型,其中以羊种1型最多,牛种布鲁氏菌生物1、3型,其中牛种布鲁氏菌生物1型最多,猪种布鲁氏菌生物3型,犬种布鲁氏菌、绵羊附睾种布鲁氏菌[19]。近年来畜间布鲁氏菌病疫情持续上升,2005—2007年家畜总布病阳性率为20世纪90年代的2倍,2010年家畜布病发病数是2006年的4.01倍[20]。本研究从牛奶、羊奶以及羊流产胎儿中分离出羊种布鲁氏菌生物3型与近年来新疆地区及我国其它部分省市布鲁氏菌流行菌型一致[21],表明新疆地区布病疫情上升可能与家畜引进过程中隔离、复检等监管措施不力有关,应加强家畜产地检疫及流通环节的监督力度。
人间的布病来自畜间,乳和肉等畜产品是人间布鲁氏菌病流行的重要传染因子。因此,在制定合理畜间布病防治措施的同时应加强乳和肉等畜产品检疫、监督管理。
[1] Cloeckaert A,Vizcaino N, Paquet JY, et al.Major outer membrane proteins ofBrucellaspp.past, present and future[J].Vet Microbiol,2002,90:229-247.
[2] Li L,Yan JH,Yan H,et al. Research of prevention technology and prevalent in livestock brucellosis in Xinjiang[J].Grass-Feeding Livestock,2012,(9):19-22.(in Chinese)
李玲,闫晶华,闫昊,等.新疆畜间布鲁氏菌病流行情况及防制技术研究[J].草食家畜,2012(9):19-22
[3] Adams L,Station T,NetLibrary I.Advances in brucellosis research[M].Texas: Texas A&M University,1990.
[4] Corbel MJ. Manual of diagnostic tests and vaccines for terrestrial animals[M].6thed. Paris: Office International des Epizootics,OIE.2008:36-37.
[6] Ren DK,Chang Q,Shi ML,et al. Epidemic situation and preventive measures ofBrucellain Xinjiang[J].Endem Dis Bull,2008,(5):36-37.(in Chinese)
任德坤,常青,师茂林,等.新疆布鲁氏菌病疫情现状与防治对策[J].地方病通报,2008,(5):36-37
[7] M Hasan, He HB,Tai XP,et al.Analysis of surveillance data and epidemic situation of human brucellosis in Xinjiang,2013[J]. Chin J Vector Biol Ctrl,2015,(2):86-88.(in Chinese)
木合塔尔·艾山,何海波,邰新平等. 新疆2013年人间布鲁氏菌病监测结果及疫情分析[J].中国媒介生物学及控制杂志,2015(2):86-88
[8] Bricker BJ. PCR as a diagnostic tool for brucellosis[J].Vet Microbiol,2002,90:435-446.DOI: 10.1016/S0378-1135(02)00228-6
[9] Yang J,Zhao SL,Cui BY,et al. Establishment of standard operation procedures for multiple locus variable number tandem repeats analysis on typing ofBrucella[J].Dis Surveill, 2015,(2):86-88.(in Chinese)
杨杰,赵素莲,崔步云,等. 多位点可变数目串联重复序列分型方法检测布鲁氏菌分型标准化操作方法的建立和应用[J]. 疾病监测2012 ,27 (2 ).137-140.
[10] Zhong Q,Fan WX,Wu DL,et al.Establishment of method to detect the virulence factor ofBrucellathe VirB8-PCR assay[J]. Chin J Zoonoses,2008,24(1):50-54.(in Chinese)
钟旗,范伟兴,吴冬玲,等.布鲁氏菌VirB8-PCR方法的建立[J]. 中国人兽共患病学报,2008,24(1): 50-54.
[11] Zhong Q,Yi XP,Li B,et al.Study and application of polymerase chain reaction assay onBrucellaidentification[J].Chin J Zoonoses,2011,27(3): 241-245.(in Chinese)
钟旗,易新萍,李博,等.布鲁氏菌PCR鉴定方法的研究与应用[J]. 中国人兽共患病学报,2011,27(3): 241-245.
[12] Zhong Q,FanWX,He QN,et al.Use of the abbreviatedBrucellaAMOS-PCR assay for the species identification ofBrucella[J]. Chin J Zoonoses, 2007,23(7):683-686.(in Chinese)
钟旗,范伟兴,何倩倪,等.用AMOS—PCR对布鲁氏菌种型鉴定的研究[J].中国人兽共患病学报,2007,23(7):683-686.
[13] Yang J.The establishment and application of theBrucellaMLVA and the HOOF standard operation procedures[D].Taiyuan:Shanxi Medical University,2012.(in Chinese)
杨杰.布鲁氏菌MLVA和HOOF分型标准操作方法的建立及应用[D].山西医科大学,2012.
[14] Shang DQ.Brucellaregarded as re-emerging disease and the reason[J].China J Ctrl Endem Dis,2001,16(1):29-34.(in Chinese)
尚德秋.布鲁氏菌病再度肆虐及其原因[J].中国地方病防治杂志,2001,16(1):29-34
[15] Le Flèche P,Jacques I, Grayon M,et al. Evaluation and selection of tandem repeat loci for aBrucellaMLVA typing assay[J].BMC Microbiol,2006,6:9. DOI: 10.1186/1471-2180-6-9
[16] AL Dahouk S, Fleche PL,Nockler K,et al.Evaluation ofBrucellaMLVA typing for human brucellosis[J].Microbiological Methods,2007,69(1):137-145.DOI: 10.1016/j.mimet.2006.12.015
[17] Jiang H,Cui BY,Li LY,et al. TypingBrucellacanis strains gene with multiple-locus variable-number tandem-repeat analysis and multiplex PCR assay[J].Lett Biotechnol, 2009,20(3):336-338.(in Chinese)
姜海,崔步云,李兰玉,等. 用MLVA技术和多重PCR对犬种布氏菌基因分型[J].生物技术通讯,2009,20(3):336-338
[18] Mao LL,Jiang H,Lei L,et al.Brucellosis epidemic situation and typing with MLVA in Liaoning province[J].Chin J Public Health,2012,28(12):1650-1652.(in chinese)
毛玲玲,姜海,雷露,等. 辽宁省2010 年布鲁氏菌病疫情及MLVA分型[J].中国公共卫生.2012,28(12):1650-1652.
[19] Yan SD,Liu ZW,Jing GY,et al.The control of epizootic brucellosis in Xinjiang[J].Eendm Dis Bull,1993,8(4):111-113.(in Chinese)
阎守敦,刘志文,金根源. 新疆动物布鲁氏菌病的防制[J].地方病通报,1993,8(4):111-113
[20] Zheng Q,Guan XD,CaoY,et al.Time and spatial distribution of human brucellosis in Xinjiang in the last 10 years[J].Bull Dis Ctrl Prev,2015, 30(3):8-12.(in Chinese)
郑强,关晓冬,曹岩,等. 近十年新疆人间布鲁氏菌病时空分布分析[J]. 疾病预防控制通报,2015,30(3):8-12
[21] Yi XP, Li JP,Ye F,et al.Species and biotype analysis of isolated strains ofBrucellain Xinjiang[J].Xingjiang Agr Sci,2015,52(2):339-343.(in Chinese)
易新萍,李金平,叶锋,等.新疆牛羊布鲁氏菌流行株种及生物型鉴[J].2015,52(2):339-343
Zhong Qi,Email: yyyzqok@sina.com
Identification and classification ofBrucellastrain with MLVA
MA Xiao-jing1,YE Feng1,YAO Gang2,YI Xin-ping1,LIU Shuai2,GU Wen-xi1,NUER ·Tuerhong1,MA Jun-jie1, ZHONG Qi1
(1.InstituteofVeterinaryMedicine,XinjiangAcademyofAnimalScience,Urumqi830011,China;2.CollegeofAnimalMedicine,XinjiangAgriculturalUniversity,Urumqi, 830052,China)
We identified the type ofBrucellastrain from milk and abortus.The 20 portions of milk from dairy cows,20 portions of milk and 10 aborted fetuses from sheep were collected from four different area in Xinjiang.The suspected strains were identified by VirB8-PCR and AMOS-PCR.The further comparative analysis was conducted between our results andBrucellafrom database.(http://mlva.u-psud.fr/),and further phylogenetic tree was constructed by BioNumerics 6.6.Results showed that sixBrucellastrain were identified asBrucellamelitensis 3 by MLVA, and were close to theBrucellastrain belonging to Liaoning Province. Multiple Loci VNTR Analysis (MLVA )assays could be applied fast and reliably to detectBrucella.The result of MLVA provide the basis for tracing the source of infection and the scientific basis for the establishment of comprehensive measures for prevention and control of brucellosis.
MLVA;milk;Brucella;identification
钟 旗,Email:yyyzqok@sina.com
1.新疆畜牧科学院兽医研究所,乌鲁木齐 830011;
2.新疆农业大学动物科学院,乌鲁木齐 830052
10.3969/j.issn.1002-2694.2016.08.008
378
A
1002-2694(2016)08-0722-06
2016-04-20;
2016-05-29
新疆维吾尔自治区公益性科研院所基本科研业务经费项目(No.KY2014008)资助
Supported by the Basic Research Funds in Public Welfare Institution of Xinjiang(No. KY2014008)
