汉防己甲素对系统性白念珠菌感染小鼠的治疗作用
2016-12-01石建萍李水秀朱坤举张玲玲张艺山
石建萍,李水秀,朱坤举,张玲玲,张艺山,张 宏
汉防己甲素对系统性白念珠菌感染小鼠的治疗作用
石建萍1,李水秀2,朱坤举2,张玲玲2,张艺山2,张 宏2
目的 观察汉防己甲素在系统性白念珠菌感染小鼠中抗真菌疗效、细胞免疫调节效应及两者相关性。方法 雌性BALB/c小鼠随机分为对照组和感染组。对照组予生理盐水,感染组在尾静脉注射白念珠菌悬液后3 h,经腹腔注射不同剂量汉防己甲素(0、15、30、45和90 mg/kg),每日一次,连续7 d。观察小鼠生存时间、肾脏载菌量以及肾脏组织病理学检查评估抗真菌疗效;同时以ELISA法检测血清和Real-time RT-PCR检测肾组织中细胞因子IFN-γ、IL-10、TGF-β1 和IL-17A水平的动态变化。结果 与腹腔注射生理盐水的感染小鼠比较,汉防己甲素在90 mg/kg时,肾脏载菌量减少(P<0.05),与升高血清及肾组织IFN-γ、TGF-β1水平,降低IL-10、IL-17A水平有相关性;在 45 mg/kg及以下剂量时,生存时间、组织载菌量及细胞因子无差异(P>0.05)。结论 汉防己甲素在90 mg/kg时对系统性白念珠菌感染小鼠具有治疗作用,与其细胞免疫调节有相关性。
汉防己甲素;白念珠菌;小鼠
系统性白念珠菌病成为各种重症患者和免疫功能低下患者主要感染并发症之一[1]。对白念珠菌感染发病机制的研究表明[2-3],细胞免疫在白念珠菌感染中占主导地位,是宿主抵御真菌感染的主要机制,免疫细胞发挥作用的主要方式之一是分泌细胞因子,包括各种促炎因子及抑炎因子,它们在血清和组织中含量的高低,代表着机体抵御病原生物感染的能力及免疫状况,从而造成疾病的不同发展和转归。
汉防己甲素(Tetrandrine, TET),是从天然药用植物防己科千金藤属植物粉防己的块根中抽提出来的一种生物碱,药理作用广泛,用于抗炎、抗高血压、抗矽肺、抗纤维化、免疫调节等治疗[4]。其在免疫调节的作用是多方面的[5-6],包括抑制 T 淋巴细胞、嗜中性粒细胞及单核巨噬细胞等炎症细胞的增殖和激活、抗自由基损伤、抑制炎症介质释放。近十年,我们证实,在体外、实验动物局部外用和单纯性阴道念珠菌病志愿患者局部外用,汉防己甲素对氟康唑等唑类药物抗白念珠菌活性有显著的增效作用[7-13]。但汉防己甲素对系统性白念珠菌病的体内影响,尚未明确。检索文献,未见报道。因此,在本实验中,我们以系统性白念珠菌感染小鼠为研究对象,通过腹腔注射不同剂量汉防己甲素,以小鼠生存时间、肾脏真菌载菌量以及肾脏组织病理学检查评估其抗真菌疗效;以ELISA法检测血清和Real-time RT-PCR检测肾脏中细胞因子IFN-γ、IL-10、TGF-β1和IL-17A水平,评估其对各细胞因子的影响情况,初步探讨其抗真菌疗效、细胞免疫调节效应以及两者的相关性。
1 材料与方法
1.1 材料
1.1.1 实验菌株 白念珠菌标准株SC5314 由William A Fonzi教授( Department of Microbiology and Immunology,Georgetow n University, Washington DC, USA) 惠赠。菌种-80 ℃保存。
1.1.2 药物 TET,陕西慧科植物有限公司,批号20041226,纯度98%。TET 粉用灭菌蒸馏水和0.1 mol/L HCI溶解,配制成15 mg/mL的储备液,根据实验要求将原液分别稀释为15、30、45和90 mg/kg。
1.1.3 实验动物 SPF 级雌性BALB/c小鼠,6-8周龄,体质量17~20g,由广东省实验动物实验中心提供,批号:No.43007101008664。饲养于深圳北京大学香港科技大学医学中心[动物许可证号:SYXK(粤)2010-0106],动物伦理委员会批准号:(2013-005)。
1.1.4 试剂 ELISA试剂盒购自杭州联科生物技术有限公司;抗小鼠CD4 FITC-CD4抗体、抗小鼠TGF-β1 PE-TGF-β1抗体、抗小鼠IL-17APE-IL17A抗体、抗小鼠IL-10 PE-IL10抗体、抗小鼠IFN-γPE-IFN-γ抗体、破膜剂缓冲液及布雷非德菌素购自Ebioscience USA公司;Trizol总RNA提取试剂盒购自英潍捷基(上海)贸易有限;FastQuant cDNA第一链合成试剂盒购自天根生化科技(北京)有限公司;UltraSYBR Mixture购自北京康为世纪生物科技有限公司。
1.1.5 主要仪器设备 ST16R高性能通用台式冷冻离心机购自美国赛默飞世尔科技有限公司;实时荧光定量PCR仪购自ABI 7000(美国应用生物系统公司);酶标仪型号SpectraMax M2购自美国分子仪器公司。
1.2 方法
1.2.1 构建系统性白念珠菌感染小鼠模型 挑取白念珠菌SC5314 单克隆菌落,接种前菌株经2次SDA培养基活化(培养温度为 35 ℃)后,挑取新培养 24 h 的白念珠菌菌落,采集对数生长期细胞(摇菌12-16h),洗涤,悬浮在生理盐水中,血球计数板记数,以5 ×105CFU/mL的白念珠菌悬液0.2 mL尾静脉注射小鼠。
1.2.2 分组及治疗[14]分为6组,每组23只小鼠。对照组:正常小鼠,给予生理盐水;感染组:白念珠菌悬液接种小鼠,TET0组为生理盐水; TET15组、 TET30组、TET45组、TET90组分别为TET的不同剂量(15、30、45和90 mg/kg),在接种小鼠后3 h,开始腹腔注射,每日一次,连续7 d。
1.3 TET在系统性白念珠菌感染小鼠中抗真菌疗效1.3.1 生存时间观察 各组8只小鼠,从尾静脉注射白念珠菌悬液,成功构建白念珠菌感染小鼠开始观察,包括在连续腹腔注射7 d以及停止治疗后,观察至28 d,每天观察并记录各组小鼠的死亡情况。
1.3.2 肾脏载菌量测定 以肾脏菌落形成单位(CFU)表示。分别予第1 d、4 d、8 d,每组各取5只小鼠,无菌取小鼠一侧肾脏。具体步骤:①用微量电子天平称量左侧肾脏的重量;②将肾脏剪成小块装入组织匀浆器中,加入1 mL无菌生理盐水,研磨;③移液器吸取100 μL组织匀浆加入900 μL无菌生理盐水10倍稀释,取100 μL接种于SDA平面培养基上,35 ℃孵育48 h;④计数培养基平面上生长的菌落数并计算出单位重量小鼠肾脏所含的菌量(log10CFU/g )。
1.3.3 病理组织活检 第8 d处死小鼠,无菌取出小鼠一侧肾脏浸入4%多聚甲醛固定,乙醇脱水,二甲苯固定透明,石蜡包埋,连续组织切片(片厚5 μm)。予HE染色和PAS染色。
1.4 TET在系统性白念珠菌感染小鼠中IFN-γ、IL-10、IL-17A 和TGF-β1影响
1.4.1 ELISA检测血清IFN-γ、IL-10、IL-17A 和TGF-β1水平 分别予第1 d、4 d、8 d,每组各取5只小鼠,内眦静脉取血至肝素抗凝管,通过双抗体夹心酶联免疫吸附试验(ELISA)测定血清IFN-γ、IL-10、IL-17A 和TGF-β1水平。
1.4.2 Real-time RT-PCR检测肾脏中IFN-γ、IL-10、IL-17A 和TGF-β1 mRNA相对表达量 Trizol提取肾脏组织总RNA,按照FastQuant cDNA第一链合成试剂盒说明书操作步骤合成cDNA,应用SYBR Green染料法,通过ABI 7000定量PCR仪检测。扩增引物合成,设计长度约15~20 bp,各种细胞因子的引物由上海生物工程有限公司合成,用ddH2O稀释至200 pmpl/μL,分装后-20 ℃冰箱保存。
引物序列如下:
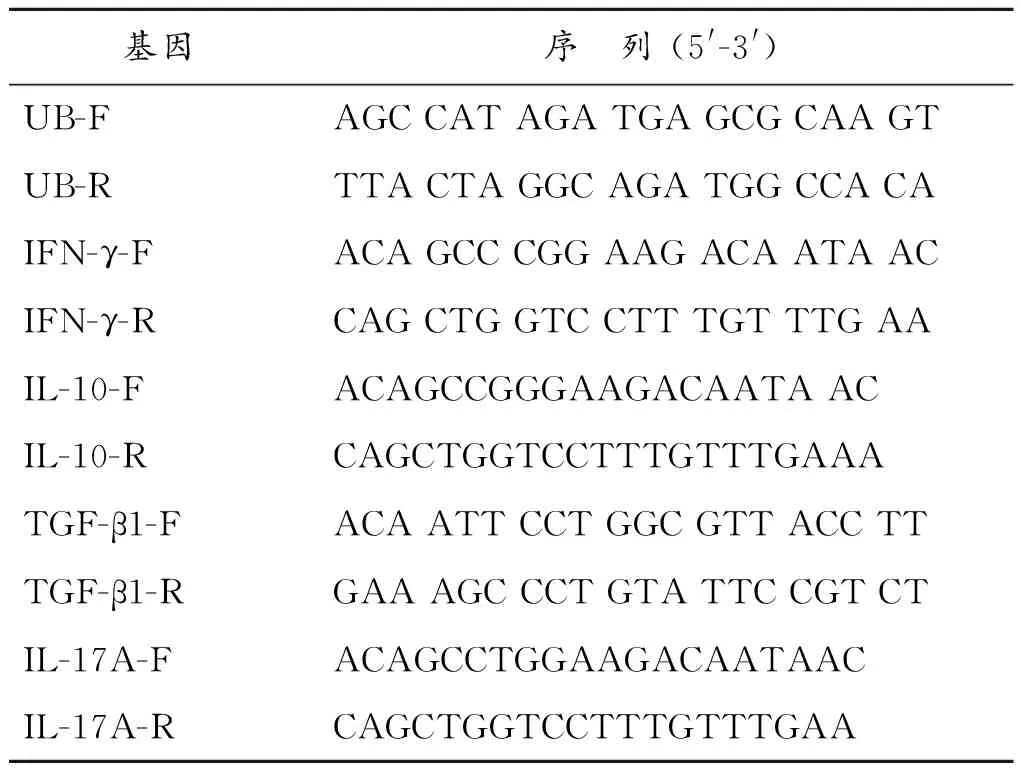
基因序 列(5'-3')UB-FAGCCATAGATGAGCGCAAGTUB-RTTACTAGGCAGATGGCCACAIFN-γ-FACAGCCCGGAAGACAATAACIFN-γ-RCAGCTGGTCCTTTGTTTGAAIL-10-FACAGCCGGGAAGACAATAACIL-10-RCAGCTGGTCCTTTGTTTGAAATGF-β1-FACAATTCCTGGCGTTACCTTTGF-β1-RGAAAGCCCTGTATTCCGTCTIL-17A-FACAGCCTGGAAGACAATAACIL-17A-RCAGCTGGTCCTTTGTTTGAA
以相同的cDNA扩增目的基因,分别取cDNA 1 μL加入PCR八连管,依次加入UltraSYBR Mixture 10 μL,目的基因上下游引物各0.5 μL,无菌蒸馏水8 μL,构成20 μL反应体系,每个样品做3次重复。扩增条件:95 ℃预变性10 min,变性95 ℃ 10 s,退火60 ℃ 30 s,延伸72 ℃ 32 s,共40个循环。结果根据目标基因和内参基因UB 得到的Ct值,采用2-△△Ct法进行样品间相对定量分析。

2 结 果
2.1 TET对系统性白念珠菌感染小鼠中抗真菌疗效
2.1.1 生存时间观察 对照组和TET0、TET15、TET30、TET45、TET90组中小鼠中位生存时间分别为25 d、12 d、12 d、12 d、12 d、16 d。经Log-rank检验,与TET0组生存率曲线比较,TET15、TET30和TET45组无差异(P>0.05);而TET90组与对照组和其他TET剂量组比较,有差异(P<0.05),见图1。

图1 TET在各组中的生存曲线Fig.1 Survival curves of control group and TET at 0 to 90 mg/kg groups respectively in mice infected with C. albicans 5314. Each group consisted of 8 mice.
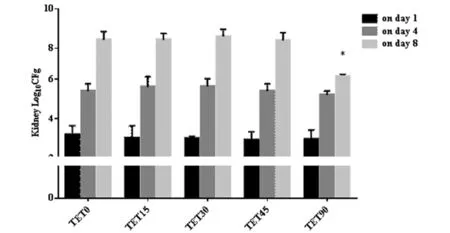
Mice were infected with i.v. for 5×105 via SC5314 C. albicans yeast cells. At 3h later they received TET i.p. at 0, 15, 30, 45 and 90 mg/kg body weight. Kidneys CFU were assessed on day1, 4, 8. Bar indicates standard error (S.E.). Each group consisted of 5 mice.*P<0.05.图2 TET在系统性白念珠菌小鼠的抗真菌作用Fig.2 Effect of TET in the treatment in mice with Candida albicans.
2.1.2 肾脏载菌量测定 在不同时间点,与TET0组比较,TET15、TET30和TET45组检测肾脏载菌量,无差异(P>0.05),TET15、TET30、TET45组间两两比较,也无差异(P>0.05),均随着时间推移,肾脏真菌载菌量增加。在第4 d,TET90组与TET0、TET15、TET30、TET45组两两比较,无差异(P>0.05),而在第8d,TET0、TET15、TET30、TET45和TET90组肾脏载菌量均数分别为8.67、8.51、8.77、8.50 和6.34 log10 CFU/g,TET90组出现肾脏载菌量减少,与各组比较,均有差异(F=37.28,P=0.000)。可见TET在45 mg/kg及以下剂量时,均无抗真菌作用,而TET 90 mg/kg连续腹腔注射7 d后,出现肾脏载菌量减少,提示TET在90 mg/kg剂量对白念珠菌有一定抑制作用。见图2。2.1.3 病理组织学检查 在第8 d,TET0、TET15、TET30、TET45各组中,HE染色镜下可见肾间质充血、水肿,有大量中性粒细胞浸润,肾小管部分坏死,核固缩;PAS染色中可见大量,成团菌丝;而TET90组小鼠,HE染色镜下可见肾小管胞浆红染变性,少量中性粒细胞浸润;PAS 染色可见少量菌丝。见图3。
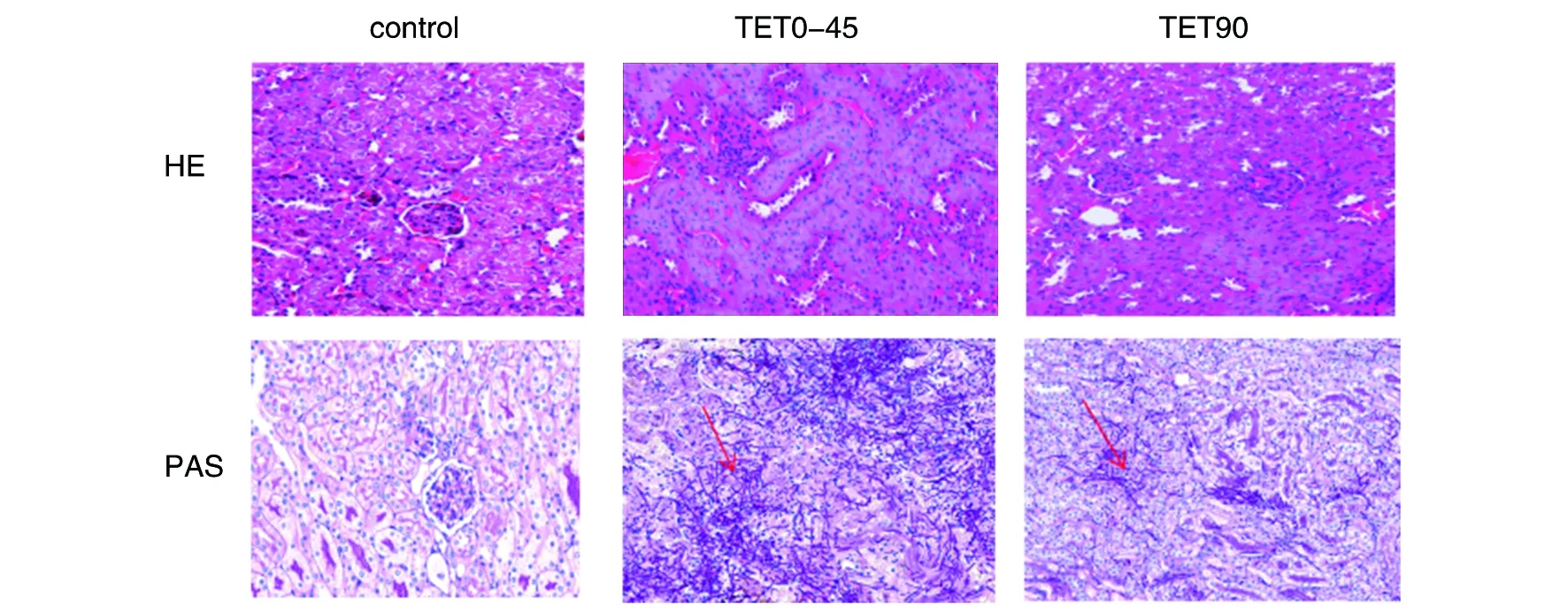
图3 系统性白念珠菌感染小鼠中各组肾脏的病理学变化(HE×200,PAS×200)Fig.3 Histopathologic assessment of the kidneys in mice with disseminated candidiasis (HE×200,PAS×200)
2.2 TET对系统性白念珠菌感染小鼠中IFN-γ、IL-10、IL-17A 和TGF-β1影响
2.2.1 血清ELISA 检测IFN-γ、IL-10、IL-17A 和TGF-β1水平 与对照组比较,TET0组在第1 d,IFN-γ水平出现降低,IL-10、IL-17A 水平升高,TGF-β1水平无变化;在第4 d,IFN-γ水平升高,IL-17A 进一步升高,IL-10、TGF-β1出现下降,在第8 d,IFN-γ、TGF-β1水平出现下降,IL-10、IL-17A明显升高。TET15、TET30和TET45组各小鼠的IFN-γ、IL-10、IL-17A 和TGF-β1动态水平与TET0组一致,无统计学意义(P>0.05)。TET90组小鼠在第1 d、第4 d,各细胞因子动态变化与其他感染组一致,无统计学意义(P>0.05)。但在第8 d,TET90组检测IFN-γ、TGF-β1水平升高,IL-10、IL-17A水平下降,与TET0、TET15、TET30和TET45组比较,均有差异(P<0.05),见图5。

图5 血清ELISA 检测IFN-γ、IL-10、IL-17A 和TGF-β1水平Fig.5 Serum level of IFN-γ, IL-10, TGF-β1 and IL-17A by ELISA detection
2.2.2 RT-PCR 检测肾组织中IFN-γ、IL-10、IL-17A 和TGF-β1mRNA表达水平 在肾组织RT-PCR结果中,与正常小鼠比较,TET0、TET15、TET30和TET45组在第1 d,IFN-γ、TGF-β1 mRNA表达量降低,IL-10、IL-17A mRNA表达量升高,均有差异(P<0.05);在第4 d,IFN-γ、IL-17A mRNA表达量升高,IL-10、TGF-β1 mRNA表达量下降,均有差异(P<0.05);在第8 d,IFN-γ、TGF-β1 mRNA表达量出现下降,IL-10、IL-17A mRNA表达量升高,均有差异(P<0.05)。而TET0、TET15、TET30和TET45各组间在每个时间点各细胞因子mRNA表达量,两两比较,均无差异(P>0.05)。TET90组,在第1 d、第4 d,与正常小鼠比较,均有差异(P<0.05);而与TET0、TET15、TET30和TET45各组比较,细胞因子表达量变化趋势与各组一致,均无差异(P>0.05);但在第8 d,TET90组的小鼠IFN-γ、TGF-β1 mRNA表达量出现升高,IL-10、IL-17A mRNA表达量出现降低,与正常小鼠比较,均有差异(P<0.05);与TET0组、TET15、TET30和TET45各组比较,均有差异(P<0.05),见图6。

图6 Rt-PCR 检测肾组织中IFN-γ、IL-10、IL-17A 和TGF-β1mRNA表达水平Fig.6 Relative expression of IFN-γ, IL- 10, TGF-β1 and IL-17A mRNA in Kidney
2.3 相关性分析 第8天时,TET90组小鼠肾脏载菌量下降,发现与与血清IFN-γ、TGF-β1浓度呈明显负相关(Pearson相关系数分别为-0.790和-0.827;P均<0.05);与血清IL-10、IL-17A浓度呈正相关相关(Pearson相关系数分别为0.911和0.795,P均<0.05),见图7A。与肾脏组织中IFN-γ、TGF-β1 mRNA表达水平呈明显负相关(Pearson相关系数分别为-0.730和-0.841;P均<0.05),与IL-17A、IL-10 mRNA表达水平呈明显正相关相关(Pearson相关系数分别为0.847和0.971;P均<0.05)见图7B。
3 讨论
有关TET免疫方面的研究报道中,调节免疫机能的作用是多方面的,包括抑制T淋巴细胞增殖,下调 CD4+和CD8+T细胞亚群的 Th1和 Th2细胞因子表达、抑制嗜中性粒细胞及单核巨噬细胞等炎症细胞的增殖和激活、抗自由基损伤、抑制炎症介质释放或对抗炎症介质的效应[5-6]。He FQ等报道[15],发现TET通过抑制NF-KB p65表达,减少IL-1β和TNF-α的分泌,从而减少小胶质损害的神经毒性和保护小胶质神经细胞;Chen Y[16]等报道,TET通过下调树突状细胞的CD80 和CD86的表达,从而提高了IL-10的分泌,延长了小鼠皮肤移植存活时间。
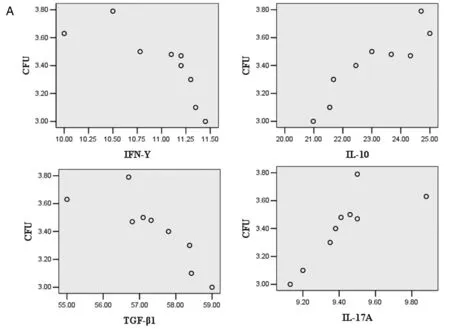
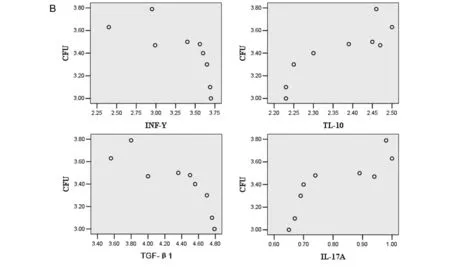
(7A): scatter diagram of Pearson correlation analyses between kidneys CFU and Serum level of IFN-γ, IL-10, TGF-β1 and IL-17A;(7B): scatter diagram of Pearson correlation between kidneys CFU and relative expression of IFN-γ, IL- 10, TGF-β1 and IL-17A mRNA in kidney.图7 TET90组肾脏载菌量与细胞因子的相关性分析Fig.7 Correlatation analyzes between kidneys CFU and cytokines in TET90 group
IFN-γ 能活化中性粒细胞、NK细胞,刺激血管内皮细胞和白细胞合成的粘附分子,促进Th1细胞发育和抑制Th2细胞活化与增殖,刺激B细胞产生的抗体类型向调理素方向转变[17]。IL-10细胞不但能抑制Th1细胞合成IFN-γ,还可抑制单核/巨噬细胞、树突状细胞抗原提呈能力,同时是一种抗炎因子,具有抑制炎症反应的发生发展和减轻炎症损伤的作用[18]。IL-17A是Th17细胞分泌的最重要的细胞因子,与炎症因子TNF-α等有协同作用,放大其致炎效应。在白念珠菌感染的脏器组织中Thl7细胞以及IL-17、IL-21、IL-22等的表达明显升高,其浓度随着病情加重而逐渐升高趋势,说明IL-17的表达水平与白念珠菌炎症程度及疾病进展密切相关,被认为是介导白念珠菌感染中炎症反应的重要细胞[19]。TGF-β1在抑制免疫反应、介导免疫耐受等过程中起重要作用。有研究发现在白念珠菌感染小鼠,Treg细胞抑制Th1和Th2,但能提高Th17[20]。
目前CD4+T细胞可分化为Thl、Th2、Treg、Th17等4个细胞亚群。Th1/Th2、Th17/Treg是两对相互制约的细胞,其比值平衡对维持机体免疫稳态有重要作用。其中IFN-γ、IL-10、TGF-β1和IL-17A分别是Th1、Th2、Treg、Th17具有代表性的一种细胞因子,这些细胞因子交叉调节Th1、Th2、Treg和Th 17细胞,既可诱发有效免疫应答起保护作用,又可因在此过程中引起的炎症反应造成器官损伤[21-22]。
由于肾脏的血液循环较其他组织更为丰富,有利于菌的生长繁殖,且肾小球血管迂曲,血流较慢,不利于真菌的清除,因此肾脏常是机体内白念珠菌最易感染且最后一个清除的脏器,所以我们以肾脏载菌量作为真菌疗效的指标。
在本实验中,早期TGF-β1改变只在肾脏组织中检测到,在血清未检测到。一方面表明白念珠菌作为一个致病菌抗原对机体的肾脏免疫系统有明显的刺激作用,从而调动机体整体免疫反应。另一方面可见通过RT-PCR检测肾组织中细胞因子表达较ELISA检测血清中细胞因子水平在早期更有提示作用。在白念珠菌感染早期的血清、肾组织最先调动的是IL-17A的升高,促进早期炎症反应,IFN-γ水平的变化可能受到IL-17A的促进而逐渐呈上升作用,但在第4 d随着IL-10与TGF-β1水平的逐渐下降,促炎因子及抑炎因子的平衡失调;在第8 d,IFN-γ与TGF-β1水平下降,IL-10与IL-17A水平的升高,致使Th1/Th2,Treg/Th17平衡失调。早期因促炎细胞因子升高,机体组织损害,后期又因免疫抑制因子升高造成机体免疫低下,使得疾病逐渐恶化至死亡。组织病理上可见到肾小管、肾小球充血,坏死的改变。随着时间推移,小鼠肾脏载菌量逐渐增加,小鼠于第10 d开始出现死亡,平均生存时间为12 d。在给予感染小鼠 15、30和45 mg/kg的TET治疗后,其细胞因子动态变化、小鼠生存时间、真菌载菌量与给予生理盐水的感染小鼠一致。而当TET 90 mg/kg剂量时,在第8 d,细胞因子的变化与其他组不一致,血清、肾组织中IFN-γ和TGF-β1水平上升,IL-10和Th17A水平下降。在TET 90 mg/kg,出现小鼠生存时间延长、真菌载菌量有下降、组织病理炎症反应减少,菌丝减少,与TET其他各组,均有差异(P<0.05)。且相关性分析表明肾脏载菌量与血清、肾组织IFN-γ、TGF-β1水平与呈负相关性,与IL-10、Th17A水平呈正相关性。可见TET在90 mg/kg时,机体免疫中Th1/Th2趋于表现为Th1为主,Treg/Th17趋于表现为Treg,对白念珠菌感染小鼠的免疫影响趋于正性调节,机体免疫力促使有效抵抗真菌感染。而TET 在45 mg/kg及以下剂量时,所引起的各CD4+细胞因子水平改变还不足以引发Th细胞之间的极化,不足以增强机体抵御白念珠菌感染的能力及机体免疫状况。
[1] Thakur JK, Arthanari H, Yang F, et al. A nuclear receptor-like pathway regulating multidrug resistance in fungi [J]. Nature, 2008,452(7187):604-609.DOI: 10.1038/nature06836.
[2] Rebecca A, Drummond, Wallace C,et al. Cutting edge: failure of antigen-specific CD4+T cell recruitment to the kidney during systemic candidiasis [J]. J Immunol, 2014,193(11):5381-5385.DOI: 10.4049/jimmunol.1401675. Epub 2014 Oct 24
[3] Kim J,Han BJ,Kim H,et al.Th1 immunity induction by ginsenoside Re involves in protection of mice against disseminated candidiasisdue to Candida albicans [J]. Int Immunopharmacol, 2012,14(4):481-486.DOI: 10.1016/j.intimp.2012.08.014. Epub 2012 Aug 29
[4] Lu JJ, Bao JL, Chen XP, et al. Alkaloids isolated from natural herbs as the anticancer agents [J]. Evid Based Complement Alternat Med,2012,2012:485042.DOI: 10.1155/2012/485042. Epub 2012 Sep 4
[5] Lai JH, Ho LJ, Lu KC, et al. Western and Chinese antirheumatic drug-induced T cell apoptotic DNA damage uses different caspase cascades and is independent of Fas/Fas ligand Interaction [J]. J Immunol, 2001, 166 (11):6914-6924.
[6] Jang BC, Lim KJ, Paik JH, et al. Tetrandrine-induced apoptosis is mediated by activation of caspases and PKCdelta in U937 cells [J]. Biochem Pharmacol, 2004, 67(10):1819-1829.
[7] Zhang H, Gao AL, Li FX, et al. Mechanism of action of tetrandrine,a natural inhibitor ofCandidaalbicansdrug efflux Pumps [J].Yakugaku Zasshi, 2009, 129(5):623-630.
[8] Guo H, Xie SM, Li SX, et al. Synergistic mechanism for tetrandrine on fluconazole againstCandidaalbicansthrough the mitochondrial aerobic respiratory metabolism pathway[J]. J Med Microbiol. 2014,63(7):988-96.DOI: 10.1099/jmm.0.073890-0. Epub 2014 May 1
[9] Gao LQ, Zhang H, Zhang XL, et al. Differential proteomic analysis of fluconazole-sensitiveCandidaalbicansbefore and after tetrandrine treatment[J].Chin Dermatol,2011, 44(8):560-563.(in Chinese)
高来强, 张宏, 张晓利, 等. 白念珠菌经汉防己甲素作用前后的差异蛋白质组学分析[J].中华皮肤科杂志, 2011, 44(8):560-563.[10] Wang KL, Zhang H, Jiang HH, et al.Invitrostudy on tetrandrine as a synergist to fluconazole in murine model of vaginal candidiasis[J]. Chin J Zoonoses, 2007, 23(5): 474-478,483. (in Chinese)
王凯丽,张宏,姜红浩,等. 汉防己甲素对氟康唑抗白念珠菌活性的增效作用的体内实验研究[J]. 中国人兽共患病学报,2007,23(5):474-478,483.
[11] Zhang X,Guo H,Gao L,et al. Molecular mechanisms underlying the tetrandrine-mediated reversal of the fluconazole resistance ofCandidaalbicans[J]. Pharm Biol,2013,51(6):749-752.DOI: 10.3109/13880209.2013.764537. Epub 2013 Mar 25.
[12] Zhang XL,Zhang GH,Wang ZY,et al. Proteomic analysis reveals that Adh1p is involved in a synergistic fluconazole and tetrandrine mechanism against Candida albicans[J]. Pharmazie, 2013, 68(12):951-954.
[13] Shi JP, Zhang H, Zhang ZD,et al. Clinical investigation on the synergistic effect of tetrandrine on the antifungal activity of fluconazole for vulvovaginal candidiasis[J]. Chin J Zoonoses,2009,25(11):1121-1123.(in Chinese)
石建平, 张宏, 张志东, 等.汉防己甲素对氟康唑外用治疗单纯性外阴阴道念珠菌病增效作用的临床研究[J].中国人兽共患病学报,2009,25(11):1121-1123.
[14] Shi J, LI S, MA Z,et al.Acute and sub-chronic toxicity of tetrandrine in intravenously exposed female BALB/c Mice[J]. Chin J Integr Med,DOI:10.1007/s11655-015-2303-2.2015,10.29
[15] He FQ, Qiu BY, Li TK, et al. Tetrandrine suppresses amyloid-β-induced inflammatory cytokines by inhibiting NF-κB pathway in murine BV2 microglial cells[J].Immunopharmacol, 2011,11(9):1220-1225.DOI: 10.1016/j.intimp.2011.03.023. Epub 2011 Apr 13
[16] Chen Y, Lai HS, Chiang BL, et al.Tetrandrine attenuates dendritic cell-mediated alloimmune responses and prolongs graft survival in mice[J].Lanta Med, 2010,76(13):1424-1430.DOI:10.1055/s-0029-1240909. Epub 2010 Feb 25.
[17] Fatahinia M,Khosravi AR,Shokri H. Propolis efficacy on TNF-α, IFN-γ and IL2 cytokines production in old mice with and without systemic candidiasis [J].J Mycol Med, 2012,22(3):237-242. DOI:10.1016/j.mycmed.2012.05.004. Epub 2012 Aug 9
[18] Shimonkevitz R, Bar-Or D, Harris L, et al. Granulocytes, including neutrophils, synthesize IL-10 after traumatic pancreatitis:case report [J]. Trauma, 2000,48(1):165-168.
[19] Hernández-Santos1 N and Gaffen SL.Th17 cells in immunity toCandidaalbicans[J].Cell Host Microbe. 2012,11(5): 425-435.DOI:10.1016/j.chom.2012.04.008.
[20] Whibley N, MacCallum DM, Vickers MA, et al. Expansion of Foxp3+ T-cell populations byCandidaalbicansenhances both Th17-cell responses and fungal dissemination after intravenous challenge[J].Eur J Immunol, 2014,44(4):1069-1083.DOI: 10.1002/eji.201343604. Epub 2014 Feb 13
[21] Mottet C, Uhlig H H, Powrie F. Cutting edge:cure of colitis by CD4+CD25+regulatory T cells [J]. Immunol, 2003,170:3939-3943.
[22] Zhou L, Lopes JE, Chong MM, et al. TGF-beta-induced Foxp3 inhibitsT(H) 17 cell differentiation by antagonizing ROR gammat function [J]. Nature, 2008,453(7192):236-240. DOI:10.1038/nature06878. Epub 2008 Mar 26
Zhang Hong, Email: tzhangh@jnu.edu.cn
Tetrandrine on the dynamic changes of cytokines and antifungal effect in mice withCandidaalbicans
SHI Jian-ping1, LI Shui-xiu2, ZHU Kun-ju2, ZHANG Ling-ling2, ZHANG Yi-shan2, ZHANG Hong2
( 1.ShenzhenShajingAffiliatedHospitalofGuangzhouMedicalUniversity,Shenzhen518000,China;2.TheFirstAffiliatedHospitalandInstituteofMycology,JinanUniversity,Guangzhou510632,China)
To study the therapeutic effect of tetrandrine(TET) on the mice infected withCandidaalbicans. The mice with disseminated candidiasis were randomly divided into experimental group and control group, The serum level of the IFN-γ, IL-10, TGF-β1 and IL-17A were determined by ELISA and kidney IFN-γ, IL-10, TGF-β1 and IL-17A mRNA expression levels were tested with real-time RT-PCR method. At the same time, kidmey fungal burdens were measured. Results showed that therapy with TET ranging from 15 to 45 mg/kg did not affect organ fungal burdens and survival times (P>0.05), and has nothing with the cellular immunity. However, 90 mg/kg of TET decreased organ fungal burdens and prolonged survival times, and correlated with increasing levels of cytokines of IFN-γ and TGF-β1, decreasing levels of IL-17A and IL-10 when observed in mice infected with SC5 314 compared with control group on day 8 after infection. Thus, 90 mg/kg of TET has therapeutic effects on disseminated candidiasis of mice.
tetrandrine;Candidaalbicans; mice
国家自然科学基金(No.81171542/81471995)广东省医学科研基金(No.A2016377)联合资助
张宏,Email: tzhangh@jnu.edu.cn
1.广州医学院附属深圳沙井医院皮肤科,深圳 518000
2.暨南大学附属第一医院、暨南大学真菌病研究所,广州 510632
10.3969/j.issn.1002-2694.2016.08.002
R378
A
1002-2694(2016)08-0689-08
2015-10-25;
2016-02-20
Supported by grants from the National Natural Science Foundation of China (Nos. 81171542/81471995) and the Guangdong Provincial Medical Research Fund(No. A2016377)
