青蒿素对小麦种子萌发及幼苗生长的影响
2016-11-30来庆捷赵婉莹李雪丽吕建洲
来庆捷,赵婉莹,李雪丽,吕建洲
(辽宁师范大学生命科学学院,辽宁大连 116081)
青蒿素对小麦种子萌发及幼苗生长的影响
来庆捷,赵婉莹,李雪丽,吕建洲
(辽宁师范大学生命科学学院,辽宁大连 116081)
为了解青蒿素对小麦种子萌发和幼苗生长的影响,运用室内培养皿法,分析了不同浓度的青蒿素溶液浸种后小麦种子发芽率及幼苗高度、根长、整株鲜重、根和茎鲜重及干重、根系活力等指标的变化。结果表明,青蒿素对小麦种子萌发及幼苗生长有抑制作用,且浓度越高,抑制作用越显著。与无菌水对照相比,青蒿素浸种处理显著降低了小麦的种子发芽率、苗高、根长、根鲜重和茎的鲜、干重,增加了根干重和根冠比。小麦的根系活力和可溶性蛋白含量随青蒿素浓度的增加而递减,可溶性糖含量则随之递增,叶绿素含量则呈先升高后降低的趋势,以20 mg·L-1处理含量最高。此外,青蒿素浸种处理对小麦幼苗各项指标的影响与15 mg·L-1多效唑相似。
青蒿素;小麦;种子萌发;幼苗生长
黄花蒿 (ArtemisiaannuaL.)又名臭蒿、青蒿,为菊科蒿属(Artemisia)一年生草本植物[1],在我国已有2 000余年的药用历史,其已知成分有青蒿素、青蒿酸、香豆酸、黄酮、异蒿酮、挥发油等[2-3]。20世纪70年代科学家从黄花蒿中分离出青蒿素,成为提取青蒿素的唯一原料药材[4]。目前,青蒿素被WHO推荐为治疗疟疾的首选一线药物,引起国内外医学界的广泛关注。1937年德国科学家Molisch首次提出化感作用,它是指自然界生物体通过释放化学物质对其他生物产生有害或有益的影响[5]。化感作用的研究对农业栽培制度的建立和植物生长调节物质的开发应用等有着重要的意义,近年来受到世界各国科学家的重视,逐步形成了一个新的研究领域。黄建国等[6]报道,黄花蒿在生长过程中会向环境释放青蒿素等化感物质,影响植物、动物和微生物的繁殖与生长。Chen等[7]研究发现,青蒿素及其生物合成前体可调节植物的生长。Duke 等[8]研究表明,青蒿素可抑制多种杂草的根芽和地上部生长。Dule等[9]的研究结果显示,青蒿素在低浓度时可促进穿心莲和甜菜的生长发育,高浓度则抑制生长。不同浓度青蒿素影响土壤微生物的数量[10]。当青蒿素在土壤中的浓度达到6~24 mg·L-1时,可抑制燕麦、黄瓜、萝卜、油菜、甘蓝等作物种子的发芽,并造成根系活力降低,使叶绿素不能合成,导致生长发育停滞直至死亡[11-12];当青蒿素在土壤和水体中的浓度为12 mg·kg-1时,对蚯蚓和绿藻产生毒害作用,导致土壤肥力和水体生产力降低[13]。有关青蒿素对小麦的化感作用尚未见报道。本研究采用室内培养皿法,初步探讨青蒿素对小麦种子萌发及幼苗生长的影响,以期开发一种高效、无毒、无污染的新型植物生长调节物质,为生物源植物生长调节剂的开发利用和作物环境友好栽培提供科学参考依据。
1 材料与方法
1.1 试验材料
供试植物为小麦(TriticumaestivumL.),购于大连广大种子有限公司。供试青蒿素购于陕西森弗天然制品有限公司,纯度98%。供试多效唑(PP333)购于济宁黑土地生物营养技术有限公司。上述材料使用前均于4 ℃黑暗条件密封保存。
1.2 试验方法
挑选颗粒饱满、大小均一的小麦种子,用质量分数10%次氯酸钠溶液消毒10 min,再用蒸馏水冲洗5次。用丙酮助溶并配制0、10、20、30、40、50、60 mg·L-1的青蒿素溶液。试验设置3组对照:无菌水(CK1)、0.01%丙酮溶液(CK2,相当于青蒿素母液稀释后的最大丙酮浓度)、15 mg·L-1多效唑(CK3)。在25 ℃条件下用上述溶液浸种12 h,然后挑选30颗露白的种子置于皿底铺好一层滤纸、直径为9 cm的培养皿中,均匀铺开,每个处理设置3个重复。每天补加适量无菌水使小麦种子在25 ℃、4 000 lx光照培养箱中正常生长,培养至第3天观察种子发芽情况,7 d后统计发芽率,第10天测量其他生理生化指标。
1.3 测定指标与方法
以胚芽长为种子长度的一半为标准[14],计算发芽率,并测定苗高和根长,电子天平称量小麦幼苗根、茎的鲜重和干重,计算根冠比。取幼苗根系用TTC法测定根系活力,幼苗叶片用乙醇提取-分光光度法测定叶绿素含量,考马斯亮蓝G-250法测定可溶性蛋白含量,蒽酮比色法测定可溶性糖含量[15]。
1.4 数据分析
采用Excel 2014、GraphPad Prism 5、SPSS 2.0数据处理系统。
2 结果与分析
2.1 青蒿素对小麦种子萌发及幼苗生长的影响
与CK1相比,0.01%丙酮对小麦种子萌发及幼苗生长无影响(表1)。青蒿素浸种处理后,随其浓度的增加,小麦种子发芽率、苗高和根长呈降低趋势,说明青蒿素浸种对小麦种子萌发及幼苗生长产生抑制作用,而且抑制作用的强度与其浓度密切相关。其中浓度为60 mg·L-1的青蒿素处理下小麦种子发芽率、苗高和根长较CK1分别降低了22.62%、32.50%和90.37%,种子萌发率和根长较CK3分别降低了24.46%、88.39%,而苗高增加了20.89%。
2.2 青蒿素对小麦幼苗鲜重、干重和根冠比的影响
与CK1相比,0.01%丙酮对小麦幼苗鲜重、干重和根冠比均无显著影响(表2)。青蒿素浸种处理后幼苗根、茎鲜重显著低于CK1;青蒿素浓度为50 mg·L-1时根鲜重降幅最大(46.58%);浓度为40 mg·L-1时茎鲜重降幅最大(29.13%)。青蒿素浓度为10 mg·L-1时,根鲜重与CK3无显著差异,而后随其浓度的增加,根鲜重逐渐降低。青蒿素浓度为10、20 mg·L-1时,茎鲜重显著高于CK3,其他浓度处理与CK3均无显著差异。青蒿素浸种后幼苗根干重较CK1升高,茎干重降低,而根、茎干重与CK3无显著差异。青蒿素处理后幼苗的根冠比均高于CK1,低于CK3,且根冠比随着青蒿素浓度的增加而升高。
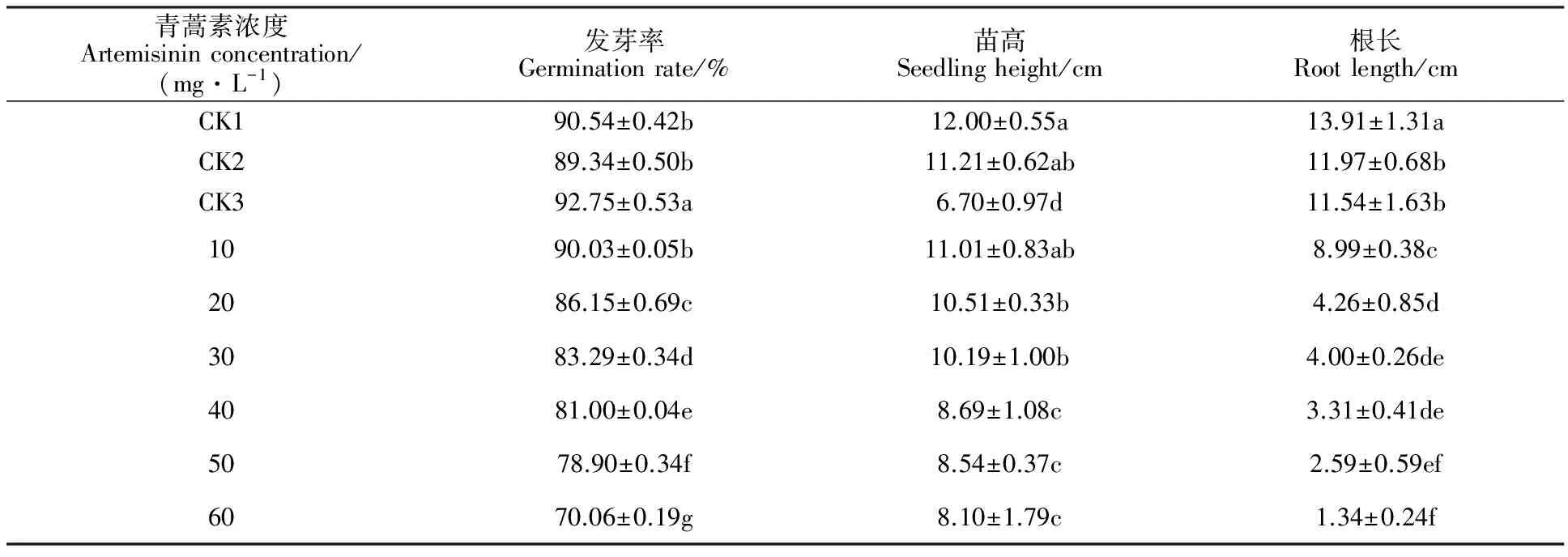
表1 青蒿素对小麦种子发芽率、苗高和根长的影响
同列数值后字母相同的表示处理间无显著差异(LSD,P>0.05)。表2同。
The same letter following the values in the same column indicates no significant difference among the treatments at 0.05 level (LSD). The same as in table 2.
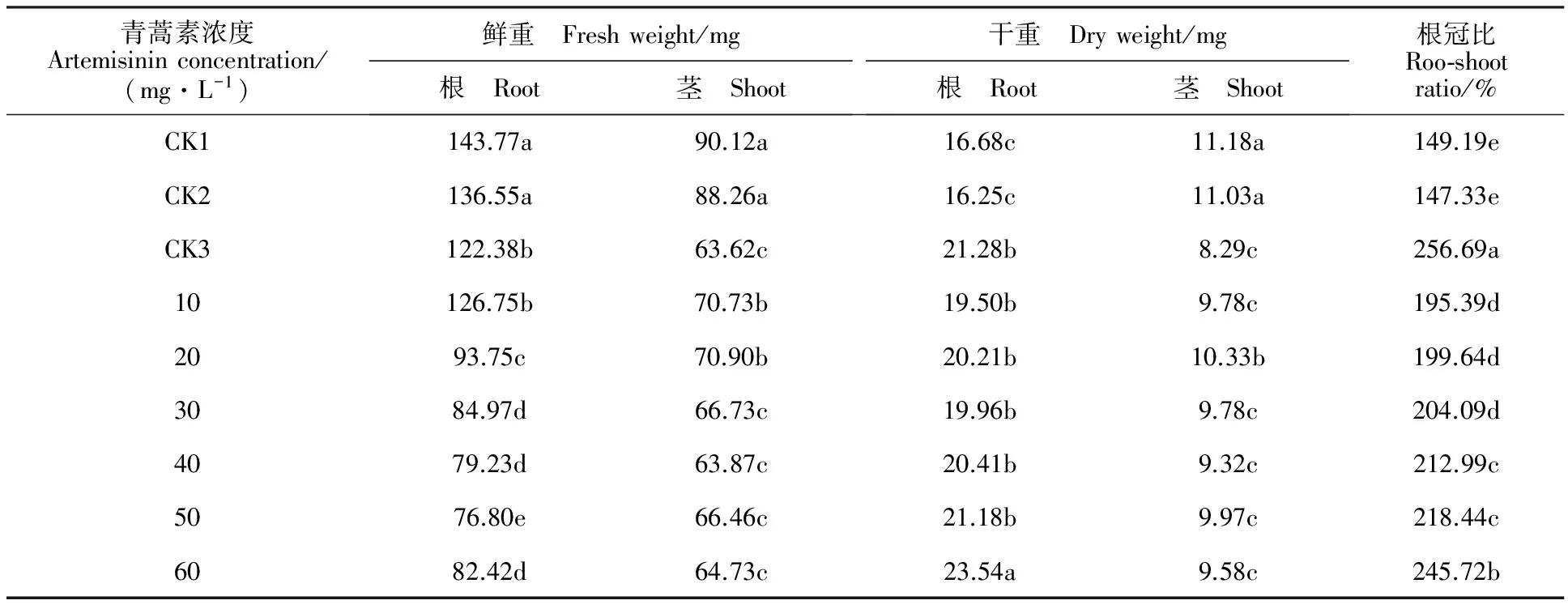
表2 青蒿素对小麦幼苗单株根和茎的干、鲜重及根冠比的影响
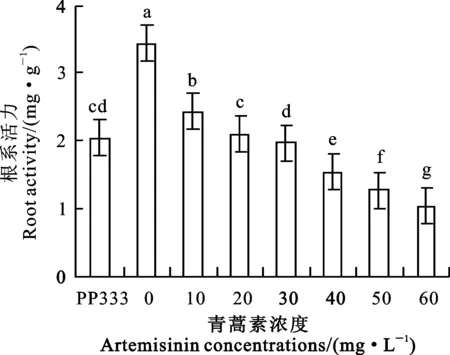
2.3 青蒿素对小麦幼苗根系活力的影响
从图1可以看出,青蒿素浸种后,随着其浓度的升高,小麦幼苗根系活力逐渐降低,较CK1下降29.24%~69.88%。青蒿素浓度为10、20 mg·L-1时,小麦幼苗根系活力较多效唑(PP333)处理分别增加了19.21%和2.96%,其他浓度处理降低了3.45%~49.26%。
2.4 青蒿素对小麦幼苗叶绿素含量的影响
小麦幼苗的总叶绿素含量随青蒿素浓度的增加呈先升高后降低的趋势(图2)。在10~50 mg·L-1青蒿素浓度下小麦幼苗叶绿素含量较CK1分别增加37.50%、65.28%、26.39%、12.50%和2.78%,青蒿素浓度浓度为60 mg·L-1时降低了20.83%。青蒿素浓度为10、20 mg·L-1时叶绿素含量较多效唑(PP333)处理增加了2.06%和22.00%,其他浓度处理分别降低了6.19%~41.24%。
2.5 青蒿素对小麦幼苗可溶性蛋白含量的影响
青蒿素浸种后小麦幼苗的可溶性蛋白含量显著降低(图3),10~60 mg·L-1青蒿素浓度处理较CK1分别降低6.89%、15.86%、16.40%、23.79%、32.22%和32.76%。青蒿素浓度为10、20 和30 mg·L-1时可溶性蛋白含量较多效唑(PP333)处理增加了17.30%、5.99%和5.31%,其他浓度处理分别降低了3.99%~15.29%。
图柱上字母相同表示处理间无显著差异(LSD,P>0.05)。下图同。
The same letter above columns indicates no significant difference among the treatments at 0.05 level (LSD). The same as in figure 2-4.
图1 青蒿素对小麦根系活力的影响
Fig.1 Effect of artemisinin on root activity in wheat root
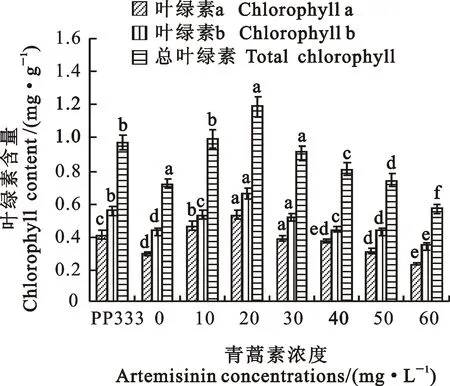
图2 青蒿素对小麦叶片叶绿素含量的影响
2.6 青蒿素对小麦幼苗可溶性糖含量的影响
青蒿素浸种后小麦的可溶性糖含量显著升高(图4),10~60 mg·L-1青蒿素浓度处理较CK1分别增加了15.03%、22.93%、25.99%、29.04%、46.88%和65.09%,较多效唑(PP333)处理分别降低了34.04%、29.51%、27.76%、26.00%、15.78%和5.33%。
3 讨 论
青蒿素浸种处理对小麦种子萌发及幼苗生长有显著的抑制作用,且随其浓度的增加,抑制作用增强,这与Lyden 等[16]、白 祯等[17]实验结果相符。本试验结果表明,青蒿素溶液对小麦种子的发芽率、苗高和根长有显著的抑制作用,且对根的抑制作用更显著。此外,经青蒿素浸种处理后小麦幼苗的根冠比显著高于无菌水对照,说明青蒿素对地上部生长的影响较大。在植物体内,叶绿素含量的高低在一定程度上反映了植物光合作用及有机物合成的能力[18-19]。本试验中小麦叶绿素含量随青蒿素浸种浓度的增加呈现先增加后降低的趋势,说明青蒿素对小麦叶绿素含量影响存在浓度效应。根系活力是指根系吸收和代谢能力的强弱,其大小与植物的生命活动紧密相关[20]。本试验结果表明,青蒿素浸种后,随其浓度的增加,小麦的根系活力逐渐降低,这会降低幼苗对养分、水分的吸收能力,进而导致生长发育受阻。在逆境环境下的植物的水解作用会增强,合成作用会减弱[21-22]。可溶性糖是种子在萌发过程中经水解酶的作用形成的低分子糖类。本试验中小麦可溶性糖含量随青蒿素浓度增加而增加,幼苗生长受到抑制,推测青蒿素增加种子水解酶活性,但同时又抑制合成酶催化的生化反应,从而抑制小麦的生长。同时,随青蒿素浓度的增加,可溶性蛋白含量呈下降趋势,推测小麦幼苗在青蒿素胁迫的环境中生长受到抑制是由于植物体内的水解作用增强,将可溶性蛋白降解为氨基酸,这种代谢失调最终对植物产生伤害。经适宜浓度的青蒿素浸种处理后,小麦幼苗的苗高、根冠比、根系活力、叶绿素含量、可溶性蛋白含量等指标的影响均与多效唑处理相似,推测适宜浓度的青蒿素可用作植物生长调节剂来调节植物的生长。虽然青蒿素可用于小麦种子萌发及幼苗生长的调节,但其对植物的生长调节机制还需进行多方面、多层次的研究。其次,对于小麦的田间试验及对其他植物的作用效果如何,还有待于进一步研究。
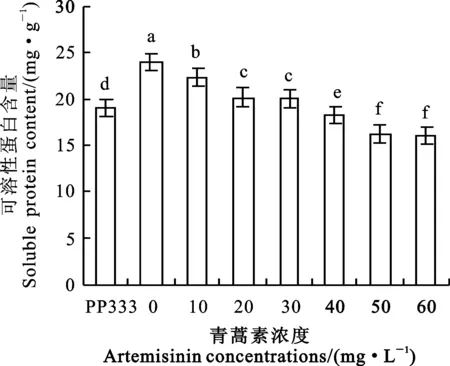
图3 青蒿素对小麦可溶性蛋白含量的影响
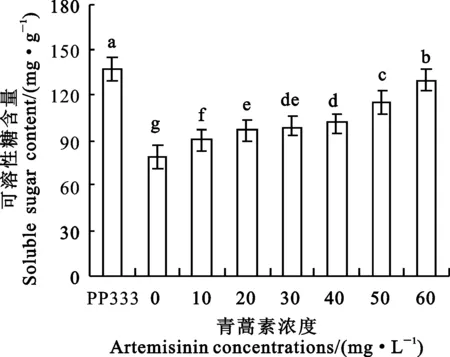
图4 青蒿素对小麦可溶性糖含量的影响
[1]慕小倩,马 燕,王 硕,等.黄花蒿化感作用机理的初步研究[J].西北植物学报,2005,25(5):1025.
MU X Q,MA Y,WANG S,etal.Preliminar study of allelopathy mechanism ofArtemisiaannua[J].ActaBotanicaBoreali-OccidentaliaSinica,2005,25(5):1025.
[2]郭鸿儒,沈慧敏,杨顺义,等.黄花蒿化感物质对受体燕麦化感作用机理的初步研究[J].甘肃农业大学学报,2008,2(1):102.
GUO H R,SHEN H M,YANG S Y,etal.Effect of extraction ofArtemisiaannuaon activity of some enzymes inAvenafata[J].JournalofGansuAgriculturalUniversity,2008,2(1):102.
[3]高志梅,李拥军,谷文祥.青蒿化感作用的初步研究[J].华南农业大学学报,2007,28(1):122.
GAO Z M,LI Y J,GU W X.Preliminary studies on the allelopathic effects ofArtemisiaannua[J].JournalofSouthChinaAgriculturalUniversity,2007,28 (1):122.
[4]LU S S,WU L O,YANG Z Q.Progress of research on artemisinin in combination with other anti-malarial drugs [J].JournalofPathogenBiology,2009,4(3):232.
[5]RICE E L.Alleiopathy(2nd ed) [M].London:Academic Press,1984:1-2.
[6]黄建国.黄花蒿的化感效应[J].山地农业生物学报,2015,34(4):1.
HUANG J G.Review of the allelopathic effects ofArtemisiaannua[J].JournalofMountainAgricultureandBiology,2015,34(4):1.
[7]CHEN P K,LEATHER G R.Plant growth regulatory activities of artemisinin and its related compounds [J].ChemicalEcology,1990,16(6):1867.
[8]DUKE S D,VAUGHN K C,CROOM Z M,etal.Artemis-inin,acon-stituento annual worm wood(Artemisiaannua) isaseIective phytotoxin [J].WeedScience,1992,35:499.
[9]DULE S O,VAUGHN K C,CROOM E M,etal.Artemiainin’a constituen of annual wormwood(Artemisiaannua),is a selective phytotoxin [J].WeedScience,1987,35:499.
[10]刘 飞,伍晓莉,崔广林,等.青蒿根际微生物数量动态及其与青蒿素含量的关系研究[J].时珍围医国药,2010,21(1):37.
LU F,WU X L,CUI G L.etal.Relationship dynamics ofArtemisiaannuarhizosphere microorganisms and artemisinin content [J].LishizhenMedicineandMadicaResearch,2010,21(1):37.
[11]赵红梅,杨顺义,郭鸿儒,等.黄花蒿对4种受体植物的化感作用研究[J].西北植物学报,2007,27(11):2292.
ZHAO H M,YANG S Y,GUO H R,etal.Allelopathy ofArtemisiaannuaon 4 receptor plants [J].ActaBotanicaBoreali-OccidentaliaSinica,2007,27(11):2292.
[12]何 军,王三根,丁 伟.青蒿浸提物对小麦化感作用的初步研究[J].西南农业大学学报(自然科学版),2004,26(3):281.
HE J,WANG S G,DING W.Study on allelopathic effects of alcohol extracts fromArtemisiaannuaL.[J].JournalofSouthwestAgriculturalUniversity(NaturalScience),2004,26(3):281.
[13]黄 玥,袁 玲.青蒿素的化感效应及机理研究进展[J].贵州农业科学,2011,39(6):111.
HUANG Y,YUAN L.Advances of allelopathic effect of artemisinin and related mechanisms [J].GuizhouAgriculturalSciences,2011,39(6):111.
[14]ZEHHAR N,INGOUFF M,BOUYA D,etal.Possible involvement of gibberellins and ethylene inOrobancheramosagermination [J].WeedResearch,2003,42(6):464.
[15]王学奎.植物生理生化实验原理和技术[M].北京.高等教育出版社,2006:190-192.
WANG X K. Principles and Techniques of Plant Physiology and Biochemistry [M].Beijing:Higher Education Press,2006:190-192.
[16]LYDEN J,TEASDALE J R,CHEN P K.Allelopathic activity of annual wormwood(Artemisiaannua) and the role of artemisinin [J].WeedScience,1997,30(3):1.
[17]白 祯,黄 玥,黄建国.青蒿素对蔬菜种子发芽和幼苗生长的化感效应[J].生态学报,2013,33(23):7576.
BAI Z,HUANG Y,HUANG J G.Allelopathic effects of artemisinin on seed germination and seedling growth of vegetables [J].ActaEcologicaSinica,2013,33(23):7576.
[18]JIAO Y,GE C M,MENG Q H,etal.Dihydroartemisinin is an inhibitor of ovarian cancer cell growth [J].ActaPharmacologicaSinica,2007,28(7):104.
[19]FINAURINI S,BASILICO N,CORBETT Y.Dihydroartemisinin inhibits the human erythroid cell differentiation by altering the cell cycle [J].Toxicology,2012,300(1):57.
[20]李朝苏,刘 鹏,蔡妙珍,等.荞麦对酸铝胁迫生理响应的研究[J].水土保持学报,2005,19(3):105.
LI C S,LIU P,CAI M Z,etal.Physiological response of buckwheat to acid-aluminum stress in growth [J].JournalofSoilandWaterConservation,2005,19(3):105.
[21]JIANG W,HUANG Y,WANG J P,etal.The synergistic anticancer effect of artesunate combined with allicin in osteosarcoma cell lineinvitroandinvivo[J].AsianPacificJournalofCancerPreventionApjcp,2013,14(8):4615.
[22]GÜZIN K,SALIH M,LOKMAN A,etal.Genotoxic effects of catmint (NepetameyeriBenth.) essential oils on some weed and crop plants.[J].Toxicology&IndustrialHealth,2013,29(6):504.
Effects of Artemisinin on Seed Germination and Seedling Growth of Wheat
LAI Qingjie,ZHAO Wanying,LI Xueli,LÜ Jianzhou
(Department of Life Science, Liaoning Normal University, Dalian,Liaoning 116081,China)
The effects of different concentrations of artemisinin on germination,morphological and physiological characteristics of wheat seeds were discussed by using indoor Petri dish method. The results showed that artemisinin presented the inhibition ability on the seed germination and seedling growth of wheat,and the inhibition ability showed more significant under higher concentration. Compared with the control group(sterile water),the seed germination rate,seedling height, root length, fresh weight and stem dry weight were significantly reduced under artemisinin soaking treatments,but the dry weight of root as well as root-shoot ratio were increased. With the increase of concentration of artemisinin, root activity and content of soluble protein of seedling were decreased, but the content of soluble sugar was increased, and the chlorophyll content was increased first and then tended to decrease, and the peak appeared at the artemisinin value of 20 mg·L-1. In addition, after soaking the seeds with artemisinin solutions,the effect on the indicators of wheat seedlings was similar to that of PP333 (15 mg·L-1).
Artemisinin;TriticumaestivumL.; Seed germination; Seedling growth
时间:2016-10-08
2016-04-18
2016-05-31
大连市科技计划项目(2015B11NC077)
E-mail:626190046@qq.com
吕建洲 (E-mail:jianzhoulv@126.com)
S512.1;S311
A
1009-1041(2016)10-1386-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161008.0932.028.html
