基于SRAP和SSR标记的小麦品质相关性状的QTL定位
2016-11-30郭利建王竹林汪世娟刘振华刘香利胡胜武赵惠贤
郭利建,王竹林,汪世娟,刘振华,刘香利,胡胜武,赵惠贤
(1.西北农林科技大学生命学院,陕西杨凌 712100; 2.西北农林科技大学农学院,陕西杨凌 712100)
基于SRAP和SSR标记的小麦品质相关性状的QTL定位
郭利建1,王竹林2,汪世娟1,刘振华1,刘香利1,胡胜武2,赵惠贤1
(1.西北农林科技大学生命学院,陕西杨凌 712100; 2.西北农林科技大学农学院,陕西杨凌 712100)
为了对小麦品质相关性状进行QTL定位,以两个品质性状差异较大的小麦品种西农981和陕麦159构建的169株F2群体和F2:3家系为材料,利用SRAP标记和SSR标记进行遗传图谱构建,并通过完备区间作图法对杨凌及三原两个环境下籽粒的粗蛋白质含量、淀粉含量、湿面筋含量和Zeleny沉降值进行QTL定位。结果表明,在两个环境下共检测到33个与品质性状相关的QTL,其中11个为粗蛋白含量QTL,分布于1A、3A、5A、6A、2B和4B染色体上,可解释表型效应的0.69%~2.48%;7个为淀粉含量QTL,分布于1A、6A、4B和2D染色体上,可解释表型变异的2.94%~6.99%;12个为湿面筋含量QTL,分布于1A、3A、5A、6A、2B、3B和4B染色体上,可解释表型变异的0.58%~2.37%;3个为Zeleny沉降值QTL,分布于3A、1B和3B染色体上,可解释表型变异的2.72%~11.31%。同时,在1A、3A、5A、6A、2B、4B染色体上存在粗蛋白质含量、淀粉含量和湿面筋含量QTL富集区,在后续研究中可重点关注。
小麦;SRAP标记;QTL定位;品质性状
小麦是世界上最主要的粮食作物之一,随着小麦产量及人们生活水平的不断提高,小麦品质受到育种者和消费者的极大关注,选育优质品种已成为小麦育种的主要目标。粗蛋白含量、湿面筋含量、淀粉含量、Zeleny沉降值等都是重要的小麦品质指标;粗蛋白含量和湿面筋含量是小麦品质分级的重要指标,淀粉含量对于后期的面粉加工具有重要影响[1],Zeleny沉降值可反映面筋蛋白的含量及质量[2],这些品质指标对于小麦育种具有重要的指导作用。小麦品质的常规分析需要大量种子样品,只适用于高代育种材料的测定;近红外品质分析是利用近红外透射光谱对有机物进行含量测定的一种新技术,其方便、简单、一次可以分析测定蛋白质、面筋、淀粉、纤维素等多种成分的含量,而且样品用量少[3],为育种早代材料的品质指标测定提供了可能。小麦的品质性状由多基因控制,表现为数量性状,遗传基础较为复杂;而分子标记和QTL定位技术的发展为品质性状的分子检测和数量性状的研究提供了有效的方法。品质性状QTL的研究前人已有许多报道,大多都集中在蛋白质QTL方面;利用SSR、AFLP和STS标记定位得到的蛋白质含量QTL基本遍布于小麦21条染色体上[4-7]。Li等[8]定位到7个湿面筋和9个蛋白质含量QTL;关于小麦淀粉含量及Zeleny沉降值QTL研究也有少量报道。Mccartney等[9]利用双单倍体材料定位到19个淀粉含量QTL,其中位于1D染色体上的QTL可解释表型变异率为17.7%。吴云鹏等[10]利用重组自交系定位到7个Zeleny沉降值QTL,分别位于1B、1D、3A和3B染色体上。这些品质性状QTL研究主要采用SSR、AFPL和STS分子标记。SRAP标记是由Li等[11]首先于芸薹属植物中建立的基于基因表达序列的功能性分子标记,目前多被应用于植物遗传多样性研究[12-13],而在小麦数量性状QTL定位研究中尚未见应用SRAP标记的报道。本研究利用近年来审定的农艺性状优良的小麦品种西农981和陕麦159杂交构建的F2群体和F2:3家系,通过SRAP标记和SSR标记相结合的方法进行遗传图谱构建;在两个不同环境条件下对粗蛋白质含量、湿面筋含量、淀粉含量及Zeleny沉降值等性状进行近红外透射光谱测定和QTL定位,以期揭示控制小麦湿面筋含量、淀粉含量及Zeleny沉降值的遗传基础,寻找新的QTL位点,为分子标记辅助小麦品质育种提供参考。
1 材料与方法
1.1 植物材料及其种植
以籽粒品质性状差异较大的2个小麦品种西农981和陕麦159进行杂交,构建含有169个单株的F2群体和F2:3家系,分别作为作图群体和表型定位群体。
2012年4月以西农981为母本,以陕麦159为父本,进行杂交,6月收获杂交种子,10月将杂交种子种植于西北农林科技大学杨凌小麦试验田,2013年6月收获F1种子,同年10月将F1种子种植于杨凌小麦试验田,同时种植2个亲本,田间常规管理。2014年4月分单株挂牌标记169个F2单株,同年6月按单株收获并脱粒。2014年10月将收获的169个F2单株的种子一分为二,分别种植于陕西杨凌试验站(环境E1)(34°17′N,108°4′E,海拔525 m)和陕西三原试验站(环境E2)(34°36′N,108°52′E,海拔429 m),形成2个环境点的F2:3家系群体,采用随机区组分布,单行区,行长2 m,行距0.24 m;同时,种植亲本西农981和陕麦159及西农979作对照,试验设3次重复,田间常规管理。
1.2 SRAP引物与SSR引物
SRAP引物信息来源于Li和Quiros等[11]以及本实验室积攒而得,其中正向引物34条,反向引物18条,共能组成612对引物,均由英潍捷基(上海)贸易有限公司合成。
SSR引物包括Xbarc系列、Xwmc系列、Xgdm系列、Xcfa系列、Xcfd系列等共计1 550对,由西北农林科技大学农学院王竹林老师提供。
1.3 DNA提取及分子标记检测
分别取2个亲本、F1代植株及F2分离群体中挂牌单株幼苗叶片,采用CTAB法[14]进行小麦基因组DNA的提取,然后通过琼脂糖凝胶电泳及超微量微孔板分光光度计分析DNA纯度及测量DNA浓度。
SRAP引物PCR反应体系(10 μL):ddH2O 2.4 μL、2×EsTaqMasterMix(康为世纪)5 μL、SRAP引物(10 μmol·L-1)各0.3 μL、模板DNA(20 ng· μL-1)2 μL。SRAP引物扩增程序:95 ℃预变性60 s;94 ℃变性60 s,35 ℃退火60 s,72 ℃延伸60 s,5个循环;94 ℃变性60 s,50 ℃退火60 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min,4 ℃保存。SSR引物PCR反应体系(15 μL):ddH2O 5.5 μL、2×EsTaqMasterMix(康为世纪)7.5 μL、SSR引物(10 μmol·L-1)各0.5 μL、模版DNA(20 ng· μL-1)1 μL。SSR引物扩增程序:95 ℃预变性4 min;94 ℃变性45 s,60 ℃退火60 s(每个循环降低0.5 ℃),72 ℃延伸55 s,10个循环;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min,4 ℃保存。
扩增产物用8%的聚丙烯酰胺凝胶电泳分离,银染法检测并拍照统计扩增条带。
1.4 品质性状测定及分析
2015年6月分别收获两个环境点的169个F2:3家系;每株系随机选取6个单株分别收获、脱粒及性状分析。采用瑞典Perten公司生产的DA-7200近红外分析仪对籽粒硬度、水分含量、蛋白含量、淀粉含量、纤维含量、湿面筋含量、Zelery降落值及SDS沉降值进行测定,3次重复,取平均值;两个环境下各重复试验每个株系各品质性状结果均取平均值。利用对应环境下各株系品质性状的平均值进行QTL分析。采用SPSS 19.0软件对这些性状进行数据统计分析。
1.5 连锁图谱构建及QTL定位
遗传连锁图谱构建采用软件QTL IciMapping V4.1(www.isbreeding.net)进行。带型记录参照软件要求,各参数值依照软件初始设置,用Kosambi函数和ICIM-ADD方法作图[15]。
2 结果与分析
2.1 亲本及F2:3家系的品质性状
亲本及F2:3家系的部分品质性状见表1。
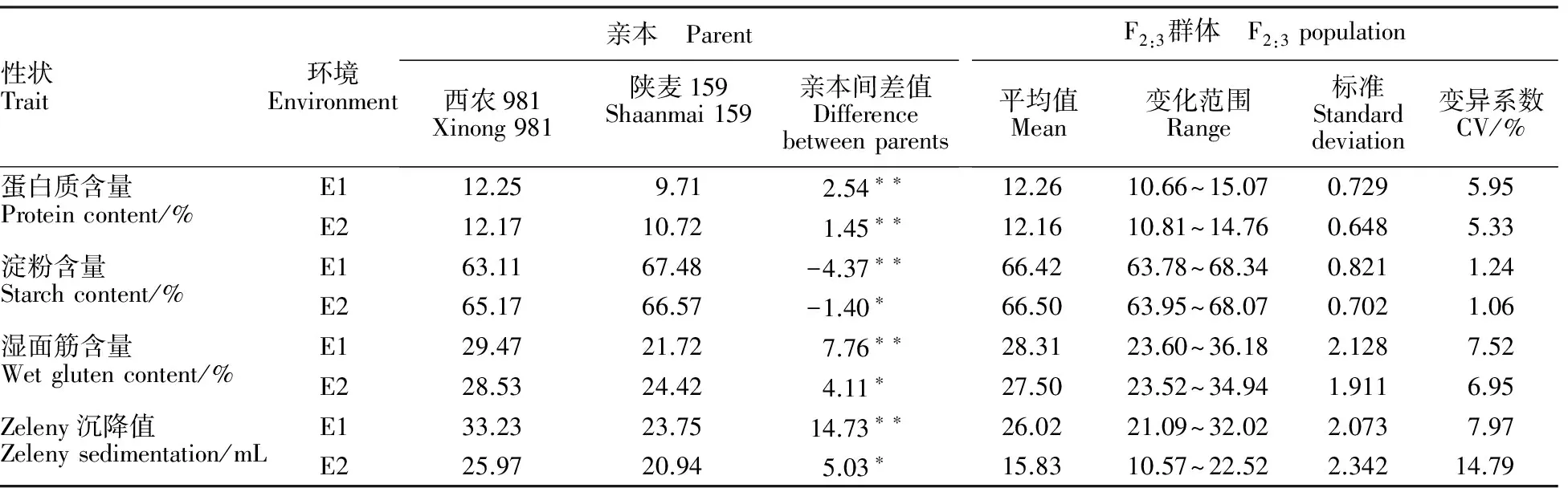
表1 两环境条件下亲本及F2:3家系部分品质性状分析
E1:杨凌;E2:三原;*和**分别表示亲本间差异达到显著和极显著水平。
E1: Yangling; E2: Sanyuan; * and ** indicate significant difference between parents at 0.05 and 0.01 levels,respectively.
单因素方差分析(表1)表明,亲本间蛋白质含量在两环境条件下均达到极显著差异;亲本间淀粉含量、湿面筋含量、Zeleny沉降值差异在杨凌均极显著,而在三原差异显著;亲本间籽粒硬度、水分含量、纤维含量及SDS沉降值差异未达显著水平,因此表1中未列出且不做后续分析。两亲本比较,陕麦159除淀粉含量显著高于西农981外,蛋白质含量、湿面筋含量、Zeleny沉降值均显著低于西农981。 F2:3家系在不同环境下变异系数不同,且表现出超亲分离现象,说明双亲及F2:3家系存在真实的遗传差异,符合数量性状遗传分析的要求。
2.2 分子标记连锁图谱
利用SRAP引物和SSR引物在两个亲本西农981和陕麦159之间进行单重复筛选及双重复验证, 获得有多态性的SRAP引物81对、SSR引物150对。将这些在亲本间有多态性的引物用F2群体进行检测,SRAP引物有66对出现多态性,SSR引物有63对出现多态性,但最终仅有115对多态性标记(55对SRAP标记、60对SSR标记)被正确定位到遗传连锁图谱上。图谱全长3 203.67 cM,标记主要定位于A染色体组和B染色体组,其中2B染色体标记数量最多,共有21对,D基因组的1D染色体最少,共有3对。
2.3 小麦品质性状QTL定位结果
基于上述构建的连锁图谱对粗蛋白含量、淀粉含量、湿面筋含量和Zeleny沉降值进行QTL分析,在两个环境点共检测到33个QTL(图1及表2),其中粗蛋白含量QTL检测到11个,淀粉含量QTL检测到7个,湿面筋含量QTL检测到12个,Zeleny沉降值QTL检测到3个。这些QTL分布于1A、3A、5A、6A、1B、2B、3B、4B、2D染色体上。
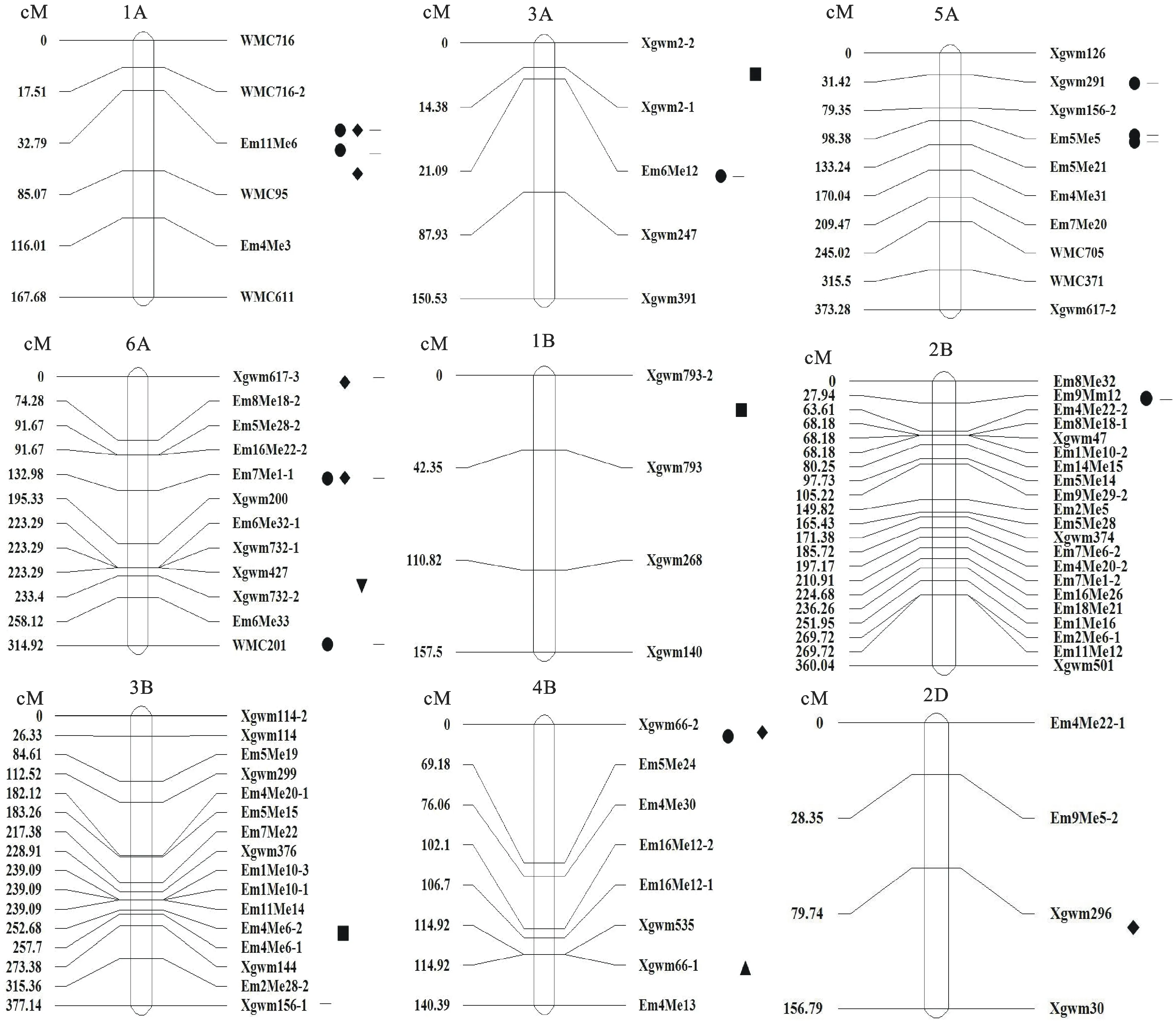
●:杨凌蛋白质;▲:三原蛋白质;◆:杨凌淀粉;▼:三原淀粉;-:杨凌湿面筋;■:杨凌Zeleny沉降值。
●: Yangling protein;▲: Sanyuan protein; ◆: Yangling starch; ▼: Sanyuan starch; -: Yangling wet gluten; ■: Yangling Zeleny sedimentation.

图1 品质相关性状QTL位置
在杨凌环境点检测到蛋白含量相关QTL位点10个,其中1A染色体上2个,3A染色体上1个,5A染色体上3个,6A染色体上1个,2B染色体上1个,4B染色体上1个,可解释表型变异的0.69%~2.48%。三原环境点只在4B染色体上检测到1个蛋白含量相关QTL,位于Xgwm66-1~Em4Me13区间,可解释表型变异的1.74%。加性效应值表明,蛋白相关QTL的增效等位基因基本来源于亲本西农981。
淀粉含量QTL位点在杨凌环境点检测到6个,其中,1A染色体上检测到2个,6A染色体上检测到2个,4B和2D染色体上分别各检测到1个,可解释表型效应的2.94%~6.99%。三原环境点定位得到的淀粉含量QTL位于6A染色体Xgwm427~Xgwm732-2区间内,可解释表型变异的4.83%。加性效应值表明,淀粉含量QTL的增效等位基因来源于亲本陕麦159。
杨凌环境点检测到12个湿面筋含量QTL位点,其中,1A染色体上检测到2个,3A染色体上检测到1个,5A染色体上检测到3个,6A染色体上检测到3个,2B、3B、4B染色体上各检测到1个,可解释表型变异的0.58%~2.37%。三原区间未检测到湿面筋含量QTL。加性效应值表明,湿面筋含量QTL的增效等位基因基本来源于亲本西农981。
在杨凌环境点检测到3个Zeleny沉降值QTL位点,分别位于3A、1B、3B染色体上,可解释表型变异的2.72%~11.31%。其中,1B染色体上检测到的Zeleny沉降值QTL可解释表型变异的11.31%,且其增效等位基因来源于亲本西农981。三原环境点未检测到Zeleny沉降值QTL。
3 讨 论
3.1 SRAP标记在小麦遗传图谱构建及QTL定位中的有效性
SRAP标记技术是首次在芸薹属植物中建立的,该标记是基于外显子中一般GC含量较高,而内含子中GC比例通常较低的现象,通过设计富含CG和AT的双引物针对开放阅读框进行扩增的,因此SRAP标记是基于基因表达序列的功能性分子标记[11]。目前,SRAP标记已被用于遗传多样性研究,但尚未见其被应用于小麦数量性状QTL定位。本试验首次将SRAP标记和SSR标记相结合进行遗传图谱的构建,SRAP引物共612对,最终有55对多态性标记定位到遗传图谱上,多态性检出率为8.99%;SSR引物1 550对,最终有60对多态性标记定位到遗传图谱上,多态性检出率为3.87%。SRAP标记多态性检出率高于SSR标记。李媛媛等[16]利用SRAP标记、AFLP标记和SSR标记对甘蓝型油菜进行遗传图谱的构建,结果也发现SRAP多态性检出率最高。此外,本研究在两种环境下检测得到粗蛋白含量、淀粉含量、湿面筋含量和Zeleny沉降值的33个QTL中,27个QTL的标记区间均与SRAP标记相关,这表明SRAP标记应用于小麦性状QTL定位是切实有效的。特别是,SRAP标记操作简单方便,SRAP引物没有物种局限性,而且不同的引物可进行排列组合,使得引物合成的成本大幅降低,因此,SRAP标记在小麦遗传图谱构建和性状QTL定位中具有很大的利用空间。
3.2 QTL定位结果对比
本研究测定了2个亲本西农981和陕麦159种子的水分含量、粗蛋白含量、淀粉含量、纤维含量、湿面筋含量、硬度、Zeleny沉降值、SDS沉降值等性状,其中,粗蛋白质含量、湿面筋含量、淀粉含量和Zelery沉降值等4个性状在亲本之间存在显著差异,因此本研究对这4个品质性状进行QTL分析。本研究共检测出33个粗蛋白含量、淀粉含量、湿面筋含量、Zelery沉降值的QTL。在两环境下检测到的4个品质性状QTL差距较大,粗蛋白质含量QTL在杨凌环境点检测到10个,而在三原环境点只检测到1个;淀粉QTL在杨凌环境点检测到6个,在三原环境点只检测到1个;湿面筋含量QTL和Zeleny沉降值QTL在三原环境点则未检测到。通过对杨凌及三原环境下的亲本表型数据分析表明,杨凌环境点4个品质性状在亲本间均达到了极显著差异,而三原环境点4个品质性状中只有粗蛋白含量在亲本间差异极显著;在粗蛋白含量、湿面筋含量和Zeleny沉降值3个性状上,亲本西农981在三原环境下的表型值均低于杨凌环境点,而亲本陕麦159的粗蛋白含量和湿面筋含量表型值则呈现相反的变化趋势。因此,我们推测本研究所用双亲品质性状的环境效应不同,在三原环境条件下,亲本西农981和陕麦159中控制这些品质性状的基因分别受到抑制或诱导表达,从而导致双亲的这些品质性状差异变小;三原环境条件同样也影响了F2:3家系,通过对F2:3表型数据分析表明,F2:3变异系数除Zeleny沉降值外,其他3个性状变异系数在杨凌环境点均大于在三原环境点;这可能是导致在两个环境下几乎没有共同QTL位点的原因之一。另外一个原因可能是由于本研究所用SSR标记数量偏少,多位于A、B染色体组上,所以构建的遗传连锁图谱中D组染色体较少;再加上本研究所定位到的品质性状QTL遗传贡献率都较低,属于微效QTL,遗传效应值较低,易受环境影响;因此,导致在2个不同环境下检测到的品质性状相关QTL差异较大。王晨阳等[17]研究表明小麦品质性状易受地理环境和生产条件的影响,同一品种在不同地区或同一地区不同种植地点都可能存在明显差异,这与本研究结果相似。为了提高QTL定位的准确性,我们后续仍需提高标记密度继续研究,以期寻找到在不同环境下稳定表达的品质性状QTL。
本研究在1A(2个)、3A(1个)、5A(3个)、6A(2个)、2B(1个)、4B(2个)染色体上检测到粗蛋白含量QTL。同样,杨 林等[18]在3A、5A、2B染色体上也检测到粗蛋白含量QTL;Blanco等[19]也在6A染色体上检测到2个控制籽粒粗蛋白含量的QTL位点。这说明3A、5A、6A、2B染色体上的确存在控制粗蛋白含量的QTL。庞 欢等[20]在2D染色体上检测到淀粉QTL;本研究同样也在2D染色体上检测到淀粉QTL,但是由于本研究在2D染色体上标记密度较低,无法确定是否为同一QTL。吴云鹏等[10]在1B、1D、3B染色体上检测到3个Zeleny沉降值的QTL;本研究则在1B、3B染色体上检测到Zeleny沉降值的QTL,并且在1B染色体上检测到的Zeleny沉降值的QTL可解释表型变异的11.31%,可能为一主效QTL;另外,本研究还在3A染色体上检测到1个新的Zeleny沉降值QTL,但是贡献率较低,需要进行后续验证。Walid等[21]在6A、5B、6B、7B、7D染色体上检测到5个湿面筋含量相关QTL,本研究则在6A染色体上检测到3个控制湿面筋含量的QTL,表明6A染色体上的确存在控制湿面筋含量的QTL。另外,本研究在3A、5A、2B染色体上检测到粗蛋白含量QTL和湿面筋含量QTL在同一区间相邻或相同位置;在1A、6A、4B染色上检测到控制粗蛋白含量QTL、湿面筋含量QTL、淀粉含量QTL位于同一区间的相邻或相同位置,这说明在这些染色体上存在粗蛋白质含量、淀粉含量和湿面筋含量QTL富集区,可能具有“一因多效”QTL位点,这些区段可能对小麦品质具有重要的影响作用。本研究所采用的2个亲本西农981和陕麦159是近年来审定的农艺性状优良的小麦品种,本研究结果对利用这两个亲本进行新品种的选育具有一定的借鉴意义;我们在后续的研究中可对上述染色体区段进行加密研究,为利用分子标记辅助育种培育具有多个优良品质特性的品种提供理论指导。
[1]刘建军,何中虎,赵振东,等.小麦面条加工品质研究进展[J].麦类作物学报,2001,21(2):81.
LIU J J,HE Z H,ZHAO Z D,etal.Review of noodle industrial quality of wheat [J].JournalofTriticeaeCrops,2001,21(2):81.
[2]Axford D W E,Mcdermott E E,Redman D G.Small scale tests of bread making quality [J].MillingFeedFert,1978,161:18.
[3]陈 锋,何中虎,崔党群,等.利用近红外透射光谱技术测定小麦品质性状的研究[J].麦类作物学报,2003,23(3):1.
CHEN F,HE Z H,CUI D Q,etal.Measurement of wheat quality traits by near infrared transmittance spectroscopy [J].JournalofTriticeaeCrops,2003,23(3):1.
[4]WANG L,CUI F,WANG J,etal.Conditional QTL mapping of protein content in wheat with respect to grain yield and its components [J].JournalofGenetics,2012,91(3):303.
[5]ECHEVERRY-SOLARTE M,KUMAR A,KIANIAN S,etal.New QTL alleles for quality-related traits in spring wheat revealed by RIL population derived from supernumerary× non-supernumerary spikelet genotypes [J].TheoreticalandAppliedGenetics,2015,128(5):893.
[6]DENG Z,HU S,CHEN F,etal.Genetic dissection of interaction between wheat protein and starch using three mapping populations [J].MolecularBreeding,2015,35(1):1.
[7]CUI F,FAN X,CHEN M,etal.QTL detection for wheat kernel size and quality and the responses of these traits to low nitrogen stress [J].TheoreticalandAppliedGenetics,2016,129:469.
[8]LI H M,TANG Z X,ZHANG H Q,etal.Major quality trait analysis and QTL detection in hexaploid wheat in humid rain-fed agriculture [J].GeneticsandMolecularResearch,2013,12:1740.
[9]MCCARTNEY C A,SOMERS D J,LUKOW O,etal.QTL analysis of quality traits in the spring wheat cross RL4452בAC Domain’[J].PlantBreeding,2006,125(6):565.
[10]吴云鹏,张业伦,肖永贵,等.小麦重要品质性状的QTL定位[J].中国农业科学,2008,41(2):331.
WU Y P,ZHANG Y L,XIAO Y G,etal.QTL mapping for important quality traits in common wheat [J].ScientiaAgriculturaSinica,2008,41(2):331.
[11]LI G,QUIROS C F.Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction: its application to mapping and gene tagging inBrassica[J].TheoreticalandAppliedGenetics,2001,103(2-3):455.
[12]祁建民,梁景霞,陈美霞,等.应用ISSR与SRAP分析烟草种质资源遗传多样性及遗传演化关系[J].作物学报,2012,38(8):1425.
QI J M,LIANG J X,CHEN M X,etal.Genetic diversity and evolutionary analysis of tobacco (NicotianatabacumL.) germplasm resources based on ISSR and SRAP markers [J].ActaAgronomicaSinica,2012,38(8):1425.
[13]韩 芳,亓佳佳,马守才,等.黄淮麦区部分小麦品种(系)遗传多样性的SRAP分析[J].西北农业学报,2014,23(12):60.
HAN F,YUAN J J,MA S C,etal.Genetic diversity of some wheat varieties in Huang-Huai wheat area revealed by SRAP marker [J].ActaAgriculturaeBoreali-OccidentalisSinica,2014,23(12):60.
[14]SAGHAI-MAROOF M A,SOLIMAN K M,JORGENSEN R A,etal.Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance,chromosomal location,and population dynamics [J].ProceedingsoftheNationalAcademyofSciences,1984,81(24):8014.
[15]JIANG Y F,LAN X J,LUO W,etal.Genome-wide quantitative trait locus mapping identifies multiple major loci for brittle rachis and threshability in Tibetan semi-wild wheat (Triticumaestivumssp.tibetanumShao) [J].PloSOne,2014,9(12):e114066.
[16]李媛媛,沈金雄,王同华,等.利用SRAP、SSR和AFLP标记构建甘蓝型油菜遗传连锁图谱[J].中国农业科学,2007,40(6):1118.
LI Y Y,SHEN J X,WANG T H,etal.Construction of a linkage map using SRAP,SSR and AFLP markers inBrassicanapusL.[J].ScientiaAgriculturaSinica,2007,40(6):1118.
[17]王晨阳,郭天财,朱云集,等.不同环境条件下小麦主要品质性状的聚类分析[J].河南农业科学,2003(12):9.
WANG C Y,GUO T C,ZHU Y J,etal.Cluster analysis on wheat quality characteristics under various environments in Henan province [J].JournalofHenanAgriculturalSciences,2003(12):9.
[18]杨 林,吴青霞,邵 慧,等.小麦籽粒品质性状的QTL分析[J].西北植物学报,2013,33(8):1574.
YANG L,WU Q X,SHAO H,etal.QTL mapping for grain quality traits in wheat [J].ActaBotanicaBoreali-OccidentaliaSinica,2013,33(8):1574.
[19]BLANCO A,PASQUALONE A,TROCCOLI A,etal.Detection of grain protein content QTLs across environments in tetraploid wheats [J].PlantMolecularBiology,2002,48(5-6):615.
[20]庞 欢,王 琳,王昊龙,等.小麦籽粒淀粉含量的QTL定位及效应分析[J].麦类作物学报,2014,34(1):1.
PANG H,WANG L,WANG H L,etal.QTL mapping for kernel starch content in wheat [J].JournalofTriticeaeCrops,2014,34(1):1.
[21]ELFEKI W M,BYRNE P F,REID S D,etal.Quantitative trait locus mapping for end-use quality traits in hard winter wheat under contrasting soil moisture levels [J].CropScience,2013,53(5):1953.
QTL Mapping of Wheat Grain Quality Traits Based on SRAP and SSR Marker
GUO Lijian1,WANG Zhulin2,WANG Shijuan1,LIU Zhenhua1,LIU Xiangli1,HU Shengwu2,ZHAO Huixian1
(1.College of Life Science,Northwest A&F University,Yangling,Shaanxi 712100,China;2.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China)
The quality characteristics of wheat directly affect its processing and consumption. To explore the wheat quality related QTL (protein,starch,gluten and Zeleny),two different wheat varieties Xinong 981 and Shaanmai 159 were used to develop 169 F2population and F2:3lines. The F2population was exploited to construct genetic map and the F2:3lines were grown in two different environments for phenotyping. The analysis of variance revealed highly significant difference for protein in two environments,whereas,the quality of starch,gluten and Zeleny were highly significant at Yangling and significant at Sanyuan. 612 pairs of SRAP primers and 1 550 pairs of SSR primers were used to detect polymorphism between parents and F2population. Of them,66 SRAP and 63 SSR primers showed polymorphism among F2population. The genetic map and QTL detection results indicated 14 linkage groups including A,B and D genomes with 115 molecular markers constructed,and the whole genetic linkage covered 3 203.67 cM and most markers located on A and B genomes. The 2B chromosome contained maximum number of 21 markers while 1D chromosome revealed minimum three markers. Thirty-three QTLs for quality related traits were identified,including 11 QTLs for protein content,which were distributed on the 1A,3A,5A,6A,2B and 4B chromosomes. Seven QTLs for starch content were distributed on the 1A,6A,4B and 2D chromosomes. Twelve QTLs for gluten content were distributed on the 1A,3A,5A,6A,2B,3B and 4B chromosomes and three QTLs for Zeleny sedimentation value were distributed on the 3A,1B and 3B chromosomes. They could explain 0.69%-2.48%,2.94%-6.99%,0.58%-2.37% and 2.72%-11.31% phenotypic effects,respectively. This study could not detect quality related QTL stable in two environments but detect some QTLs controlling protein,starch and wet gluten traits stable in the same region of chromosome.
Wheat; SRAP; QTL; Quality
时间:2016-10-08
2016-04-07
2016-09-18
国家自然科学基金项目(31471482)
E-mail:baiheichaye@163.com(郭利建);wangzhulin1@163.com(王竹林,与第一作者同等贡献)
赵惠贤(E-mail:hxzhao212@nwsuaf.edu.cn)
S512.1;S331
A
1009-1041(2016)10-1275-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161008.0932.002.html
