肺腺癌浸润前病变的CT诊断评价
2016-11-30陈聪傅钢泽陈永华吴恩福
陈聪,傅钢泽,陈永华,吴恩福
(温州医科大学附属第一医院 放射科,浙江 温州 325015)
肺腺癌浸润前病变的CT诊断评价
陈聪,傅钢泽,陈永华,吴恩福
(温州医科大学附属第一医院 放射科,浙江 温州 325015)
目的:分析肺腺癌浸润前病变不典型腺瘤样增生(AAH)和原位腺癌(AIS)的CT表现特征,提高
不典型腺瘤样增生;原位腺癌;体层摄影术,X线计算机
近年来随着胸部CT的广泛应用及扫描技术的快速发展,肺结节尤其是肺局灶性磨玻璃样结节(focal ground glass nodule,fGGN)的检出率大为增高。大量研究发现fGGN与肺腺癌尤其是肺腺癌早期病变密切相关[1-3]。2011年国际肺癌研究学会、美国胸科学会和欧洲呼吸学会公布的肺腺癌国际多学科分类方案引入原位腺癌(adenocarcinoma in situ,AIS)的新概念,而取消了细支气管肺泡癌的概念,并将不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)与AIS同时列为肺腺癌浸润前病变[4]。AAH和AIS在胸部CT图上均可表现为fGGN,对其准确诊断及鉴别诊断是放射诊断医师需要解决的一大难点。本研究旨在回顾性分析比较经手术病理证实的AAH和AIS的薄层CT表现特征,提高临床对AAH和AIS的诊断及鉴别诊断水平。
1 资料和方法
1.1 一般资料 收集我院2010年1月至2015年5 月手术病理证实的AAH和AIS,筛选出病灶最大径≤ 20mm且在薄层CT上表现为fGGN的81例患者,共85个病灶,包括AAH 28个和AIS 57个。其中女58例,男23例,年龄32~72岁,平均(54.5±9.8)岁。15例因呼吸系统症状在就诊中被发现,其余均于体检中偶然发现。
1.2 仪器和方法
1.2.1 CT扫描仪器:采用的设备有Phillips Brillance 16、GE Light Speed及Bright Speed螺旋CT,扫描范围从胸廓入口至肺底,管电压120 kV,管电流50 mA,重建层厚1~2mm。适当调整窗宽窗位评价病灶。CT图像经PACS系统传至工作站。
1.2.2 CT图像分析:由2名有经验的放射科医师盲法阅读作出诊断并达成一致意见,分析内容包括①部位:左肺上叶、左肺下叶、右肺上叶、右肺中叶
及右肺下叶;②fGGN类型:单纯型、混合型;③形态:圆形或类圆形/椭圆形、不规则形;④界面:清楚、不清;⑤边缘:有无分叶征、毛刺征;⑥内部特征:有无空泡征、血管穿行;⑦大小:取病变轴面最大横径(单位:mm);⑧病灶平均CT值:在病灶最大且上下层面均为磨玻璃密度影的层面选取兴趣区测量病灶平均CT值,测量时避开血管和支气管(单位:HU)。
1.3 病理诊断 所有标本均为胸腔镜或开胸肺叶、肺段或楔形切除所得。由2名具有高级专业技术职称的病理科医师按照2011年版肺腺癌新分类标准[4]共同作出诊断。
1.4 统计学处理方法 采用SPSS19.0软件进行统计分析。计量资料用t检验,绘制病灶大小、CT值的受试者工作特征(receiver operating characteristic,ROC)曲线,同时计算相应的曲线下面积 (area under curve,AUC)。AUC在0.50~0.70范围内诊断价值较低,在0.71~0.90之间诊断价值中等,计数资料用x2检验。P<0.05为差异有统计学意义。
2 结果
根据病灶内有无实性成分将fGGN分纯磨玻璃样结节(pure ground glass nodule,pGGN)和混合磨玻璃样结节(mixed ground glass nodule,mGGN)。AAH有26个pGGN(见图1A-C),2个mGGN;AIS有46个pGGN(见图1D、F),11个mGGN(见图1E)。AIS中mGGN所占比率(为19.3%)大于AAH(为7.1%),但差异无统计学意义(P>0.05),见表1。
病灶的部位、形状、边缘、界面及内部特征统计分析结果显示AAH和AIS在血管穿行方面差异有统计学意义(P<0.05),而在部位、形态、边界、分叶、毛刺及空泡征方面差异均无统计学意义(均P> 0.05),见表1。
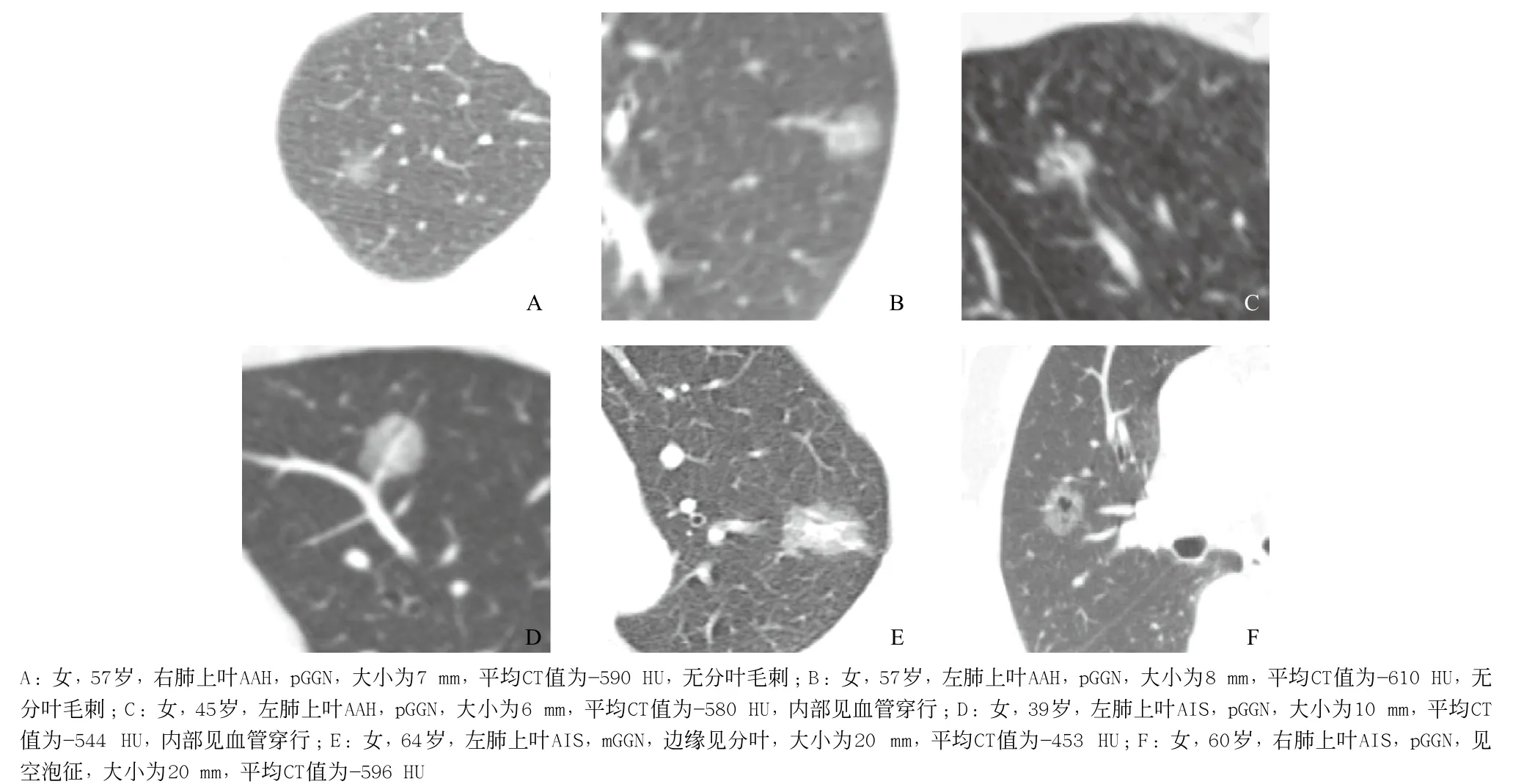
图1 AAH和AIS的CT表现

表1 AAH和AIS的CT表现特征分析比较
AAH平均大小为(7.9±3.0)mm(4~15mm),AIS平均大小为(12.3±3.9)mm(7~20mm),两者差异有统计学意义(P=0.000)。对2组病灶大小绘制ROC曲线显示鉴别AAH和AIS的最佳截断值是8.5mm, AUC=82.6%,诊断价值中等,敏感度为82.5%,特异度为71.4%(见图2)。

图2 病灶大小、平均CT值对AAH和AIS鉴别诊断的ROC曲线
AAH的平均CT值为(-644±71)HU(-763~-450 HU),AIS的平均CT值为(-492±87)HU(-680~-320 HU),差异有统计学意义(P=0.000)。ROC曲线分析显示通过平均CT值鉴别AAH和AIS的最佳截断值是-549 HU,AUC=91.3%,诊断价值高,其敏感度为77.2%,特异度为96.4%(见图2)。
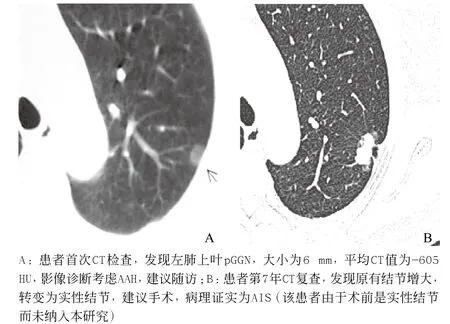
图3 同一患者不同时期CT表现
3 讨论
肺癌是全球发病率和病死率最高的肿瘤,腺癌是其最常见的亚型,约占50%[5]。大多数肺癌患者就 诊时已属于中晚期且失去手术机会,其术后总体5年生存率只有约17%[6],而早期肺癌术后总体5年生存率能达到70%[7],尤其是AAH和AIS术后5年生存率达到100%[8]。所以及时发现和准确诊断肺腺癌浸润前病变是降低肺癌病死率的关键。
根据2011年版对肺腺癌的新病理学分类[4],AAH是指直径≤5mm的局灶性病变,由轻、中度不典型增生的上皮细胞沿肺泡或呼吸性支气管壁生长,无间质炎性反应和纤维增生;AIS是直径≤30mm 的局灶性病灶,由肿瘤细胞沿肺泡壁附壁式生长,无间质、血管或胸膜浸润。AAH和AIS在CT图像上均 可表现为fGGN。fGGN是高分辨率CT上显示的局灶性 淡薄密度增高区,其内可见血管和支气管[9]。病理 基础是肺泡内气体减少、细胞数量相对增多、肺泡上 皮细胞增生、间隔增厚和终末气道部分充填等[10]。研究[11-12]证明fGGN实性成分比例越高,恶性可能性越大。本研究中AAH和AIS多为pGGN,AIS中mGGN所占比率(为19.3%)大于AAH(为7.14%),但差异无统计学意义。根据病理,AAH的实性成分主要是明显增生的不典型上皮细胞;AIS的实性成分主要是局部肺泡的塌陷、纤维组织的增生或增生的肿瘤细胞。
病灶的形态和边缘特征可反映其病理特征。本研究中AAH和AIS形态均以圆形或类圆形为主,提示肺腺癌浸润前病变是一种膨胀式的生长方式。AAH和AIS均沿肺泡壁生长,肺泡结构基本保存,所以两者边界多清楚。但随着肿瘤细胞不断地增殖,由于分化程度不一、生长速度不同,或病灶内纤维组织增生、收缩均可导致fGGN出现分叶、毛刺。空泡征(见图1F)是结节内直径≤5mm的气体密度影,是结节内未受肿瘤累及的肺支架结构。既往研究指出分叶、毛刺及空泡征提示恶性可能大[13-16]。本研究中分叶、毛刺及空泡征在AAH和AIS之间的差异均无统计学意义,是因为AIS为肺腺癌早期病变,恶性征象不明显。但AIS恶性征象所占比率高于AAH,预示AIS向浸润性肺腺癌发展的可能性与趋势。病灶内部有无血管穿行在一定程度上反映了病灶的血供需求。肿瘤在生长过程中需要丰富的血供,从病灶内穿行的血管(见图1C-D)能够保证病灶足够的营养,利于肿瘤细胞生长浸润。本研究中AAH和AIS血管穿行差异有统计学意义,提示肿瘤细胞在生长过程中对血供的需求增加。所以病灶内血管穿行对鉴别AAH和AIS有一定意义。
病灶的大小是诊断恶性病变的独立因素之一,病灶越大其恶性可能越大[17]。Wahidi等[18]研究发现≤5mm的结节恶性率<1%;5~10mm的结节恶性率为6%~28%;>10mm且<20mm的结节恶性率为41%~64%;>20mm且<30mm的结节恶性率为67%~82%。本研究中AAH平均大小小于AIS,差异有统计学意义,提示细胞数量的增加伴随着病灶体积 的增大。对2组病灶大小绘制ROC曲线显示鉴别AAH和 AIS的最佳截断值为8.5mm。要注意的是AAH在CT上 测得大小可大于病理标本大小,原因是病理标本是萎缩固定的,本研究中AAH在CT上最大可达15mm。
肺泡内气体的减少和细胞成分的增加使肺组织密度增高,由于AAH的细胞成分较AIS少,所以AAH的平均CT值低于AIS。本研究中AAH的平均CT值为(-644±71)HU,低于AAH的(-492±87)HU,且差异有统计学意义,ROC曲线显示最佳截断值为-549 HU。 但要指出的是平均CT值的测量受较多因素影响,如部分容积效应或周围血管间隙等因素,亦随测量位置不同而不同。Ikeda等[19]提出三维CT值测量比平均CT值鉴别病变性质更准确,CT值见双峰即可排除AAH,但在很大程度上依赖于所使用的软件及扫描技术,目前尚未广泛应用。平均CT值的测量是简单易行的方法,可作为鉴别AAH和AIS的参考指标。
本研究有以下几点不足:①本研究是回顾性病例分析,选择的病例为临床评价存在恶性可能而入院诊治的患者,未包括门诊随访的患者,数据分析上可能会有偏差;②虽然均为薄层检查,但机器型号及技术参数不完全一致,可能影响部分病灶的评估;③目前对手术病理证实的fGGN尚无大样本,尚待进一步扩大病例数,进行随机多中心的研究。
综上所述,AAH和AIS在表现特征上有一定的差异,有助于两者鉴别。同时AAH和AIS的CT表现差异反映了AAH进展为腺癌的过程中伴随体积的增大、密度的增加及相应形态学的变化。对于薄层CT上≤8.5mm且为pGGN的病灶,若无其他恶性征象,CT值<-549 HU,需考虑AAH,建议随访。在随访中出现直径增大、密度增高或出现实性成分增加等提示AIS可能(见图3),应尽早行手术切除,阻止其恶性发展。
[1] AOKI T, HANAMIYA M, URAMOTO H, et al. Adenocarcinomas with predominant ground-glass opacity: correlation of morphology and molecular biomarkers[J]. Radiology, 2012, 264(2): 590-596.
[2] DIEDERICH S. High resolution computed tomography of the lungs: ground glass opacity and its differential diagnosis [J]. Der Radiologe, 2010, 50(12): 1141-1152.
[3] FELIX L, SERRA-TOSIO G, LANTUEJOUL S, et al. CT characteristics of resolving ground-glass opacities in a lung cancer screening programme[J]. Eur J Radiol, 2011, 77(3):410-416.
[4] TRAVIS W D, BRAMBILLA E, NOGUCHI M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol, 2011, 6(2): 244-285.
[5] AHMEDIN J, FREDDIE B, CENTER M M, et al. Global cancer statistics[J]. CA-Cancer J Clin, 2011, 61(2): 69-90.
[6] HUMPHREY L, DEFFEBACH M, PAPPAS M, et al. Screening for lung cancer: systematic review to update the U.S. preventive services task force recommendation[J]. Ann Intern Med, 2013, 159(6): 411-420.
[7] GROSU H B, EAPEN G A, JIMENEZ C A, et al. Lung cancer screening:making the transition from research to clinical practice[J]. Curr Opin Pulm Med, 2012, 18(4): 295-303.
[8] YOSHIZAWA A, MOTOI N, RIELY G J, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases[J]. Mod Pathol, 2011, 24(5): 653-664.
[9] HANSELL D M, BANKIER A A, MACMAHON H, et al. Fleischner Society: glossary of terms for thoracic imaging [J]. Radiology, 2008, 246(3): 697-722.
[10] 王建卫, 张宏图, 马霄虹, 等. 肺不典型腺瘤样增生的影像与病理对照分析[J]. 中华放射学杂志, 2007, 41(5): 483-486.
[11] PACK C M, GOO F M, KIM T J, et al. Pulmonary nodular ground-glass opacities in patients with extrapulmonary cancers[J].Chest, 2008, 113(6): 1402-1409.
[12] MIN L S, MIN P C, MO G J, et al. Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as groundglass nodules: differentiation by using CT features[J]. Radiology, 2013, 268(1): 265-273.
[13] STEFAN WALBOM H, HANS HENRIK M, TORBEN RIIS R, et al. High resolution spiral CT for determining the malignant potential of solitary pulmonary nodules: refining and testing the test[J]. Acta Radiol, 2011, 52(4): 401-409.
[14] FUSSNER L A, MIDTHUN D E. Characteristics and management strategies for the incidental pulmonary nodule[J]. Lung Cancer Manage, 2014, 3(2): 191-205.
[15] NAMBU A, ARAKI T, TAGUCHI Y, et al. Focal area of ground-glass opacity and ground glass opacity predominance on thin-section CT: discrimination between neoplastic and non-neoplastic lesions[J]. Clin Radiol, 2005, 60(9): 1006-1017.
[16] 肖时满, 张玉, 强金伟, 等. 超高分辨率CT(UHRCT)鉴别肺原位腺癌(AIS)与微浸润性腺癌(MIA)[J]. 复旦学报(医学版), 2014, 41(3): 285-290.
[17] FAN L, LIU S Y, LI Q C, et al. Multidetector CT features of pulmonary focal ground glass opacity: differences between benign and malignant[J]. Br J Radiol, 2012, 85(1015): 897-904.
[18] WAHIDI M M, GOVERT J A, GOUDAR R K, et al. Evidence for the treatment of patients with pulmonary nodules:when is it lung cancer? ACCP evidence-based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132(3S): 94S-107S.
[19] IKEDA K, AWAI K, MORI T, et al. Differential diagnosis of ground-glass opacity nodules: CT number analysis by threedimensional computerized quantification[J]. Chest, 2007, 132(3): 984-990.
(本文编辑:丁敏娇)
The value of imaging characteristics on CT in the diagnosis of preinvasive lesions of lung adenocarcinoma
CHEN Cong, FU Gangze, CHEN Yonghua, WU Enfu. Department of Radiology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To analyze the computed tomography appearances of preinvasive leisions of lung adenocarcinoma and to improve the diagnosis of atypical adenomatous hyperplasia (AAH) and adenocarcinoma in situ (AIS). Methods: Twenty-eight cases of AAH and 57 cases of AIS confirmed pathologically were retrospectively recruited. Comparison of CT features of lung nodules in the two groups, including location, shape, margin, diameter, solid component, internal characteristics and mean CT attenuation. Results: The blood vessels through of focal ground glass nodule (fGGN), diameter and the mean CT attenuation were significantly different between the two diseases (P<0.05 for all), while no difference was found in the pattern of fGGN, location, shape, boundary, lobulation speculation and vacuole sign between AAH and AIS (P>0.05 for all). The average of diameters was (7.9±3.0) mm for AAH, which was smaller than (12.3±3.9) mm for AIS. The optimal cut-off value from the receiver characteristic (ROC) curve was 8.5 mm, with sensitivity of 82.5% and specificity of 71.4%. The mean CT attenuation was (-644±71) HU for AAH, which was smaller than (-492±87) HU for AIS. The optimal cut-off value from ROC was -549 HU, with sensitivity of 77.2% and specificity of 96.4%. Concluion: Comprehensive analysis of the pattern, size, density, shape and internal characteristics of fGGN is helpful for differential diagnosis of AAH and AIS.
atypical adenomatous hyperplasia; adenocarcinoma in situ; tomography, X-ray computed
R816.4
A
10.3969/j.issn.2095-9400.2016.10.008
2015-11-02
陈聪(1990-),女,浙江温州人,硕士生。
吴恩福,主任医师,硕士生导师,Email:wzwef@163. com。
临床诊断水平。方法:回顾性分析经病理证实的28个AAH和57个AIS病灶的CT表现特征,包括病变的部位、大小、形态、边缘、平均CT值等。结果:AAH和AIS在血管穿行、大小及平均CT值方面差异均有统计学意义(均P<0.05),而在磨玻璃样结节类型、部位、形态、边界、分叶、空泡征及毛刺征方面差异无统计学意义(均P>0.05)。AAH的平均大小为(7.9±3.0)mm,AIS为(12.3±3.9)mm,对2组大小绘制受试者工作特征曲线(ROC)显示最佳截断值为8.5 mm(敏感度为82.5%,特异度为71.4%);AAH平均CT值为(-644±71)HU,AIS为(-492±87)HU,ROC曲线分析显示其最佳截断值为-549 HU(敏感度为77.2%,特异度为96.4%)。结论:综合分析肺磨玻
璃结节的类型、大小、密度及形态等有助于AAH和AIS的鉴别诊断。
