胚胎移植绒山羊生殖内分泌调控规律研究
2016-11-30杨秋凤张晓鹰李丰田
郭 丹,杨秋凤,张晓鹰,张 辉,李丰田,冯 媛
(1.辽宁省畜牧科学研究院,辽阳 111000;2.辽宁省重大动物疫病应急中心,沈阳 110161;3.沈阳农业大学,辽宁 沈阳 110161)
繁殖与生理
胚胎移植绒山羊生殖内分泌调控规律研究
郭 丹1,杨秋凤1,张晓鹰1,张 辉2,李丰田1,冯 媛3
(1.辽宁省畜牧科学研究院,辽阳 111000;2.辽宁省重大动物疫病应急中心,沈阳 110161;3.沈阳农业大学,辽宁 沈阳 110161)
以30只母羊为试验样本,研究在胚胎移植过程中,经过同期发情处理和超排处理的供、受体母羊的生殖内分泌调控规律。用放射免疫法测定血清中促卵泡素(FSH)、促黄体素(LH)、孕酮(P4)、雌二醇(E2)和促乳素(PRL)5种激素的动态变化,同时测定血清中生化指标和介素-1β(IL-1β)、白介素-6(IL-6)、转化生长因子-α(TGF-α)、胰岛素样生长因子-I(IIGF-II)等4种细胞因子水平的变化规律。结果表明:供体羊接受处理后,IL-1β、FSH、E2、P4水平均显著高于对照组(P<0.05),在胚胎移植时供体羊的LH、IL-6水平显著高于对照组(P<0.05)。并进一步探讨了细胞因子与激素水平表达的相关性,为预测超排效果定性地提供了有价值的信息,并对胚胎移植生产具有一定的指导意义。
胚胎移植;绒山羊;生殖内分泌
辽宁绒山羊是世界上最优秀的绒山羊品种,具有产绒量高,绒纤维长,细度良好,体形壮大,适应性强,遗传性能稳定、改良低产山羊效果显著等特点,其产绒量居全国之首,被誉为“中华国宝”,是我国农业领域拥有自主知识产权的特殊品种资源。主要分布在盖州及其相邻的岫岩、辽阳、本溪、凤城、宽甸、庄河、瓦房店等地区。辽宁绒山羊种用价值极高,改良低产羊效果显著,被称为“中国绒山羊之父”。
随着辽宁省“封山禁牧”政策的实施和舍饲高效养殖技术的研究与推广,辽宁绒山羊产业的发展模式逐渐向集约化和规模化方向发展,辽宁省政府已经在辽东9市县建成了绒山羊养殖基地,旨在将辽宁省打造成为全国绒山羊供种基地,绒山羊胚胎移植的产业化也被提到日程上来。本研究建立在规模化绒山羊胚胎移植生产的基础上,研究绒山羊同期发情和超排过程及胚胎移植时,母羊的主要激素、细胞因子和生化物质的变化规律。一方面为羊妊娠生理学、妊娠病理学研究及阐明细胞因子对哺乳动物胚胎发育免疫调控作用机理提供理论基础;另一方面,为进一步进行绒山羊体外胚胎生产、胚胎移植产业化及相关科学研究提供重要理论依据,在生产实践中具有指导意义。
1 材料
1.1 动物
本试验的试验羊均由辽宁省辽宁绒山羊原种场有限公司提供,选择体质健壮、无疾病、发情状态一致,且有过分娩记录的母羊共30只,分为3组。
处理组:胚胎移植供体母羊10只,经过同期发情处理和超数排卵处理;
对照组:正常繁殖母羊10只,发情一致,未经过药物处理;
受体组:胚胎移植受体母羊10只,经同期发情处理。
1.2 主要试剂
1.2.1 测试试剂 胆固醇、蛋白质、葡萄糖、钙和钾5种试剂盒和促卵泡素(FSH)、促黄体素(LH)、孕酮(P4)、雌二醇(E2)、促乳素(PRL)5种放射免疫测定试剂盒均购于天津协和医药科技有限公司;白介素-1β(IL-1β)、白介素-6(IL-6)、转化生长因子-α(TGF-α)、胰岛素样生长因子-II(IGF-II)放射免疫测定试剂盒均购于中国人民解放军总医院科技开发中心放免研究所;表皮生长因子(EGF)放射免疫测定试剂盒购于北京原子能研究所。
1.2.2 超数排卵药物 促卵泡素FSH(100 IU/支,宁波第二激素厂产)、促卵泡素FSH(400 mg/瓶,加拿大产)、孕马血清促性腺激素PMSG(1 000 IU/支,宁波市三生药业有限公司产)、促黄体素LH(40 mg/瓶,加拿大产)。
2 方法
2.1 同期发情、超数排卵方案
供体母羊放栓(新西兰CIDR)15 d后,开始激素超排,采取后腿内侧肌肉注射,分8针注射,前7针为加拿大FSH(40 mg),每针间隔12 h。第8针为国产的PMSG(300 IU),各超排药物需统一用稀释液溶解后,用移液器按计量分装到EPPENDOF管内,冷冻保存,避免药物因反复冻融而导致药物成分的变化。
2.2 血样的采集和处理
处理组和对照组均在供体母羊埋栓之日起,每5天从颈静脉采血10 mL,连续采血5次。现场离心后,分离血清,分装在1.5 mL离心管中,于-20℃条件下保存。用以测定胚胎移植受体羊妊娠期FSH、LH、PRL、P4、E2五种激素,IL-1、IL-6、EGF、IGF-II、TGF-α五种细胞因子在血浆中的含量及其变化规律,以及血清胆固醇、蛋白质、葡萄糖、钙和钾含量。
2.3 生化物质的测定方法
样本中的葡萄糖经葡萄糖氧化酶作用生成葡萄糖酸和过氧化氢,后者在过氧化物酶的作用下,将还原性的4-氨基安替双林与酚偶联合成可被分光光度计测定的醌类化合物。样本中游离胆固醇,经过系列反应产生醌亚胺,可用分光光度法在500 nm处设定其吸光度(A)值,然后推算出胆固醇的含量。
血清中钙离子在碱性溶液中与甲基百里香酚蓝(MTB)结合,生成蓝色络合物,通过比色与同样处理的钙标准进行比较而得出最后结果。
血清蛋白质的测定方法用双缩脲法。
血清中钾的测定原理:在碱性介质中,经蛋白沉淀剂处理后的血清样本中的钾离子与NA-TPB反应产生混浊并有稳定悬浮液,混浊度与样本中钾离子浓度成正比。
以上5种物质测定的操作程序按试剂盒说明并加以修改进行测定。
2.4 激素含量的测定方法
血清促卵泡素试剂盒的测定灵敏度为0.6 mIU/mL,最佳曲线方程为4P.LOGISTIC,拟合度为0.999 8;黄体促生成素试剂盒的测定灵敏度为0.4 mIU/mL,最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 8;血清雌二醇放免试剂盒的测定灵敏度为1.4 pg/mL,最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 88;血清孕酮放免试剂盒的测定灵敏度为0.5 mIU/mL,最佳曲线方程为4P.LOGISTIC,拟合度为0.999 7;血清促乳素放免试剂盒的测定灵敏度为1.0 ng/mL,最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 88。
2.5 血清细胞因子的测定方法
2.5.1 白细胞介素1β测定 白细胞介素1β测定试剂盒的测定范围为0.1~24.3 ng/mL;灵敏度小于0.08 ng/mL。试验采用平衡法,标准品在使用前溶解和配制。最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 88。
2.5.2 白细胞介素-6的测定 白细胞介素-6放免试剂盒的测定范围为50~4 000 pg/mL,灵敏度小于50 pg/mL。最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 9,采用平衡法。
2.5.3 转化生长因子α的测定 转化生长因子α的测定试剂盒的测定范围为3.3~270 pg/mL,灵敏度小于5 pg/mL。最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 99,试验采用平衡法,加样程序如下:
向每管加入分离剂500 μL,充分混匀后放室温15~20 min,4℃条件下离心3 500 r/min 20 min。弃去上清,在自动γ计数仪上测定放免性,依据放免仪上的程序,读出有关指标及样品浓度。
2.5.4 胰岛素样生长因子II的测定 胰岛素样生长因子II的测定试剂盒的测定范围为0.1~8.1 pg/mL,灵敏度小于0.1 pg/mL。最佳曲线方程为Y=F(LN(X)∧3),拟合度为0.999 85,试验采用平衡法。
2.5.5 表皮生长因子的测定 表皮生长因子放免试剂盒采用竞争性放免分析法,125I-EGF和待测样品或标准品中的EGF与有限量的EGF抗体竞争反应,加入分离剂,使复合物部分与游离抗原部分分离,弃去上清液,测沉的放射性计数,放射性强度与抗原浓度成正比。最佳曲线方程为LOGIT(Y)=A+B×(LN(X)∧3),拟合度为0.999 48。
3 结果与分析
3.1 超排供体生化物质含量的变化
如表1所示:处理后的第1次采样,供体血清中总胆固醇含量试验组(90.73 mg/dL±6.89 mg/dL)显著高于对照组(70.91 mg/dL±2.74 mg/dL)(P<0.05);血清葡萄糖水平在处理期间变化情况基本一致,第4次采样,供体血清中葡萄糖水平试验组(52.39 mmol/L±5.74 mmol/L)显著高于对照组(42.94 mmol/L±3.66 mmol/L)(P<0.05);血清蛋白质水平在各试验组之间变化情况基本一致,在采卵时试验组(109.50 mg/mL±29.39 mg/mL)显著高于对照组(94.48 mg/mL±2.44 mg/mL)(P<0.05)。同期发期和超排处理期间,各试验组血清中钙含量基本处于稳定状态,并且变化趋势也没有明显的差异。血清钾在各试验组间变化明显不同,对照组血清钾在处理期间基本处于恒定状态,而处理组血清钾含量的最高值和最低值则分别出现在第2次采样和第1次采样。
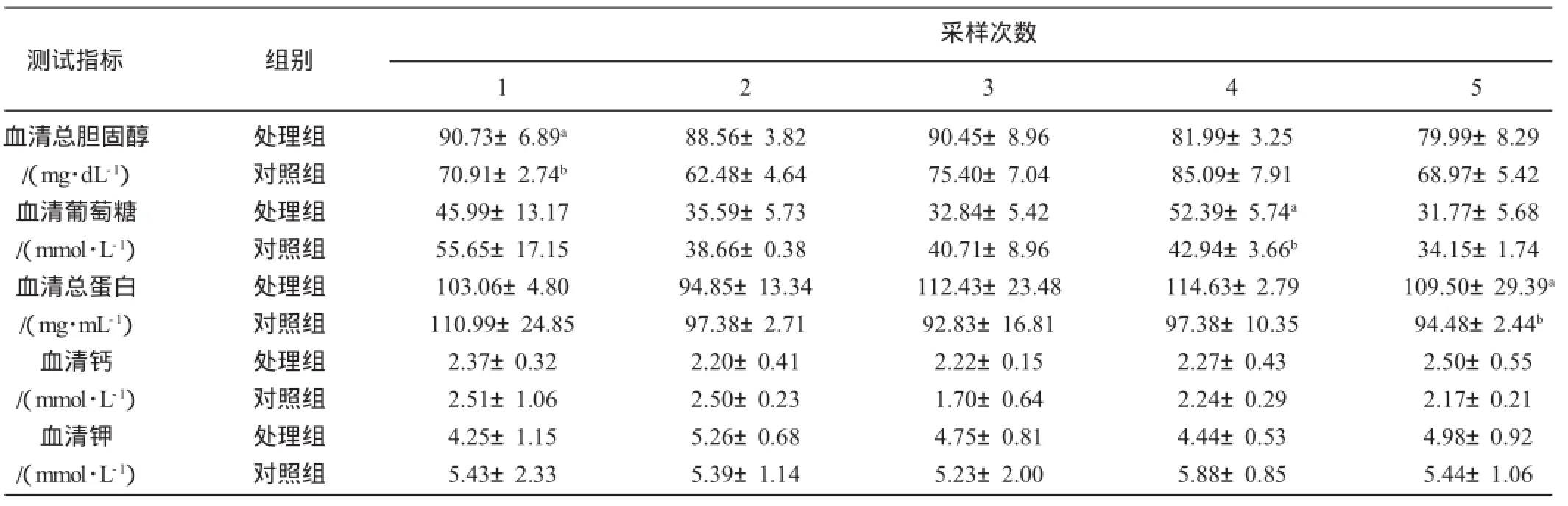
表1 超排供体羊几种生化物质测定结果
3.2 超排供体激素水平的变化分析
由表2可知,辽宁绒山羊同期发情和超排期间,在处理前(即第1次采样),对照组FSH水平(0.35 mIU/mL± 0.12 mIU/mL)显著低于处理组(0.76mIU/mL±0.49mIU/mL)(P<0.05)。试验组FSH于发情时(即第4次采样)达最高值,为0.98 mIU/mL±0.47 mIU/mL,显著高于对照组峰值(P<0.05)。
促黄体素在处理组和对照组中,第3次采样以前,变化趋势基本一致。于第4次采样时,对照组显著升高(P<0.05),移植时又显著下降到0.47 mIU/mL± 0.03 mIU/mL,与处理组差异显著(P<0.05)。
经同期发情处理后,血清雌二醇的水平在处理组中由处理前的2.77 pg/mL±1.51 pg/mL升至4.69 pg/mL± 2.16 pg/mL。但经促超排后,处理组下降,稳至发情配种期,超排时又升至最高4.93 pg/mL±1.91 pg/mL。对照组血清雌二醇水平在发情周期基本稳定。
同期发期用孕酮处理后,第2次采样时,血清孕酮水平显著升高,处理组由处理前的 9.73 ng/mL± 2.53 ng/mL升高至第2次采样时的17.48 ng/mL±3.75 ng/mL。处理组于第3次采样时达峰值23.04ng/mL±12.70ng/mL,第 4次采样时,孕酮水平下降,且显著低于对照组(P<0.05);对照组的血清孕酮水平基本处于稳定状态。
血清促乳素水平在绒山羊同期发情和超排期间的变化趋势:在发情日,对照组显著高于超排组(P<0.05)。在移植时又低于超排组(P<0.05)。

表2 超排供体羊几种激素水平测定结果
3.3 超排供体细胞因子水平的变化分析
由表3可知,辽宁绒山羊同期发情和超排处理时,处理组的血清IL-1β水平一直处于恒定状态;IL-6经同期发情和超排处理后,对照组与超排组的变化趋势高度一致;TGF-a在处理组基本处于恒定水平,对照组于处理后血清TGF-a下降;IGF-II在超排组的水平高于对照组,并于发情日达最高0.098 ng/mL±0.041 ng/mL,但与对照组的0.089 ng/mL±0.003 ng/mL差异不显著(P>0.05);EGF超排组于发情日处于较低水平,为0.70 μg/L±0.22 μg/L,对照组达高峰,且与试验组差异显著(P<0.05)。移植时,各组间差异不显著(P>0.05)。
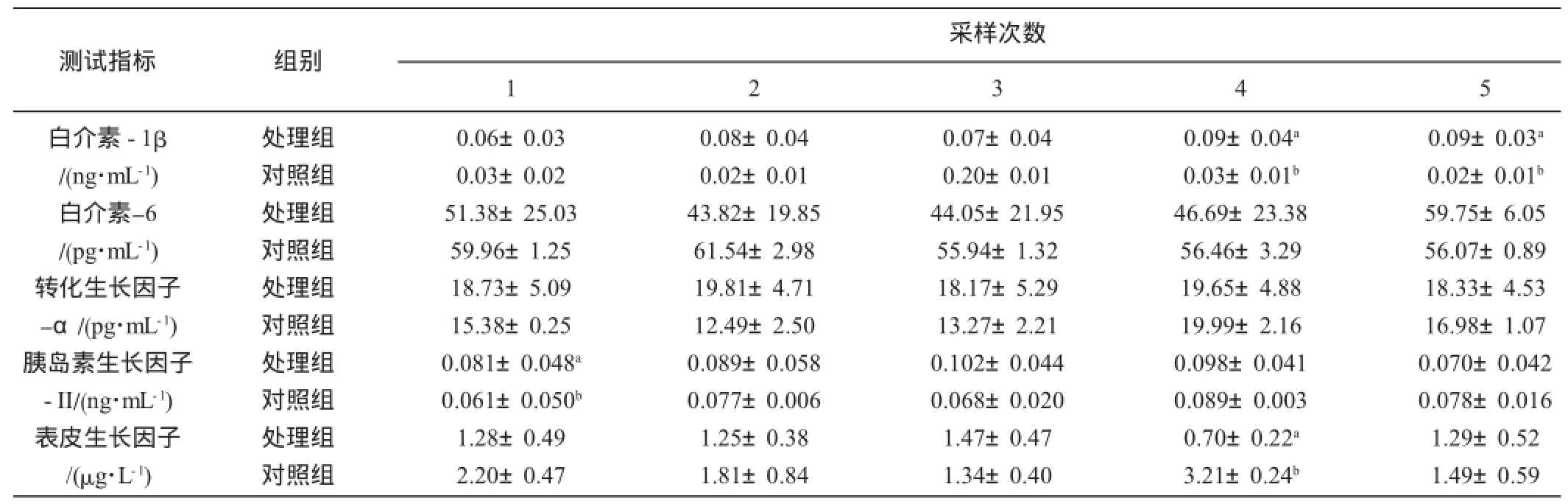
表3 超排供体羊细胞因子水平测定结果
3.4 胚胎移植时供、受体羊激素水平的比较分析
由表4可知,经同期发情处理的供、受体羊在胚胎移植时,血清中的FSH水平接近,差异均不显著(P>0.05);LH水平在对照组较低,且与供体羊差异显著(P<0.05);雌二醇对照组最高,且与供、受体羊差异显著(P<0.05);供体羊孕酮水平极显著高于受体羊和对照组(P<0.01)。
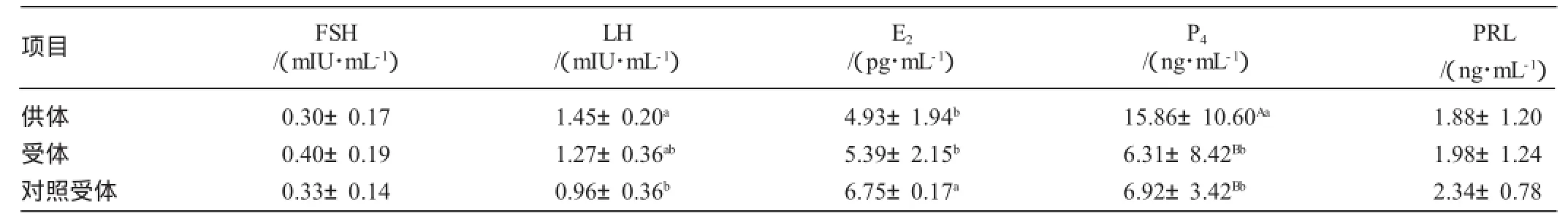
表4 移植时供、受体羊激素水平的比较
3.5 移植时供、受体羊细胞因子水平比较分析
由表5可知,胚胎移植时,IL-1β在供、受体羊间差异不显著(P>0.05),但均显著高于对照受体羊(P<0.05)。供体羊的IL-6水平又显著高于受体羊和对照受体羊(P<0.05)。供、受体羊和对照受体羊的TGF-α水平差异均不显著(P>0.05)。IGF-II在移植受体羊中最高,与对照受体羊和供体羊均差异显著(P<0.05)。EGF在各组间差异均不显著(P>0.05)。

表5 移植时供、受体羊细胞因子水平的比较
4 讨论
4.1 超排供体绒山羊生化物质含量的变化
Patil等[1]研究报道,超排供体羊血液中生化物质水平可反映当时机体的营养状态,另外同期发情所使用的药物与动物体蛋白质代谢和类固醇生成有关。本研究中供体羊经过同期发情处理和超排处理,从总体看,对血清中几种生化物质变化的影响不大。但这种不明显的变化可能是由于采样时间间隔长的原因。在用FSH超排期间(第4次和第5次采血),处理组的血清蛋白质水平高于对照组。血清钙水平基本不受外源激素的影响。而血清钾水平在对照组中的变化不明显,但在处理组发情后有一定差异,这也说明与卵巢所处状态和排卵反应有关,其机理尚待深入研究。
4.2 超排供体激素水平的变化
由于促超排卵可引起多个卵泡发育和多个黄体形成,使机体内分泌水平发生明显的变化。FSH和LH是卵巢卵泡发育和分化的外源调控因子,它们各自受体在卵泡上表达的数量和活性以及卵泡内激素和蛋白因子的合成水平不仅制约着FSH和LH的作用效果,而且反馈性地调节着FSH和LH的分泌水平。有研究表明,产羔性能高的山羊品种较之产羔性能低的品种含有较高浓度的FSH[2]。本研究超排处理后,FSH的血清水平升高,于发情时达高峰;较低浓度的FSH出现在对照组。
当LH水平低时,有62.5%的母羊于24h内发情[3],说明LH水平的高低与发情同期化程度有关。本试验结果表明,处理组于取卵日达峰值,为 1.45 mIU/mL(P<0.05),可能对超排效果影响不大。此结果与徐向明等[4]在山羊上的研究结果相一致。
Gran等[5]研究指出,超排发情牛血清雌二醇水平明显高于非处理牛。本研究在绒山羊上的试验结果为处理组血清雌二醇水平高于对照组,支持上述观点。
佐藤繁等[6]在牛上研究表明,从输精日至输精后7 d,再到20~22d时,妊娠牛的孕酮水平依次增加。黄群山等[7]在非超排西农萨能奶山羊妊娠期外周血浆孕酮、17β-雌二醇和皮质醇的变化上研究表明,外周血浆孕酮水平在配种日最低,为0.5 ng/mL。本试验中配种日最低值为8.96 ng/mL,配种后5 d为15.86 ng/mL,水平较高,可能是由于超排时用孕酮进行同期发情的缘故。
研究表明,PRL在妊娠过程中发挥重要作用。资料中在超排过程中对PRL的分泌情况的研究报道不多。本试验各组PRL的变化趋势基本一致,可能超排因素不直接影响PRL的分泌。
4.3 超排供体细胞因子水平的变化
魏志新等[8]在人上研究表明,促超排药物作用后,血清中EGF、TGF-α水平明显升高,提示促性腺激素可能存在刺激EGFS的分泌作用,但机理未知。本试验研究结果支持此观点。
Machelon等[9]和Ghersevich等[10]在人上研究表明,未受激素刺激时,人排卵后黄体期血浆中IL-1β活性明显增强,提示血清IL-1β的活性与孕酮密切相关;低水平的孕酮可促进IL-1β的基因表达,高浓度时则抑制其表达,但孕酮的浓度界限并不十分清楚。Kol等[11]对模拟动情周期未成熟大鼠卵巢组织进行原位杂交分析,显示IL-1β表达在排卵前逐渐增多,排卵时达高峰,较对照组高3倍。Karagouni等[12]认为,控制超排卵周期IL-1β的分泌受卵泡刺激素/黄体生成素(FSH/LH)或HCG注射的影响,但必须考虑促性腺激素的直接作用及卵巢类固醇激素的调节作用。王玮等[13]在人上研究发现,卵泡液中IL-1β水平与取卵日外周血及卵泡液中的E2水平均呈正相关。表明IL-1β的分泌受E2的影响,且IL-1β对卵母细胞的成熟有调节作用;同时还进一步证明,卵泡液中的IL-1β浓度与取卵数目、成熟细胞的数目均呈正相关。本研究结果表明,由于处理组用了孕酮栓,导致处理组的IL-1β水平一直高于对照组,与上述结论基本一致。
陈丹青等[14]在人上研究表明,促排卵过程中TGF-α水平显著升高(P<0.05),说明促性腺激素有刺激TGF-α分泌的作用,并发现高反应类型血清的TGF-α水平高于低反应类型,这与本研究在绒山羊上经过超排处理组的TGF-α水平高于对照组的研究结果基本一致。
胰岛素样生长因子(IGFS)是一类与胰岛素呈现高度同源性的肽类物质。Wilmut等[15]在猪的输卵管液中发现有大量的IGF-I和IGF-II,发情时的浓度显著高于非发情时,而外周血中的浓度水平却相当恒定,不随生殖状态的变化而变化。另外研究指出,从后情期至发情期,高产仔数组的IGF-II水平高于低产仔数组,表明排卵数高,IGF-II水平高。本试验中处理组的IGF-II水平要高于对照组,与上述报道的结果相一致。表明绒山羊经过超排,发情时血清IGF-II的水平可能与超排效果的好坏有关系。
4.4 移植时供、受体羊激素水平的比较
从内分泌学的角度看,供体、受体母羊虽然在发情时间上达到了同期化,但内分泌及生理状况并未真正同期,因为供体母羊经超数排卵处理后,血液中激素水平较高,而自然发情的受体母羊激素水平相对较低,这种供体内分泌的差别必定会影响到其生理状况的平衡。但在大规模的绒山羊胚胎移植生产中,经过同期发情处理的受体羊,在移植时,是否与相应的供体羊的激素处于相同的水平,也是研究影响移植胚胎进一步发育因素的重要内容之一。经试验测定,移植时,供、受体羊的FSH、LH、E2、PRL基本处于相同的水平,但孕酮含量差异较大,这种差异是否影响移植胚胎的进一步发育,尚需深入研究。早期流产受体羊血清孕酮、雌二醇水平高于妊娠产羔受体(P>0.05),与Shiv等[16]在牛上的研究结果一致。
4.5 移植时供、受体羊细胞因子水平比较
本试验结果表明,在胚胎移植时,供、受体羊的TGF-α和EGF水平差异不显著(P>0.05)。对照组羊的IL-1β水平低于供、受体组羊,供、受体羊组间差异不显著(P>0.05)。供体羊的IL-6显著高于受体羊和对照组(P<0.05)。IGF-II在移植受体组最高,但与供体组和对照组间差异均不显著(P>0.05)。Peclaris等[17]的研究表明,用莫能菌素和孕酮处理绵羊,能提高血液中IGF水平,促使排卵卵泡发育成功能黄体,从而改善绵羊的繁殖能力。此结论和观点解释了本试验中供体羊孕酮水平和IL-6均处于较高水平的结果。由于胚胎自身有适应环境变化的能力,移植时,供、受体之间的部分血清激素如孕酮水平及细胞因子如IL-6、IGF-II即使处于不同的水平,可能不会影响胚胎的进一步生长发育,但胚胎移植时供、受体间的这些差异值得深入研究。
5 小结
相关激素在超排绒山羊血液中的动态变化得到进一步研究,为预测超排效果定性地提供了有价值的信息,并对胚胎移植生产具有一定的指导意义。但由于激素的释放受中枢神经系统控制,短时间的变化较大,尤其是LH的脉冲式分泌。该试验采样的间隔时间较长,其峰值或其平均值难以确定,因而不能说明其与P4、雌激素之间的变化关系,同时由于生产需要而不能进行频密采样,其动态变化与超排效果关系尚需深入研究。
[1] Patil A D,Kurhe B P.Serum total protein and cholesterol following synchronization of oestrus with PGF2αin Osmamabadi goats[J]. Indian Journal ofAnimal Sciences,2004,74(2):182-183.
[2] Driancourt MA,Fry R C.Effect of superovulation with pFSH or PMSG on growth and maturation of the ovulatory follicles in sheep[J].Anim Reprod Sci,1992:27:27-29.
[3] Torres S,Sevellec C.Repeated superovulation and surgical recovery of embryos in the ewe[J].Reprod Nutr Dev,1987,27(4):859-863.
[4] 徐向明,叶进培,张朝昆,等.山羊血浆生殖激素浓度与超排反应的关系[J].江苏农学院学报,1996,17(1):77-82.
[5] Gran DG.Fine structure of the sheep oocyte during antral follicle development[J].J Reprod Tert,1980,59:125-132.
[6] 佐藤繁等著.陈宏摘译.牛人工授精后血清中孕酮浓度的变化与受胎效果[J].黑龙江动物繁殖,1994(1):41-42.
[7] 黄群山,武浩,王建辰.西农萨能奶山羊妊娠期外周血浆孕酮、17β-雌二醇和皮质醇的变化[J].中国畜牧杂志,1994,30(1):7-8.
[8] 魏志新,张丽珠,李美芝,等.促超排卵周期表皮生长因子对人卵泡发育的调节[J].中华妇产科杂志,1997,32(2):87-89.
[9] Machelon V,Nome F,Durand-Gasselin I,et al.,Macrophage and granulosa interleukin-I beta mRNA in human ovulatory follicles[J]. Human Reprod,1995,10(8):2198-2203.
[10]Ghersevich S,Isomaa V,Vihko P.Cytokine regulation of the expression of estrogenic biosynthetic enzymes in cultured rat granulisa cells[J]. Mol Cell Endocrinol,2001,172(1-2):21-31.
[11]Kol S,Ruutiainen-Altman K,Scherzer W J,et al.,The rat intraovarian interleukin(IL-1)system:cellular localization,cyclic variation and hormonal regulation of IL-1 beta and the II IL-1 receptors[J].Mol Cell Endocrinol,1999,149:115-128.
[12] Karagiannidis A,Varsakeli S,Karatzas G,et al.,Effect of time of artificial insemination on fertility of progestagen and PMSG treated indigenous Greek ewes,during non-breeding season[J].Small Ruminant Research,2001,39:67-71.
[13]王玮,沈鸿敏,徐素欣,等.外周血与卵泡液中白介素1β在控制超排卵周期中的变化[J].生殖医学杂志,2001,10(5):270-274.
[14]陈丹青,余美玉.转化生长因子-对促超排卵周期和卵泡发育的调节[J].浙江预防医学,2000,12(10):8-9.
[15] Wilmut I,Sales D I.Effect of an asynchronous environment on embryonic development in sheep[J].J Reprod Fertil,1981,61(1):179-184.
[16]Shiv Prasad,Maurya S N,Misra A K.Total proteinalbum and globulin in relation to embryo transfer in Sahiwal cows[J].Indian Journal of Animal Science,2003,73(3):249-251.
[17]Peclaris G M,Koutsotolis K,Seferiadis K,et al.Effect of monensin and progesterone priming on ram-induced reproductive performance of Boutsiko mountain breeds ewes[J].Theriogenology,1999,51(3):531-540.
Study on the Regulation of Reproductive Endocrine of Embryo Transfer Cashmere Goats
GuoDan,YangQiufeng,ZhangXiaoying,et al
(Animal HusbandryInstitute ofLiaoningProvince,Liaoyang111000,China)
In this study,thirty does were selected as the test sample to study the regulation of reproductive endocrine of donor and recipient does.These does received estrus synchronization and super ovulation.Radioimmunoassay was used to determine five kinds of serum hormones,including follicle stimulating hormone(FSH),luteinizing hormone(LH),progesterone(P4),estradiol(E2)and prolactin prime(PRL).Simultaneously the serum biochemical indexes and four dielectric cell factors. including dielectric element-1 beta(IL-1)and interleukin 6(IL-6),transforming growth factor alpha(tgf-a)and insulin like growth factor II(IGF-II)were determined.The results showed that the levels of P4,FSH,E2and IL-1 in the donors were significantly higher than those in the control group(P<0.05),the levels of LH and IL-6 in the donors were significantly higher than those in the control group(P<0.05).The relationship between cytokine and hormone expression level were explored for predicting the superovulation effect qualitatively and these could provide valuable information and have certain guiding significance to the production of embryo transplantation.
embryotransfer;cashmere goat;reproductive endocrine
S827.3
A
2095-3887(2016)02-0020-06
10.3969/j.issn.2095-3887.2016.02.006
2016-02-26
辽宁省自然科学基金项目(2014020179)
郭丹(1981-),女,高级畜牧师,硕士。研究方向:绒山羊育种。
