高效液相色谱同时测定植物饮料中7种植物毒素
2016-11-29杜伟锋张瑞瑞周思黄金凤王永华何敏恒黄荣荣
杜伟锋,张瑞瑞,周思,黄金凤,王永华*,何敏恒,黄荣荣
(1.华南理工大学轻工与食品学院,广东广州510006;2.广州质量监督检测研究院,广东广州511400)
高效液相色谱同时测定植物饮料中7种植物毒素
杜伟锋1,2,张瑞瑞2,周思2,黄金凤2,王永华1*,何敏恒2,黄荣荣2
(1.华南理工大学轻工与食品学院,广东广州510006;2.广州质量监督检测研究院,广东广州511400)
建立了同时检测植物饮料中原百部碱、香豆素、黄连素、山道年、细辛脑、长叶薄荷酮和芦荟苷A 7种植物毒素含量的高效液相色谱法。试样经HLB固相萃柱富集净化,甲醇洗脱,氮吹浓缩后用流动相起始梯度定容至1.0 mL,经Welch Ultimate XB-C18色谱柱(4.6 mm×150 mm,5 μm)分离,以甲醇-10 mmol/L乙酸铵水溶液(pH=3)为流动相梯度洗脱,通过紫外检测器进行检测。7种植物毒素化合物在0.20~100.00 mg/L范围内线性关系良好,相关系数均>0.99,方法的检出限分别为0.2~6.5 μg/kg,定量限为0.8~21.6 μg/kg。分别对3种植物饮料样品进行加标回收率实验,回收率为67.1%~104.0%,相对标准偏差(n=6)为1.08%~5.12%。该方法操作简单,具有较高的准确度和精密度,适用于植物饮料中7种植物毒素含量的检测。
植物毒素;植物饮料;高效液相色谱法
近年来,随着人们健康养生意识的提高,植物饮料受到越来越多人的青睐,凉茶等天然植物饮料销量迅速增长,产销量直追包装水、碳酸类饮料等传统饮品。植物饮料的安全性成为食品安全领域中不可回避的问题,其中以植物毒素的监测尤为突出。目前,我国暂时还无相关的标准和法规出台,只对植物饮料原辅料的要求中提到不得使用或添加非食品用原料[1-2],国际方面《欧盟食品中化学污染物限量规定》对饮料中的植物相关毒素规定如下:原百部碱为1 mg/kg,香豆素为2 mg/kg,黄连素为0.1 mg/kg,山道年为1 mg/kg,细辛脑为0.1 mg/kg,长叶薄荷酮为250 mg/kg和芦荟苷为0.1 mg/kg。鉴于我国作为植物性饮料的生产和消费大国,在专门针对植物饮料的相关检测方法及标准的建立上比较滞后,暂无相关报道。因此,开展植物饮料中的植物毒素的检测研究,建立相关检测方法,对保障植物饮料质量安全、规范饮料生产市场、进行相关安全隐患调查及风险评估具有积极意义。
目前关于植物毒素的检测方法主要有传感器法、电化学方法[3-4]、化学发光[5]、气相色谱法(gas chromatogra phy,GC)[5]、液相色谱法(high performance liquid chromatography,HPLC)[6-9]、气相色谱-电子轰击离子化质谱法(gas chromatography-electronic ionization-mass spectrometer,GC-EI-MS)[10]、超高压液相色谱法(ultra performance liquidchromatography,UPLC)[11]、气相色谱-串联质谱(gas chro matography-tandem mass spectrometer,GC-MS/MS)法[10]、高效液相色谱串联三重四极杆质谱法(high performance liquid chromatography-triple quadroploe massspectrometry,HPLC-TQ/MS)[12-13]、液相色谱串联四级杆飞行时间质谱(liquid chromatography-quadrupole-time of flight,LC-Q-TOF)[14]等。鉴于GC-MS/MS、HPLC-MS/MS、LC-Q-TOF仪器昂贵,使用成本高,且7种植物毒素多为不易挥发性类物质,因此本试验通过比较选择固相萃取柱、洗脱溶剂,确定氮吹温度、优化仪器参数和条件,建立了高效液相色谱法同时检测植物饮料中7种植物毒素类化合物含量的方法。
1 材料与方法
1.1材料与试剂
原百部碱(纯度98%):上海源叶生物技术有限公司;香豆素(纯度98.0%):上海哈灵生物科技有限公司;黄连素标准品(纯度99.0%):美国Sigma-Aldrich公司;山道年标准品(纯度99.8%):湖北远成赛创科技有限公司;细辛脑标准品(纯度70.9%):德国Dr.Ehrenstorfer GmbH公司;长叶薄荷酮标准品(纯度93.5%):美国Chroma Dex公司;芦荟苷A标准品(纯度99.0%):上海安谱实验科技有限公司。7种植物毒素用甲醇分别配制成1.0 g/L标准储备液,4℃保存。
甲醇、乙腈、丙酮、乙酸乙酯、正己烷(均为色谱纯):德国Merck公司;甲酸(色谱纯):美国Sigma公司;超纯水(18.2 MΩ·cm):实验室自制。HLB固相萃取柱(60 mg,3 mL)、C18固相萃取柱(500 mg,6 mL)、NH2固相萃取柱(500 mg,6cc):沃特世科技(上海)有限公司;Carbon-GCB固相萃取柱(250 mg,6 mL):上海安谱科学仪器有限公司。
分析样品(20种植物饮料):市售。
1.2仪器与设备
Agilent 1260DAD VL高效液相色谱/二极管阵列检测器系统:美国安捷伦公司;MS3 basic漩涡混合器:德国IKA公司;Turbo LV浓缩工作站:美国Biotage公司;Milli-Q去离子水发生器:美国Millipore公司。
1.3方法
1.3.1色谱条件
色谱柱:Welch Ultimate XB-C18(4.6 mm×150 mm,5 μm);流动相A为甲醇,流动相B为10 mmol/L乙酸铵水溶液(pH=3);梯度洗脱程序:0~12.0 min,10%A~55%A;12.0~27.0 min,55%A;27.0~27.1 min,55%A~90%A;27.1~29.9min,90%A;29.9~30.0min,90%A~10%A;流速:1.0 mL/min;柱温:40℃;后运行5 min;检测波长:260 nm(原百部碱、香豆素、黄连素、山道年、细辛脑、长叶薄荷酮),355 nm(芦荟苷A);进样量50 μL。
1.3.2样品预处理
样品摇匀后(如样品存在固体或者果肉沉淀,则需要均质),准确称取10.0g样品于25mL高速离心管中,15 000 r/min高速离心3 min后吸取上清液到HLB固相萃取柱(使用前用6 mL甲醇,6 mL去离子水活化)中,在离心管中加入3 mL去离子水洗涤残渣,高速离心后上柱,重复一次。用5 mL 25%(V/V)甲醇-水淋洗HLB柱,弃去流出液。用5 mL甲醇洗脱,接收洗脱液于60℃水浴氮吹浓缩至近干,使用流动相A∶B=10∶90(V/V)定容至1.00 mL,涡旋复溶,待HPLC分析。
2 结果与分析
2.1标准品的高效液相色谱检测
由于原百部碱和黄连素为生物碱,化合物的碱性较强、极性大,在进行高效液相色谱检测时,易出现色谱峰形较差、拖尾等现象。因此,采用在流动相中添加乙酸铵缓冲液(pH=3)以改善峰形和分离效果。将7种植物毒素标准溶液按1.3.1所示的色谱条件进行检测,得到标准品色谱图,结果如图1。

图1 7种植物毒素的高效液相色谱图Fig.1 HPLC chromatogram of seven kinds of phytotoxins
由图1可知,该色谱条件既可加快以上7种植物毒素的分析时间,又能达到较好的分离效果及响应需求。
2.2固相萃取柱、淋洗液及洗脱剂的选择
2.2.1固相萃取柱的选择
HLB、C18、NH2柱和Carbon-GCB 4种固相萃取柱,分别添加相同质量浓度的7种植物毒素标准溶液进行回收率实验,在其他实验条件相同的情况下,考察不同固相萃取柱对加标回收率的影响,结果见图2。
由图2可知,使用HLB固相萃取柱富集净化时,7种植物毒素的回收率均为最高,回收率范围为74.9%~105%。因此,选择HLB固相萃取柱进行萃取植物毒素。
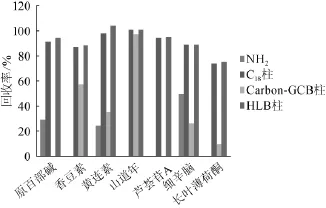
图2 固相萃取柱对回收率的影响Fig.2 Effect of solid phase extraction column on recoveries
2.2.2淋洗液的选择
在淋洗过程中,分别选择10%、15%、20%、25%,30%、35%(V/V)甲醇-水淋洗上样后的萃取柱,收集流出液使用HPLC进行分析,考察淋洗液甲醇含量对洗脱率的影响,结果见图3。

图3 淋洗液甲醇含量对洗脱率的影响Fig.3 Effect of leacheate methanol concentration on elution rates
由图3可知,淋洗液甲醇含量>25%时,流出液中可以检测出黄连素、香豆素、山道年、芦荟苷A,所以选择使用25%(V/V)甲醇-水作为淋洗液。
2.2.3洗脱剂的选择

图4 洗脱溶剂对回收率的影响Fig.4 Effect of elution solvent on recoveries
选用甲醇、乙腈、正己烷、乙酸乙酯、丙酮5种溶剂,分别对3种阴性样品进行高、低2个水平的加标回收实验。3类样品在每种溶剂下做2个平行,测定不同溶剂对加标回收率的影响,结果见图4。
由图4可知,用甲醇洗脱时,7种植物毒素的回收率均最高,在86%~105%之间。所以选择甲醇作为洗脱剂。
2.3氮吹温度及氮吹程度的确定
分别设定氮吹温度为30℃、40℃、50℃、60℃和70℃,在3种阴性样品中添加一定质量浓度的植物毒素标准溶液做回收率实验,每个样品做2个平行,考察不同氮吹温度对回收率的影响,结果见图5。

图5 氮吹温度对7种植物毒素回收率的影响Fig.5 Effect of nitrogen blowing temperature on recoveries of seven phytotoxins
由图5可知,不同氮吹温度对原百部碱、香豆素、黄连素、山道年和芦荟苷的回收率无显著影响。由于长叶薄荷酮和细辛脑不稳定,受光、热、时间影响较大,易发生降解[15],因此不同的氮吹温度和氮吹时间对长叶薄荷酮及细辛脑的回收率影响很大,低温氮吹时,所需的氮吹时间相对较长,进而使其最终回收率较低;70℃高温氮吹时,长叶薄荷酮和细辛脑受热发生分解,从而使其回收率较低。经系列实验表明,氮吹温度为60℃时7种植物毒素的回收率均最高,为79.2%~104%之间。氮吹过程中发现最终吹干和近干对样品的回收率有显著的影响,吹干后长叶薄荷酮与细辛脑损失严重,可能由于长叶薄荷酮和细辛脑的溶解性及热稳定差[15],吹干会造成降解;实验发现近干对7种植物毒素的回收率无显著影响,综合考虑,最终确定60℃条件下氮吹至近干后采用流动相A∶B=10∶90(V/V)复溶定容。
2.4线性范围与检出限
分别对上述系列浓度的混合标准工作溶液进行测定,以7种植物毒素的色谱峰面积(y)对其质量浓度(x)进行线性回归,得到7种植物毒素在0.20~100.00 mg/L范围内线性关系良好,相关系数R均>0.99(见表1)。以3倍信噪比(S/N)计算仪器检出限(instrument detection limit,IDL),结合前处理浓缩倍数(10倍)和回收率情况,计算得到7种植物毒素的方法检出限(methoddetectionlimit,MDL)和方法定量限(method quantitation limit,MLQ),见表1。可见,IDL为2.4~65 μg/kg,由于前处理方法中样品浓缩了10倍,所以MLQ为0.8~21.6 μg/kg。表明本方法灵敏,适用于植物饮料中7种植物毒素的定量分析。

表1 7种植物毒素的线性范围、线性方程、相关系数、方法检出限和方法定量限Table 1 Linear ranges,regression equations,correlation indexes,detection limits and quantitation limits of 7 phytotoxins
2.5方法回收率与精密度
选取阴性植物饮料,分别添加3个质量浓度水平的植物毒素混合标准溶液,混合均匀后,按照本方法进行前处理和色谱检测,每个浓度水平平行测定6次,计算回收率和相对标准偏差;选取中间添加水平,连续测试5 d,计算日间精密度。结果表明:该方法测定植物饮料中7种植物毒素的回收率为67.1%~104.0%,相对标准偏差(relative standard deviation,RSD,n=6)为1.08%~5.12%,日间精密度为0.4%~4.3%,表明方法的重复性良好,准确度符合GB/T 27404—2008《实验室质量控制规范食品理化检测》要求。

表2 回收率和精密度测定结果(n=6)Table 2 Determination results of recoveries and precision tests(n=6)
2.6实际样品的测定
采用本方法对从市场购买的20种植物饮料样品进行分析,所有样品均未检出7种目标化合物。
3 结论
建立了一种同时检测植物饮料中原百部碱、香豆素、黄连素、山道年、细辛脑、长叶薄荷酮和芦荟苷A7种植物毒素含量的高效液相色谱分析方法,植物饮料样品经HLB固相萃取柱富集净化后,用甲醇洗脱,氮吹至近干用流动相定容,以高效液相色谱检测定量,实际样品分析表明本方法具有简单方便、定量准确、灵敏快速的特点,检测仪器是实验室广泛普及的常规HPLC,满足欧盟相关规定限量要求,适用于植物饮料中上述7类化合物的快速确认和准确定量分析。
[1]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T31326—2014植物饮料[S].北京:中国标准出版社,2014.
[2]广州市质量技术监督局.DBJ 440100/T 30—2009植物饮料卫生要求[S].北京:中国标准出版社,2009.
[3]徐丽红,王建清,陶秋.高效液相色谱同时测定3类食品中的5种罂粟壳生物碱[J].分析测试学报,2011,30(12):1387-1391.
[4]李军,孟祥松,刘文苹,等.RP-HPLC法测定接骨木中盐酸小檗碱的含量研究[J].药学研究,2013,32(12):691-694.
[5]张慧君,罗仓学,张新申,等.芦荟主要活性成分的检测方法[J].陕西科技大学学报:自然科学版,2003,21(5):105-108.
[6]李婷,钟英,王芝,等.芦荟苷A、B以及异芦荟色苷D的同时分离纯化[J].天然产物研究与开发,2011,23(5):878-945.
[7]姚曦,岳永德,汤锋.高效液相色谱法同时测定种丛生竹竹叶中香豆素类成分[J].食品科学,2015,36(20):105-109.
[8]侯冬岩,回瑞华,吴师.芦荟花中芦荟苷的HPLC分析及抗氧化性能测定[J].浙江大学学报,2004,31(4):438-441.
[9]肖维强,张超洪,谢路斯,等.化橘红中香豆素类物质的高效液相色谱法测定[J].食品科学,2009,30(24):320-323.
[10]CHENX,LAIY,CAIZ.Simultaneousanalysisofstrychnine and brucine and their major metabolites by liquid chromatography-electrospray ion trapmassspectrometry[J].J Anal Toxic,2012,36(3):171-176.
[11]于玥,张考飞,李军,等.保健食品中添加小檗碱的检测方法研究[J].药物分析杂志,2013,33(9):1551-1554.
[12]马晓斐,梁天佐,宋炜,等.高效液相色谱-串联质谱法同时测定中草药饮料中11种有毒生物碱[J].食品科学,2014,35(8):226-230.
[13]朱建育,燕惠芬.百部生物碱的研究进展及其药理作用[J].上海应用技术学院学报:自然科学版,2010,10(1):26-33.
[14]王学虎,袁敏,张前上,等.液相色谱-质谱法自动筛选常见30种生物碱[J].理化检验-化学分册,2011(4):427-432.
[15]廖娟娟.细辛脑氯化钠注射液的研究[D].武汉:华中科技大学,2010.
Simultaneous detection of seven phytotoxin compounds in plant beverage by HPLC
DU Weifeng1,2,ZHANG Ruirui2,ZHOU Si2,HUANG Jinfeng2,WANG Yonghua1*,HE Minheng2,HUANG Rongrong2
(1.School of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510006,China; 2.Guangzhou Quality Supervision and Testing Institute,Guangzhou 511400,China)
A new method was developed for the simultaneous detection of seven phytotoxin compounds(protostemonine,coumarin,berberine,santonin,β-asarone,R-(+)-pulegone,aloin A)in plant beverage by HPLC.The samples were purified with HLB solid phase extraction column,eluted by methanol,concentrated by nitrogen blowing,and separated by gradient elution in a Welch Ultimate XB-C18column(4.6 mm×150 mm,5 μm)with methanol-ammonium acetate(10 mmol/L,pH=3)as mobile phase(initial volume 1.0 ml),and then detected by UV detector.Under the optimal conditions,the calibration curves for the seven analytes were linear within the range of 0.20-100.0 mg/L and the correlation coefficients were higher than 0.99.The detection limits and quantitation limits of the method were in the range of 0.2-6.5 μg/kg and 0.8-21.6 μg/kg,respectively.The mean recoveries for three sample matrixes were in the range of 67.1%-104.0%,with the relative standard deviations(n=6)ranged from 1.08%to 5.12%.This method was simple and accurate,which could be applied to the detection of seven phytotoxin compounds in plant beverage.
phytotoxin;palnt beverage;HPLC
O652.63
0254-5071(2016)08-0169-04
10.11882/j.issn.0254-5071.2016.08.038
2016-04-01
国家质检总局科技计划项目(2014QK052;2015QK161)
杜伟锋(1986-),男,工程师,硕士研究生,研究方向为食品及食品相关产品分析技术。
王永华(1973-),女,教授,博士,研究方向为工业酶与生物脂质及食品安全。
