5种抗菌药物体外抗厌氧菌活性研究
2016-11-29程敬伟周梦兰徐志鹏谢秀丽徐英春
程敬伟, 王 瑶, 侯 欣, 周梦兰, 徐志鹏, 谢秀丽, 徐英春
·论著·
5种抗菌药物体外抗厌氧菌活性研究
程敬伟, 王 瑶, 侯 欣, 周梦兰, 徐志鹏, 谢秀丽, 徐英春
目的 研究氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南、甲硝唑和克林霉素对临床多中心标本分离厌氧菌的抗菌活性。方法 对179株厌氧菌进行16S rRNA基因测序鉴定。药敏试验参考CLSI M11-A8文件,采用琼脂稀释法测定5种抗菌药物对179株临床分离厌氧菌的最低抑菌浓度(MIC)。结果 77株革兰阴性厌氧杆菌中,56株拟杆菌属细菌对厄他培南敏感率最高,为96.4 %,对克林霉素敏感率为39.3 %;21株革兰阴性厌氧杆菌对氨苄西林-舒巴坦全敏感。43株革兰阳性厌氧杆菌和54株革兰阳性厌氧球菌,对氨苄西林-舒巴坦和厄他培南的敏感率较高(>87.5 %),对克林霉素的耐药率较高。结论 氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南对临床常见厌氧菌保持较高的抗菌活性,不同菌属细菌对甲硝唑耐药率差异较大,对克林霉素耐药率较高。
厌氧菌; 最低抑菌浓度; 耐药性
厌氧菌在自然界广泛分布,与人类有关的大多数厌氧菌为正常定值菌群或条件致病菌。机体深部组织损伤和免疫力低下是形成厌氧菌感染的重要原因。在感染性疾病中,厌氧菌感染占有很大比例,尤其是深部感染,严重者可危及生命[1]。厌氧菌常与需氧菌或兼性厌氧菌共同引起混合感染。厌氧菌感染既往多以经验用药为主,随着抗菌药物的广泛使用,厌氧菌的药敏谱不断变迁,耐药率逐年增加,厌氧菌耐药的问题在欧洲、美国、加拿大和新西兰均有报道[2-4],但我国目前尚缺乏大规模的流行病学资料。了解引起感染的厌氧菌耐药性,对合理使用抗菌药物及制定防治策略非常重要。
厌氧菌标本的采集、运输、培养条件要求较高,且药敏试验操作复杂,制约了其在临床微生物实验室的常规开展。美国临床和实验室标准化协会(CLSI)仅推荐对导致重度感染如菌血症、脑脓肿、心内膜炎、骨髓炎及关节感染等厌氧菌或分离自无菌体液及经验治疗失败的菌株检测药敏。临床治疗厌氧菌感染通常经验性使用广谱抗菌药物,主要包括β内酰胺类、β内酰胺类-β内酰胺酶抑制剂复合制剂、甲硝唑、氯霉素、克林霉素、大环内脂类、四环素和喹诺酮类等[5]。本研究旨在通过多中心收集的厌氧菌检测临床常用的5种抗菌药物包括氨苄西林-舒巴坦、厄他培南、克林霉素、阿莫西林-克拉维酸和甲硝唑的体外药敏结果。
1 材料与方法
1.1材料
1.1.1实验菌株及来源 ①2010年6月-2011年9月收集10所医院分离的146株厌氧菌,来源于外科腹腔感染和妇科盆腔感染患者感染部位标本,所有标本使用运输拭子(意大利COPAN公司)运送至北京协和医院检验科细菌室,进行厌氧菌培养。②2013年10月-2014年3月收集北京协和医院血培养分离的厌氧菌33株。所有菌株均冻存于-80 ℃冰箱。179株厌氧菌中,包括13个菌属,37个菌种。其中北京协和医院52株,河北省人民医院45株,北京世纪坛医院26株,西安交通大学医学院附属第一医院17株,北京大学人民医院12株,天津市人民医院9株,包头市中心医院7株,天津市南开医院6株,第四军医大学附属唐都医院3株,山西医科大学附属第二医院2株。质控菌株为脆弱拟杆菌ATCC 25285和大肠埃希菌ATCC 25922。
1.1.2培养基 厌氧菌药敏使用含有5 %(v/v)脱纤维羊血、氯化血红素(5 mg/L)和维生素K1(1 mg/L)的强化布氏琼脂培养基。布氏培养基为英国OXOID公司产品,血红素和维生素K1为西格玛奥德里奇公司产品;脱纤维羊血从万峰动物饲养场购买。
1.1.3抗菌药物 氨苄西林、舒巴坦、阿莫西林、克拉维酸、厄他培南、克林霉素购于中国食品药品检定研究院,甲硝唑购于德国Dr. Ehrenstorfer公司。其中氨苄西林-舒巴坦、阿莫西林-克拉维酸配比为2∶1。
1.2方法
1.2.1菌株鉴定 所有菌株采用16S rRNA基因测序技术进行鉴定。扩增引物为5F (5’ -TTGGA GAGTTTGATCCTGGCTC-3’)和1194R(5’ -ACGT CATCCCCACCTTCCTC-3’)。测序引物使用5F和810R(5’ -GGCGTGGACTTCCAGGGTATCT-3’),具体操作参考文献报道[6]。
1.2.2MIC测定 参考CLSI 2012年版M11-A8[7]推荐的琼脂稀释法,对179株厌氧菌进行药敏试验。使用日本Sakuma多点接种仪接种。药敏平皿自然干燥后置于35 ℃孵箱厌氧培养48 h,观察结果,质控菌株同时参与试验,所有厌氧菌同步进行耐氧试验。
1.2.3结果判读及统计分析 药敏结果判读参考CLSI M11-A8文件标准[7]。折点参考2015年版M100-S25文件标准[8]。采用SPSS 17.0统计软件对药敏结果进行分析。
2 结果
2.1革兰阴性厌氧菌
56株拟杆菌属细菌对厄他培南敏感率最高,为96.4 %,对阿莫西林-克拉维酸和甲硝唑也保持着较高的敏感率,分别89.3 %和87.5 %,对克林霉素敏感率仅为39.3 %。10株普雷沃菌属对氨苄西林-舒巴坦、阿莫西林-克拉维酸和厄他培南均敏感。6株不解糖卟啉单胞菌中2株对克林霉素耐药,对其余4种药物保持较高的敏感性,而5株柯氏动弯杆菌均对克林霉素耐药。5株小韦荣球菌中,4株对甲硝唑耐药。见表1。
2.2革兰阳性厌氧杆菌
18株乳杆菌属细菌对氨苄西林-舒巴坦、阿莫西林-克拉维酸完全敏感,仅1株对厄他培南耐药,但全部对甲硝唑耐药,对克林霉素的敏感率也仅为27.8 %。11株梭菌属细菌对氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南和甲硝唑的敏感率均在90 %以上,对克林霉素的敏感率仅为45.5 %。8株痤疮丙酸杆菌对氨苄西林-舒巴坦、阿莫西林 -克拉维酸、厄他培南保持较高的敏感率,但均对甲硝唑耐药。见表1。
2.3革兰阳性厌氧球菌
54株革兰阳性厌氧球菌均对氨苄西林-舒巴坦敏感,对厄他培南的敏感率在90 %以上,对阿莫西林-克拉维酸的敏感率为77.8 %~92 %。对甲硝唑的敏感率为55.6 %~77.8 %。对克林霉素的耐药率较高,其中嗜胨菌属、消化链球菌属及大芬格尔德菌耐药率超过65 %。见表1。

表1 5种抗菌药物对179株临床厌氧菌的抗菌活性Table 1 In vitro activity of fi ve antimicrobial agents against 179 strains of anaerobic bacteria
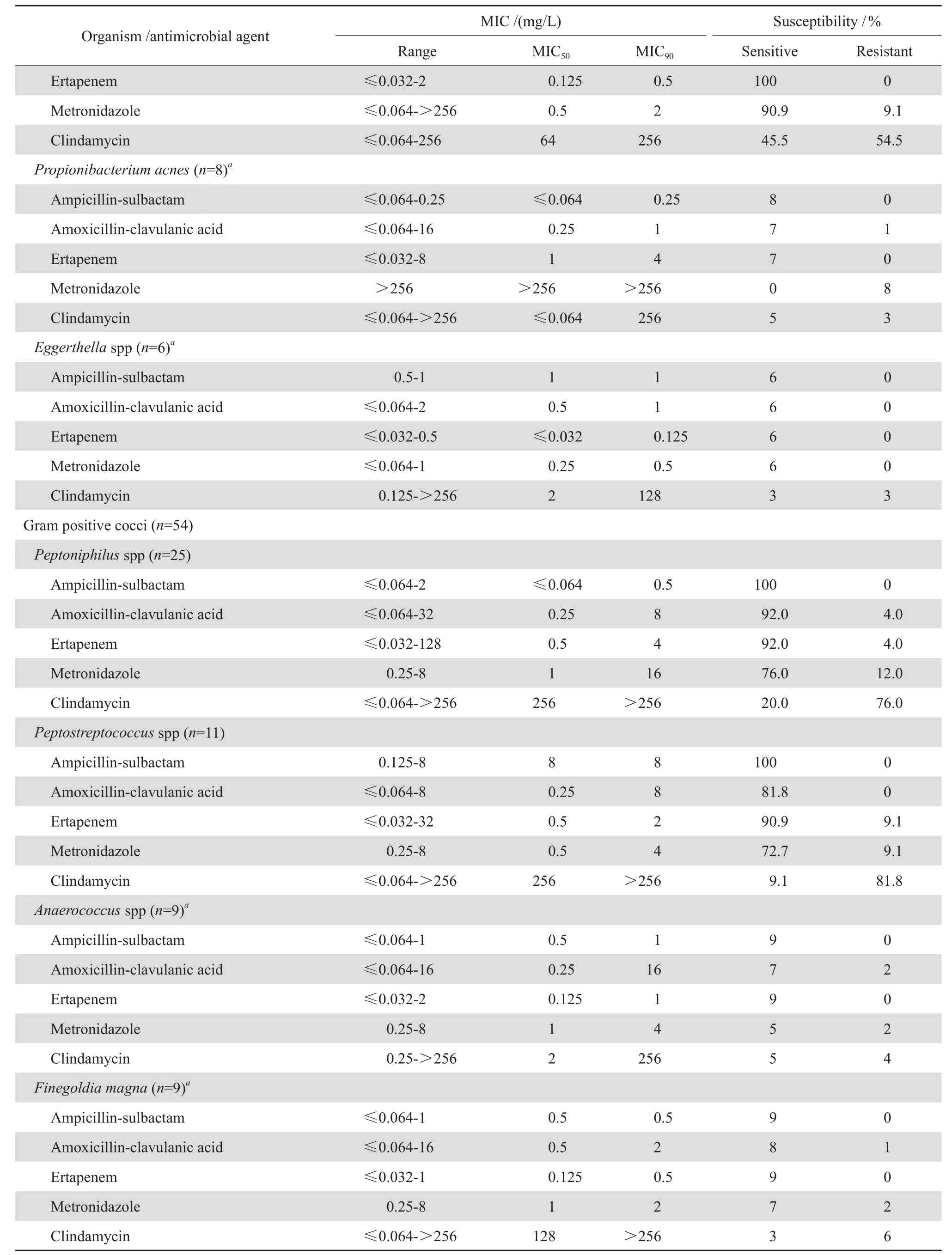
表1 (续)Table 1(continued)
3 讨论
与人类有关的大多数厌氧菌为正常定值菌群或条件致病菌。脑脓肿、肝脓肿,以及接受免疫抑制剂等引起的内源性厌氧菌感染和长期慢性消耗性疾病诱发的继发性厌氧菌感染临床上较为常见[9]。传统认为的“无菌性”感染通常是未检测厌氧菌而得出的错误认识。厌氧菌感染既往多以经验用药为主,但随着抗菌药物的广泛使用,厌氧菌的耐药谱不断变迁,耐药率逐年增高[10]。了解临床常见厌氧菌感染的病原谱和药敏谱对抗感染治疗十分重要。
本课题为多中心参与的厌氧菌药物敏感性研究。研究纳入了179株临床分离厌氧菌,共13个菌属,37个菌种,覆盖范围广,且所有菌株经16S r RNA基因测序技术鉴定至种水平,参考CLSI推荐的琼脂稀释法进行药敏检测,研究常见病原菌的药敏谱。研究发现,最常见的厌氧菌感染为拟杆菌属细菌,其对厄他培南敏感率最高,为96.4 %,与德国的一项多中心研究相似[11];对克林霉素的耐药率超过50 %,接近欧洲、韩国和中国台湾的报道[2,12-13],对阿莫西林-克拉维酸和甲硝唑的敏感率在80 %以上。小韦荣球菌对甲硝唑耐药率较高,其他革兰阴性厌氧菌对氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南保持较高的敏感性。革兰阳性杆菌中,丙酸杆菌属和乳杆菌属细菌均对甲硝唑耐药,其余厌氧菌对氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南和甲硝唑的敏感率较高,对克林霉素敏感率较低。克林霉素的应用是诱发艰难梭菌感染的风险因素[14]。革兰阳性球菌中,对氨苄西林-舒巴坦、厄他培南的敏感率超过90 %,与美国和欧洲的报道相似[15],对甲硝唑的敏感率仅为70 %左右,对克林霉素的耐药率较高,显著高于国外的报道(7 %~20 %)[10]。韩国和加拿大的2项研究表明克林霉素的敏感率在逐渐下降[16-17],同样,我们的研究发现厌氧菌对5种抗菌药物中克林霉素的敏感率最低,这可能与克林霉素在中国的广泛应用相关[18]。
因此,临床常见厌氧菌对氨苄西林-舒巴坦、阿莫西林-克拉维酸、厄他培南保持较高的敏感率,但对克林霉素的耐药率较高。临床微生物实验室应监测厌氧菌耐药性的变迁,并进一步研究其耐药机制,提高实验室诊断能力,为临床合理使用抗菌药物提供有效的数据支撑。
[1] 苏建荣,马纪平. 实验室开展厌氧菌检查的重要性 [J]. 中华检验医学杂志, 2007, 30(1): 12-13.
[2] NAGY E, URBAN E, NORD CE, et al. Antimicrobial susceptibility of Bacteroides fragilis group isolates in Europe:20 years of experience [J]. Clin Microbiol Infect, 2011, 17(3):371-379.
[3] SNYDMAN DR, JACOBUS NV, MCDERMOTT LA, et al. Lessons learned from the anaerobe survey: historical perspective and review of the most recent data (2005-2007) [J]. Clin Infect Dis, 2010, 50 (Suppl 1):s26-s33.
[4] ROBERTS SA, SHORE KP, PAVIOUR SD, et al. Antimicrobial susceptibility of anaerobic bacteria in New Zealand: 1999-2003 [J]. J Antimicrob Chemother, 2006, 57(5): 992-998.
[5] BROOK I, WEXLER HM, GOLDSTEIN EJ. Antianaerobic antimicrobials: spectrum and susceptibility testing [J]. Clin Microbiol Rev, 2013, 26(3): 526-546.
[6] SIMMON KE, MIRRETT S, RELLER LB, et al. Genotypic diversity of anaerobic isolates from bloodstream infections [J]. J Clin Microbiol, 2008, 46(5): 1596-1601.
[7] Clinical and Laboratory Standards Institute. Methods for antimicrobial susceptibility testing of anaerobic bacteria;approved standard-eighth edition[S]. 2012, M11-A8.
[8] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement[S]. 2015, M100-S25.
[9] BROOK I. Spectrum and treatment of anaerobic infections [J]. J Infect Chemother, 2016, 22(1): 1-13.
[10] SCHUETZ AN. Antimicrobial resistance and susceptibility testing of anaerobic bacteria [J]. Clin Infect Dis, 2014, 59(5):698-705.
[11] SEIFERT H, DALHOFF A, GROUP PS. German multicentre survey of the antibiotic susceptibility of Bacteroides fragilis group and Prevotella species isolated from intra-abdominal infections: results from the PRISMA study [J]. J Antimicrob Chemother, 2010, 65(11): 2405-2410.
[12] LIU CY, HUANG YT, LIAO CH, et al. Increasing trends in antimicrobial resistance among clinically important anaerobes and Bacteroides fragilis isolates causing nosocomial infections:Emerging resistance to carbapenems [J]. Antimicrob Agents Chemother, 2008, 52(9): 3161-3168.
[13] LEE Y, PARK Y, KIM MS, et al. Antimicrobial susceptibility patterns for recent clinical isolates of anaerobic bacteria in South Korea [J]. Antimicrob Agents Chemother, 2010, 54(9):3993-3997.
[14] BASSETTI M, VILLA G, PECORI D, et al. Epidemiology,diagnosis and treatment of Clostridium difficile infection [J]. Expert Rev Anti Infect Ther, 2012, 10(12): 1405-1423.
[15] KOETH LM, GOOD CE, APPELBAUM PC, et al. Surveillance of susceptibility patterns in 1297 European and US anaerobic and capnophilic isolates to co-amoxiclav and fi ve other antimicrobial agents [J]. J Antimicrob Chemother, 2004, 53(6):1039-1044.
[16] MARCHAND-AUSTIN A, RAWTE P, TOYE B, et al. Antimicrobial susceptibility of clinical isolates of anaerobic bacteria in Ontario, 2010-2011 [J]. Anaerobe, 2014, 28:120-125.
[17] YIM J, LEE Y, KIM M, et al. Antimicrobial susceptibility of clinical isolates of Bacteroides fragilis group organisms recovered from 2009 to 2012 in a Korean hospital [J]. Ann Lab Med, 2015, 35(1): 94-98.
[18] 曾化松 王艳琳. 抗生素滥用的现状及应对策略 [J]. 中国卫生事业管理, 2012, 29(5): 341-343.
In vitro activity of fi ve antimicrobial agents against anaerobic bacteria
CHENG Jingwei, WANG Yao, HOU Xin, ZHOU Menglan, XU Zhipeng, XIE Xiuli, XU Yingchun. (Department of Clinical Laboratory, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China)
Objective To determine the in vitro activity of ampicillin-sulbactam, amoxicillin-clavulanic acid, clindamycin, ertapenem and metronidazole against the anaerobes isolated from multi-center clinical specimens. Methods All the 179 anaerobic isolates were identifi ed by 16S rRNA gene sequencing. The MICs were determined by CLSI agar dilution method according CLSI document M11-A8. Results Ertapenem showed the highest susceptibility (96.4 %) against the 56 bacteroides group strains, while clindamycin showed the lowest activity (39.3 % susceptible). The remaining 21 strains of gram negative bacilli were all sensitive to ampicillin-sulbactam. In addition, ampicillin-sulbactam and ertapenem showed high activity against the 43 strains of gram positive bacilli and 54 strains of gram positive cocci (at least 87.5 % susceptible). The antimicrobial activity of clindamycin was much lower. Conclusions Ampicillin-sulbactam, amoxicillin-clavulanic acid, and ertapenem showed high activity against most of the clinical anaerobic strains. The activity of metronidazole differed much among different species. Clindamycin showed the lowest antianaerobic activity.
anaerobe; minimum inhibitory concentration; antibiotic resistance
R378;R978.1
A
1009-7708 ( 2016 ) 06-0755-06
10.16718/j.1009-7708.2016.06.014
国家卫生计生委公益性行业科研专项(201402001)。
中国医学科学院北京协和医院检验科,中国医学科学院北京协和医学院研究生院,北京 100730。
程敬伟(1989—),男,博士研究生,主要从事微生物鉴定及耐药机制研究。
徐英春,E-mail:xycpumch@139.com。
2015-12-01
2016-03-23
