131I-c(RGD)2的药代动力学及急性毒性研究
2016-11-29王荣福陈雪祺张春丽
马 欢,郝 攀,马 超,闫 平,刘 敏,王荣福,陈雪祺,张春丽
(1.北京大学第一医院核医学科,北京 100034;2.厦门大学附属中山医院核医学科,福建 厦门 361004)
·基础研究·
131I-c(RGD)2的药代动力学及急性毒性研究
马 欢1,郝 攀1,马 超2,闫 平1,刘 敏1,王荣福1,陈雪祺1,张春丽1
(1.北京大学第一医院核医学科,北京 100034;2.厦门大学附属中山医院核医学科,福建 厦门 361004)
目的 用131I标记二硫键成环的 RGD肽二聚体 c(RGD)2,探讨其在裸鼠体内的药代动力学参数、急性毒性反应和死亡情况,评价其应用的安全性。方法 选取5只裸鼠为实验对象,每只经尾静脉注射131I-c(RGD)2(7.4 MBq/200 μL),分别于注射后3、6、10、15、30、45、60、120、180及360min断尾取血5 μL,测量血液的放射性计数,采用PKSolver软件进行药代动力学分析。另取裸鼠10只随机分为实验组及对照组,实验组每只经尾静脉注射131I-c(RGD)2(7.4 MB/60μL);对照组经尾静脉注射生理盐水60μL,观察注射后72 h内裸鼠的不良反应和死亡情况。结果 血液药-时曲线符合权重系数为1/CC的开放性二房室分布模型,其中分布相半衰期(t1/2α)为15.364 min,消除相半衰期(t1/2β)为123.125 min。注射131I-c(RGD)2后72 h内,裸鼠无不良反应与死亡。结论 c(RGD)2具有理想的药代动力学特点,且无明显毒性作用,这些均有利于其作为新药应用于临床。
药代动力学; RGD肽; 急性毒性
RGD是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的多肽,在生物体内广泛存在,它是整合素及其配体作用的识别位点,介导细胞与细胞及细胞与细胞外基质之间的黏附作用,并且具有信号传导的功能[1-3]。整合素 αvβ3受体在肿瘤新生血管内皮细胞表面高度表达,而含 RGD序列的多肽可特异性地与αvβ3受体结合,放射性核素标记的含 RGD序列的多肽已应用于肿瘤血管生成显像研究[4]。
目前研究较多的 RGD肽多为酰胺键成环的环肽及其多聚体,其环化过程困难,而二硫键成环的RGD肽合成相对容易。在前期研究中,我们通过 V-life软件分子对接程序筛选出了二硫键成环的新型RGD二聚体肽c(RGD)2[5],制备合成了具有高放化纯度的131I-c(RGD)2,并且在活体动物显像中获得了高质量的影像[6],表明该新型多肽有应用于临床肿瘤显像的潜在价值。作为新药用于临床显像,不仅要求 c(RGD)2在靶组织中具有较高的摄取率,而且要具有适合于诊断的药代动力学性质。
本文采用放射性核素131I标记 c(RGD)2,研究131I-c(RGD)2在裸鼠体内的药代动力学特征及急性毒性反应,获取体内半衰期等主要药代动力学参数,为其作为新药在临床中的应用提供理论依据。
材料和方法
1 主要材料
Na131I溶液由中国原子能科学研究院同位素所提供;氯胺-T(ChT):上海国药集团化学试剂有限公司产品,纯度>98%;Sephadex TM G10:Amersham Bioscience(AB公司)产品。层析纸为新华 1号滤纸。BALB/c裸鼠15只(雌性,体重20~22g,4~6周龄)由北京大学医学部实验动物科学部提供,符合实验动物质量标准。
2 方法
2.1131I-(RGD)2的制备与纯化 采用ChT法标记c(RGD)2,将50 μg c(RGD)2溶于100 μL pH 7.4的0.5 mmol/L的磷酸盐缓冲液中,然后向上述反应液中加入 10 μL Na131I溶液,同时加入 ChT溶液,使ChT的终浓度为 10 μg/μL,总反应体积不超过 200 μL,室温下震荡反应2 min,立即将标记物经Sephadex G10柱层析分离纯化,用pH 7.4的0.05 mmol/L磷酸盐缓冲液冲洗,收集淋洗液1 mL/管,测定每管的放射性计数。第一个计数峰值管为131I-c(RGD)2,采用纸层析法测定标记率与放化纯度,展开剂为正丁醇∶无水乙醇∶0.5mol/L氨水 =5∶1∶2(V∶V∶V),Rf为0~0.1。最终产品的放化纯度≥90%。
2.2 最佳房室模型分析与药代动力学参数计算 取 5只裸鼠,分别经尾静脉注射 7.4 MBq131I-c(RGD)2,于注射后 3、6、10、15、30、45、60、120、180及360 min经断尾取血5 μL,测定血液样品的放射性计数,并换算为血液放射性浓度(即kBq/mL)。应用药代动力学软件PKSolver,将软件中药物浓度用血液放射性浓度替换,对 5只裸鼠的平均血液放射性浓度-时间数据进行分析,分别用一、二、三室模型进行消除曲线拟合,同时将 1、1/C、1/CC作为权重系数(C为血液的放射性浓度),AUC、AUMC、MRT采用统计矩参数,遵循最小信息准则(Akaike information criterion,AIC)最小原则,得出最佳房室模型,求得各有关体内代谢动力学方程系数及代谢动力学参数。
2.3 急性毒性试验 取裸鼠 10只,随机分为实验组及对照组,每组5只,实验组每只裸鼠经尾静脉注射131I-c(RGD)2溶液 7.4 MBq/60 μL;对照组每只裸鼠经尾静脉注射生理盐水 60 μL。给药后 72 h内观察裸鼠的中枢神经系统症状、活动行为、粪便、体重变化及死亡等情况。
3 统计学处理
采用SPSS17.0统计软件进行单因素方差分析,P<0.05为差异有统计学意义。
结 果
1 最佳房室模型及药代动力学参数
利用 PKSolver软件绘制出平均血液放射性浓度-时间曲线(图 1),并得出不同模型各权重下的AIC及拟合度(R2)值(表1)。可见131I-c(RGD)2在裸鼠体内的最佳药代动力学房室模型为权重1/CC的二室模型。经拟合得到血液放射性浓度-时间关系式为:
C(t)=9245.084e-0.045t+2278.969e-0.006t
其中,公式中C为血液放射性浓度(kBq/mL),t为注射标记物后的时间(min)。标记物在裸鼠体内的药代动力学参数见表2。
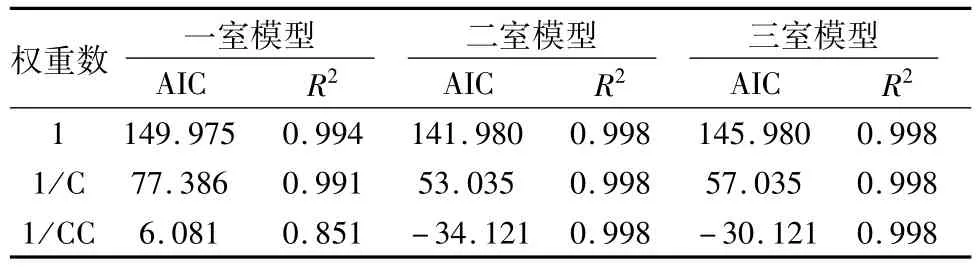
表1 不同权重数下各室模型的 AIC值和 R2
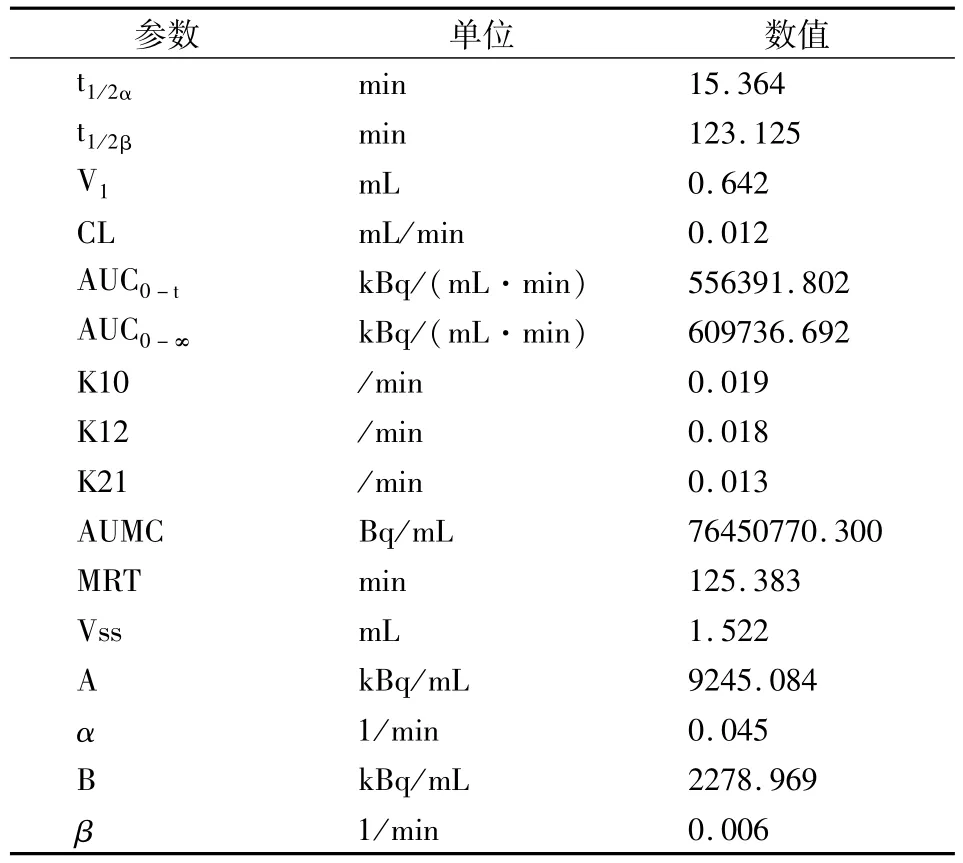
表2 标记物131I-c(RGD)2在裸鼠体内的药代动力学参数
2 急性毒性试验结果
注射131I-c(RGD)2后72 h内,裸鼠未出现步伐不稳、抽搐、呼吸困难、后肢强直及死亡等不良现象。实验组裸鼠注射131I-c(RGD)2后,体重未发生明显改变,且饮水量与对照组裸鼠无差别。
讨 论
药代动力学研究是新药临床前研究的重要组成部分,通过对新药的动物和人体药代动力学研究,明确药物吸收、分布、代谢和排泄的特征,寻找药物在体内的处置过程和转运规律,药物在体内的积蓄速度和积蓄程度,为临床安全合理用药提供依据。
药代动力学研究显示,多肽 c(RGD)2在裸鼠体内符合权重系数为1/CC的二室模型,与αvβ3受体在正常组织中极低表达或不表达的结论相符[7]。药代动力学参数中,反映药物自血液向组织液分布快慢的α值(0.045)是代表体内药物消除速率β值(0.006)的 7.5倍。分布相半衰期(t1/2α)表示药物在血液中的浓度达到最大值的一半所需要的时间,代表药物吸收的快慢。t1/2α为15.364 min,说明131I-c(RGD)2吸收快,静脉注射后能迅速通过血液循环向组织液分布,能较快的到达靶器官,有利于减少早期显像时心脏与大血管的影像干扰。消除相半衰期表示血液药物浓度下降一半所需要的时间,反应药物在血中维持时间的长短及从体内消除的快慢。t1/2β(123.125 min)符合小分子多肽血液清除快的特点,能保证常规显像时间内软组织处于低放射性本底,并有利于减少对其他组织器官的辐射损伤。这也与 c(RGD)2多肽结构的预期设计一致,我们在c(RGD)2结构中引入了两个D型丝氨酸以增加它的水溶性,以加快多肽在正常组织中的清除、降低肝脏摄取,提高肿瘤与正常组织的靶本比。K12值大于K2l值,提示131I-c(RGD)2在裸鼠体内的分布达到暂时平衡后,进入组织液中的量大于离开量,保证了高表达 αvβ3受体的肿瘤新生血管内皮细胞与放射性核素标记的c(RGD)2有充足的时间进行结合。表观分布容积(Vd)是给药剂量与血药浓度的一个比值,表观分布容积大,说明药物分布广,组织摄取多,而血药浓度低。该多肽Vd值为 0.880,因此该多肽组织摄取多而血液中浓度低,组织与血液本底的比值高,可以得到高质量的图像。
对以上参数进行分析可知,静脉注射131I-c(RGD)2后可在短时间内行αvβ3受体阳性肿瘤显像,且延迟显像可获得低血池本底及高质量的图像,这与我们前期的显像研究结果一致,在前期我们选用了αvβ3受体高表达的神经胶质瘤裸鼠模型,静脉注射131I-c(RGD)2后3 h即可获得高对比度的肿瘤显像图像,静脉注射后 5 h、24 h时行延迟显像图像质量更佳[7]。本实验为在注射131I-c(RGD)2后的较短时间内行核素显像,并获得低血池本底及高质量图像提供了理论依据。
通过V-life软件分子对接程序设计合成的二硫键成环的c(RGD)2多肽结构简单、合成容易,标记方便、标记率高,该药物具有良好的药代动力学特点,且急性毒性试验未见不良反应,这些均有利于其作为新药应用于临床肿瘤的显像研究。
[1]Seong J,Wang N,Wang Y.Mechanotransduction at focal adhesions:from physiology to cancer development.J Cell Mol Med,2013,17(5):597-604.
[2]Robinson S D,Hodivala-Dilke K M.The role of beta3-integrins in tumor angiogenesis:context is everything.Curr Opin Cell Biol,2011,23(5):630-637.
[3]Haubner R,Wester H J,Reuning U,et al.Radiolabeled αvβ3integrin antagonists:a new class of tracers for tumor targeting.J Nucl Med,1999,40(6):1061-1071.
[4]Gaertner F C,Kessler H,Wester H J,et al.Radiolabelled RGD peptides for imaging and therapy.Eur J Nucl Med Mol Imaging,2012,39 Suppl 1:S126-138.
[5]张丽,张春丽,王荣福,等.RGD多肽类药物设计、活性测定及99mTc-cRGD二聚体的制备.核化学与放射化学,2011,33(2):106-113.
[6]张春丽,郝攀,成彧,等.131I-c(RGD)2在荷不同类型肿瘤小鼠中的生物分布与显像研究.肿瘤学杂志,2014,20(11):875-880.
[7]von Wallbrunn A,Holtke C,Zuhlsdorf M,et al.In vivo imaging of integrin αvβ3expression using fluorescence-mediated tomography.Eur J Nucl Med Mol Imaging,2007,34(5):745-754.
(潘子昂编辑)
Pharmacokinetics and Acute Toxicity Study of131I-c(RGD)2
MA Huan,HAO Pan,MA Chao,YAN Ping,LIU Min,WANG Rong-fu,CHEN Xue-qi,ZHANG Chun-li
(Department of Nuclear Medicine,Peking University First Hospital,Beijing 100034,China)
Objective To evaluate the safety,pharmacokinetics and acute toxicity of131I-c(RGD)2in nude mice.Methods Five nude mice were injected with131I-c(RGD)2via tail vein(7.4 MBq in 200 μL/mouse)and blood samples(5 μL)were collected by cutting down the tail end at 3,6,10,15,30,45,60,120,180 and 360 min after administration.The radioactive accounts of blood samples were measured using a γ-counter and the pharmacokinetics data was calculated by the PKSolver software.10 nude mice were randomly divided into 2 groups,the experimental group and the control group,for the acute toxicity study.The experimental mice were injected with131I-c(RGD)2via tail vein(7.4 MBq in 60 μL/mouse)and the control mice were injected with saline(60 μL/mouse)to observe the adverse reaction.Results The blood dynamics of131I-c(RGD)2in nude mice conformed to the two-compartment model with the weight of 1/CC,and t1/2αand t1/2βwere 15.364 min and 123.125 min respectively.No adverse reaction was observed within 72 h after injection.Conclusion The ideal pharmacokinetic characteristics and tissue tolerance of131I-c(RGD)2suggest it to be a potential agent in clinical practice.
Pharmacokinetics; RGD peptide; Acute toxicity
10.11748/bjmy.issn.1006-1703.2016.01.024
2015-11-03;
2015-11-26
北京市自然科学基金(7112129)
张春丽,研究员,博士。E-mail:zhangcl0326@sina.com
