安吉毛竹林净生态系统碳交换量及叶绿素荧光参数的变化
2016-11-28龚莎莎马锦丽舒海燕陈晓峰
龚莎莎,江 洪,2,*,马锦丽,舒海燕,陈晓峰
(1.浙江农林大学 国际生态研究中心,浙江 杭州 311300; 2.南京大学 国际地球系统科学研究所,江苏 南京 210093; 3.西南大学 生命科学学院,重庆 400715)
安吉毛竹林净生态系统碳交换量及叶绿素荧光参数的变化
龚莎莎1,江 洪1,2,*,马锦丽1,舒海燕3,陈晓峰1
(1.浙江农林大学 国际生态研究中心,浙江 杭州 311300; 2.南京大学 国际地球系统科学研究所,江苏 南京 210093; 3.西南大学 生命科学学院,重庆 400715)
利用涡度相关法,对安吉毛竹林生态系统的碳通量进行实时观测,同时用叶绿素荧光仪PAM-2500测定通量框架下毛竹的叶绿素荧光参数。分析了毛竹林净生态系统碳交换量(NEE)的日变化和月平均变化及荧光参数变化。结果表明,NEE值在6:00—7:00开始转为负值,至17:00—18:00转为正值;白天表现为碳汇,并且在数值上,NEE值的负值最高点表现为秋季(9月,10月,11月)>春季(3月,4月,5月)>冬季(12月,1月,2月),说明毛竹CO2通量具有明显的季节变化。逐月NEE值变化范围为-25.563 3~85.531 2 gC·m-2·月-1,12和1月份NEE值较低,1月份达到最低点。叶绿素荧光参数中PSⅡ的最大光合量子产量(Fv/Fm)先降后升,12月,1月和3月份Fv/Fm低于正常水平,与其他月份差异显著(P< 0.05),说明毛竹在这3个月份受到了胁迫,光化学效率降低;Fv/Fo与Fv/Fm趋势相同,12月,1月和3月份潜在活性最低,并且与其他月份差异显著(P<0.05);PSⅡ的实际光合量子产量(ФPSⅡ)变化趋势与Fv/Fm、光化学猝灭系数(qP)大致相同;在10月至翌年3月份,qP逐渐下降之后开始升高,同时伴随非光化学猝灭系数(qN)值的上升和下降。研究表明,毛竹在受到低温胁迫时,会导致其吸收的光能用于光化学电子传递的部分减少,光合碳同化率下降。
毛竹林;生态系统;净生态系统碳交换量;叶绿素荧光
随着社会现代化进程的发展,人类活动大大改变了地球表面物质的形态及动植物分布[1],尤其是大量使用化石燃料、破坏森林植被、汽车尾气排放等显著增加了大气CO2含量,这引起了社会和科学界的高度重视。因此,探索CO2源/汇奥秘成为许多科学家研究的课题[2]。森林生态系统作为吸收CO2的一个重要的汇[3],量化其碳通量值在研究全球生态系统碳循环以及全球碳的源/汇奥秘方面具有相当重要的意义[1]。
毛竹(Phyllostachysedulis)作为森林植被中固碳效果较好的林木之一[4],近年来,其在全球维持碳平衡的贡献开始受到关注[5]。安吉作为中国著名的“竹子之乡”,其毛竹的经营及加工利用长期处于国内领先地位[6]。为全面了解毛竹的固碳能力及对安吉的碳汇贡献,安吉建立了全球第1个毛竹林碳汇通量观测系统,对毛竹林进行实时动态检测[7]。相关学者对毛竹的固碳能力进行了大量研究,如刘恩斌等[8]通过构建基于非空间结构的毛竹林固碳潜力模型,研究毛竹地固碳能力;勐海月等[9]分析了不同经营类型的毛竹林固碳潜力。
目前,中国对森林碳通量的研究涉及土壤[10]、栎林[11]、草地[12]等各个尺度,但是从生理生态角度进行碳通量研究的报道较少。植物的光合作用和呼吸作用是决定陆地生态系统CO2通量的生理生态学过程[13];叶绿素荧光动力学技术被视为测定叶片光合作用的快速、高效、无损伤的探针[14],其与光合作用中各个反应过程紧密相关[15]。本文以安吉毛竹林为对象,采用涡度相关微气象观测方法,对毛竹林生态系统的碳通量进行实时观测,分析了毛竹的净生态系统CO2交换量,同时对通量框架下毛竹的叶绿素荧光参数进行分析,以揭示毛竹林净生态系统碳交换量(net ecosystem carbon eschange, NEE)及叶绿素荧光参数的变化,为从生理生态角度研究毛竹的碳汇功能及毛竹开发利用提供参考。
1 材料与方法
1.1 试验地概况
试验基地位于浙江省湖州市安吉县山川乡(30°28′34.5″N,119°40′25.7″E),属亚热带季风气候类型。该地区四季分明,雨热同期,空气湿润,有典型的梅雨季节。年平均气温16.6 ℃,1月份气温最低(平均-0.4~5.5 ℃),7月份最高(平均24.4~30.8 ℃),年降水量761~1 780 mm。此外,该地区有竹林面积2 155 hm2,占该地区森林总面积的50.7%,其中毛竹林面积1 693 hm2,占竹林总面积的78.6%。
竹林中通量观测塔位于海拔高度380 m处,塔高40 m,周围1 000 m范围内的植物类型以毛竹为主,土壤类型为黄壤、黄红壤,下垫面坡度为2.5~14°,坡向为北偏东8°。试验区毛竹林为人工纯林,林分密度为4 500 株·hm-2,毛竹胸径12~18 cm,高度13~20 m,枝下高10~17 m,冠幅3.0 m × 2.5 m,盖度90%,郁闭度0.9,毛竹节间短,壁厚,出笋期为3月—5月份,且连年出笋能力较强,平均每年出笋产量为1 000~1 500 kg·hm-2,林下有稀疏灌木和草本。
1.2 试验方法
1.2.1 通量观测
利用微气象观测塔测定毛竹林与大气间CO2等湍流通量,观测探头安装在距地面38 m的高度,主要有三维超声风速仪(CAST-3,Campbell Inc.,USA)和开路式红外CO2/H2O分析仪(Li-7500,LiCor Inc.,USA),分别测定三维风速、CO2/H2O密度脉动,原始采样频率为10 Hz,利用数据采集器(CR1000,Campbell Inc.,USA)存储数据;辐射数据由净辐射仪传感器收集,仪器安装在距地面38 m处。
1.2.2 荧光参数测定
从2014年9月份开始,每月选定天气晴朗光照较好的1天,于上午利用便携式调制叶绿素荧光仪PAM-2500,选取试验样地通量塔周围生长良好、长势一致的2~3年生毛竹,并选取向阳方向、长势较好、健康饱满的竹叶进行叶绿素荧光参数测定,每次选6株,每株3个重复。测定前将选取的叶片进行20 min的暗适应。主要测定指标包括初始荧光(Fo),最大荧光(Fm),非光化学猝灭系数(qN),光化学猝灭系数(qP)等,选取的叶绿素荧光参数有:PSⅡ的最大光合量子产量(Fv/Fm)、qP、qN、PSⅡ的实际光合量子产量(ФPSⅡ),计算公式参照张守仁[16]引用的公式:Fv/Fm=(Fm-Fo)/Fm,qP=(Fm′-F) / (Fm′-Fo′),qN=1-(Fm′-Fo′) / (Fm-Fo)=1-Fv′/Fv,ФPSⅡ=(Fm′-F) /Fm′。植物叶片吸收光能用于天线热耗散的部分D=( 1-Fv′/Fm′) × 100%,光化学耗散P=qP×Fv′/Fm′× 100%,PSⅡ反应中心非光化学能量耗散E=( 1-qP)×Fv′/Fm′× 100%[17]。
1.3 数据处理
使用安吉毛竹林2014年9月至2015年5月的通量数据(数据是通量塔能够实时检测到整个毛竹林的通量数据),而荧光数据为每月固定日期通过人工实测获得,由于一些技术上的原因,荧光参数从2014年10月份正式测定,因此,荧光数据选用10月至翌年5月的数据(其中2月份数据未得)。利用Excel对所有数据进行整理,利用SPASS软件对数据进行相关性分析和多重比较,结果取平均值±标准误,用Excel作图。
2 结果与分析
2.1 毛竹各月份净生态系统碳通量变化
图1为不同季节毛竹林净生态系统碳交换量(NEE)的日变化规律,NEE为负值表示生态系统吸收CO2,即碳汇;为正值表示生态系统放出CO2,即碳源[18]。图1显示6:00—7:00 NEE开始转为负值,表明此时毛竹生态系统光合同化量开始大于呼吸释放量,表现为碳汇,并且在10:00—14:00维持在较大吸收量,随后逐渐降低,至17:00—18:00NEE转为正值,生态系统转为碳释放,说明毛竹生态系统CO2的呼吸释放量开始大于光合作用吸收量。由于冬季(12月,1月,2月)日照短、温度低,NEE由正转负的时间较晚,负值最大,说明白天吸收CO2量最少,即生态系统固碳量最小,在数值上NEE的负值最高点表现为秋季(9月,10月,11月)>春季(3月,4月,5月)>
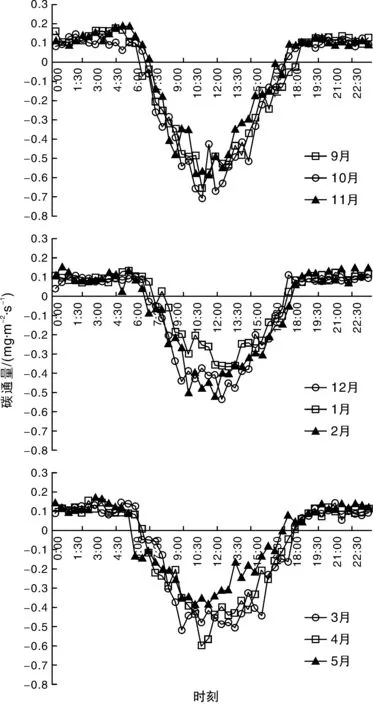
图1 CO2通量每月的平均日变化Fig.1 Diurnal variations of monthly-mean CO2 flux
冬季(12月,1月,2月),说明毛竹CO2通量具有明显的季节变化,各季节均表现为明显的碳汇作用。
图2为2014年9月至2015年5月各月份CO2吸收量的月变化趋势,可知逐月NEE值变化范围为-25.563 3~-85.531 2 gC·m-2·月-1,12月和1月份由于温度降低NEE值较低,1月份达到最低点;此后,随着温度的升高,NEE值开始升高,3月份达到最高,之后又开始下降。这可能是因为2015年是大年,3月—5月份毛竹笋暴发式生长导致CO2排放量增加,与孙成等[25]对亚热带毛竹林CO2通量的研究结果一致。
2.2 毛竹各月份叶绿素荧光参数的变化
经充分暗适应的叶片光系统Ⅱ的最大光化学效率值即最大光合量子产量值,用可变荧光与最大荧光比值Fv/Fm来表示。Fv/Fm在非胁迫条件下变化极小,不受物种和生长条件的影响,一旦受到胁迫,该参数会明显下降[19]。由表1可以看出,Fv/Fm从10月份到翌年1月份呈下降趋势,之后开始回升。其中12月,1月,3月份Fv/Fm低于正常水平并且与其他月份差异显著(P<0.05),说明毛竹在这3个月份受到了胁迫,光化学效率降低。此时Fv/Fo变化趋势与Fv/Fm相同,12月,1月和3月份潜在活性最低,并且与其他月份差异显著(P<0.05)。

图2 NEE的月变化Fig.2 Monthly variation of NEE
光化学猝灭系数qP是PSⅡ天线色素吸收的光能用于光化学电子传递的部分[20]。qP越大表明PSⅡ的电子传递活性越大。非光化学猝灭系数qN表示PSⅡ天线色素吸收的光能不能用于光化学传递的部分,反映了PSⅡ反应中心吸收过多光能后的热耗散能力及损伤程度,是一种自我保护机制,对光和器官起着一定的保护作用[21]。由表1可以看出,10月至翌年3月qP逐渐下降,之后开始升高,同期伴随qN的上升和下降。
ФPSⅡ反映的是PSⅡ的实际光合量子产量,它是植物叶片光合电子传递速率的相对指标[22],反映了叶片在光下的实际光能转化效率。ФPSⅡ出现先降后增的趋势,其中12月至翌年3月较低,与其他月份差异显著(P<0.05),并且其变化趋势与Fv/Fm,qP大致相同(表1)。冬季ФPSⅡ随着温度的降低开始下降,间接说明毛竹光合碳同化率开始下降。
叶片吸收的光能的分配与光合机构的影响及其PSⅡ功能直接相关[17]。表2为各月份毛竹叶片吸收光能的分配情况。由表2可知,各月份毛竹叶片光化学反应耗散(P)表现为先降后升,天线热耗散(D)表现为先升后降,而反应中心由非光化学反应耗散(E)也大致呈现一个先升后降的趋势。这是由于从10月至翌年3月,随着温度的降低,叶片吸收光能用于光化学反应的部分(P)显著降低,而此时E却略有升高,说明随着温度的降低,E增加引起了光合机构的可逆失活,随后3月—5月温度回升,P增加,PSⅡ功能逐渐恢复,E迅速下降。
表1 毛竹荧光参数
Table 1 Chorophll fluorescence parameters ofPhyllostachysedulis

月份Fv/FmqPqNФPSⅡFv/Fo100.7498±0.0062a0.8182±0.0048a0.3874±0.0189c0.5518±0.0074a3.0299±0.0957a110.7328±0.0068a0.7648±0.0117b0.5363±0.0234b0.4693±0.0122b2.7792±0.0899b120.5926±0.0181b0.7405±0.0209b0.5682±0.0339b0.3363±0.0222c1.5034±0.1109c10.5373±0.0167c0.6699±0.0205c0.5739±0.0337b0.2819±0.0115d1.1860±0.0766d30.6041±0.0189b0.5134±0.0451d0.6698±0.0377a0.2263±0.0221e1.5620±0.1121c40.7116±0.0105a0.7667±0.0089ab0.4695±0.0325bc0.4750±0.0202b2.5390±0.1336b50.7108±0.1314a0.7590±0.0190b0.5163±0.0394b0.4538±0.0126b2.4793±0.1598b
注:同列数据后无相同小写字母表示差异显著(P<0.05)。表2同。
表2 各月份毛竹叶片吸收光能分配
Table 2 The absorbed light energy distribution ofPhyllostachysedulisin different months

月份天线热耗散(D)/%光化学反应耗散(P)/%非光化学反应耗散(E)/%100.3261±0.0063d0.5516±0.0074a0.1222±0.0028b110.3875±0.0089c0.4695±0.0122b0.1430±0.0061b120.5107±0.0189b0.3613±0.0146c0.1279±0.0132b10.5789±0.0134a0.2817±0.0116d0.1393±0.0094b30.5605±0.0111a0.2262±0.0220e0.2134±0.0196a40.3808±0.0187c0.4753±0.0201b0.1439±0.0029b50.4019±0.0132c0.4537±0.0124b0.1444±0.0125b
3 结论与讨论
本试验表明,安吉毛竹林整个生态系统CO2通量具有明显的季节变化,各季节都表现为明显的碳汇作用。各月份从6:00—7:00,毛竹的NEE由正转负,生态系统开始吸收CO2,并且吸收量随着光合作用的增强逐渐增加,然后随着光合作用的减弱逐渐减少,至17:00—18:00 NEE转为正值,生态系统呼吸量开始增加,CO2吸收量小于释放量。CO2吸收量的月变化显示冬季NEE最低,1月份达到最低点,3月份达到一个峰值之后开始下降。3月—5月气温开始逐渐回升,NEE却开始下降,这可能与毛竹大小年有关。毛竹的大年是指毛竹在换叶后当年孕竹,至第2年春天发笋成竹的期间;第2年发笋成竹后到第3年再换叶前称为毛竹的小年[23]。2015年正是毛竹的大年,3月份毛竹开始出笋,生态系统呼吸量增大,CO2排放量增多,4月—5月正是毛竹出笋旺期(即爆发式生长期),呼吸作用强,并且毛竹在高速生长期能大量消耗土壤养分,造成养分的缺乏,从而影响土壤的微生物群落结构[24],因此,减少了生态系统碳交换量,CO2排放量增加,NEE降低。虽然毛竹夜间生态系统呼吸量较大,白天碳吸收量减少,但由于4月份毛竹生理活性处于上升期,白天生态系统碳吸收量仍不会低于冬季。这与孙成等[25]对亚热带毛竹林的研究结果一致。
PSⅡ的最大光合量子产量Fv/Fm从10月份开始下降,至4月份上升到正常水平,说明随着冬季的到来,气温不断降低,低温使毛竹叶绿体的类囊体膜受到损伤,导致叶绿体的光化学效率降低[26],进而产生胁迫。而3月份气温理应回升,不会出现显著差异的胁迫,然而图1显示3月份Fv/Fm值低于正常范围,并且与10月,11月,4月,5月Fv/Fm值相比差异显著,这可能是因为2015年2月底至3月初临安天目山出现一场冻雨,受冷空气影响,安吉3月上旬气温偏低,多低温阴雨天气,其中5日—6日出现雨夹雪天气(来自安吉气象网),毛竹林整个冬季受低温覆盖,整个生态系统光合能力比较弱,3月份气温没有及时回升,使竹林光合速率降低,有机物含量降低;另外,2015年是大年,3月份正是出笋初期,需要足够的养分和能量,而竹林本身光合速率较低,有机物含量降低,还要将同化产物用于幼笋的生长,因此,3月份毛竹光合潜能弱,Fv/Fm值下降。与此同时,光化学猝灭系数qP也出现先下降后上升的趋势,并且伴随非光化学猝灭系数qN的上升和下降,两者分别在3月达到最低和最高值。这是因为随着Fv/Fm的下降,毛竹受到低温胁迫,光化学效率降低,导致PSⅡ天线色素吸收的光能不能完全用于光化学电子传递,从而累积了过量光能,这时通过加强非光化学猝灭、增加热耗散来消除过量光能[26],从而使得qN上升,这与李平等[27]对籼稻品种桂山矮选3的叶绿素荧光的研究结果相似。ФPSⅡ在10月至翌年3月逐渐降低随后又开始增加,其变化趋势与Fv/Fm,qP大致相同,这是因为ФPSⅡ是PSⅡ的内禀光能转化效率(Fv/Fm)与开放的反应中心比例(qP)之间的乘积[28],ФPSⅡ与二者呈现一个正比的关系。Fv/Fo表示PSⅡ的潜在活性,本研究中Fv/Fo与Fv/Fm趋势相同,表明低温胁迫下,Fv/Fo和Fv/Fm都受到抑制,导致PSⅡ功能的下降,光合机构对光能的利用能力下降。
一般来说,植物叶片在吸收光能后有3种利用途径,一种是以热量耗散的部分(天线热耗散的能量,D),另一种是用于光化学反应的部分(P),还有一种是反应中心由非光化学反应耗散的能量(E)[29]。光合作用和热耗散的变化会引起荧光的相应变化[30],因此,从叶片吸收光能的分配情况可以看出,其与Fv/Fm,Fv/Fo,qP,ФPSⅡ等的关系可简单描述为:随着Fv/Fm的下降,毛竹生态系统受到胁迫,PSⅡ潜在活性(Fv/Fo)下降;天线色素吸收的光能用于光化学反应的部分减少,光合电子传递速率下降(qP,ФPSⅡ下降;D,qN升高);E略有升高。反之,随着气温的回升,PSⅡ功能恢复,生态系统光合能力增强,Fv/Fm,Fv/Fo,qP,ФPSⅡ升高,D,qN,E下降。
综上所述,毛竹林生态系统碳交换量NEE在白天为负值,表现为碳汇;通量观测系统范围内,荧光参数的变化及光能分配说明毛竹林能通过自身调节对环境的变化及时做出响应。此外,从NEE值的月变化趋势来看,其与荧光参数的变化基本吻合,总体表现为毛竹林在受到低温胁迫时光合能力减弱,CO2的吸收量也减少,即NEE值降低,但毛竹可通过其自身调节对环境变化及时做出响应,保证其生理活动的正常进行,NEE值在各季白天也表现为碳汇。但是3月份,各荧光参数值的变化可说明此时毛竹光合速率是降低的,而NEE值却在3月份出现一个峰值,这可能与3月份出笋有关。本研究仅对2~3年生老竹的荧光参数进行分析研究,关于森林生态系统碳交换量与荧光参数之间更深层次的关系还需要进一步的研究和论证。
[1] 程东来, 钟学斌. 温室效应与气候变化及人类活动的关系[J]. 咸宁学院学报, 2008, 28(6): 86-88.
[2] 王妍, 张旭东, 彭镇华, 等. 森林生态系统碳通量研究进展[J]. 世界林业研究, 2006, 19(3): 12-17.
[3] 吴家兵, 张玉书, 关德新. 森林生态系统CO2通量研究方法与进展[J]. 东北林业大学学报, 2003, 31(6): 49-51.
[4] 周国模, 吴家森, 姜培坤. 不同管理模式对毛竹林碳贮量的影响[J]. 北京林业大学学报, 2006, 28(6): 51-55.
[5] DU H Q, ZHOU G M, FAN W Y, et al. Spatial heterogeneity and carbon contribution of aboveground biomass of moso bamboo by using geostatistical theory [J].PlantEcology, 2010, 207(1): 131-139.
[6] 王宏. 从竹乡安吉看我国南方竹产业的发展[J]. 绿色中国, 2004 (22): 60-61.
[7] 吕玉龙. 安吉积极推进竹林碳汇发展[J]. 浙江林业, 2012 (1): 18.
[8] 刘恩斌, 施拥军, 李永夫, 等. 基于非空间结构的浙江省毛竹林固碳潜力[J]. 林业科学, 2012, 48(11): 9-14.
[9] 孟海月, 刘强, 吴伟光. 不同经营类型毛竹林经营效益及固碳能力分析[J]. 浙江农林大学学报, 2014, 31(6): 959-964.
[10] 高程达, 孙向阳, 张林,等. 北温带干旱地区土壤—大气界面CO2通量的变化特征[J]. 北京林业大学学报, 2009, 31(6): 32-38.
[11] 林晓渝. 北亚热带次生栎林碳通量及其影响因子研究[J]. 南京林业大学学报(自然科学版), 2011, 35(3): 38-42.
[12] 樊江文, 钟华平, 梁飚, 等. 草地生态系统碳储量及其影响因素[J]. 中国草地学报, 2003, 25(6): 51-58.
[13] 张利平. 会同杉木人工林生态系统与大气间CO2通量特征的研究[D]. 长沙: 中南林业科技大学, 2010.
[14] 李晓, 冯伟, 曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报, 2006, 26(10): 2186-2196.
[15] 王正航, 武仙山, 昌小平, 等. 小麦旗叶叶绿素含量及荧光动力学参数与产量的灰色关联度分析[J]. 作物学报, 2010, 36(2): 217-227.
[16] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学报, 1999 (4): 444-448.
[17] 胡文海, 肖宜安, 喻景权, 等. 低夜温后不同光强对榕树叶片PSⅡ功能和光能分配的影响[J]. 植物研究, 2005, 25(2): 159-162.
[18] 于贵瑞, 孙晓敏. 陆地生态系统通量观测的原理与方法[M]. 北京: 高等教育出版社, 2006: 37-39.
[19] 陈辰, 何小定, 秦金舟,等. 4种含笑叶片叶绿素荧光参数Fv/Fm特性的比较[J]. 安徽农业大学学报, 2013, 40(1): 32-37.
[20] 陶文文, 蒋文伟, 赵丽娟. 3个钓钟柳品种叶绿素荧光特性比较[J]. 浙江农林大学学报, 2011, 28(3): 367-371.[21] 夏丽, 陈贻竹. 盐藻叶绿素荧光非光化学猝灭产生的条件和主要组分的检测[J]. 海洋与湖沼, 2000 (5): 498-505.[22] 李想, 史世京, 曹颖, 等. 冷冻胁迫下毛竹叶绿素荧光参数变化及抗寒相关转录因子表达[J]. 福建林学院学报, 2014, 34(1): 57-63.
[23] 陈新安. 毛竹林大小年生长规律探讨[J]. 中南林业调查规划, 2010, 29(1): 21-23.
[24] 王雪芹, 张奇春, 姚槐应. 毛竹高速生长期土壤碳氮动态及其微生物特性[J]. 生态学报, 2012, 32(5): 1412-1418.[25] 孙成, 江洪, 周国模,等. 我国亚热带毛竹林CO2通量的变异特征[J]. 应用生态学报, 2013, 24(10): 2717-2724.[26] 李平, 李晓萍, 陈贻竹, 等. 低温光抑制胁迫对不同抗冷性的籼稻抽穗期剑叶叶绿素荧光的影响[J]. 中国水稻科学, 2000, 14(2): 88-92.
[27] 李平, 李晓萍, 陈贻竹. 光温对不同抗冷力的籼稻抽穗期剑叶叶绿素荧光的影响[J]. 中国水稻科学, 1995 (2): 97-102.
[28] 林植芳, 彭长连, 林桂珠. C3、C4植物叶片叶绿素荧光猝灭日变化和对光氧化作用的响应[J]. 作物学报, 1999 (3): 284-290.
[29] 崔晓伟, 高健, 张志坚, 等. 5种地被竹叶绿素荧光特性研究[J]. 江西农业大学学报, 2011, 33(4): 726-730.
[30] 郑淑霞, 上官周平. 8种阔叶树种叶片气体交换特征和叶绿素荧光特性比较[J]. 生态学报, 2006, 26(4): 1080-1087.
(责任编辑 侯春晓)
Variations of net ecosystem carbon exchange and chlorophyll fluorescence parameters ofPhyllostachysedulisforest in Anji
GONG Sha-sha1, JIANG Hong1,2,*, MA Jin-li1, SHU Hai-yan3, CHEN Xiao-feng1
(1.InternationalEcologicalResearchCenter,ZhejiangA&FUniversity,Hangzhou311300,China; 2.InternationalEarthSystemScientificInstitute,NanjingUniversity,Nanjing210093,China; 3.SchoolofLifeScience,SouthwestUniversity,Chongqing400715,China)
CO2fluxes ofPhyllostachysedulisecosystem in Anji was 24 hours observationed using an eddy covariance method. Meanwhile, the chlorophyll fluorescence parameters ofPhyllostachysedulisunder the framework of CO2fluxes were measured by PAM-2500 chlorophyll fluorometer. The diurnal variations and monthly variation of net ecosystem carbon exchange (NEE) and the variations of chlorophyll fluorescence parameters were analyzed. The results showed that the monthly NEE was always negative in 6∶00—7∶00, positive in 17∶00—18∶00, indicating thatPhyllostachysedulisassimilated CO2in daytime. The highest NEE in the numerical value was autumn (September, October, November) > spring (March, April, May) > winter (December, January, February), which showed that the NEE had obvious seasonal characteristics. The monthly variation range of NEE value was-25.563 3-85.531 2 gC·m-2·month-1, with the minimum in January. The maximal photochemical efficiency of photosystem Ⅱ (Fv/Fm) showed the trend of down after rise, the values from December to March were significantly lower than those of the normal levels (P<0.05). It illustrated thatPhyllostachyseduliswas stressed and photochemical efficiency(ФPSⅡ) was decreased in that three months.Fv/Fowas the same asFv/Fm. Photochemical quenching coefficient (qP) gradually decreased from October to March then rose. On the contrary, non-photochemical quenching coefficient (qN) gradually rose then decreased. The study showed that low temperature stress reduced the proportion of light energy which used for photochemical electron transport, and decreased the photosynthetic carbon assimilation ofPhyllostachysedulis.
Phyllostachysedulisforest; ecosystem; net ecosystem carbon exchange; chlorophyll fluorescence
10.3969/j.issn.1004-1524.2016.06.16
2015-09-26
国家自然科学基金项目(61190114,41171324);上海市科学委员会项目(12231205101);科技部国家科技基础条件平台项目(2005DKA32300)
龚莎莎(1990—),女,山东济宁人,硕士研究生,从事植物生理生态学研究。E-mail:2690587953@qq.com
*通信作者,江洪,E-mail:jianghong_china@hotmail.com
S795.7; S718.5
A
1004-1524(2016)06-1003-06
龚莎莎, 江洪, 马锦丽, 等. 安吉毛竹林净生态系统碳交换量及叶绿素荧光参数的变化[J]. 浙江农业学报, 2016, 28(6): 1003-1008.
