菌草灵芝多糖提取工艺优化及抗氧化活性研究
2016-11-28刘晓艳陈艺煊吴林秀徐阳阳童爱均刘斌
刘晓艳,陈艺煊,吴林秀,徐阳阳,童爱均,刘斌
(福建农林大学食品科学学院,福建 福州350002)
菌草灵芝多糖提取工艺优化及抗氧化活性研究
刘晓艳,陈艺煊,吴林秀,徐阳阳,童爱均,*刘斌
(福建农林大学食品科学学院,福建福州350002)
在单因素试验的基础上,利用正交试验对菌草灵芝多糖的提取工艺条件进行优化,同时通过对DPPH自由基、羟自由基的清除能力和还原力对其抗氧化活性进行评价。结果表明,菌草灵芝多糖的最佳提取工艺条件为提取时间2.5 h,提取温度95℃,料液比1∶25(g∶g);在该条件下提取率为1.65%。抗氧化试验结果表明,菌草灵芝多糖对DPPH自由基和羟自由基有一定的清除能力,且与多糖质量浓度存在一定的量效关系,表明菌草灵芝多糖是一种潜在的抗氧化剂。
菌草灵芝多糖;正交试验;抗氧化
灵芝性平味甘,是我国传统的珍贵药用菌,是古代医药学中的一种滋补性中药,在临床和保健食品方面已得到广泛的关注。灵芝多糖是灵芝所含物质中生物活性极强的成分之一,其种类较多,目前已经分离到的有200多种,主要包括水溶性、碱性和酸性多糖,多糖构型以β型葡聚糖为主,还有少数α型葡聚糖,分子量从数百到数十万不等[1]。现代研究表明,灵芝多糖具有抗肿瘤、调节免疫力、抗氧化、降血脂和降血糖等多种药理作用[2-5]。
菌草灵芝是指利用芒萁、类芦、巨菌草、象草等营养野生草替代阔叶树栽培的灵芝子实体[6]。菌草灵芝栽培原料来源丰富、价格低廉,大大降低了灵芝的栽培成本,且栽培出的灵芝中氨基酸、脂肪酸和微量元素含量丰富,同时研究表明其粗多糖、三萜类物质和孢子油含量均比椴木灵芝高[7-8]。目前,对菌草灵芝的研究主要集中在其栽培上,而对其生物活性物质方面的研究较少,尤其对于菌草灵芝多糖的提取率及其活性的研究更少。鉴于此,本研究利用正交试验对菌草灵芝多糖的提取工艺条件进行了优化,同时对其抗氧化活性进行研究,从而进一步为菌草灵芝的开发利用提供一定的理论基础。
1 材料与方法
1.1试验材料
菌草灵芝,由福建农林大学菌草所(国家菌草工程技术研究中心)提供。
1.2仪器及试剂
1.2.1化学试剂
葡萄糖、浓硫酸、苯酚、高氯酸、香草醛、冰醋酸、芦丁、乙酸乙酯、亚硝酸钠、氢氧化钠、硝酸氯等均为分析纯,国药集团化学试剂有限公司提供。
1.2.2主要仪器与设备
HH-3A型数显三用水浴锅,金坛市精达仪器制造厂产品;SC-3612型低速离心机,科大创新股份有限公司产品;SHB-III型循环水式多用真空泵,郑州长城科技工贸有限公司产品;旋转蒸发仪R系列,上海申生科技有限公司产品;7200型紫外可见分光光度计,上海精密科学仪器有限公司产品;FZ102型微型植物粉碎器,天津市泰斯特仪器有限公司产品。
1.3试验方法
1.3.1水提提取法
菌草灵芝子实体烘干并粉碎→过筛20目→加入水提取→过滤→滤液浓缩→离心(3 500 r/min,10 min)→上清液→95%乙醇醇沉→离心,收集沉淀→干燥→灵芝水粗提物→水复溶→测定活性物质含量。
1.3.2葡萄糖标准曲线绘制
采用苯酚-硫酸法[9-10]测定,并制作标准曲线:①称取已恒质量的葡萄糖0.100 0 g,加入适量蒸馏水溶解,转移到1000 mL的容量瓶中,定容至刻度,摇匀,备用;②得到葡萄糖标准溶液,其质量浓度为0.1 mg/mL;③分别吸取标准葡萄糖溶液0,0.2,0.4,0.6,0.8,1.0 mL,置于20 mL具塞试管中,加入蒸馏水稀释至1.0 mL,摇匀;④向其中先后加入5%苯酚溶液1.0 mL,快速垂直加入5.0 mL浓硫酸,摇匀,静置10 min;⑤将具塞试管放置在30℃水浴锅中反应25 min,拿出后冷却至室温,并于波长490 nm处测其吸光度,以葡萄糖含量为横坐标、吸光度为纵坐标,制得标准曲线;⑥得到的回归方程为:Y=0.879 7X+0.021,相关系数R2=0.998 3。
1.3.3多糖含量测定
精密称取3.0 g灵芝粉末于锥形瓶中,进行上述各提法提取[11-12],抽滤后将滤液定容至100 mL,加入3倍体积的乙醇,使乙醇含量达到70%,移至4℃冰箱中过夜,以转速3 500 r/min离心6 min,弃上清液,将醇沉所得粗多糖于烘箱内烘至恒质量,再加入100 mL的蒸馏水溶解离心管内物质,按苯酚-浓硫酸法显色测定,根据标准曲线回归方程,由吸光度求出提取液中的多糖质量浓度,多糖提取率见公式(1)。

式中:W——多糖提取率,mg/g;
C——多糖质量浓度,mg/mL;
V——定容体积,mL;
m——原料质量,mg。
1.3.4单因素试验
精确称取灵芝粉末3.0 g,以水为提取溶剂,分别研究料液比(1∶15,1∶20,1∶25,1∶30,1∶35)、提取温度(55,65,75,85,95℃)、提取时间(1.0,1.5,2.0,2.5,3.0 h)对菌草灵芝多糖得率的影响。(文中所涉及的料液比均为质量比。)
1.3.5正交试验
灵芝的水提物以提取时间、提取温度、料液比为研究因素,故本试验采用L9(34)的正交试验方法,对灵芝水浸提提取工艺条件进行优化。
1.3.6抗氧化能力测定
(1)DPPH自由基清除率的测定。根据文献[11-12]称取一定量的DPPH自由基,用无水乙醇配制成0.04 mg/mL的DPPH溶液。分别取不同质量浓度的样品(0.2,0.4,0.6,0.8,1.0 mg/mL),加入2 mL DPPH自由基溶液,混合均匀,室温放置30 min后,以转速5 000 r/min离心10 min。取上清液于波长517 nm处测吸光度,用抗坏血酸作为阳性对照。DPPH自由基清除率见公式(2)。
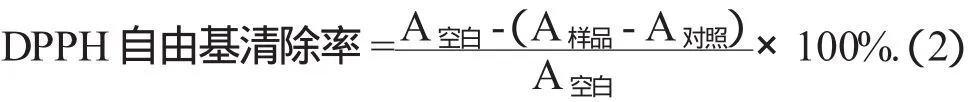
(2)羟自由基清除率的测定。羟自由基清除率参照弓晓峰等人[13-14]进行。分别取不同质量浓度的样品(0.2,0.4,0.6,0.8,1.0 mg/mL),依次加入9 mmol/L的FeSO4,9 mmol/L水杨酸-乙醇溶液各1 mL,最后加入9 mmol/L H2O21 mL启动反应。在37℃水浴下反应30 min,于波长510 nm处测定各个样品质量浓度的吸光度。以样液1 mL,FeSO4溶液1 mL,水杨酸-乙醇溶液1 mL,及蒸馏水1 mL作为样品对照液和空白对照。羟自由基清除率见公式(3)。
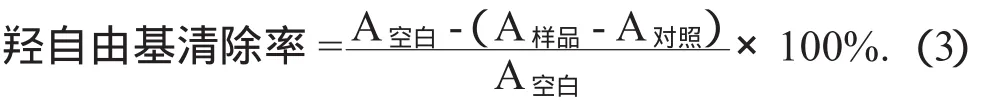
(3)还原力的测定。还原力的测定根据文献[15-16]进行。在试管中加入0.2 mol/L pH值6.6的磷酸缓冲液2.5 mL和不同质量浓度的待测样品溶液1 mL,加入0.1%的铁氰化钾2.5 mL,混匀后,放置在50℃的水中反应25 min。再加入2.5 mL 10%三氯乙酸终止反应,以转速4 000 r/min离心15 min。取上清液2.5 mL和0.5%三氯化铁溶液0.5 mL混合静置,于波长700 nm处测定吸光度。还原力的测定见公式(4)。

2 结果与讨论
2.1灵芝水提单因素试验
2.1.1料液比对菌草灵芝多糖提取率的影响
按不同的料液比,提取时间为2 h,提取温度为65℃,用水为提取剂进行浸提。
料液比对菌草灵芝多糖提取率的影响见图1。
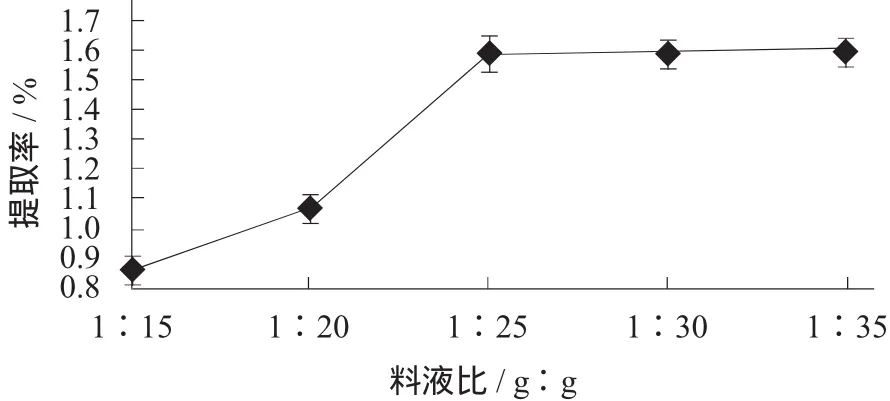
图1 料液比对菌草灵芝多糖提取率的影响
由图1可知,随着料液比增大,菌草灵芝多糖的提取率不断提高;但当料液比大于1∶25时,菌草灵芝多糖提取率在1∶25后趋于稳定,出于成本的考虑,选取料液比为1∶25为宜。
2.1.2提取时间对菌草灵芝多糖提取率的影响
按不同的提取时间,提取温度75℃,料液比1∶30,以水为提取剂进行浸提。
提取时间对菌草灵芝多糖提取率的影响见图2。
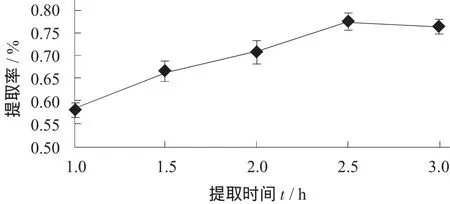
图2 提取时间对菌草灵芝多糖提取率的影响
由图2可知,随着提取时间的延长,菌草灵芝多糖的提取率逐渐增高,而在2.5 h后提取率的增速开始变得缓慢,故试验选取提取时间为2.5 h。
2.1.3提取温度对菌草灵芝多糖提取率的影响
按不同的提取温度,提取时间2.5 h,料液比1∶30,以水为提取剂进行浸提。
提取温度对菌草灵芝多糖提取率的影响见图3。

图3 提取温度对菌草灵芝多糖提取率的影响
由图3可知,菌草灵芝多糖的提取率随着提取温度的升高而不断增加,说明提取温度的升高对多糖的提取有促进作用。因此,提取温度选取95℃。
2.2灵芝水提正交试验结果
正交试验的因素与水平设计见表1,正交试验结果与分析见表2,方差分析见表3。

表1 正交试验的因素与水平设计

表2 正交试验结果与分析
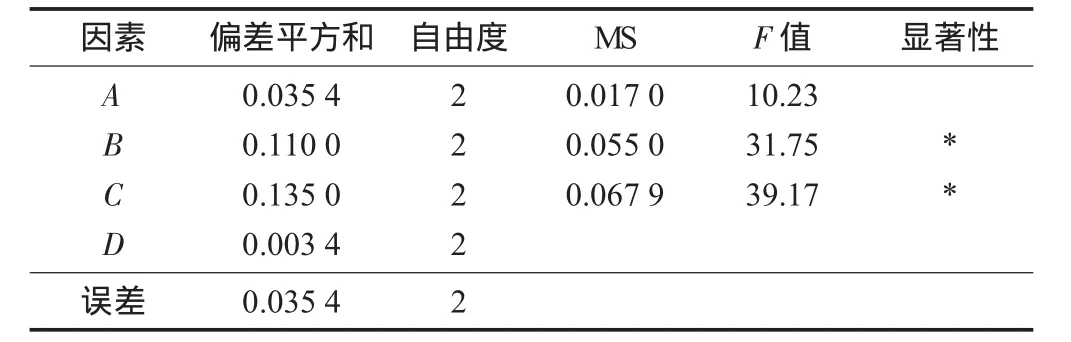
表3 方差分析
由表1~表2可知,提取温度、提取时间、料液比对菌草灵芝多糖的提取均有不同程度的影响。由于各因素间的相互作用比较复杂,因此本研究以提取率为指标,采用正交试验设计对提取工艺进行优化。从正交试验极差分析可以判断出,影响提取率诸因素的主次关系依次为提取时间(C)>提取温度(B)>料液比(A),最佳组合为C3B3A2。由表3可知,提取时间和提取温度对提取率具有显著性影响(p<0.05),各因素对多糖提取率的影响主次关系与极差分析结果一致。
2.3菌草灵芝水提验证试验结果
为了检验模型的准确性,在最佳提取工艺条件下,即提取时间2.5 h,提取温度95℃,料液比1∶25,进行3次平行验证试验,测得多糖提取率分别为1.65%,1.71%和1.59%,平均提取率为1.65%。
2.4抗氧化试验结果
2.4.1菌草灵芝多糖对DPPH自由基清除作用
菌草灵芝多糖对DPPH自由基的清除作用见图4。
由图4可知,菌草灵芝粗多糖对DPPH自由基清除率随着多糖质量浓度的增加而逐渐升高,在质量浓度为2.5 mg/mL时,清除率达到最高;然而,当质量浓度继续增加时,清除率未发生显著性改变(p>0.05)。与阳性对照组抗坏血酸相比,在测定的质量浓度范围内菌草灵芝多糖对DPPH自由基清除效果没有抗坏血酸强,但菌草灵芝多糖在质量浓度为2.5 mg/mL时,对DPPH自由基的清除率可达到73.26%,表明菌草灵芝多糖具有一定的抗氧化能力。
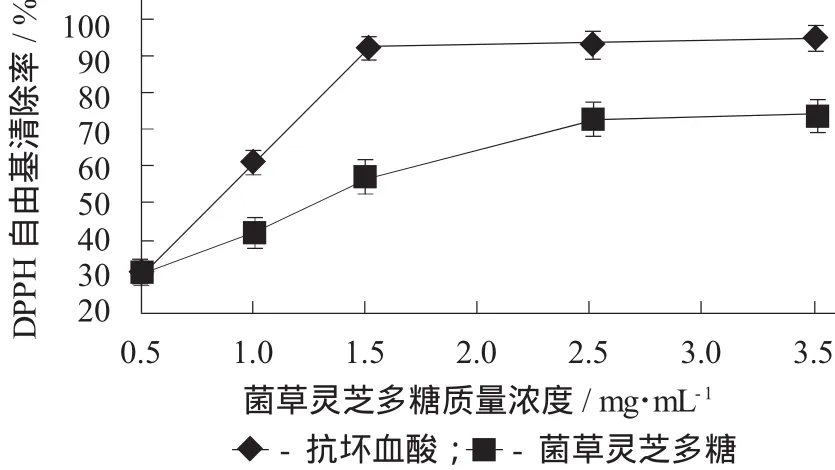
图4 菌草灵芝多糖对DPPH自由基的清除作用
2.4.2菌草灵芝多糖对羟自由基清除作用
菌草灵芝多糖对羟自由基的清除能力见图5。
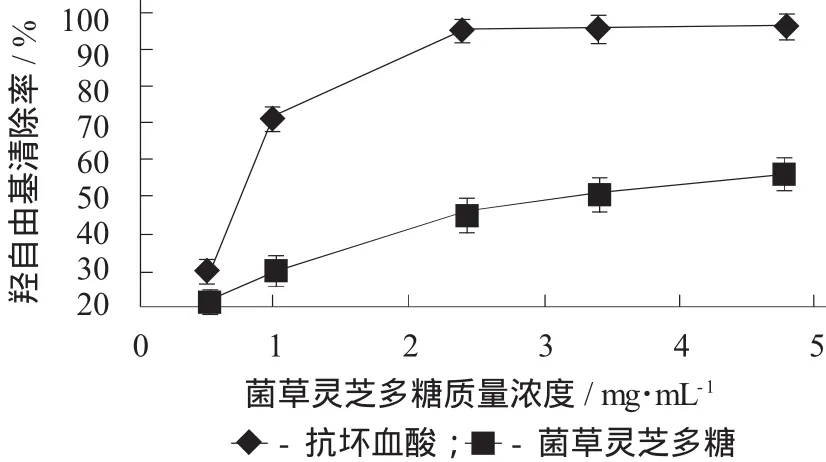
图5 菌草灵芝多糖对羟自由基的清除能力
人体的免疫反应可能伴随着羟自由基的产生,该自由基能够破坏多种大分子物质,如碳水化合物、核酸和氨基酸等。因此,清除体内多余的羟自由基对人体的健康非常重要[17-19]。由图5可知,菌草灵芝多糖对羟自由基的清除能力随着多糖质量浓度的增加而缓慢增加,但在试验质量浓度范围内,对羟自由基的清除能力在菌草灵芝多糖质量浓度4.8 mg/mL时达到最大值56.21%。与阳性对照组抗坏血酸对比可知,在试验质量浓度范围内,菌草灵芝多糖对羟自由基的清除能力较弱。
2.4.3菌草灵芝多糖的还原力
菌草灵芝多糖的还原力见图6。
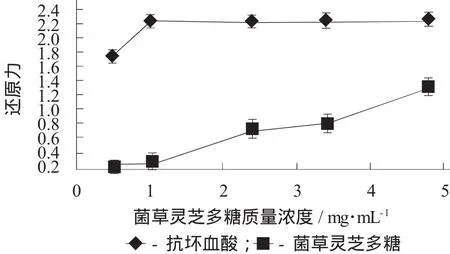
图6 菌草灵芝多糖的还原力
由图6可知,菌草灵芝多糖的还原力同样呈现大致相同的趋势,即随着质量浓度的增加,还原力逐渐增强。在试验质量浓度范围内,开始随着质量浓度的增加,还原力增大速度较慢;而当质量浓度继续增加时,还原力的增大速度越来越快;在菌草灵芝多糖质量浓度为4.8 mg/mL时,还原力达到最大为1.32。虽然还是比抗坏血酸弱,但其有还原力的存在,说明菌草灵芝多糖具有一定的抗氧化潜能。
3 结论
在单因素试验的基础上,通过正交试验对菌草灵芝多糖的提取工艺条件进行优化。结果显示,在提取时间2.5 h,提取温度95℃,料液比1∶25的条件下,菌草灵芝多糖提取率最高。进一步的抗氧化活性试验显示,菌草灵芝多糖质量浓度为2.5 mg/mL时对DPPH自由基的清除率达到73.26%,在质量浓度为4.8 mg/mL时,对羟自由基的清除能力达到最大值56.21%,在质量浓度为4.8 mg/mL时,还原力达到最大值1.32。虽然本试验中菌草灵芝多糖对羟自由基的清除能力低于张志军等人[20]的57.6%(2.5 mg/mL),但菌草灵芝多糖在还原力上与其研究结果大致相同,甚至略高。由此可见,菌草灵芝多糖具有一定的抗氧化能力。
[1]乔英.灵芝多糖的研究概况[J].云南民族大学学报(自然科学版),2006,15(2):134-137.
[2]卢玉振,李祥,周磊.灵芝多糖的抑瘤作用及对小鼠免疫系统影响的实验研究[J].河北医学,2016(2):190-192.
[3]白凤岐,牟建楼,陈志周,等.水提法提取灵芝多糖及其体外抗氧化研究[J].食品工业,2015(3):143-146.
[4]朱科学,聂少平,宋丹,等.黑灵芝多糖对Ⅱ型糖尿病大鼠血糖、血脂及肠系膜上动脉病变改善作用[J].食品科学,2013,34(23):300-304.
[5]黄智璇,石晓,欧阳蒲月.灵芝多糖调节血糖血脂作用的实验研究[J].黑龙江医药杂志,2008(5):39-41.
[6]王维源.引起世界注目的中国菌草技术[J].今日科技,1999(4):1-2.
[7]胡居吾,范青生,肖小年.菌草灵芝与椴木灵芝的功效成分的比较研究[J].天然产物研究与开发,2006(3):458-460.
[8]童金华,林应兴,李晶,等.菌草灵芝提取物的危害及控制措施[J].福建农林大学学报(自然科学版),2015(6):634-638.
[9]李晓晖,李书平.灵芝多糖的含量测定研究[J].中草药,1997,28(9):530-531.
[10]张志军,刘建华,李淑芳,等.灵芝多糖含量的苯酚硫酸法检测研究[J].食品工业科技,2006,27(2):193-195.
[11]Amarowicz R,Naczk M,Shahidi F.Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J]. Journal of Agricultural and Food Chemistry,2000,48(7):2 755-2 759.
[12]朱尚彬,聂少平,朱盼,等.黑灵芝不同溶剂提取物抗氧化活性比较研究[J].食品科学,2009,30(17):98-101.
[13]弓晓峰,谢明勇,陈奕.黑灵芝与赤灵芝提取物的抗氧化作用比较[J].食品科学,2006,27(4):44-47.
[14]邵佳,郁建平,胡美忠.草珊瑚水溶性粗多糖提取及抗氧化性能研究[J].食品科学,2008,29(11):283-286.
[15]龙春,高志强,陈凤鸣,等.黄酮类化合物的结构-抗氧化活性关系研究进展[J].重庆文理学院学报(自然科学版),2006,5(2):13-17.
[16]张志军,李淑芳,魏雪生,等.灵芝多糖体外抗氧化活性的研究[J].化学与生物工程,2011,28(3):63-65.
[17]Sies H.Strategies of antioxidant defense[J].Springer Berlin Heidelberg,1994(4):101-107.
[18]Reiter R J,Melchiorri D,Sewerynek E,et al.A review of the evidence supporting melatonin's role as an antioxidant[J]. Journal of Pineal Research,1995,18(1):1-11.
[19]Reiter R J,Carneiro R C,Oh C S.Melatonin in relation to cellular antioxidative defense mechanisms[J].Hormone and Metabolic Research,1997,29(8):363-372.
[20]张志军,李淑芳,魏雪生.灵芝多糖清除自由基活性的研究[J].食品研究与开发,2012(3):167-170.◇
Optimization of Polysaccharides Extraction from Juncao Ganoderma Lucidum and its Antioxidant Activities
LIU Xiaoyan,CHEN Yixuan,WU Linxiu,XU Yangyang,TONG Aijun,*LIU Bin
(Food Science College,Fujian Agriculture and Foresly University,Fuzhou,Fujian 350002,China)
Based on the single factor experiments,orthogonal experiments are used to optimize the polysaccharides extraction conditions from Juncao Ganoderma Lucidum.In addition,the antioxidant activities of Juncao Ganoderma Lucidum polysaccharides are investigated by the reducing power and the scavenging activity on DPPH·and hydroxyl radicals.The results show that the optimal extraction conditions are as follows:extraction time 2.5 h,extraction temperature 95℃and solid to liquid ratio 1∶25(g∶g),under these optimal conditions the extraction yield of polysaccharides is 1.65%.The antioxidant activities experiments show that the polysaccharides from Juncao Ganoderma Lucidum possess the scavenging abilities on DPPH·and hydroxyl radicals,and increased with the concentration increased,which indicated that the Juncao Ganoderma Lucidum polysaccharides is the potential resource of antioxidant.
Juncao Ganoderma Lucidum polysaccharides;orthogonal experiments;antioxidant activities
TS201.2
A
10.16693/j.cnki.1671-9646(X).2016.10.041
2016-08-31
福建省科技重大专项“菌草食药用菌产业化关键技术研究与示范”(2014NZ2002-1);国家科技支撑计划子课题“中轻度侵蚀区菌草特色生态循环产业集成与示范”(2014BAD15B01-6)。
刘晓艳(1981—),女,博士,助理实验师,研究方向为食品营养。
刘斌(1969—),男,博士,教授,研究方向为食品生物技术。
1671-9646(2016)10b-0048-03
1671-9646(2016)10b-0045-03
