过度磷酸化tau蛋白抑制海马DG区神经元的发生
2016-11-28胡家劭
王 翔,胡家劭
(江汉大学医学院,湖北 武汉 430056)
过度磷酸化tau蛋白抑制海马DG区神经元的发生
王 翔,胡家劭
(江汉大学医学院,湖北 武汉 430056)
目的 老年痴呆(Alzheimer's disease,AD)以tau蛋白过度磷酸化,淀粉样蛋白聚集为主要病理表现,同时出现神经发生紊乱。本研究探讨过度磷酸化的tau蛋白对神经发生的影响。方法 通过在大鼠海马DG区定位注射冈田酸(OA)诱导过度磷酸化tau蛋白的AD模型,并通过5-溴脱氧尿嘧啶核苷(Brdu)标记,双皮质素(doublecortin,DCX)免疫组织化学染色,并通过计算切片上的标记细胞个数来判断神经元发生情况。使用水迷宫的方法检测模型鼠的学习记忆情况。结果 OA模型鼠表现出明显的学习和短期记忆障碍,PP2A特异性的tau蛋白过度磷酸化位点,包括丝氨酸404和262位点。虽然总的新生神经元没有明显差异,但是与对照组相比OA模型鼠中新生的神经元明显减少,说明过度磷酸化的tau蛋白抑制干细胞转化为神经元。结论 过度磷酸化的tau蛋白可以抑制新生神经元的发生,同时也为AD的治疗提供了新的方向。
冈田酸;过度磷酸化tau蛋白;神经发生;分化
老年痴呆(Alzheimer's disease,AD)主要表现为海马依赖的瞬时记忆以及短时记忆的丧失,同时海马也是神经纤维缠结与老年斑沉积的主要脑区之一[1]。因此AD中海马的病变是导致其临床表现的主要原因之一。
成年人脑内的神经元干细胞主要分布于海马齿状回粒细胞下区(SubgranularZone,SGZ)。家族性AD转基因小鼠中早期神经元发生受损[2],说明神经元发生的紊乱是AD早期事件。
近期的研究表明过度磷酸化的tau蛋白可能是导致神经元和突触丢失的主要原因[3],但是tau蛋白的过度磷酸化与AD中神经元发生紊乱的关系还不清楚。
我们使用冈田酸(Okadaic Acid,OA)来模拟过度磷酸化的tau蛋白AD模型[4-5],观察tau蛋白过度磷酸化对AD模型鼠海马齿状回颗粒细胞下区的神经元发生情况。
1 材料与方法
1.1 实验动物 从华中科技大学同济医学院实验动物中心购买雄性SD大鼠38只,每只体质量(250±20)g,所有动物饲养在宽松的环境,自由饮水和进食,正常昼夜节律,并且饲养于室温(25±2)℃以及合适的湿度。
1.2 模型的建立 通过随机分组的方式,分为对照组和OA组,每组大鼠19只。对照组使用二甲基亚砜(40nmol/L),OA组使用(40nmol/L)OA分别在两组的海马DG区定位注射。DG区定位为前囟后4.0mm,旁开2.0 mm,深3.0 mm。其中每组10只大鼠给药后3d开始进行水迷宫实验;6只在给药后3d开始给予5-溴-2-脱氧尿苷(5-bromo-2-deoxyuridine,Brdu);3只给药后3d直接取材做蛋白分析。
1.3 水迷宫训练方法 训练前1 h 将实验动物移入水迷宫室,熟悉环境。水迷宫为直径120cm,高60cm的圆形水池。将直径10cm,高40cm的圆柱形有机玻璃平台固定放于圆形水池第三象限的中心位,置于水面下1~2cm,水池及平台用黑胶纸贴成黑色,训练时倒入墨汁,确保平台不可见。为减少外界因素的干扰,实验环境应尽量保持稳定。训练方法依照文献[6],空间学习时间每天固定在14:00~20:00,每次训练4个象限,连续5d,第6d检测。
1.4 神经元发生检测Brdu标记方法 Brdu注射剂量为100mg/kg,腹腔注射连续4d,2次/d,间隔8h。Brdu粉末溶于37℃生理盐水(浓度为10mg/mL),避光配置,现配现用。双皮质素(doublecortin,DCX)免疫组化:切片免疫组化常规处理后,4℃孵育DCX约48h,用超敏即用型羊二抗试剂盒37℃孵育二抗20min,DAB显色试剂盒显色约4min,终止显色。
1.5 材料和抗体 Brdu,1∶200,购自millipore;DCX,1∶200,购自Santa Cruz;tau蛋白262,404位点,1∶1000,购自SAB公司;tau 5,1∶1000,购自millipore。
1.6 数据处理方法 水迷宫数据处理:我们使用10只大鼠训练,前5d找到平台数据的平均潜伏期为5d的学习指标,第6d检测数据为短期记忆指标;tau蛋白磷酸化数据分析:使用western blot分析,得到tau蛋白丝氨酸404,丝氨酸262位点,tau5以及DM1A的灰度值,再通过比较两组的DM1A的灰度值,得到上样量的相对值;后用404、262,tau5分别除以这个相对值,得到它们的相对值,最后使用相对值比较,得出相对磷酸化程度;新生神经元数据处理:我们使用6只大鼠来做Brdu和DCX染色,每只大鼠在给予Brdu后灌流,通过振荡切片得到脑片,分别用Brdu和DCX进行免疫组织化学染色,统计每一只大鼠的新生细胞和新生神经元数量,这样每组得到6个数据,最后通过统计软件分析。
1.7 统计学方法 本文采用SPSS 17.0统计软件,所有数据行单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 OA组大鼠表现出学习记忆障碍 我们使用水迷宫检测OA所造AD模型鼠的学习记忆能力。如图1所示,从第3d开始,OA组大鼠与正常组相比有明显的学习记忆障碍。说明OA可以导致海马依赖的学习记忆障碍。
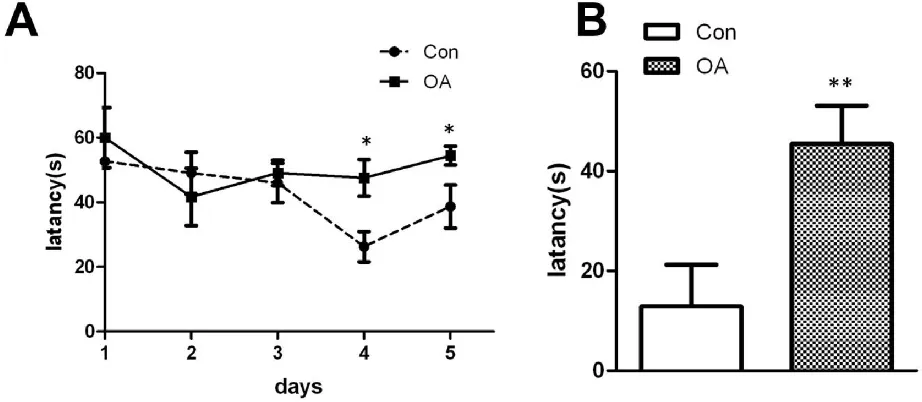
图1 OA模型鼠表现出海马依赖的学习记忆障碍
2.2 海马区tau蛋白过度磷酸化 检测OA模型鼠的海马tau蛋白磷酸化水平,发现PP2A依赖的tau蛋白磷酸化位点有明显的过度磷酸化,包括262,404。见图2。

图2 OA模型鼠表现出明显的tau蛋白磷酸化
2.3 OA组大鼠DG区神经元发生增加 Brdu标记显示海马新生细胞在OA组没有明显变化。DCX免疫组化发现:OA模型鼠DCX染色明显减少,说明在新生的细胞里向神经元方向分化的细胞明显减少。见图3(封三)。
3 讨 论
AD以细胞内的淀粉样蛋白沉积和细胞间的神经纤维缠结为主要特征,近期的研究表明双螺旋细丝(paired helical filament,PHFs)的数量与痴呆患者的临床表现直接相关[7],说明tau的病理变化在临床上的重要作用。一般认为tau蛋白有6个表型,而这些tau蛋白的异常磷酸化与他的神经毒性密切相关,因此异常磷酸化的tau蛋白在AD患者临床表现上可能起重要作用。OA的药理作用是抑制PP2A的活性从而导致tau蛋白的磷酸化,我们使用PP2A的抑制剂OA诱导AD模型,发现模型鼠海马区tau蛋白过度磷酸化,水迷宫表现出短时记忆损害。同时,在模型鼠中,我们发现海马齿状回颗粒区的新生神经元与对照组相比有明显的抑制作用,说明tau蛋白过度磷酸化会抑制神经发生,而这有可能是AD的发病机制之一。
在家族性AD的转基因模型鼠中,研究人员发现其神经发生受损[8],而在另外的一项研究中发现在AD中神经发生是增加的[9]。因此对于在AD中神经发生研究还有待进一步深入,在我们的模型中,我们使用OA诱导tau蛋白磷酸化,来观察海马DG区神经发生。我们发现海马DG区神经元发生明显受到了抑制,特别是tau蛋白可以抑制新生的细胞转化为神经元。我们的实验说明在海马DG区tau蛋白的异常磷酸化可能改变了神经发生的方向,而这就为我们的治疗提供了方向。
虽然现在对于AD患者中海马神经元发生的情况还没有结论,但是使用治疗AD的药物后发现,可以促进AD模型鼠的神经发生[10],说明我们的药物有可能是通过影响了神经发生从而促进AD的治疗。同时也有研究表明,使用成纤维细胞生长因子2(fibroblast growth factor-2,FGF-2)发现,剂量依赖性的增加tau的水平,减少微管相关蛋白2,增加海马DG区神经发生,说明FGF-2可以通过影响神经元的发生以及诱导神经元的树突向轴突转化[11]。这表明通过药物干扰海马DG区的神经发生而改善AD症状正在成为可能。
[1]GRUNDKE-IQBAL I,IQBAL K,TUNG Y C,et al.Abnormal phosphorylation of the microtubule-associated protein tau(tau) in Alzheimer cytoskeletal pathology[J].Proc Natl Acad Sci U S A,1986,83(13):4913
[2]HAUGHEY N J,NATH A,CHAN S L,et al.Disruption of neurogenesis by amyloid beta-peptide,and perturbed neural progenitor cell homeostasis,in models of Alzheimer's disease[J].J Neurochem,2002,83(6):1509
[3]HOOVER B R,REED M N,SU J,et al.Tau mislocalization to dendritic spines mediates synaptic dysfunction independently of neurodegeneration[J].NEURON,2010,68(6):1067
[4]WANG J,TUNG Y C,WANG Y,et al.Hyperphosphorylation and accumulation of neurofilament proteins in Alzheimer disease brain and in okadaic acid-treated SY5Y cells[J].FEBS Lett,2001,507(1):81
[5]ARENDT T,HOLZER M,BRUCKNER M K,et al.The use of okadaic acid in vivo and the induction of molecular changes typical for Alzheimer's disease[J].Neuroscience,1998,85(4):1337
[6]张玉霖,欧阳昌汉,吴基良,等.罗格列酮对散发性老年痴呆模型大鼠认知功能的影响[J].咸宁学院学报(医学版),2008,22(2):96
[7]KIMURA T,YAMASHITA S,FUKUDA T,et al.Hyperphosphorylated tau in parahippocampal cortex impairs place learning in aged mice expressing wild-type human tau[J].EMBO J,2007,26(24):5143
[8]DEMARS M,HU Y S,GADADHAR A,et al.Impaired neurogenesis is an early event in the etiology of familial Alzheimer's disease in transgenic mice[J].J Neurosci res,2010,88(10):2103
[9]JIN K,PEEL A L,MAO X O,et al.Increased hippocampal neurogenesis in Alzheimer's disease[J].Proc Natl Acad Sci U S A,2004,101(1):343
[10]JIN K,XIE L,MAO X O,et al.Alzheimer's disease drugs promote neurogenesis[J].Brain Res,2006,1085(1):183
[11]TATEBAYASHI Y,LEE M H,LI L,et al.The dentate gyrus neurogenesis:a therapeutic target for Alzheimer's disease[J].Acta Neuropathol,2003,105(3):225
Hyperphosphorylation Tau Inhibits Neurogenesis in the DG Region of Hippocampus
WANG Xiang,HU Jia-shao
(MedicalSchoolofJiangHanUniversity,WuhanHubei430056,China)
Objective Alzheimer's disease (AD) is characterized by hyperphosphorylation tau,amyloid aggregation.In AD the neurogenesisalso is disordered.We would explore the role of hyperphosphorylation tau in neurogenesis.Methods Okadaic acid (OA) to make hyperphosphorylation tauas AD model.By injecting the OA into the dentate gyrus (DG) of hippocampus and staining by 5-bromo-2-deoxyuridine (Brdu) and Doublecortin(DCX) we want to explore the state of neurogenesis bythestatistics of labeledneurons.We also use the water maze to test the ability of rats' learning and memory.Results We found there were an obvious learning and short-memory damage and a PP2A specific tau hyperphosphorylation at the site of serine 404 and 262.In the region of DG no different was found in the new born cell,but a huge decrease in the new neuron in AD model rats,which demonstrated hyperphosphorylation tau could inhibit the stem cell to differentiate to neurons.Conclusion Our research proved the hyperphosphorylation tau could inhibit neurogenesis and also provided new direction for therapy.
Okadaic Acid;Hyperphosphorylation Tau;Neurogenesis;Differentiate
R749.16
A
2095-4646(2016)05-0378-03
10.16751/j.cnki.2095-4646.2016.05.0378
2016-03-16)
