猪源彭氏变形杆菌分离鉴定及药敏试验
2016-11-28李剑静植枝林李军潘艳
李剑静 植枝林 李军 潘艳
(1,广西岑溪市动物疫病预防控制中心 543200;2,广西兽医研究所 530001;3,广西畜禽疫苗新技术重点实验室 530001)
猪源彭氏变形杆菌分离鉴定及药敏试验
李剑静1植枝林1李军2,3潘艳2,3
(1,广西岑溪市动物疫病预防控制中心 543200;2,广西兽医研究所 530001;3,广西畜禽疫苗新技术重点实验室 530001)
以患子宫炎的后备母猪的脓性分泌物为样本,进行病原菌分离,通过培养特性试验、生化试验、16S rRNA同源性比对和小鼠致病性试验,鉴定其中的一株优势菌为具有一定致病力的彭氏变形杆菌。24种常用抗菌药物体外药敏试验结果显示,该菌对头孢曲松、头孢噻呋、氧氟沙星、恩诺沙星、氟苯尼考敏感,对阿莫西林、诺氟沙星、环丙沙星、阿米卡星、卡那霉素、林可霉素、大观霉素、替米考星等药物耐药。
猪子宫炎;彭氏变形杆菌;分离鉴定;药敏试验
彭氏变形杆菌(Proteus penneri)属于肠杆菌科变形杆菌属的革兰阴性杆菌,是1种条件致病菌,可引起严重的疾病,在人医临床上最常见的是引起患者败血症、尿路感染及呼吸道感染[1]。据报道,在人医临床上彭氏变形杆菌的分离率,尿液标本为50%,伤口及软组织渗出液标本为25%,血液标本为15%[2-4]。彭氏变形杆菌在畜牧业上的报道相对较少,已有的报道显示,该菌可感染对虾和蛇[5-6],并且在鱼类食品加工过程中容易造成污染,人们食用后可引起感染[7-8],该菌在食品卫生检测中具有重要意义。然而,查阅现有的文献显示,彭氏变形杆菌在家畜上引起的疾病鲜有报道。
2016年3月广西某中小规模场后备母猪散发子宫内膜炎,为查明病因,无菌取其脓性分泌物进行病原菌分离鉴定,经过生长特性、生化特性和16S rRNA同源性比对,鉴定其中1株优势菌为彭氏变形杆菌,同时对该分离菌进行了体外药敏试验,现将试验及结果报告如下。
1 材料与方法
1.1 样品来源
广西某中小规模猪场患子宫炎的母猪,无菌取其脓性分泌物。
1.2 试剂
伊红美蓝培养基、麦康凯培养基、MHA培养基购自北京陆桥技术有限公司,兔血培养基购自郑州安图绿科生物工程有限公司。革兰氏染液、微量生化反应管和抗菌药物敏感试验纸片购自杭州滨和微生物试剂有限公司。Bacteria Genomic DNA Kit、 Es Taq DNA Polymerase、 dNTP、 DNA 分子量标准100bp Ladder、快速琼脂糖凝胶DNA回收试剂盒购自北京康为世纪生物技术有限公司。
1.3 细菌分离培养和生长形态观察
用接种环无菌取脓性分泌物分别划线接种于兔血平板、麦康凯琼脂平板和伊红美蓝培养基上,培养24h后观察分离菌在培养基上的生长特性。挑取优势菌进行纯培养之后进行革兰氏染色、镜检。
1.4 生化试验
依据镜检结果,将优势菌纯培养物接种于微量生化反应管,按说明书要求的条件培养,并在规定的时间内观察结果,参照 《伯杰细菌鉴定手册》[9]进行结果判定。
1.5 细菌16S rRNA鉴定
细菌16S rRNA扩增采用通用引物1492R和27F[10],由上海英骏生物技术有限公司合成。经镜检的分离菌,取其纯培养物,使用细菌DNA提取试剂盒提取菌株基因组DNA,以此作为模板进行PCR扩增,反应体系为:10x Es Taq PCR Buffer 5 ul, dNTP Mix(2.5mM each)4ul, 上下游引物各2ul,模板 DNA 为 6ul, Es Taq DNA Polymerase(5U/ul)0.25ul,RNase-Free Water补足50ul。 反应程序参照陈泽祥[10]进行。PCR扩增产物经电泳后进行目的片段回收纯化,送上海英骏生物技术有限公司测序。
1.6 小鼠毒力试验
用灭菌生理盐水将受试菌悬液浓度调至1个麦氏比浊管(3×108CFU/ml)。 取健康昆明小鼠 10 只(20.5±1)g 随机分为试验组和对照组,每组5只,试验组小鼠按0.2ml/10g腹腔注射菌液,对照组小鼠按同样剂量腹腔注射灭菌生理盐水。正常喂养,连续7d观察小鼠的活动、发病和死亡情况,剖检死亡小鼠。观察病变,并取内脏器官进行接种菌回收、鉴定。
1.7 药敏试验
药敏试验采用NCCLS(2009)[11]推荐的Kirby-Bauer法的方法。用灭菌生理盐水将受试菌浓度调至1个麦氏比浊管(3×108CFU/ml),取0.2ml均匀涂布于MHA平板,稍静置待平板吸收菌液后贴标准药敏纸片,置于恒温培养箱培养20h,用直尺量取各药敏纸片的抑菌圈,结果判定参照NCCLS(2009)颁布的标准进行。
2 结果
2.1 细菌分离和形态学观察
从其中1份样品分离到1株优势菌,该菌在血平板和伊红美蓝培养基上的菌落形态为表面光滑、边缘整齐、扁平、透明、膜状的小菌落。镜检结果为革兰氏阴性小杆菌。
2.2 生化试验结果
受试菌不能分解鸟氨酸脱羧酶、赖氨酸脱羧酶、精氨酸双水解酶,能分解尿素酶、苯丙氨酸脱氨酶,吲哚阳性,产生H2S,能发酵葡萄糖和麦芽糖少产气,不能水解七叶苷。受试菌的生化特性与 《伯杰细菌鉴定手册》中的彭氏变形杆菌生化特性相符。
2.3 16S rRNA同源性比对结果
将测序获得分离菌的16S rRNA序列在NCBI网站进行同源性比对,与数据库记载的彭氏变形杆菌(GenBank登录号:JF775423.1)的16S rRNA序列同源性达98%。
2.4 小鼠致病力试验
试验组小白鼠腹腔接种细菌悬液后12h,表现为精神沉郁、呼吸困难,食欲饮欲减退,在24h内出现死亡,连续饲养7d内,共死亡3只,无菌取死亡小白鼠的心血、肝脏等组织接种于血平板和伊红美蓝平板,分离到与接种菌一样的细菌。对照组小白鼠表现正常,无死亡。
依据分离菌的生长形态、生化特性、16S rRNA同源性比对和小鼠致病力试验结果,鉴定该分离菌为具有一定致病力的彭氏变形杆菌。
2.5 药敏结果
体外药敏试验结果显示,受试菌对头孢曲松、头孢噻呋、氧氟沙星、恩诺沙星、氟苯尼考敏感,对阿莫西林、诺氟沙星、环丙沙星、阿米卡星、卡那霉素、林可霉素、大观霉素、替米考星等药物耐药(附表)。
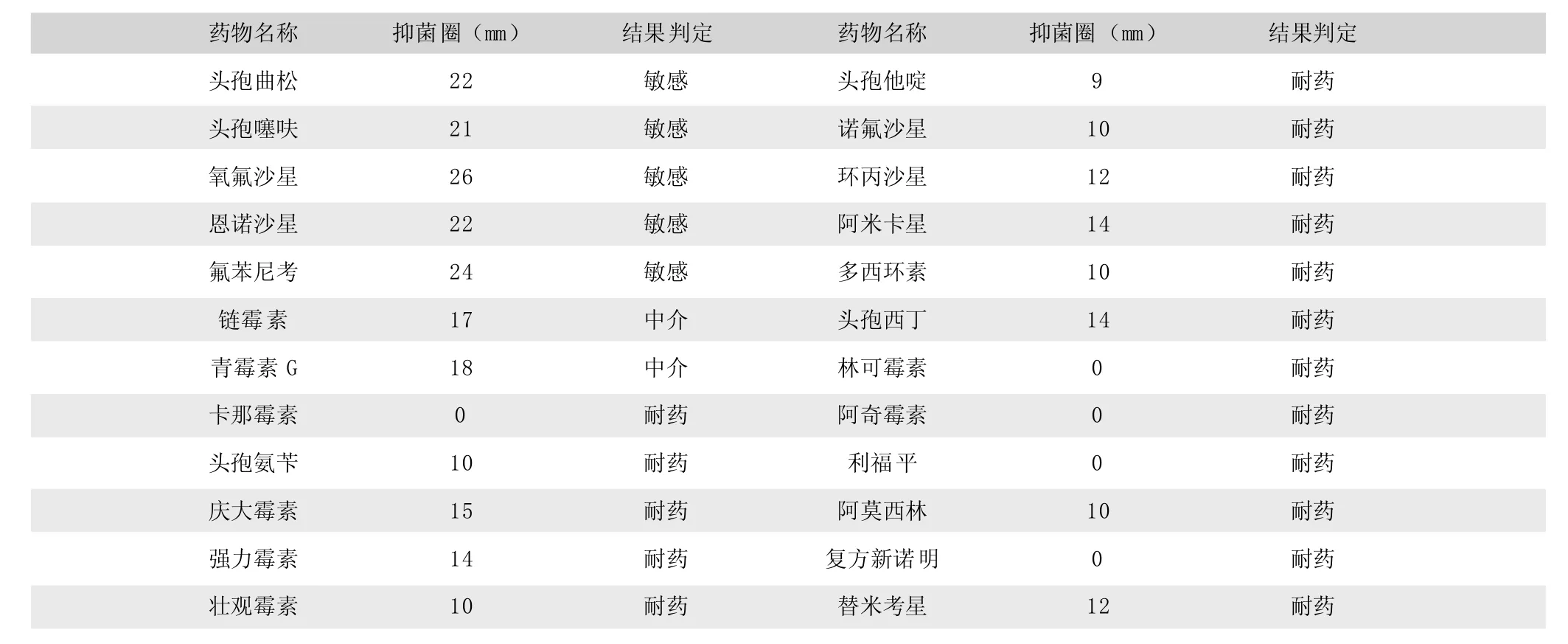
附表 分离菌的体外药敏试验结果
3 讨论
(1)母猪子宫炎发病率高,表现为生殖道流出脓性分泌物、产后无乳或少乳、发情不及时、屡配不孕、产仔数低等。引起母猪子宫炎的因素多种多样,自然因素、人为因素、管理因素、饲料因素和疾病因素均可导致母猪患子宫炎,其中多种疾病可引起猪子宫炎,细菌性感染主要是大肠杆菌、链球菌、葡萄球菌、棒状杆菌、绿脓杆菌、变形杆菌等,病毒性感染有细小病毒、伪狂犬病毒、乙型脑炎病毒、蓝耳病病毒和圆环病毒等,呈单一感染和混合感染,以多种病原混合感染为主,本次样品除了分离出彭氏变性杆菌,还有葡萄球菌和链球菌。母猪子宫炎给猪场造成较为严重的经济损失,需引起养猪人的重视,做好防治工作。
(2)彭氏变形杆菌是一种条件致病菌,当动物机体抵抗力下降时可造成感染,通过尿液粪便排放可照成饲养环境和水体污染,因此加强饲养动物营养水平、提高免疫力,切实做好饲养环境消毒等管理工作可减少该条件致病菌引起的感染。此外,该菌在食品加工过程中也容易污染食品,如果这些污染的食品在食用前未进行充分加热,可能会引起食用者感染,应引起关注。
(3)药敏试验结果显示,受试的24种抗菌药物,彭氏变形杆菌的敏感率为20.8%(5/24), 中介率8.3%(2/24),耐药率70.9%(17/24),表明分离到的彭氏变形杆菌已产生较强的耐药性。细菌耐药性日益严重,与不科学的使用抗菌药物密不可分,如不必要的预防用药、没有依据的用药和过量使用药物。而进行细菌分离和体外药敏试验,可为临床治疗用药提供科学参考,避免了凭经验乱用抗菌药物,减少药物成本,同时能减缓细菌耐药性的产生。
[1]Malgorzata Siwińskaa,Evgeniya A.Levinac,D,et al.Classification of a Proteus penneri clinical isolate with a unique O-antigen structure to a new Proteus serogroup[J].Carbohydrate Research灾olume,2015,407:131-136.
[2]Cantón R,Sánchez-Moreno MP,Morosini Reilly MI.Pro teus penneri[J].Enferm Infecc Microbiol Clin,2006,24(l1):8-13.
[3]Castro ST,Rodríguez CR,Perazzi BE,et al.Comparison of different methods in order to identify Proteus spp.Rev Argent Microbiol,2006,38:119-124.
[4]Krajden S,Fuksa M,Petrea C,et al.Expanded clinical spectrum of infections caused by Proteus penneri[J].J Clin Microbiol.1987,25:578-579.
[5]Cao H,He S,Lu L,et al.Chen B Identification of a Proteus penneri isolate as the causal agent of red body disease of the cultured white shrimp Penaeus vannamei and its control with Bdellovibrio bacteriovorus[J].Antonie灾an Leeuwenhoek.2014,105(2):423-430.
[6]赵成坚.蛇源细菌的分离与鉴定[M].广西大学硕士,2013.
[7]郑瑞生,陈凉凉,肖熙.熟制鲍鱼残留细菌的分离及16S rDNA鉴定[J].食品科学技术学报,2013,31(4):32-36.
[8]郭全友,何木,李保国,等.大黄鱼腐败细菌鉴定及PLFAs初级模型的建立[J].现代食品科技,2015,31(12):227-234.
[9]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:667-675.
[10]陈泽祥,潘艳,禤雄标,等.鸭疫里氏杆菌广西分离株16S rRNA基因序列的测定和系统进化分析[J].广西农业科学,2007,38(2):205-208.
[11]National Committee for Clinical Laboratoray Standards.Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals approved standard[M].2nd.Wayne,Pa.NCCLS,2009:47-55.
广西自然科学基金项目(2014GXNSFAA118119),广西科学研究与技术开发计划(桂科重14121003-3-1)。
李剑静(1977-),女,广西岑溪市人,本科,兽医师,研究方向:动物疫病防控。
潘艳(1978-),女,广西南宁市人,博士,副研究员,研究方向:家畜传染病与分子生物学。
