高效液相色谱法检测卷烟辅料中双酚A的含量
2016-11-26彭圣明
庄 晶, 梁 勇, 彭圣明
(湘潭大学 化学学院,环境友好化学与应用省部共建教育部重点实验室,湖南 湘潭 411105)
高效液相色谱法检测卷烟辅料中双酚A的含量
庄 晶, 梁 勇, 彭圣明*
(湘潭大学 化学学院,环境友好化学与应用省部共建教育部重点实验室,湖南 湘潭 411105)
建立并优化了卷烟辅料中双酚A的高效液相色谱检测方法.样品剪碎或直接置于锥形瓶中,经超声萃取,膜过滤,以58%的乙腈和42%的0.1%乙酸水溶液作为流动相进行梯度洗脱,采用荧光检测器进行检测.结果表明:① 方法的线性范围是2~100 μg·L-1,线性关系良好(R2>0.999),平均回收率大于91.63%,相对标准偏差小于10%(n=6),定量限为0.115 0 μg·L-1;② 样品前处理简单,无需复杂的衍生化处理.该方法对于卷烟辅料中双酚A的含量检测结果准确,操作方便、快捷,满足卷烟行业对该指标的控制要求.
HPLC;双酚A;荧光检测;卷烟辅料
双酚A是一类具有弱雌激素样作用及较强抗雄激素样作用的物质[1~3],能干扰人的内分泌系统,导致生殖、发育和代谢等生命活动异常[4].其危害极大,备受关注.近年来许多国家开始对双酚A的使用进行限制:2008年加拿大将双酚A定为有毒化学物质,并禁止在奶瓶、食品及饮料等包装材料中使用[4];2011年欧盟颁布的2011/8/EU指令规定与食品接触的材料中双酚A的迁移限值为0.6 mg·kg-1,并扩大对双酚A的禁售范围[4];2011年我国卫生部等部门规定禁止双酚A在婴幼儿奶瓶材料中使用,并限量规定了其在食品包装材料、容器和涂料的使用标准.GB 13116-1991《食品容器及包装材料用聚碳酸酯树脂卫生标准》和GB 14942-1994《食品容器包装材料用聚碳酸酯成型品卫生标准》规定树脂料和成型品中双酚A的限量均为0.05 mg·L-1[5,6].
为了严格控制材料中双酚A的含量,其含量检测方法的建立与优化引起了越来越多研究者关注.近年来建立起了许多双酚A含量的检测方法,主要包括极谱法[7]、荧光光谱法[8]、HPLC-MS[9,10]、GC-MS[11~15]和HPLC[16~22]等,其中GC-MS、HPLC较为常见,但是GC-MS需要对双酚A进行酯化,操作步骤繁琐,而HPLC更为简便.
现有的HPLC法主要用于对食品包装材料中的聚碳酸酯材料等样品的检测,如彭青枝等用乙腈和水作为流动相检测PC材质的水杯、水瓶和婴儿奶瓶等中的双酚A含量[18].但常见的纸质包装材料及包装材料上的涂层和粘连剂中双酚A的检测方法却很少[12,21,22],而卷烟纸质包装材料、油墨及水基胶等双酚A的检测则未见文献报道.随着生活水平的日益提高,人们对于自身的健康意识也随之加强,在通过吸烟来得到生理和心理满足感的同时,又希望尽可能地减少吸烟所带来的危害.本文在现有HPLC法的基础上,采用HPLC-FLD检测双酚A的含量,并对HPLC和FLD的条件进行优化,使双酚A的检测限更低、精密度更高.该法可方便、快捷地测定卷烟各种辅料中双酚A的含量,为有效控制卷烟辅料的纸质包装材料、油墨及水基胶中的双酚A提供了技术借鉴.
1 实 验
1.1 实验材料、试剂和仪器
卷烟辅料一般包括卷烟用纸、烟用水基胶和烟用油墨等.
乙腈、乙酸、甲醇均为色谱纯(德国Merck公司);超纯水(自制);标准物质为双酚A(纯度均大于97%,美国Sigma公司).Waters2695高效液相色谱仪(配备自动进样器、柱温箱和荧光检测器,美国Waters公司);AE200电子天平(感量0.000 1 g,瑞士Mettler Toledo公司);KQ-600de型超声波振荡器(昆山舒美超声仪器有限公司);Milli-Q超纯水仪(美国Millipore公司);0.45 μm有机相微孔滤膜(迪马科技).
1.2 方 法
1.2.1 标准储备液的配制 (1) 一级标准储备液配制:称取双酚A标准品0.1 g(精确至0.1 mg),置于100 mL棕色容量瓶中,用萃取剂(甲醇)定容.(2) 二级标准储备液配制:准确移取1.0 mL一级标准储备液至100 mL棕色容量瓶中,用萃取剂定容.于0~4 ℃下保存,3个月内使用.(3) 一级标准溶液配制:准确移取1.0 mL二级标准储备液至100 mL棕色容量瓶中,用萃取剂定容.该一级标准液应在使用前配制.(4) 系列标准工作溶液配制:移取1.0、2.5、5.0、10、25 mL一级标准溶液至50 mL棕色容量瓶中,用萃取剂定容,以此5个标准溶液和一级标准溶液为6级系列标准工作溶液.
1.2.2 样品的处理与分析 称取1 g样品(纸样需剪碎)置于100 mL锥形瓶中.准确加入20 mL萃取剂,室温下超声萃取35 min,超声功率为80 kW.12 000 r/min离心10 min,取上层清液,用有机相微孔滤膜过滤,进行HPLC检测.
HPLC分析条件为:色谱柱:DIONEX Acclaim C18柱(250 mm×4.6 mm,5 μm,美国Phenomenex公司);流动相A:乙腈,流动相B:0.1%乙酸水溶液(体积分数);梯度洗脱:0 min,(58%A+42%B),15 min,(58%A+42%B),16 min,(10%A+90%B),25 min,(10%A+90%B),26 min,(58%A+42%B),40 min,(58%A+42%B);柱温:30 ℃;流速:1 mL/min;进样量:10 μL;检测器:荧光检测器,激发波长为227 nm,发射波长为317 nm;分析时间:40 min.采用保留时间定性,外标法定量.
2 结果与讨论
2.1 萃取条件的选择
2.1.1 萃取溶液 双酚A微溶于水、脂肪烃,溶于丙酮、乙醇、甲醇、乙醚、乙酸及稀碱溶液,微溶于二氯甲烷、甲苯等.实验分别比较了乙醇、甲醇、乙腈、1%乙酸水溶液及30 mmol/L醋酸铵水溶液作为萃取剂的萃取效果.结果显示:(1) 乙腈在萃取的时候会有较大的颗粒出现,过膜的时候很困难;(2) 1%乙酸水溶液的萃取效果不理想,检测结果不稳定,回收率较低,其原因是双酚A有两个酚羟基,显弱酸性,萃取不完全;(3) 30 mmol/L乙酸铵水溶液可将样品中双酚A萃取完全,但有部分双酚A以离子形式存在,结果稳定性差,不利于推广;(4) 乙醇和甲醇能够将双酚A萃取完全,但在同一样品中,乙醇作为萃取溶液峰面积为3 565 μV*S,而甲醇作为萃取溶液峰面积则有7 355 μV*S,所以最终选择甲醇作为萃取溶液.
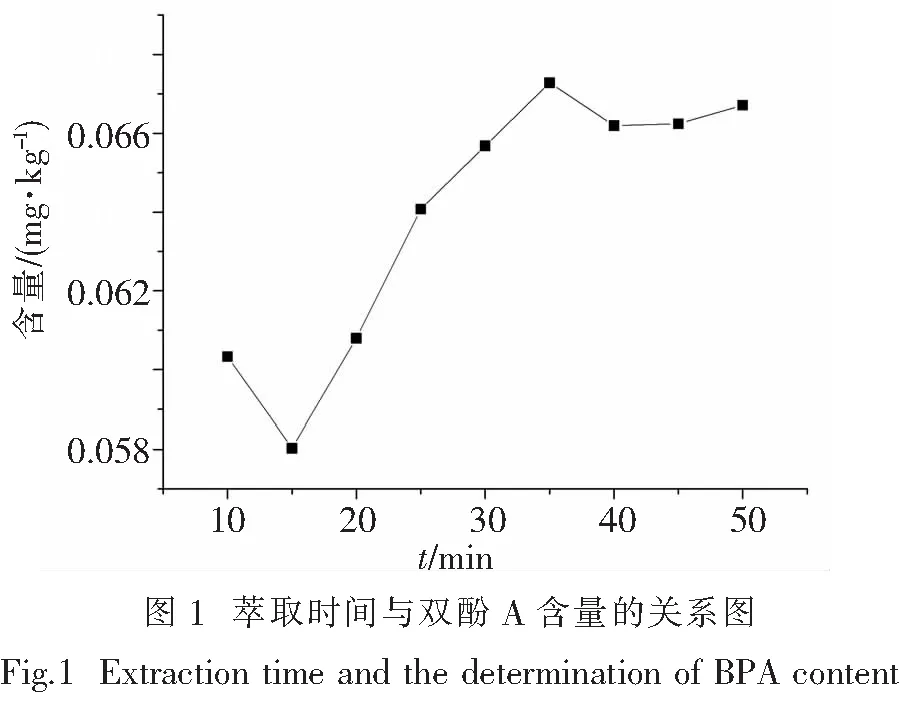
2.1.2 萃取时间 以超声萃取的方式,对同一样品分别萃取10、15、20、25、30、35、40、45、50 min,结果如图1所示.萃取35 min后,双酚A含量最高,故选择35 min作为最佳萃取时间.
2.1.3 萃取方式 同一样品分别选用振荡和超声35 min进行萃取,检测出的双酚A的含量如表1所示.结果显示,超声方式萃取所得的双酚A含量较高,故选用该方式为最佳萃取方式.
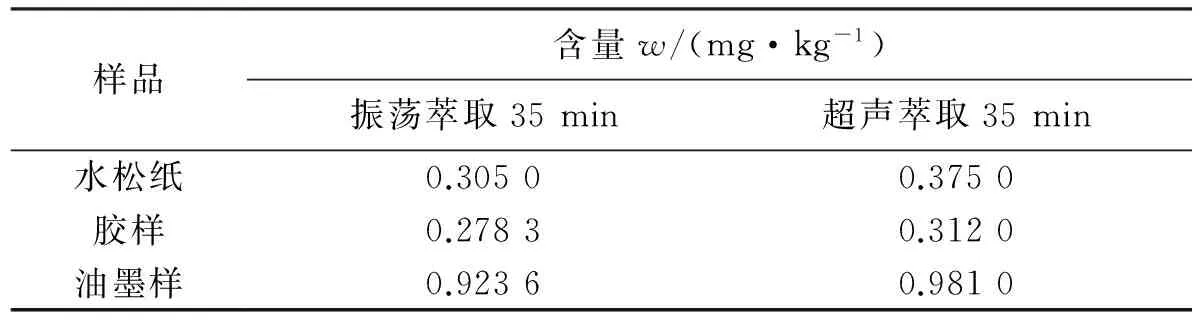
表1 萃取方式与双酚A含量测定的关系
2.2 液相色谱条件的优化
根据双酚A的性质选择了DIONEX Acclaim C18(4.6*250 mm,5 μm)色谱柱,该色谱柱对纸质样品中双酚A的色谱分离峰型好,可满足定性定量分析.
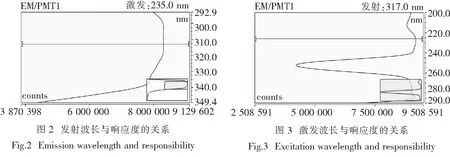
2.2.1 波长的选择 固定激发波长235 nm,对样品进行3D扫描,结果如图2所示:发射波长在317 nm处吸收最强.固定发射波长317 nm,对样品进行3D扫描,结果如图3所示:发射波长在227 nm处吸收最强.对比激发波长235 nm和227 nm的响应度,227 nm处强于235 nm处.故选择最佳激发波长为227 nm,最佳发射波长为317 nm.
2.2.2流动相的选择 实验比较了乙腈-水、乙腈-乙酸水溶液、甲醇-乙酸铵水溶液、甲醇-乙酸水溶液作为流动相的分离效果.同样浓度的标样,以甲醇-乙酸铵水溶液为流动相时,峰高为7 767 μV,峰面积为2.471×104μV*S;以甲醇-乙酸水溶液为流动相时,峰高为2.973×104μV,峰面积为2.905×104μV*S;而以乙腈-乙酸水溶液为流动相,则峰高为4.532×104μV,峰面积为4.293×104μV*S.同一样品,流动相A为乙腈、流动相B为乙酸水溶液时,峰面积为7 356 μV*S;而流动相B为去离子水时,峰面积为6 292 μV*S.故最终以乙腈-乙酸水溶液作为流动相体系.
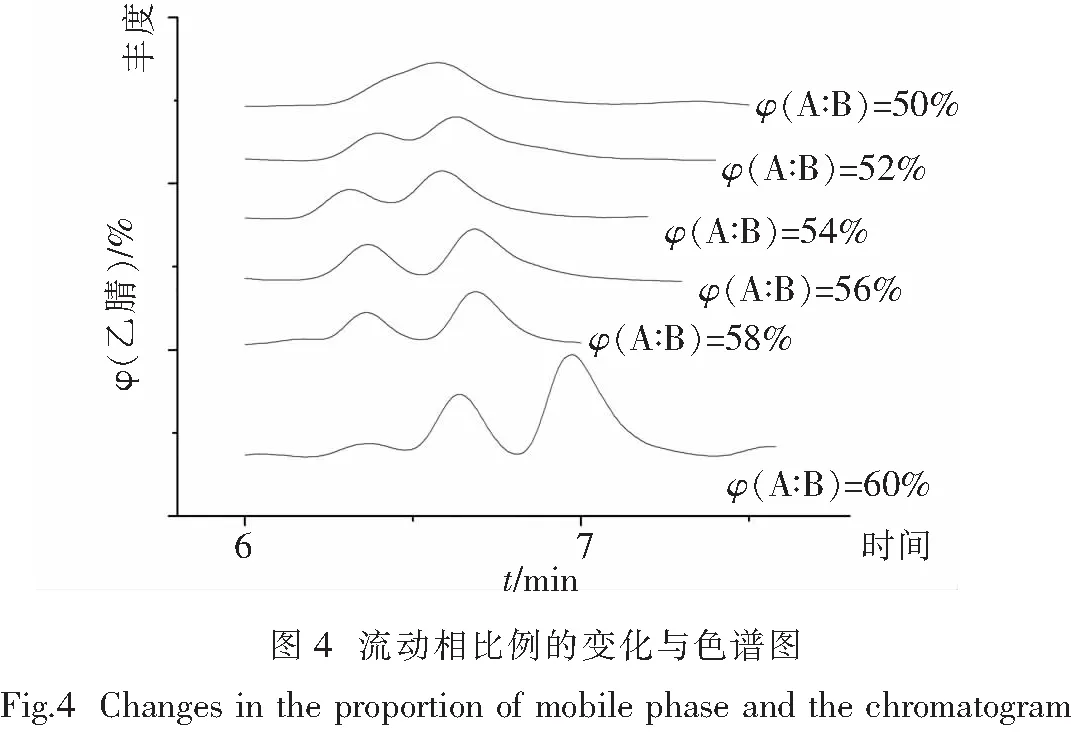
2.2.3 流动相乙腈-乙酸水溶液的优化 实验研究了φ(A︰B)从50%到60%变化的情况.由图4可知,φ(A︰B)为58%时分离效果最好;随着(A︰B)的降低,分离效果越来越差;当φ(A︰B)为50%时,后面的杂峰与双酚A的有部分重叠,无法分离;当φ(A︰B)为60%时,峰与前面的杂峰相连,分离效果不好.故最终选择流动相比例为φ(A︰B)=58︰42(体积比).
2.3 工作曲线、检测限及定量限
对系列标准工作溶液分别进行HPLC分析,以双酚A浓度(X,μg·L-1)为横坐标,双酚A峰面积(Y,μV*S)为纵坐标,建立双酚A的标准工作曲线Y=1 440X+5 380,相关系数0.999 9;取最低浓度标准工作溶液进样10次,计算标准偏差(SD),分别以3倍和10倍SD计算检测限为0.034 5 μg/L和定量限0.115 0 μg/L.

2.4 方法的重复性
按上述方法,选取某一纸质样品称取6个平行样品,用高效液相色谱仪进行测定,计算方法的日内RSD;在6个不同的工作日内,按上述方法,用高效液相色谱仪进行测定,计算方法的日间RSD,结果如表2所示.

表2 日内、日间重复性实验结果
由表2可知,该方法的日内RSD小于5%,日间RSD小于10%,表明该方法具有良好的重复性.
2.5 回收率的考察
取某一样品以其平行5次测定的平均值作为计算双酚A原始含量的依据,添加高、中、低三个浓度水平的标准(添加的标准高、中、低浓度的量分别约为1倍、0.5倍和0.3倍样品原始含量)进行回收试验.由表3可见,双酚A的回收率η在91.63%~110.4 %之间,说明本方法对双酚A都有很高的回收率.
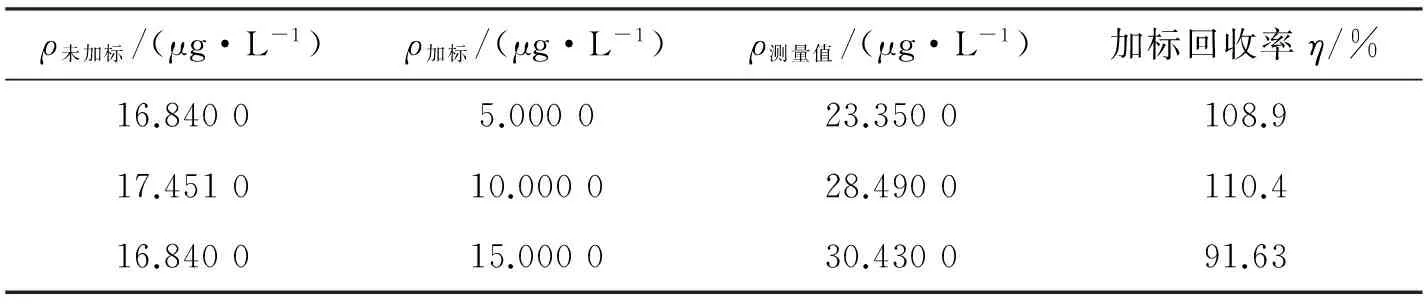
表3 试样加标回收率
2.6 样品分析
采用本方法测定三种类型的样品,包括纸质样品、水基胶样品、油墨样品,每个样品平行测定3次,测定结果如表4所示,检测实际样品相对标准偏差小于8%,用吕刚等[13]建立的固相微萃取/气质法检测包装材料中酚类环境激素的方法来检测样品中双酚A的含量与本实验方法检测结果相对标准偏差低于17%.其中纸质样品的色谱图如图5所示.
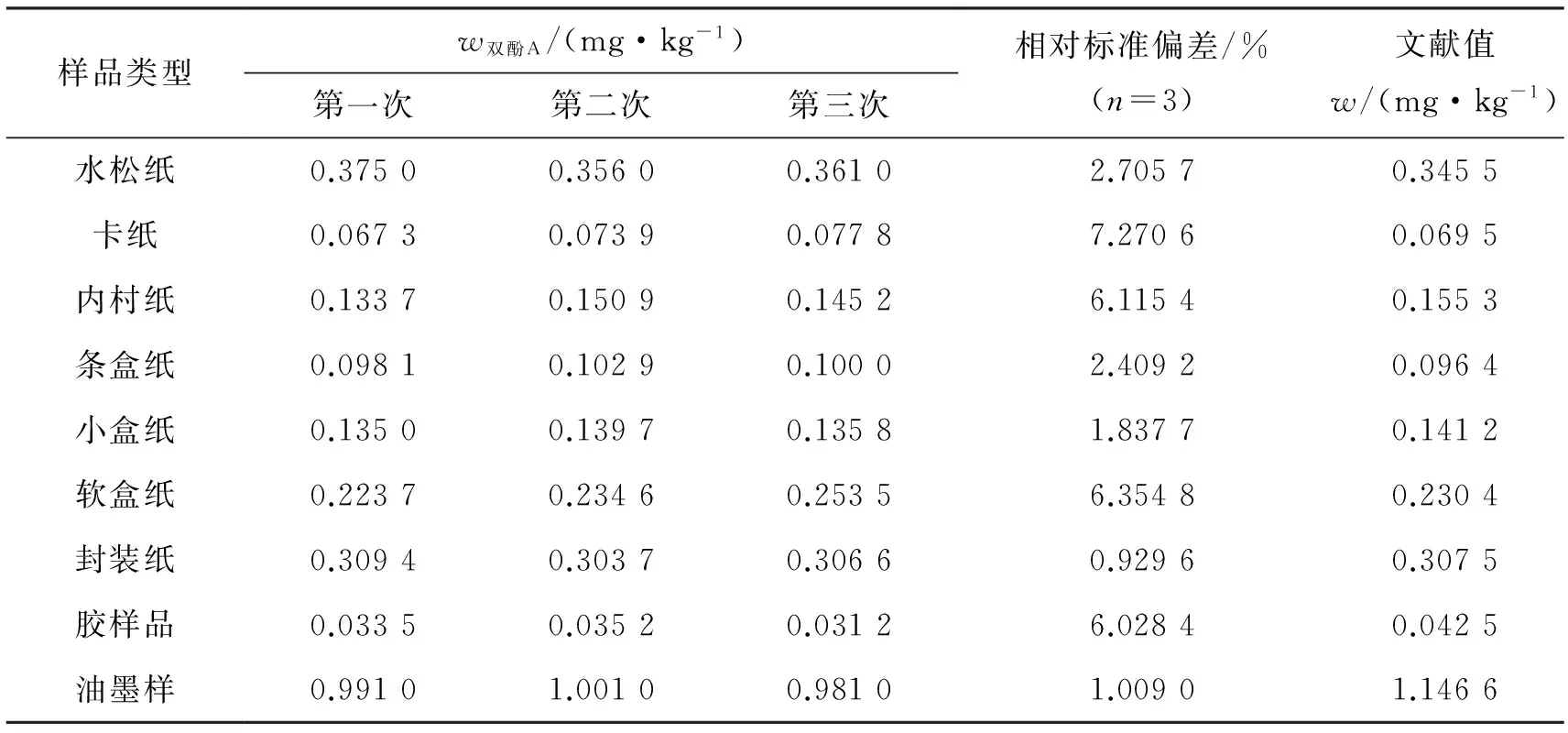
表4 不同样品中双酚A含量分析

3 结 论
通过优化前处理条件选用甲醇作为溶剂,超声萃取35 min,并优化色谱条件,采用乙腈与1%乙酸水溶液作为流动相,激发波长为227 nm,发射波长为317 nm的高效液相-荧光检测法,该方法操作简单,快速,灵敏度高,检出限低,重现性好,日内变异系数小于5%,日间变异系数小于10%,回收率在91%~111%之间,并可检测卷烟辅料纸样、油墨样及胶样中的双酚A含量.
[1] LERANTH C, HAJSZAN T, SZIGETI-BUCK K,et al. Bisphenol A prevents the synaptogenic response to estradiol in hippocampus and prefrontal cortex of ovariectomized nonhuman primates[C]// Proceedings of the National Academy of Sciences of the United States of America, 2008, 105:14 187-14 191.
[2] 苗颂,寇增强,高志贤.双酚A暴露对大鼠脾脏结构及雌激素受体-α表达的影响[J]. 环境与健康杂志, 2010, 27(2):121-123.
[3] 陈蕾,徐晓虹,田栋.环境雌激素双酚A对脑和行为发育的影响[J].中国科学C辑:生命科学,2009,39:1 111-1 119.
[4] 李君君,李力军. 双酚A的健康影响以及各国对其在塑料制品中的限量要求[J].环球健康杂志,2012,29(4):379-382.
[5] 食品容器及包装材料用聚碳酸酯树脂卫生标准:GB 13116—1991[S].
[6] 食品容器、包装材料用聚碳酸酯成型品卫生标准:GB 14942—1994[S].
[7] 张宏,郭大成,孙成均. 示波极谱法测定聚碳酸酯塑料中双酚A[J].理化检验-化学分册,2002, 38(8):379-381.
[8] 王广军,樊静,刘国光. 用溴酸钾-丁基罗丹明B体系动力学荧光法测定双酚A[J]. 分析科学学报, 2007, 23(4): 478-480.
[9] BERGER U,OEHME M,GIRADIN L. Quantification of derivatives of bisphenol A diglycidylether(BADGE) novolacglycidylether (NOGE) migrated from can coatings into tuna by HPLC/fluorescence and MS detection [J]. Fresenius J Anal Chem, 2001, 369(28):115-123.
[10] 俞雪钧,谷云云,冯睿,等.高效液相色谱串联质谱法同时测定海产品中双酚A及烷基酚残留[J].华中农业大学学报,2014,33(3):52-59.
[11] 陈雪峰,蒋俊,丁敏,等.GC-TQ-MS/MS测定生理盐水注射液中双酚A[J].药物评价研究,2013(6):460-462.
[12] 朱军峰,王卓妮,李元博,等.表面印迹聚合物萃取/气相色谱质谱联用检测双酚A[J].分析实验室,2014(1):13.
[13] 吕刚,王利兵,刘军,等. 包装材料中的酚环境雌激素的测定-固相萃取/气相色谱质谱法[J].分析实验室, 2008, 9(27):73-75.
[14] BROTONS J A,OLEA-SERRANO M F,VILLALOBOS M,et al.Xenoestrogens released from lacquer coating in canned food[J]. Environmental Health Perspectires,1995,103(6):608-612.
[15] 聚碳酸酯树脂及其成型品中双酚A的测定气相色谱-质谱法:SN/T 2379—2009[S].
[16] HADJMOHAMMADI M R,SAEIDI I.Determination of bisphenol A in Iranian packaged milk by solid-phase extraction and HPLC [J]. Monatsh Chem,2010,141:501-506.
[17] 胡文凌,张杰,余文娟,等.磁固相萃取-高效液相色谱法测定环境水样中双酚A[J].理化检验-化学分册,2015(2):4.
[18] 彭青枝,李涛,潘思轶. 食品包装材料聚碳酸酯中双酚A残留量的测定[J].中国卫生检验杂志,2009, 4(4):798-799.
[19] 食品接触材料高分子材料食品模拟物中2,2-二(4-羟基苯基)丙烷(双酚A)的测定高效液相色谱法:GB/T 23296.16—2009[S].
[20] 食品接触材料高分子材料食品模拟物中双酚A 高效液相色谱法:SN/T 2282—2009[S].
[21] 张杰,许家胜,崔岩,等.高效液相色谱法检测一次性纸杯中的双酚A[J].化学研究与应用,2014,26 (03):454-456.
[22] 马强,白桦,王超,等.高效液相色谱法对纺织品和食品包装材料中的壬基酚、辛基酚和双酚A的同时测定[J].分析测试学报,2009,28(10):1 160-1 164.
责任编辑:朱美香
Using HPLC to Detect the Quantity of the Bisphenol A in the Accessory Materials of the Cigarette
ZHUANGJing,LIANGYong,PENGSheng-ming*
(Key Laboratory of Environmentally Friendly Chemistry and Application of Ministry of Education, College of Chemistry, Xiangtan University, Xiangtan 411105 China)
A high performance liquid chromatography detection method was established and optimized which could measure the content of the bisphenol A in the accessory materials of the cigarette. The mixedsolvent(the volume ratio of acetonitrile and 0.1% aqueous acetic acid was for 58︰42)was used as the mobile phase for gradient elute.A series of procedures were carried out to the samples, including cutting the samples into pieces, ultrasonic extraction, membrane filtration and using the fluorescence detector machine. The results showed that: ①the linear range and quantification limit of this method were 2~100 μg·L-1and 0.115 0 μg·L-1,respectively. The liner relation was good(R2>0.999). The average recoveries were more than 91.63% with the relative standard deviations less than 10% (n=6). ②The pretreatment method was simple and quick without derivatization.The developed method was fast, simple, sensitive and suitable for the detection of the precise outcome of the bisphenol A, and could meet the controllable requirements of this industry.
HPLC; BPA;fluorescence detection;cigarette material accessories
2016-04-18
彭圣明(1976-),男,湖南 桃江人,博士,副教授.E-mail:pengshengming@sina.com
O657.7+2
A
1000-5900(2016)02-0056-06