诊断性抗结核治疗在鉴别儿童克罗恩病与肠结核时评估工具和时点的诊断准确性研究
2016-11-26彭凯玥卢水华
洪 燕 王 琳 彭凯玥 吴 婕 张 羿 卢水华 黄 瑛
·论著·
诊断性抗结核治疗在鉴别儿童克罗恩病与肠结核时评估工具和时点的诊断准确性研究
洪 燕1,4王 琳1彭凯玥1吴 婕1张 羿2卢水华3黄 瑛1
目的 探讨诊断性抗结核治疗在鉴别儿童克罗恩病(CD)与肠结核(ITB)中评估工具及其合适的鉴别时点。方法 回顾性收集临床和病理难以判断CD或ITB且明确结核或抗酸染色阳性的病例,剔除入院前曾经抗结核治疗或应用免疫抑制剂和先天免疫缺陷合并结核感染。活检干酪样坏死,或病理抗酸染色阳性,或肠外活动性结核,或 PPD皮试强阳性,或细菌涂片阳性者,接受诊断性抗结核治疗,于诊断性抗结核治疗前(基线),治疗后3、6和12个月时,行儿童CD活动指数(PCDAI)评分、肠镜评估。诊断性抗结核治疗ITB确诊依据Logan修订的per Paustian标准。抗结核均采用2~3HRZE/7~10HR方案。结果 26例难以判断CD或ITB的患儿完成了基线、3、6和12个月时的PCDAI评分和肠镜评估进入本文分析,ITB 组17例,CD 组9例,2组一般情况、临床表现、实验室检测指标、肠镜表现、小肠MRE表现、病理组织学表现、抗结核治疗时间和抗结核治疗方案差异无统计学意义。ITB组治疗3、6和12个月较基线PCDAI评分下降≥12.5分或不同时点PCDAI评分≤10分分别为6、14和16例;其中3个月较基线、6个月较3个月 、12个月较6个月PCDAI评分下降≥12.5分分别为6、4、4例。CD组治疗3、6和12个月较基线PCDAI评分下降≥12.5分或不同时点PCDAI评分≤10分分别为1、2、1例。ITB组和CD组,6个月时肠镜评估痊愈+明显好转分别为76.5%(13/17)和22.2%(2/9),12个月时痊愈+明显好转分别为94.1%(16/17)和11.1%(1/9),差异有统计学意义(Fisher精确检验,P=0.000)。以诊断性抗结核治疗ITB确诊标准作为金标准,3和6个月时PCDAI评分阳性预测值分别为85.7%和86.7%,6个月时肠镜评估阳性预测值86.7%;6个月时PCDAI评分+肠镜评估特异度88.9%,阳性预测值92.9%;12个月时PCDAI评分+肠镜评估阳性预测值(94.1%)比6个月时提高了1.2%。结论 诊断性抗结核治疗过程中,难以判断有ITB或CD患儿临床症状好转较肠镜好转快,PCDAI评分+肠镜评估可作为难以判断ITB或CD患儿评估工具,诊断性抗结核治疗6个月时为最佳时点。
肠结核; 克罗恩病; 诊断性抗结核; 鉴别; 儿童
克罗恩病(CD)是近年来全球消化领域最热门的话题之一。研究发现43.4%的CD在儿童期即发病[1],目前全世界儿童CD的发病率为2.5/10万~11.4/10万[2],尽管对CD的认识正逐渐加深,但困惑亦随之增加。尤其是在我国,一方面结核病仍高发,另一方面诊断儿童CD的病例也以惊人的速度在增加。儿童CD与肠结核(ITB)临床表现相似且均不典型,但在某些处理措施上却截然相反,治疗CD关键手段,如免疫抑制剂、生物制剂可使结核病复燃、播散,误诊误治会导致非常严重的后果,而抗结核治疗导致肝功能损坏及延误病情可影响儿童生长发育。因此鉴别儿童CD与ITB意义重大。目前公认在CD与ITB鉴别诊断困难不能确诊时,一般多先行诊断性抗结核治疗[3]。虽然诊断性抗结核治疗效果的评估标准至今尚无共识,但仅凭短期临床症状改善,并不能排除CD。本文回顾性分析抗酸阳性难以判断CD和IBD病例接受诊断性抗结核治疗,探讨诊断性抗结核治疗结果的评估工具及其合适的鉴别时点。
1 方法
1.1 纳入标准 同时满足以下条件:①2009年1月至2015年12月在复旦大学附属儿科医院和复旦大学附属公共卫生临床中心住院年龄<18岁的病例,②通过临床和病理难以判断CD[4]或ITB[5], ③肠黏膜活检见干酪样坏死性上皮肉芽肿或(及)抗酸染色阳性,或肠外活动性结核,或 PPD皮试强阳性,或细菌涂片阳性。④诊断性抗结核治疗前(基线),治疗后3、6和12个月时诊断评估数据完整。
1.2 排除和剔除标准 ①入院前曾经抗结核治疗﹥3个月或应用免疫抑制剂﹥6个月,②诊断性抗结核治疗过程中确诊为先天(或获得性)免疫缺陷合并结核感染,包括慢性肉芽肿、IL-10受体缺陷、IL-12基因缺陷和HIV等。
1.3 随访时点和评估工具
1.3.1 PCDAI评分标准[4]于诊断性抗结核治疗基线、治疗后3、6和12个月时评分,较基线下降≥12.5分[6]或不同时点PCDAI≤10分为好转,余为复发或无好转。
1.3.2 肠镜评估标准 于诊断性抗结核治疗基线、治疗后6和12个月时行肠镜检查,由本课题组资深肠镜专家调取肠镜原始图像重新做出判断,根据病变性质(溃疡、结节样病变、炎症性息肉、肠腔狭窄)和范围定性评估疗效,与基线相比,愈合:病变完全消失,好转:病变范围减少≥1/2,无好转:病变范围减少<1/2或加重。
1.4 诊断性抗结核治疗12个月时ITB诊断标准 ITB的最终确诊依据Logan修订的per Paustian标准[7,8]。确诊病例:基线或治疗过程中,肠黏膜活检组织或手术病理见干酪样坏死性肉芽肿或(及)抗酸杆菌阳性,或罗氏培养/液体培养结核杆菌阳性;临床诊断:同时满足以下条件,①正规抗结核治疗疗程≥6个月,②PCDAI评分达好转,③肠镜评估达好转或愈合,④开始抗结核治疗12个月(或带药或停药)临床症状无复发(PCDAI评分上升>10分为复发)[4]和/或肠镜下溃疡及结节样病变无复发。
1.5 诊断性抗结核治疗12个月时CD判断标准 鉴于本文纳入标准或为ITB或为CD,并在抗结核诊断性治疗中尽可能排除免疫缺陷病合并结核,因此,经抗结核治疗12个月时非ITB即归为临床诊断CD。
1.6 资料采集 从住院病史中截取初次入院的一般信息,截取基线影像学和病理资料,截取初次入院和随访时点症状体征、实验室检测结果和肠镜所见用于PCDAI评分和肠镜评估分析。①一般信息:性别、发病年龄、预防接种史、家族史;②症状体征:体温、腹痛、腹泻、便血、腹部包块、体重下降、肛周病变、肠外表现和并发症;③实验室检测结果:CRP、ESR、PLT、HB、HCT、肝功能、大便常规、PPD皮试、结核抗体检测和T-SPOT.TB;④胸部影像学(CT或X线片)结核病灶;⑤肠镜表现:纵行溃疡、鹅卵石外观、阿弗他溃疡、病变≥4个部位、结节息肉样改变、黏膜桥、肠腔狭窄、回盲瓣开口固定、环形溃疡、瘢痕、跳跃式分布;⑥小肠MRE:累及小肠、肠壁增厚、明显强化、靶征、梳征、淋巴结肿大和肠腔狭窄等;⑦肠黏膜组织病理学检查:溃疡、肉芽肿、炎性渗出坏死、小肠黏膜萎缩、隐窝结构改变、黏膜全程炎、浆细胞聚集、淋巴细胞聚集、嗜酸性粒细胞浸润、中性粒细胞浸润和类上皮细胞增多等。
1.7 诊断性抗结核治疗方案 均采用2~3HRZE/7~10HR方案治疗[9],不能耐受者根据2014 年WHO《国家结核病规划关于儿童结核病处理指南( 第 2 版) 》中“儿童结核病治疗方案”[10,11]进行调整。

2 结果
2.1 一般情况 研究期间符合本文纳入标准的CD或ITB 36例,抗结核治疗中失访1例,死亡1例(抗结核治疗3个月内),抗结核治疗中逐渐诊断为免疫缺陷合并结核感染8例,26例难以判断CD或ITB患儿进入本文分析。
2.2 CD组和IBT组基线情况比较 诊断性抗结核治疗12个月后行PCDAI评分和肠镜评估,确诊ITB 17例,男10例,女7例,发病年龄(8.0±5.0)岁,16例接种卡介苗,4例有结核接触史,15例生长发育水平正常;确诊CD 9例,男6例,女3例,发病年龄(9.8±4.1)岁,9例接种卡介苗,1例有结核接触史,8例生长发育水平正常。表1显示,CD组和ITB组一般情况、临床表现、小肠MRE表现差异均无统计学意义;ITB组外周血RBC及Hb较CD组低,差异有统计学意义;CD组阿弗他溃疡及病变累及≥4个节段以上较ITB组严重,差异有统计学意义,13项病理CD组中除类上皮细胞增多较ITB组多,差异有统计学意义,其余12个项目差异均无统计学意义。
CD组和ITB组均至少符合本文接受抗结核治疗或诊断性抗结核治疗标准中任何1条,同时符合2条者CD组2例(22.2%),ITB组8例(47.1%),差异无统计学意义,(P=0.21);同时符合3条及以上者CD组1例(11.1%),ITB组3例(11.7%),差异无统计学意义(P=0.57)。
2.3 诊断性抗结核治疗情况 ITB组最终抗结核治疗时间18(12~30)个月,CD组18(12~24)个月,差异无统计学意义(P= 0.194);ITB组(16例)和CD组(8例)均主要以HRE及(或)Z方案为主,ITB组中1例以HREZP方案为主,CD组中1例以HR为主,差异无统计学意义(P= 0.370)。

表1 诊断性抗结核治疗前两组患儿基线情况比较±s,n(%)]
2.4 诊断性抗结核治疗前后不同时点PCDAI评分比较 图1显示ITB组基线PCDAI评分(36.2±9.7)高于CD组(30.4±8.5),但差异无统计学意义(t=1.495,P=0.148);随抗结核治疗时间延长,PCDAI评分ITB组和CD组均呈下降趋势,并在3~6个间形成一个交叉,ITB组下降趋势非常明显,CD组下降趋势中在6个月时略有上升。ITB组:基线PCDAI评分均﹥10分;治疗3个月(27.9±12.0)、6个月(18.6±9.1)和12个月(8.3±9.1)时较基线PCDAI评分下降≥12.5分或PCDAI≤10分的为6、14和16例。CD组:基线PCDAI评分均﹥10分;治疗后3个月(23.8±10.6)、6个月(25.4±10.6)和12个月(25.2±8.5)较基线PCDAI评分下降≥12.5分的分别为1、2和1例。图1显示,诊断性抗结核治疗3个月时PCDAI评分较基线:ITB组下降(8.2±5.1)分,CD组下降(6.6±5.0)分,差异无统计学意义(t=0.759,P=0.455);诊断性抗结核治疗6个月时PCDAI评分较基线:ITB组下降(17.6±6.1)分,CD组下降(5.0±5.9)分,差异有统计学意义(t=5.043,P=0.000);诊断性抗结核治疗12个月时PCDAI评分较基线:ITB组下降(27.8±8.4)分,CD组下降(5.2±6.2)分,差异有统计学意义(t=7.114,P=0.000)。
2.5 诊断性抗结核治疗不同时点与基线肠镜评估比较 6个月时ITB组和CD组痊愈+明显好转分别为76.5%(13/17)和22.2%(2/9),差异有统计学意义(Fisher精确检验,P=0.012);12个月时ITB组和CD组痊愈+明显好转分别为94.1%(16/17)和11.1%(1/9),差异也有统计学意义(Fisher精确检验,P=0.000)。

图1 抗结核治疗前后两组PCDAI评分比较
表2显示,ITB组6个月时肠镜评估中,ITB组活动性溃疡中8/16例消失,结节样改变中2/7例消失,炎症性息肉中3/6例消失。ITB组和CD组12个月时肠镜评估中,ITB组活动性溃疡中9/12例消失,结节样改变中4/7例消失,炎症性息肉中3/6例消失。CD组6和12个月时肠镜评估中,活动性溃疡、结节样改变和炎症性息肉均无消失

表2 ITB组和CD组6和12个月时肠镜评估具体情况(n)
2.6 ITB和CD诊断准确性参数 以诊断性抗结核治疗ITB确诊标准作为金标准。表3显示,3个月时PCDAI评分敏感度(35.3%)很低,但特异度(88.9%)和阳性预测值(85.7%)较高;6个月时PCDAI评分虽然敏感度(76.5%)上升,但特异度下降(77.8%),阳性预测值(86.7%)较高;6个月时肠镜评估虽然敏感度(76.5%)和特异度(77.8%)均不高,但阳性预测值(86.7%)较高;6个月时PCDAI评分+肠镜评估虽然敏感度(76.5%)不高,但特异度(88.9%)较高,阳性预测值(92.9%)更高;12个月时PCDAI评分+肠镜评估敏感度(94.1%)、特异度(88.9%)均较高,阳性预测值(94.1%)比6个月时仅提高了1.2%。ITB组1例在抗结核治疗12个月时依然不能确诊ITB,后续又经过HRE抗结核治疗1年好转而停药。
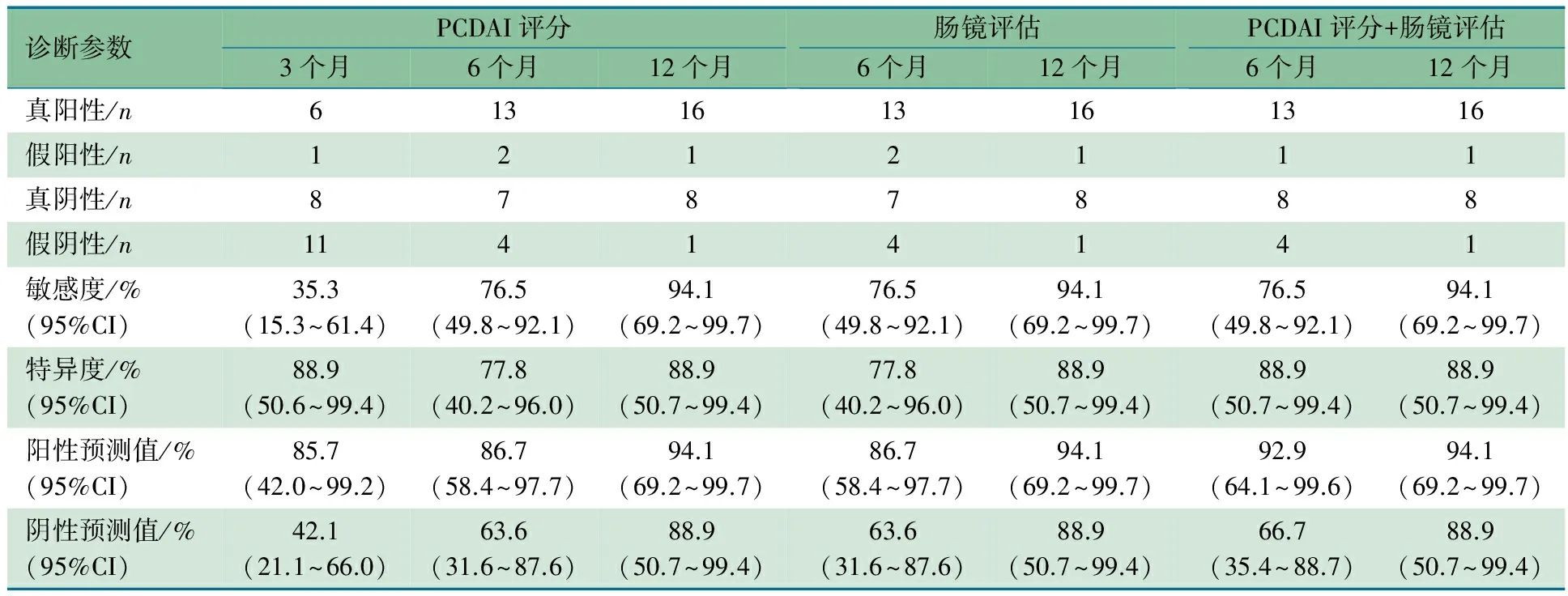
表3 不同时点PCDAI评分和/或肠镜评估诊断ITB诊断准确性参数
3 讨论
ITB与CD的诊断与鉴别诊断一直是困扰全球消化领域的难题之一,国内外就两者在临床表现、内镜所见、小肠影像表现、活检病理及结核检测方法等方面做了大量研究[12~14],为鉴别诊断提供了丰富的手段,但两病的鉴别依然相当困难,误诊率高达53.6%[15]。WHO不推荐将诊断性抗结核治疗是否有效作为儿童结核病的诊断方法[4,5],但对于肺外结核尤其是儿童ITB,因与儿童CD临床表现非常相似,缺乏特异性鉴别指标,细菌培养、PPD和T-SPOT.TB均易出现假阴性结果,当出现ITB与CD鉴别诊断困难时,采用诊断性抗结核治疗也是无奈之选。诊断性抗结核治疗效果的评估标准至今尚无共识,诊断性抗结核治疗疗效的判断,既要考虑有合适的评估工具,又要有体现恰当的鉴别时点。本文正是基于这样的目的,通过对抗酸染色阳性难以判断ITB和CD患儿,在抗结核治疗前后,以PCDAI评分和肠镜评估行诊断准确性实验,探究诊断性抗结核治疗能否作为到鉴别儿童ITB和CD的方法及恰当时点。
PCDAI评分是目前国际上公认的用于评估儿童CD活动情况的评分量表,主要包括以下各项指标:腹痛、每日便次、一般情况、身高、体重、腹部有无压痛肿块、肛周疾病、肠外表现、红细胞压积、血沉和白蛋白。根据总评分划分3个等级:0~10分为不活动,~30分为轻度,≥31分为中/重度[4]。由于ITB缺乏自身的疾病程度评价指标,而儿童ITB的临床表现与CD极其相似,因此本研究尝试用PCDAI评分评估ITB患儿的临床病情。本研究发现用PCDAI评分能较准确地反映ITB组患儿病情,且在诊断性抗结核治疗前ITB组和CD组的PCDAI评分均﹥10分,ITB组(36.2±9.7)高于CD组(30.4±8.5),差异无统计学意义,但随着抗结核治疗时间延长,ITB组PCDAI评分呈逐渐下降趋势,与患儿的病情恢复情况相符,CD组PCDAI评分抗结核治疗开始下降,以后没有变化,反映在治疗过程中临床症状有反复或增加,与国外类似研究相仿[16]。PCDAI评分诊断性抗结核治疗3个月较基线:ITB组下降(8.2±5.1)分,CD组下降(6.6±5.0)分,差异无统计学意义;6个月时ITB组PCDAI评分较治疗前下降(17.6±6.1)分,而CD组下降(5.0±5.9)分,差异开始有统计学意义。因此,6个月时PCDAI评分对儿童ITB和CD的鉴别有一定作用。
本研究在抗结核治疗6个月时复查肠镜,发现ITB组痊愈+明显好转率(76.5%)已明显高于CD组(22.2%),差异有统计学意义(Fisher精确检验,P=0.000)。通过肠镜评估鉴别儿童ITB和CD无疑是有效的,也是目前临床上主要的评估手段。但考虑到儿童尚在生长发育,且部分患儿体质虚弱或肠道病变重,急性期肠镜操作风险大,不宜太过频繁地进行肠镜检查,使肠镜评估在鉴别儿童ITB和CD上受到一定的限制。
本研究以诊断性抗结核治疗ITB确诊标准作为金标准,做不同治疗时点PCDAI评分和/或肠镜评估诊断ITB的诊断准确性比较。结果发现,无论ITB组还是CD组,临床症状的好转均较肠镜好转快。而PCDAI评分+肠镜评估的有效性要高于单纯PCDAI评分或肠镜评估。6个月时PCDAI评分+肠镜评估,虽然敏感度不高,但特异度较高,阳性预测值更高;12个月时PCDAI评分+肠镜评估,敏感度较高,但特异度与6个月时相仿,阳性预测值比6个月时仅提高了1.2%,说明6个月时PCDAI评分+肠镜评估已经可以在鉴别ITB和CD有很好作用;对于难以判断CD或ITB的对患儿来说,长达12个月抗结核治疗已不符合诊断性治疗的要求,CD患儿要经历如此长时间抗结核治疗才考虑转换治疗;如果是ITB患儿,则不应在初期因为没有信心而不坚持抗结核治疗。因此PCDAI评分+肠镜评估可以作为抗结核治疗6个月有效鉴别儿童ITB和CD的工具和时间点。对于某些经抗结核治疗6个月后仍无法判断CD或ITB的患儿,基于临床和肠镜的评估趋向于CD,可在继续抗结核治疗的同时加用抗CD试验性治疗,即可避免贻误病情,同时也可根据后期的疗效进一步鉴别两种疾病,更符合临床思维。
本文的不足与局限性,①作为诊断准确性研究,采用回顾性收集PCDAI评分项目的临床资料,如腹痛、每日便次、腹部有无压痛肿块、肛周疾病、肠外表现等,病史中可能不会反映得非常具体和恰当,为此本文在资料采集时从住院病史中截取初次入院的一般信息,截取诊断性抗结核治疗前的影像学和病理资料,截取初次入院和随访时点症状体征、实验室检测结果和肠镜所见用于本文分析,以便尽可能准确地反映12个月时PCDAI评分和肠镜评估项目;②本文不同时点PCDAI评分和/或肠镜评估诊断ITB诊断参数的95%CI范围较大,可能与样本量小有关。
[1]Benchimol EI,Fortinsky KJ,Gozdyra P,et al.Epidemiology of pediatric inflammatory bowel disease:a systematic review of international trends.Imflamm Bowel Dis,2011,17(1):423-439
[2] Leshinsky-Silver E,Karban A,Buzhakor E,et al.Is age of onest of Crohn's disease governed by mutationgs in NOD2/caspase recruitmeng domains 15 and toll-like receptor 4?Evaluation of a pediatric cohort.Pediarics,2005,58(3):499-504
[3]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州). 胃肠病学,2012(12):763-781
[4]中华医学会儿科学会消化学组儿童炎症性肠病协作组.儿童炎症性肠病诊断规范共识意见.中国实用儿科杂志,2010,25(4):263-265
[5]邹宁,刘晓红.肠结核与克罗恩病的鉴别诊断.胃肠病学,2003,8(1):13-14
[6]Chidlow J J,Langston W,Greer J J,et al.Differential angiogenic regulation of experimental colitis.Am J Pathol,2006,169(6):2014-2030
[7]Makharia GK, Srivastava S, Das P, et al. Clinical, endoscopic, and histological dirrerentiations between Crohn's disease and intestinal tuberculosis. Am J Gastroenterology, 2010,105(3):642-651
[8]Mukewar S, Ravi R, et al.Colon tuberculosis: endoscopic features and prospective endoscopic follow-up after anti-tuberculosis treatment. Clin Transl Gastroenterol, 2012,3(10):e24
[9]范永琛.儿童结核病的诊断与治疗.中国实用儿科学,2003,18(7):389-391
[10] WHO. Guidance for national tuberculosis programmes on the management of tuberculosis in children. Geneva: World Health Organization,2014.
[11]焦伟伟,孙琳,肖婧,等.国家结核病规划指南——儿童结核病管理( 第 2 版).中国循证儿科杂志, 2016,11(1):65-74
[12]顾清,欧阳钦,张文燕,等.克罗恩病与肠结核临床及病理特征的对比研究.中华内科杂志,2009,48:291-294
[13]李学峰.邹益友.周明欢.等.克罗恩病与肠结核临床及内镜特征的鉴别分析.中华消化杂志,2010, 30(1):11-14
[14]Lee YJ, Yang SK, Byeon js, et a1.Analysis of colonoscopic findings in the differential diagnosis between intestinal tuberculosis and Crohn's disease.Endoscopy,2006,38(6):592-597
[15]魏艳,董倩,吕林,等.中文医学期刊2000~2009年克罗恩病误诊文献调查分析.临床误诊误治,2010,23(9):856-858
[16]Peyrin-Biroulet L, Neut C, Colombel JF. Antimucobacterial therapy in Crohn's disease: game over? Gastroenterology,2007,132(7)2594-2598
(本文编辑:张崇凡)
A clinical diagnostic accuracy study on the evaluation tool and time points of anti-tuberculosis trial treatment for differentiating between pediatric Crohn's disease and intestinal tuberculosis
HONG Yan1,4,WANG Lin1, PENG Kai-yue1,WU Jie1,ZHANG Yi2,LU Shui-hua3,HUANG Ying1
(1 Department of Gastroenterology,Children's Hospital of Fudan University,Shanghai 201102; 2 Department of Clinical Epidemiology, Children's Hospital of Fudan University, Shanghai 201102; 3 Shanghai Public Health Clinical Center, Fudan University, Shanghai, 201508;4 Department of Pediatrics, Taizhou Municipal Hospital, Zhejiang Province,Taizhou 318000,China)
LU Shui-hua,E-mail: tubercle@shaphc.org;HUANG Ying,E-mail:yhuang815@163.com
Objective To investigate the evaluation standard and proper time point of anti-tuberculosis trial treatment for differential diagnosis between Crohn's disease (CD) and intestinal tuberculosis (ITB) in children.MethodsPatients who were suspected CD or ITB by clinical symptoms and pathological examination, and confirmed with tuberculosis infection or positive acid-fast bacilli stain were retrospectively reviewed. Patients who had a history of anti-tuberculosis or immunosuppressant treatment and were diagnosed with congenital immunodeficiency disease combined with tuberculosis infection were excluded. Patients with caseous necrosis, positive acid-fast bacilli stain, extra-intestinal active tuberculosis, positive PPD test, positive bacterial smear test were administrated with anti-tuberculosis trial treatment. Pediatric Crohn's Disease Activity Index (PCDAI) and endoscopic evaluation were analyzed at 3, 6 and 12 months. ITB was confirmed by Paustian's criteria with Logan's modification and CD by pathological examination. Trial of anti-tuberculosis treatment were with 2-3 months of HRZE and 7-10 months OF HR.ResultsA total of 26 patients suspected CD or ITB were enrolled in this study. All cases were done PCDAI and endoscopic evaluation, 17 of them were diagnosed with ITB, 9 were with CD. No significant differences were found in clinical characteristics, laboratory index, endoscopy, small bowel MRE test, pathological examination, duration of anti-tuberculosis treatment and anti-tuberculosis drugs. In ITB group, the decrease of PCDAI ≥12.5 or the PCDAI≤10 between 3 months and baseline, between 6 months and baseline, between 12 months and baseline occurred in 6, 14 and 16 cases, respectively; whereas in CD group, the data were 1, 2 and 1 case, respectively. Mucosal healing and improvement rates of lesions at 6 months of treatment in ITB and CD group were 76.5% and 22.2%, respectively; the rate at 12 months was 94.1% and 11.1%, respectively (Fisher's exact test,P=0.000). To use success of anti-tuberculosis trial treatment as a golden standard, the positive predictive values of PCDAI at 3 and 6 months were 85.7% and 86.7%, respectively. The positive predictive value of endoscopic evaluation at 6 months was 86.7%. The specificity of PCDAI plus endoscopic evaluation was 88.9%, the positive predictive value was 92.9% which was 1.2% lower than that value at 12 months (94.1%).ConclusionWith lack of special markers for differential diagnosis between CD and ITB, some cases still need to receive anti-tuberculosis trial treatment. In the course of anti-tuberculosis treatment, the improvement of clinical symptoms goes quickly compared with endoscopic evaluation. PCDAI plus endoscopic evaluation at 6 months of anti-tuberculosis trial treatment can be used as the best tool and time point for differentiating between ITB and CD in children.
Intestinal tuberculosis; Crohn's disease; Anti-tuberculosis trial treatment; Differential; Children
国家临床重点专科项目;浙江省医药卫生科技计划项目:2015KYB430
1 复旦大学附属儿科医院消化科 上海,201102;2 复旦大学附属儿科医院流行病学研究室 上海,201102;3 上海市公共卫生临床中心、复旦大学附属公共卫生临床中心呼吸结核科 上海,201508;4 浙江省台州市立医院儿内科 台州,318000
卢水华,E-mail: tubercle@shaphc.org;黄瑛,E-mail:yhuang815@163.com
10.3969/j.issn.1673-5501.2016.05.001
2016-09-12
2016-10-18)
